Электрохимия, 2019, T. 55, № 3, стр. 358-365
Анодная инверсионная вольтамперометрия с быстрой разверткой для обнаружения Pb(II) на пикомолярном уровне
Фан Янг a, Пенг Лю b, Тингтинг Хао a, Янгбо Ву b, **, Шаохуа Ма c, Юфанг Ху a, Сюй Ванг a, Цзенг Гуо a, *
a Школа материаловедения и химической технологии, Государственная главная лабораторная база науки
о новых функциональных материалах и их получении, Университет Нинбо
315211 Нинбо, КНР
b Факультет электротехники и информатики, Университет Нинбо
315211 Нинбо, КНР
c Школа медицинской техники, Колледж медицинских наук Нинбо
315100 Нинбо, КНР
** E-mail: wuyangbo@nbu.edu.cn
* E-mail: guozhiyong@nbu.edu.cn
Поступила в редакцию 13.07.2018
После доработки 06.10.2018
Принята к публикации 31.10.2018
Аннотация
Анодная инверсионная вольтамперометрия с быстрой разверткой (АИВБР) применена для чувствительного обнаружения Pb2+ на ртутном пленочном электроде (РПЭ). Метод предусматривал регулируемое предварительное концентрирование посредством накопления Pb2+ на РПЭ с последующим измерением АИВБР. При скорости развертки 500 В/с линейное соотношение между током анодного инверсионного пика и логарифмом концентрации Pb2+ в растворе наблюдалась в диапазоне от 0.1 мкМ до 0.1 пМ с пределом обнаружения 0.1 пМ. Предложенный метод успешно применен для определения Pb2+ в образцах загрязненной воды с удовлетворительным обнаружением от 98.6 до 104.3% и соответствующим относительным среднеквадратическим отклонением от 3.7 до 5.5%. Таким образом, АИВБР представляет собой чувствительный, быстрый, экономичный и простой метод обнаружения Pb2+ на пикомолярном уровне, который имеет хорошие перспективы в определении тяжелых металлов.
ВВЕДЕНИЕ
Свинец (Pb) давно считается основным токсичным тяжелым металлом для окружающей среды. Согласно сообщениям, его долгосрочное воздействие может приводить к острому или хроническому отравлению и вызывать расстройство нервной системы, иммунной системы, репродуктивной системы и сердечно-сосудистой системы [1–3]. С учетом серьезной опасности Pb для здоровья различные учреждения по охране окружающей среды ввели ряд правил по ограничению содержания Pb на безопасном уровне. Европейская Комиссия и Всемирная организация здравоохранения рекомендовали максимальный уровень свинца 10 мг/т для питьевой воды [4, 5]. В 2010 г. Управление по охране окружающей среды США установило максимальный уровень загрязнения для Pb в питьевой воде 0 мг/т [6]. Таким образом, поскольку максимальный уровень Pb в окружающей среде является очень низким, срочно требуется разработка высокочувствительных методов анализа.
В настоящее время методы обнаружения Pb2+ можно в целом разделить на два типа, а именно неэлектрохимические и электрохимические методы. Неэлектрохимические методы представляют собой масс-спектрометрия с индуктивно связанной плазмой (МС-ИСП) [7], атомная абсорбционная спектрометрия (ААС) [8], рентгеновская абсорбционная спектроскопия [9], рентгеновская флуоресценция (РФ) [10], атомная флуоресцентная спектрометрия (АФС) [11] и т.д. Несмотря на то, что данные методы проявляют высокую чувствительность для определения низких концентраций Pb2+, дорогостоящие приборы, трудоемкое приготовление образцов и продолжительные аналитические процедуры делают их менее привлекательными [12]. Электрохимические методы представляют собой, главным образом, полярография, анализ потенциала, вольтамперометрия, датчики и т.д. [13–18]. Кроме того, некоторые авторы исследовали также модифицированные электроды для выполнения требований обнаружения тяжелых металлов [19–22]. Например, предложен ковалентный объемный модифицированный стеклоуглеродный композиционный электрод нового типа, получаемый посредством химического восстановления тетрафторбората диазония 2-гидроксибензойной кислоты в присутствии фосфорноватистой кислоты в качестве восстановителя. Его получили и применили для одновременного определения ионов свинца и кадмия в водной среде с пределом обнаружения 0.18 и 0.20 мкМ, соответственно [19]. Получен угольный пастовый электрод, электрохимически модифицированный циклодекстринами, который применяли для определения Pb(II) в диапазоне от 1 × 10–5 до 1 × 10–3 М [20]. Кроме того, стеклоуглеродный электрод, содержащий сополимер силоксана и полиамида краун-эфира, получен и применен для обнаружения ионов свинца с пределом обнаружения 3.5 × 10–9 М [22].
Все же анодная инверсионная вольтамперометрия (АИВ) широко признана как один из простейших и наиболее эффективных методов анализа следов ионов металлов. Замечательная чувствительность этого метода обусловлена сочетанием эффективного предварительного концентрирования с модернизированными измерительными процедурами, которые обеспечивают превосходное соотношение сигнала и фона [23–27]. Предложены некоторые методы для дальнейшего повышения чувствительности АИВ. Например, представлена новая чувствительная проточная электрохимическая детекторная система [28], в которой применен новый твердый электрод по форме поля течения, имеющий превосходные показатели инверсионной вольтамперометрии. Он применен для обнаружения Pb2+ методом квадратно-волновой инверсионной вольтамперометрии с пределом обнаружения 0.2 мкг/л. Модифицированный углеродными нановолокнами стеклоуглеродный электрод применен для одновременного определение Pb2+ и Cd2+ методом АИВ, и получен предел обнаружения 0.9 и 1.5 нМ, соответственно [29]. Кроме того, представлен наноэлектродный массив, содержащий ориентированные углеродные нановолокна, для обнаружения Pb2+ методом АИВ с пределом обнаружения 1.73 нМ [30]. В работе Дали и др. также предложен датчик для электрохимического обнаружения Pb2+ и Cd2+ методом дифференциальной импульсной анодной инверсионной вольтамперометрии на основе биомассы грибной почвы и получен предел обнаружения 10–8 и 10–7 М, соответственно [31]. Однако практические применения данных методов ограничены, поскольку их чувствительность не превышала наномолярный уровень, и изготовление электродов было трудоемким. Таким образом, по-прежнему требуется более простой и чувствительный метод.
Циклическая вольтамперометрия с быстрой разверткой (ЦВБР) обычно означает циклическую вольтамперометрию со скоростью развертки, превышающей 10 В/с, которая может обеспечить быстрый отклик с субсекундным временным разрешением. Ее широко применяют для исследования динамики in vivo многих электроактивных нейрохимических веществ, включая дофамин [32, 33], пероксид водорода [34], кислород [35] и серотонин [36]. Кроме того, ее также применяли для обнаружения ионов тяжелых металлов [37–40]. Например, анодная инверсионная вольтамперометрия с быстрой линейной разверткой была применена для одновременного обнаружения Cd, Pb и Cu при различных скоростях развертки (0.5–10 В/с) и при различных концентрациях ионов металлов (50–800 нмоль/л) с использованием ультратонких (9 нм) ртутных пленок на электроде традиционного размера (d0 = 1 мм), что обеспечивало обнаружение Cd, Pb и Cu на уровнях ниже 1 мг/т при осаждении в течение 2 мин [37]. Однако чувствительность обнаружения не была столь высокой, потому что скорость развертки была относительно низкой. Кроме того, в работе Випф и др. [38] предложен покрытый монослоем ртути угольный волоконный электрод, используемый для обнаружения Pb2+ методом ЦВБР, предел обнаружения 80 фМ получен при скорости развертки 1000 В/с вследствие ионизации атомов Pb в ртутном слое, что катализировало окисление атомарного водорода, адсорбированного на слое Hg. Тем не менее, изготовление электрода было несколько трудоемким, и было затруднительным получение удовлетворительной воспроизводимости, что ограничивало дальнейшее применение обнаружение тяжелых металлов методом ЦВБР. Анодная инверсионная вольтамперометрия с быстрой разверткой (АИВБР) представляет собой модифицированное приложение ЦВБР в анодной инверсионной вольтамперометрии [41]. До настоящего времени было немного сообщений об обнаружении Pb2+ с применением АИВБР на электроде традиционного размера.
В настоящем исследовании впервые разработан чувствительный, быстрый, экономичный и простой метод обнаружения Pb2+ на электроде традиционного размера посредством АИВБР с пределом обнаружения 0.1 пМ.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Приборы и реагенты
АИВБР осуществляли в измерительной системе, включающей функциональный генератор AFG1022 от компании Tektronix (штат Орегон, США), осциллоскоп TBS1102 от компании Tektronix (штат Орегон, США), быстрый и самонастраивающейся контур с встроенной компенсацией омических потерь [42]. Для осуществления электроосаждения использовали электрохимическую рабочую станцию CHI760E от компании Chenhua Instrument Company (Шанхай, КНР). В процессе эксперимента была использована традиционная трехэлектродная система, включающая немодифицированный стеклоуглеродный электрод (СУЕ) диаметром 1 мм от компании GaossUnion (Ухань, КНР) в качестве рабочего электрода, платиновую проволоку в качестве противоэлектрода и электрод Ag/AgCl (3 М KCl) в качестве электрода сравнения.
Нитрат калия (KNO3), нитрат свинца (Pb(NO3)2), нитрат ртути (Hg(NO3)2) и 65–68% азотная кислота (HNO3) были приобретены у компании Sinopharm Chemical Reagent Co., Ltd. (Шанхай, КНР). Все химические реагенты имели категорию ч. д. а. и были использованы в полученном виде без дополнительной очистки или обработки. Водные растворы были свежеприготовленными с применением сверхчистой воды (сопротивление не менее Мом) из водоочистительной системы Milli-Q от компании Millipore (Биллерика, штат Массачусетс, США). Все эксперименты проводили при комнатной температуре.
Изготовление ртутного пленочного электрода (РПЭ)
Перед измерением СУЕ полировали, используя суспензию оксида алюминия с размерами частиц 1.0, 0.3 и 0.05 мкм от компании GaossUnion (Ухань, КНР), промывали водой и сушили. Затем его погружали в смешанный раствор 10–4 М Hg2+, 0.1 М KNO3 и 0.01 М HNO3, который деаэрировали азотом в течение 5 мин. Наконец, осаждение ртутной пленки на СУЕ осуществляли при постоянном потенциале –1 В в течение 300 с при перемешивании со скоростью 600 об./мин для получения РПЭ.
Обнаружение Pb2+ методом АИВБР
Изготовленный РПЭ помещали в смешанный раствор, который представлял собой 15 мл раствора, содержащего Pb2+ в переменной концентрации (10–7–10–13 М) и 0.1 М фонового электролит KNO3, который деаэрировали азотом в течение 5 мин. Потенциостатический контроль устанавливали при потенциале –1.2 В в течение 1200 с при перемешивании со скоростью 600 об./мин. Изготовленный электрод затем промывали водой и подключали к оптимально спроектированной схеме. Развертку потенциала осуществляли от –0.9 до ‒0.1 В методом АИВБР при различных скоростях развертки от 100 до 800 В/с.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Поведение Pb2+ в режиме анодной инверсионной вольтамперометрии на обычной электрохимической рабочей станции
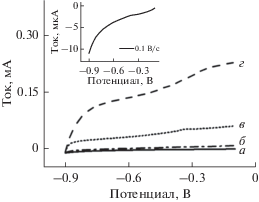
Омическое падение потенциала (падение iR) представляет собой падение потенциала, вызываемое сопротивлением раствора электролита при пропускании тока через электрод. Оно представляет собой неизбежный недостаток вольтамперометрических измерений и производит весьма существенное воздействие на вольтамперометрическое поведение. Когда омические потери являются значительными при высоких скоростях развертки, фарадеевский ток и ток заряда сочетаются, и окислительно-восстановительные пики выходят из окна потенциала [43, 44]. Таким образом, для получения надежных и пригодных для использования вольтамперометрических данных омические потери необходимо компенсировать в максимально возможной степени. Рисунок 1 представляет типичные анодные инверсионные вольтамперограммы 10–10 М Pb2+ при различных скоростях развертки (0.1, 1, 10 и 50 В/с) на обычной электрохимической рабочей станции. При обычной скорости развертки 0.1 В/с фарадеевский ток является слишком слабым для наблюдения (вставка). При увеличении скорости развертки фарадеевский ток и ток заряда синхронно увеличиваются, и инверсионные пики смещаются в направлении положительных значений. Когда скорость развертки превышает 50 В/с, не наблюдается ни один инверсионный пик, поскольку омические потери не могут быть эффективно скомпенсированы. Таким образом, оказывается затруднительным повышение чувствительности обнаружения Pb2+ посредством увеличения скорости развертки на обычной электрохимической рабочей станции.
Эффективность самонастраивающегося контура
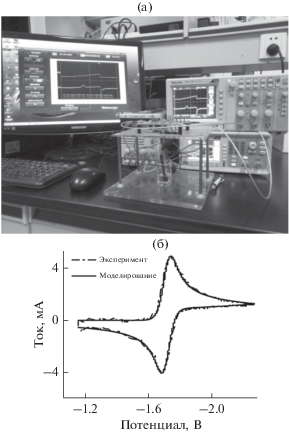
Чтобы компенсировать омические потери в системе при высоких скоростях развертки, авторы сконструировали быстрый и самонастраивающийся контур с встроенной компенсацией омических потерь согласно своей предшествующей работе [42]. Экспериментальное оборудование представлено на рис. 2а. Формы волны потенциала производили посредством генератора сигналов, вольтамперометрические данные получали посредством оцифровывающего осциллоскопа и сохраняли на персональном компьютере для последующего анализа. На рис. 2б представлена скомпенсированная на 100% вольтамперограмма для окислительно-восстановительной реакции раствора 18.0 мМ антрацена в ацетонитриле, содержащем 0.9 М NEt4BF4 в качестве фонового электролита на золотом электроде диаметром 1 мм при скорости развертки 1020 В/с. Кроме того, представлена также смоделированная вольтамперограмма согласно самоустанавливающейся программе моделирования [45–48], которая представляет собой универсальный моделирующий пакет на основе экспоненциально расширяющейся матричной модификации существующего сетевого подхода и программы симуляции аналоговой и цифровой логики, описанной на языке SPICE. Данный пакет способен виртуально моделировать любые определенные пользователем электрохимические/химические задачи в одномерной геометрии, такие как плоская диффузия, сферическая диффузия, цилиндрическая диффузия и процессы диффузии–конвекции на вращающемся диске. При этом моделировании наблюдали кинетику Батлера–Ольмера с использованием следующих параметров: стандартный электродный потенциал E0 = –1.61 В относительно платинового электрода, коэффициент электронного переноса α = 0.5, константа скорости реакции k0 = 5.1 см/с, коэффициент диффузии DO = DR = = 1.6 × 10–5 см2/с, площадь электрода 0.00785 см2, начальный потенциал Vi = –0.86 В, инверсный потенциал Vr = –2.24 В, скорость развертки v = = 1020 В/с, температура T = 20°C, некомпенсированное сопротивление раствора Ru = 0 (т.е., 100%‑ная компенсация без каких-либо омических потерь), емкость двойного слоя Cdl = 10 мкФ. Можно обнаружить, что никакое заметное возмущение не вносится даже при скорости развертки вплоть до 1020 В/с, свидетельствуя, что успешно сконструирован контур с удовлетворительной компенсацией омических потерь, который может выдержать исследования методом АИВБР при скоростях развертки вплоть до нескольких кВ/с на электроде традиционного размера.
Рис. 2.
Изображение экспериментального оборудования (а). Циклическая вольтамперограмма антрацена (б) при скорости развертки 1020 В/с на золотом электроде диаметром 1 мм. Пунктирная кривая – экспериментальные результаты при 100%-ной компенсации омических потерь; сплошная кривая – результаты моделирования.
Механизм обнаружения Pb2+ методом АИВБР
Чтобы более четко продемонстрировать влияние скорости развертки на чувствительность обнаружения методом АИВБР, ось абсцисс анодной инверсионной вольтамперограммы переводят с потенциала на время, а на оси ординат сохраняют инверсионный ток. На рис. 3а представлен ряд анодных инверсионных вольтамперограмм 10–10 М Pb2+ при различных скоростях развертки (0.1, 100, 200, 300, 400, 500, 600, 700 и 800 В/с). Очевидно, что при увеличении скорости развертки ток анодного инверсионного пика постепенно увеличивается. Однако количество электричества (Q) остается почти неизменным, как представлено на рис. 3б. Механизм может быть определен следующим образом.
Рис. 3.
Анодные инверсионные вольтамперограммы (а) с быстрой разверткой 10–10 М Pb2+ при различных скоростях развертки, В/с: 0.1 (1), 100 (2), 200 (3), 300 (4), 400 (5), 500 (6), 600 (7), 700 (8) и 800 (9). Количество электричества в инверсионном процессе (б) для 10–10 М Pb2+ при различных скоростях развертки.
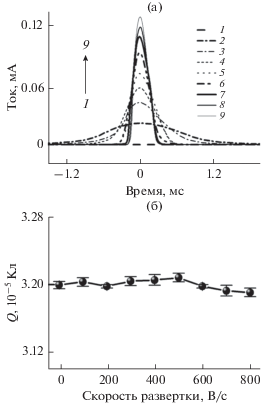
Когда сохраняются постоянными относительные экспериментальные параметры, такие как начальная концентрация Pb2+, время электрохимического осаждения, скорость перемешивания и т.д., является постоянным количество атомов свинца, осажденных в ртутная пленка на поверхности электрода. В анодном инверсионном процессе каждый атом свинца окисляется, что сопровождается потерей двух электронов, т.е. величина Q должна быть постоянной, поскольку количество атомов свинца не изменяется. Очевидно, что чем больше скорость развертки, тем меньше время развертки t, потому что фиксирован диапазон развертки потенциала. Таким образом, согласно формуле Q = It, где I представляет собой анодный инверсионный ток, и t представляет собой время развертки, уменьшение t неизбежно приводит к увеличению I при том условии, что величина Q является постоянной. Следовательно, чувствительность обнаружения может быть улучшена посредством увеличения скорости развертки потенциала согласно методу АИВБР.
Следует отметить, что величина Q уменьшалась приблизительно на 0.5%, когда скорость развертки превышала 500 В/с, вероятно, вследствие ограниченной точности прибора при высоких скоростях развертки. Таким образом, 500 В/с выбирали в качестве оптимальной скорость развертки для гарантии точности обнаружения.
Чувствительность
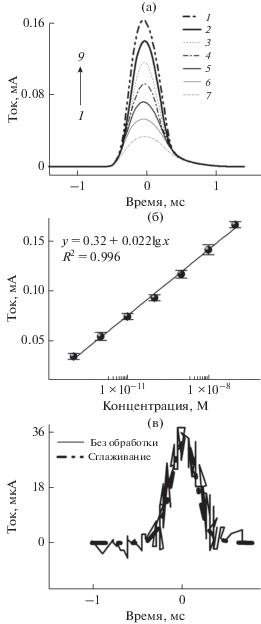
Метод АИВБР использовали для обнаружения Pb2+ в различных концентрациях (10–7–10–13 М) при 500 В/с. Как представлено на рис. 4а, сигнал тока постепенно увеличивался при увеличении концентрации Pb2+. Кроме того, можно видеть хорошее линейное соотношение между анодным инверсионным током и логарифмом концентрации Pb2+ в диапазоне от 0.1 мкМ до 0.1 пМ. Уравнение регрессии представляло собой y (мА) = = 0.32 + 0.022lg x (М), где квадрат коэффициента корреляции R2 составляет 0.996, y и x представляют собой силу тока и концентрацию Pb2+, соответственно (рис. 4б). Как представлено на рис. 4в, отсутствует существенное различие между необработанной анодной инверсионной вольтамперограммой 1 × 10–13 М Pb2+ при скорости развертки 500 В/с и сглаженной вольтамперограммой, свидетельствуя, что сглаживающая обработка может быть успешно выполнена для более четкого и интуитивного восприятия графиков. Можно видеть, что ток пика составлял приблизительно 30 мкА, в то время как шум составлял приблизительно 10 мкА, показывая, что предел обнаружения (ПО) может быть грубо оценен на уровне 1 × × 10–13 М согласно соотношению сигнала и шума (С/Ш), равному 3. Таким образом, метод АИВБР проявляет превосходную чувствительность обнаружения в случае Pb2+.
Рис. 4.
Анодные инверсионные вольтамперограммы (а) с быстрой разверткой Pb2+ при различных концентрациях, М: 10–7 (1), 10–8 (2), 10–9 (3), 10–10 (4), 10–11 (5), 10–12 (6), 10–13 (7). Скорость развертки: 500 В/с. Линейное соотношение (б) между током пика и логарифмом концентрации Pb2+. Анодная инверсионная вольтамперометрическая кривая (в), снятая для 10–13 М Pb2+ при скорости развертки 500 В/с. Сплошная кривая – необработанная кривая; штриховая кривая – сглаженная кривая.
Анализ реальных образцов
Чтобы проверить практическую эффективность метода, исследования по обнаружению были проведены с образцами загрязненной водопроводной воды, содержащими Pb2+ в различных концентрациях. Как представлено в табл. 1, получено удовлетворительное обнаружение в диапазоне от 98.6 до 104.3%, и соответствующие относительные среднеквадратические отклонения составляли от 3.7 до 5.5%. Таким образом, результаты показывают потенциальную применимость АИВБР для определения Pb2+ в образцах реальной воды.
Таблица 1.
Исследования по определению в образцах загрязненной воды методом АИВБР ($\bar {x} \pm s,$ n = 5)
| Номер | Добавлено, пМ | Найдено, пМ | Обнаружение, % | Относительное среднеквадратическое отклонение, % |
|---|---|---|---|---|
| 1 | 1.00 × 104 | (1.016 ± 0.037) × 104 | 101.6 | 3.7 |
| 2 | 1.00 × 102 | (0.986 ± 0.048) × 102 | 98.6 | 4.9 |
| 3 | 1.00 | 1.043 ± 0.057 | 104.3 | 5.5 |
ВЫВОДЫ
Итак, в настоящем исследовании разработан быстрый, простой и чувствительный электрохимический метод обнаружения Pb2+. Возможно обнаружение Pb2+ в диапазоне от 0.1 пМ до 0.1 мкМ с пределом обнаружения 0.1 пМ, что соответствует стандартам анализа воды, предусмотренным международными учреждениями по охране окружающей среды. Кроме того, данный метод успешно применен для образцов загрязненной водопроводной воды. Таким образом, разработанный метод демонстрирует огромный потенциал для обнаружения тяжелых металлов в анализе окружающей среды.
Список литературы
Flora, G., Gupta, D., and Tiwari, A., Toxicity of lead: a review with recent updates, Interdiscip. Toxicol., 2012, vol. 5, p. 47.
Niño, W.R.G. and Chaverrí, J.P., Protective effect of curcumin against heavy metals-induced liver damage, Food Chem. Toxicol., 2014, vol. 69, p. 182.
Jomova, K. and Valko, M., Advances in metal-induced oxidative stress and human disease, Toxicology, 2011, vol. 283, p. 65.
The Council of the European Union, On the quality of water intended for human consumption, Official J. Eur. Commun., 1998, Council Directive 98/83/EC.
World Health Organization, Guidelines for Drinking-Water Quality, 4th ed., World Health Organization, Geneva, 2011.
United States Environmental Protection Agency, National Primary Drinking Water Regulations, 2009, 816‑F-09-004.
Goullé, J.P., Saussereau, E., Mahieu, L., and Guerbet, M., Current role of ICP-MS in clinical toxicology and forensic toxicology: a metallic profile, Bioanalysis, 2014, vol. 6, p. 2245.
Burylina, M.Y. and Pupyshevb, A.A., Development of electrothermal atomic absorption spectrometry in 2005–2016, J. Anal. Chem., 2017, vol. 72, p. 935.
Smith, J.W. and Saykally, R.J., Soft X‑ray absorption spectroscopy of liquids and solutions, Chem. Rev., 2017, vol. 117, p. 13909.
Renfrew, A.K., Spectroscopic approaches to tracking metal-based drugs in cells and tissue, Chimia, 2017, vol. 71, p. 112.
Labatzke, T. and Schlemmer, G., Ultratrace determination of mercury in water following EN and EPA standards using atomic fluorescence spectrometry, Anal. Bioanal. Chem., 2004, vol. 378, p. 1075.
Mandil, A., Idrissi, L., and Amine, A., Stripping voltammetric determination of mercury(II) and lead(II) using screen-printed electrodes modified with gold films, and metal ion preconcentration with thiol-modified magnetic particles, Microchim. Acta, 2010, vol. 170, p. 299.
Companys, E., Galceran, J., Pinheiro, J.P., Puy, J., and Salaün, P., A review on electrochemical methods for trace metal speciation in environmental media, Curr. Opin. Electrochem., 2017, vol. 3, p. 144.
Bansod, B.K., Kumar, T., Thakur, R., Rana, S., and Singh, I., A review on various electrochemical techniques for heavy metal ions detection with different sensing platforms, Biosens. Bioelectron., 2017, vol. 94, p. 443.
Lu, Y.Y., Liang, X.Q., Niyungeko, C., Zhou, J.J., Xu, J.M., and Tian, G.M., A review of the identification and detection of heavy metal ions in the environment by voltammetry, Talanta, 2018, vol. 178, p. 324.
Mehta, J., Bhardwaj, S.K., Bhardwaj, N., Paul, A.K., Kumar, P., Kim, K.H., and Deep, A., Progress in the biosensing techniques for trace-level heavy metals, Biotechnol. Adv., 2016, vol. 34, p 47.
Saidur, M.R., Aziz, A.R.A., and Basirun, W.J., Recent advances in DNA-based electrochemical biosensors for heavy metal ion detection: A review, Biosens. Bioelectron., 2017, vol. 90, p. 125.
Zarcero, S.M., Quintanilla, D.P., and Sierra, I., A disposable electrochemical sensor based on bifunctional periodic mesoporous organosilica for the determination of lead in drinking waters, J. Solid State Electrochem., 2015, vol. 19, p. 2117.
Raghu, G.K., Sampath, S., and Pandurangappa, M., Chemically functionalized glassy carbon spheres: a new covalent bulk modified composite electrode for the simultaneous determination of lead and cadmium, J. Solid State Electrochem., 2012, vol. 16, p. 1953.
Morales, G.R., Silva, T.R., and Galicia, L., Carbon paste electrodes electrochemically modified with cyclodextrins, J. Solid State Electrochem., 2003, vol. 7, p. 355.
Salmanipour, A., and Taher, M.A., An electrochemical sensor for stripping analysis of Pb(II) based on multiwalled carbon nanotube functionalized with 5-Br-PADAP, J. Solid State Electrochem., 2011, vol. 15, p. 2695.
Simionca, I.M., Arvinte, A., Ardeleanu, R., and Pinteala, M., Siloxane-crown ether polyamide based electrode for electrochemical determination of lead(II) in aqueous solution, Electroanalysis, 2012, vol. 24, p. 1995.
Wang, J., Lu, J., Hocevar, S.B., and Farias, P.A.M., Bismuth-coated carbon electrodes for anodic stripping voltammetry, Anal. Chem., 2000, vol. 72, p. 3218.
Wang, T.T., Schlueter, K.T., Riehl, B.L., Johnson, J.M., and Heineman, W.R., Simplified nitrate-reductase-based nitrate detection by a hybrid thin-layer controlled potential coulometry/spectroscopy technique, Anal. Chem., 2013, vol. 85, p. 9486.
Deng, W., Tan, Y., Fang, Z., Xie, Q., Li, Y., Liang, X., and Yao, S., ABTS-multiwalled carbon nanotubes nanocomposite/Bi film electrode for sensitive determination of Cd and Pb by differential pulse stripping voltammetry, Electroanalysis, 2009, vol. 21, p. 2477.
Intarakamhang, S., Schuhmann, W., and Schulte A., Robotic heavy metal anodic stripping voltammetry: ease and efficacy for trace lead and cadmium electroanalysis, J. Solid State Electrochem., 2013, vol. 17, p. 1535.
Pinto, L. and Lemos, S.G., Comparison of different PLS algorithms for simultaneous determination of Cd(II), Cu(II), Pb(II), and Zn(II) by anodic stripping voltammetry at bismuth film electrode, Electroanalysis, 2014, vol. 26, p. 299.
Sun, Q.W., Wang, J.K., Tang, M.H., Huang, L.M., Zhang, Z.Y., Liu, C., Lu, X.H., Hunter, K.W., and Chen, G.S., A new electrochemical system based on a flow-field shaped solid electrode and 3D-printed thin-layer flow cell: Detection of Pb2+ ions by continuous flow accumulation square-wave anodic stripping voltammetry, Anal. Chem., 2017, vol. 89, p. 5024.
Zhao, D.L., Wang, T.T., Han, D., Rusinek, C., Steckl, A.J., and Heineman, W.R., Electrospun carbon nanofiber modified electrodes for stripping voltammetry, Anal. Chem., 2015, vol. 87, p. 9315.
Robinson, J.E., Heineman, W.R., Sagle, L.B., Meyyappan, M., and Koehne, J.E., Carbon nanofiber electrode array for the detection of lead, Electrochem. Commun., 2016, vol. 73, p. 89.
Dali, M., Zinoubi, K., Chrouda, A., Abderrahmane, S., Cherrad, S., and Renault, N.J., A biosensor based on fungal soil biomass for electrochemical detection of lead(II) and cadmium(II) by differential pulse anodic stripping voltammetry, J. Electroanal. Chem., 2018, vol. 813, p. 9.
Wakabayashi, K.T., Bruno, M.J., Bassb, C.E., and Park, J., Application of fast-scan cyclic voltammetry for the in vivo characterization of optically evoked dopamine in the olfactory tubercle of the rat brain, Analyst, 2016, vol. 141, p. 3746.
Pathirathna, P., Yang, Y., Forzley, K., McElmurry, S.P., and Hashemi, P., Fast-scan deposition-stripping voltammetry at carbon-fiber microelectrodes: real-time, subsecond, mercury free measurements of copper, Anal. Chem., 2012, vol. 84, p. 6298.
Sanford, A.L., Morton, S.W., Whitehouse, K.L., Oara, H.M., Lugo-Morales, L.Z., Roberts, J.G., and Sombers, L.A., Voltammetric detection of hydrogen peroxide at carbon fiber microelectrodes, Anal. Chem., 2010, vol. 82, p. 5205.
Zachek, M.K., Takmakov, P., Moody, B., Wightman, R.M., and McCarty, G.S., Simultaneous decoupled detection of dopamine and oxygen using pyrolyzed carbon microarrays and fast-scan cyclic voltammetry, Anal. Chem., 2009, vol. 81, p. 6258.
Hashemi, P., Dankoski, E.C., Lama, R., Wood, K.M., Takmakov, P., and Wightman, R.M., Brain dopamine and serotonin differ in regulation and its consequences, Proc. Natl. Acad. Sci. U. S. A., 2012, vol. 109, p. 11510.
Wu, H.P., Dynamics and performance of fast linear scan anodic stripping voltammetry of Cd, Pb, and Cu using in situ-generated ultrathin mercury films, Anal. Chem., 1996, vol. 68, p. 1639.
Munteanu, G., Munteanu, S., and Wipf, D.O., Rapid determination of zeptomole quantities of Pb2+ with the mercury monolayer carbon fiber electrode, J. Electroanal. Chem., 2009, vol. 632, p. 177.
Yang, Y.Y., Ibrahim, A.A., Stockdill, J.L., and Hashemi, P., A density-controlled scaffolding strategy for covalent functionalization of carbon-fiber microelectrodes, Anal. Methods-UK, 2015, vol. 7, p. 7352.
Yang, Y.Y., Ibrahim, A.A., Hashemi, P., and Stockdill, J.L., Real-time, selective detection of copper(II) using ionophore-grafted carbon-fiber microelectrodes, Anal. Chem., 2016, vol. 88, p. 6962.
Baranski, A.S., Rapid anodic stripping analysis with ultramicroelectrodes, Anal. Chem., 1987, vol. 59, p. 662.
Guo, Z.Y., and Lin, X.Q., Ultrafast cyclic voltammetry at scan rates of up to 3 MV s–1 through a single-opamp circuit with positive feedback compensation of ohmic drop, J. Electroanal. Chem., 2004, vol. 568, p. 45.
Amatore, C., Oleinick, A., and Svir, I., Theoretical analysis of microscopic ohmic drop effects on steady-state and transient voltammetry at the disk microelectrode: A quasi-conformal mapping modeling and simulation, Anal. Chem., 2008, vol. 80, p. 7947.
Wipf, D.O., Ohmic drop compensation in voltammetry: Iterative correction of the applied potential, Anal. Chem., 1996, vol. 68, p. 1871.
Deng, Z.X. and Lin, Q.X., Exponentially expanded grid network approach (EEGNA) : An efficient way for the simulation of stiff electrochemical problems, Chinese J. Chem., 2003, vol. 21, p. 1137.
Deng, Z.X. and Lin, Q.X., Digital simulation of fast cyclic voltammogram by integration of the double layer charging current, J. Electroanal. Chem., 1999, vol. 464, p. 215.
Deng, Z.X., Zhao, W., and Lin, X.Q., Simplex optimization-numerical simulation method for FCV curve fitting, Chin. J. Anal. Chem. 1999, vol. 27, p. 383.
Lin, X.Q. and Deng, Z.X., An improved electrochemical numerical simulation for the characterization of the influences of uncompensated solution resistance on cyclic voltammograms, J. Anhui Normal Univ., 1998, vol. 21, p. 333.
Дополнительные материалы отсутствуют.