Электрохимия, 2019, T. 55, № 4, стр. 473-481
Синтез наноцветков La3+/Co3O4 для чувствительного обнаружения хлорпромазина
Сомайе Таджик a, *, Фариб Гаркани-Нейджад b, **, Хади Бейтоллахи b
a Исследовательский центр нанобиоэлектрохимии, Бамский университет медицинских наук
Бам, Иран
b Экологическое отделение, Институт науки, высокой технологии и экологии,
Университет последипломного образования по передовой технологии
Керман, Иран
* E-mail: Tajik_s1365@yahoo.com
** E-mail: f.garkani95@gmail.com
Поступила в редакцию 05.06.2018
После доработки 17.09.2018
Принята к публикации 14.11.2018
Аннотация
В настоящем исследовании разработан чувствительный электрохимический датчик для хлорпромазина на основе наноцветка La3+/Co3O4. Наноцветок La3+/Co3O4 проявлял превосходную электрохимическую активность в отношении окисления хлорпромазина. Электрохимическое окисление хлорпромазина на модифицированном электроде представляет собой контролируемый диффузией процесс. Ток пика электрохимического окисления линейно увеличивается при увеличении концентрации хлорпромазина в диапазоне от 0.5 до 400.0 мкМ. Вычисленный предел обнаружения составляет 0.08 мкМ. La3+/Co3O4/СУЭ позволяет определять хлорпромазин в реальных образцах. Результаты показали, что электрохимический датчик, изготовленный в настоящем исследовании, может представлять собой весьма перспективную альтернативу современным аналитическим методам, используемым для определения хлорпромазина.
ВВЕДЕНИЕ
Фенотиазин (сокращенно ФТЗ) представляет собой органическое соединение, которое имеет трициклические кольца, содержащие атомы серы и азота в положениях 5 и 10, и относится к тиазиновому классу гетероциклических соединений [1]. Производные фенотиазина составляют основной класс терапевтических средств для лечения различных психических и личностных расстройств. Эти вещества сначала применяли для лечения малярии, аллергии и затем, главным образом, для психиатрического лечения [2].
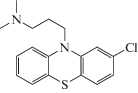
Хлорпромазин (схема 1 ) представляет собой фенотиазин, традиционное антипсихотическое средство с алифатической боковой цепью [3]. Хлорпромазин показан для шизофренических пациентов в целях контроля возбуждения, волнения и других психомоторных расстройств и смягчения маниакальной фазы маниакально-депрессивных состояний [4, 5]. Хлорпромазин воздействует на разнообразные рецепторы корковой и лимбической областей головного мозга, производя мощное антихолинергическое, антидофаминергическое, антигистаминное и антиадренергическое действие [6]. Таким образом, разработка новых датчиков для обнаружения хлорпромазина в следовых концентрациях превратилась в весьма важный предмет исследований.
Схема 1 . Химическая структура хлорпромазина.
В прошлом были разработаны многочисленные аналитические методы определения хлорпромазина, такие как электрохемилюминесценция [7], газовая хроматография в сочетании с масс-спектрометрией [8], спектрофлуориметрия [9], спектрофотометрия [10], проточная инжекция [11], капиллярный зонный электрофорез [12], высокоэффективная жидкостная хроматография [13], а также электрохимические методы [14–16]. По сравнению с предшествующими методами методы электрохимического обнаружения имеют такие преимущества, как быстрый отклик, низкая стоимость, высокая чувствительность, простая эксплуатация, легкая автоматизация и простота, хорошая селективность и возможность обнаружения в режиме реального времени в ходе анализа на месте [17–21].
В последнее время редкоземельные металлы, такие как лантан, подвергают всестороннему исследованию вследствие их уникальных каталитических свойств, что приводит к многочисленным приложениям в экологической химии и интересной универсальности в каталитических реакциях [22, 23]. Кроме того, существует сильное химическое взаимодействие между ионами лантанидов и кислородсодержащими группами [24, 25], таким образом, что ионы лантана могут легко присутствовать вместе с Co3O4.
Co3O4 представляет собой магнитный полупроводниковый материал дырочного типа, который имеет прямую и косвенную запрещенные зоны, составляющие 2.10 и 1.60 эВ, соответственно [26]. В аккумуляторах энергии [27], гетерогенных катализаторах [28], датчиках [29] и электрохромных устройствах [30] обычно используют Co3O4 вследствие его низкой стоимости, биосовместимости, широкой доступности и превосходных электрокаталитических свойств [31].
Используя вышеупомянутые благоприятные характеристики, авторы использовали лантан и Co3O4 для получения чувствительной контактной поверхности, обеспечивающей обнаружение хлорпромазина. Применение наночастиц для модификации поверхности электрода играет основную роль в усилении электрокаталитической активности, обусловленной их уникальными преимуществами, такими как высокая проводимость, большое соотношение поверхности и объема, а также чрезвычайно высокие значения механической прочности и модуля упругости [32–46].
Однако разработка новых высокоэффективных электродных материалов по-прежнему представляет собой огромную проблему. В настоящем исследовании авторы представляют вольтамперометрические исследования хлорпромазина с применением стеклоуглеродного электрода, модифицированного наноцветком La3+/Co3O4.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Химические реагенты и аппаратура
Электрохимические измерения осуществляли, используя потенциостат/гальваностат Autolab (PGSTAT 302N, Eco Chemie, Нидерланды). Экспериментальные условия регулировали, используя программное обеспечение многоцелевой электрохимической системы (МЦЭС). Традиционную трехэлектродную ячейку использовали при 25 ± 1°C. Электрод Ag/AgCl/KCl (3.0 M), платиновая проволока и La3+/Co3O4/СУЭ были использованы как сравнительный, вспомогательный и рабочий электроды, соответственно. Измеритель pH Metrohm 710 для определения pH.
Хлорпромазин и все остальные реагенты относились к категории ч. д. а. и были приобретены у компании Merck (Дармштадт, Германия). Для получения буферных растворов использовали ортофосфорную кислоту и ее соли, обеспечивая pH в диапазоне от 2.0 до 9.0.
Синтез наноцветков La3+/Co3O4
Все химические реагенты, используемые для получения нанопорошков, а именно ацетат кобальта (Co(CH3COO)2 ⋅ 2H2O), нитрат лантана (La(NO3)3 ⋅ 6H2O), тиомочевина ((NH2)2CS) и аммиак (25% NH3) относились к категории ч. д. а. Все предшественники были растворены в деионизированной воде. В процессе получения нанопорошка аммиак использовали в качестве комплексообразователя. Допированные La3+ наноструктуры Co3O4 получали, растворяя 0.46 моль ацетата кобальта в 80 мл деионизированной воды, 0.0046 моль нитрата лантана в 80 мл деионизированной воды, 0.18 моль тиомочевины в 80 мл деионизированной воды и добавляя в заключение 19.76 мл аммиака в 80 мл деионизированной воды. Количества растворов ацетата кобальта, тиомочевины и аммиака поддерживали в постоянном соотношении 1 : 1 : 1. Затем раствор ацетата кобальта помещали в лабораторный стакан на бане для проведения реакции, а затем к нему добавляли растворы тиомочевины и нитрата лантана, и смесь перемешивали в течение нескольких секунд. Наконец, в смесь медленно добавляли раствор аммиака, продолжая перемешивание в течение 5 мин. Температуру бани затем повышали до 80°C. После этого выпадал осадок, который выдерживали в течение ночи, а затем отфильтровывали. Далее осадок промывали этанолом. Полученный порошок высушивали в комнатных условиях в течение нескольких суток.
Получение электрода
На немодифицированный стеклоуглеродный электрод наносили наноцветки La3+/Co3O4 согласно следующей простой процедуре. Диспергировали 1 мг наноцветков La3+/Co3O4 в 1 мл водного раствора в течение 45 мин при воздействии ультразвука. Затем 5 мкл полученной суспензии наносили на поверхность углеродного рабочего электрода и выдерживали при комнатной температуре до высыхания.
Получение реальных образцов
Измельчали 5 таблеток, содержащих по 100 мг хлорпромазина (Tehran Chemie Pharmaceutical Company, Иран). Затем получали раствор таблеток, растворяя 100 мг порошка в 25 мл воды при воздействии ультразвука. Затем различные объемы разбавленного раствора помещали в мерную колбу объемом 25 мл и доводили до метки, используя фосфатный буферный раствор (ФБР, pH 7.0). Содержание хлорпромазина анализировали предложенным методом стандартных добавок.
Образцы мочи выдерживали в холодильнике после сбора. Для получения исследуемых образцов 10 мл собранной мочи центрифугировали при 2000 об./мин в течение 15 мин. После фильтрования надосадочной жидкости через фильтр с размером отверстий 0.45 мкм различные объемы помещали в мерную колбу объемом 25 мл и доводили до метки, используя ФБР (pH 7.0). В образцы разбавленной мочи добавляли различные количества хлорпромазина.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Исследование наноструктур
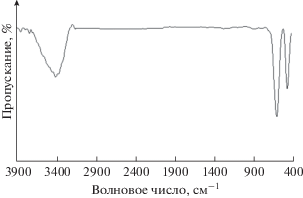
На рис. 1 представлен ИК-спектр с преобразованием Фурье наноцветка La3+/Co3O4 в диапазоне частот от 400 до 4000 см–1. На спектре наблюдаются интенсивные полосы колебаний в низкочастотных областях (около 602 и 487 см–1), которым соответствуют колебания связи металл–кислород. Поглощение, наблюдаемое около 3536 см–1, считают обусловленным симметричными колебаниями групп ‒OH абсорбированных молекул H2O [47].
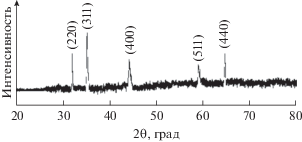
Основные характеристические дифракционные пики наноцветков La3+/Co3O4 соответствуют стандартным дифрактограммам Co3O4 (карта JCPDS (Объединенный комитет по химическому анализу с использованием порошковых дифракционных методов при Национальном Бюро стандартов США) № 71-0816) с кубической фазой типа шпинели, свидетельствуя, что внедрение La не изменяет структуру исходного Co3O4 (рис. 2). При увеличении содержания La в Co3O4 характеристический пик при 2θ = 37.2° становится слабее и слегка сдвигается в малоугловую область. Введение ионов La3+, имеющих f-электроны и большой радиус, на границу зерна Co3O4 вызывает уменьшение степени упорядоченности атомов в Co3O4, что способствует ограничению роста зерен, уменьшению их размера и снижению степени кристалличности [47].
Ширина дифракционных пиков демонстрирует природу нанопродукта, для которого средний размер (t) кристаллитов, вычисленный по формуле Дебая–Шеррера, составил 37.0 нм; t = 0.9λ/βcos(θ), где λ представляет собой длину волны рентгеновского излучения (1.54056 Å для медного источника), θ – дифракционный угол и β – полную ширину на половине высоты пика (FWHM) [48].
Морфологию продукта исследовали методом сканирующей электронной микроскопии (СЭМ) (рис. 3). Полученное методом СЭМ изображение наноцветков демонстрирует образование наноцветков с лепестками в форме наностержней, имеющих наблюдаемые размеры менее 40 нм.
Электрохимическое поведение хлорпромазина на поверхности различных электродов
Рисунок 4 представляет отклики на циклических вольтамперограммах электрохимического окисления 100.0 мкМ хлорпромазина на поверхности немодифицированного стеклоуглеродного электрода (кривая a), Co3O4/СУЭ (кривая б) и La3+/Co3O4/СУЭ (кривая в).
Рис. 4.
Циклические вольтамперограммы: (a) немодифицированный СУЭ, (б) Co3O4/СУЭ и (c) La3+/Co3O4/СУЭ в 0.1 M ФБР (pH 7.0) в присутствии 100.0 мкМ хлорпромазина при скорости развертки потенциала 50 мВ/с.
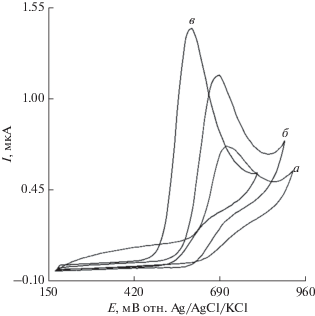
Результаты показали, что окисление хлорпромазина является незначительным на поверхности немодифицированного СУЭ, но присутствие наночастиц Co3O4 или наноцветков La3+/Co3O4 на поверхности СУЭ может увеличивать ток пика и уменьшать потенциал окисления (уменьшать перенапряжение), но наилучшие результаты были получены на поверхности La3+/Co3O4/СУЭ (кривая в). Значительный отрицательный сдвиг тока, начиная от потенциала окисления для хлорпромазина, и резкое увеличение тока доказывает хорошую способность La3+/Co3O4/СУЭ (кривая б) к окислению хлорпромазина.
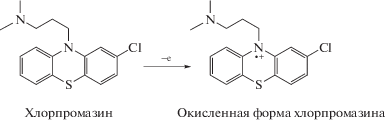
Механизм электрохимического окисления хлорпромазина на модифицированных электродах хорошо исследован и описан в [15]. Согласно предшествующим сообщениям, считается, что электрохимическое окисление хлорпромазина происходит по атому азота (схема 2).
Схема 2 . Механизм электроокисления хлорпромазина.
Влияние скорости развертки потенциала
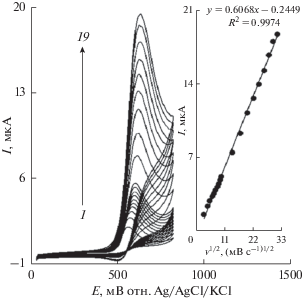
Исследовано влияние скорости развертки потенциала на ток окисления хлорпромазина (рис. 5). Результаты показали, что увеличение скорости развертки потенциала вызывало увеличение тока пика. Кроме того, процесс окисления контролируется диффузией, о чем свидетельствует линейная зависимость тока (Iп) анодного пика от квадратного корня скорости развертки потенциала (v1/2) в широком диапазоне от 10 до 1000 мВ/с (I (мкА) = 0.6068 ± 0.0002v1/2 (мВ/с)1/2 + + 0.2449, R2 = 0.9974).
Рис. 5.
Циклические вольтамперограммы La3+/Co3O4/СУЭ в 0.1 M ФБР (pH 7.0), содержащем 250.0 мкМ хлорпромазина при различных скоростях развертки потенциала; кривые 1–19 соответствуют 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500, 600, 700, 800, 900 и 1000 мВ/с, соответственно. Вставка: изменение тока анодного пика в зависимости от v1/2.
Хроноамперометрический анализ
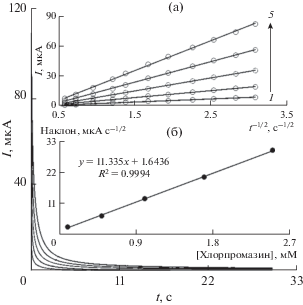
Хроноамперометрический анализ образцов хлорпромазина осуществляли, используя La3+/Co3O4/СУЭ по отношению к Ag/AgCl/KCl (3.0 M) при 0.65 В. Результаты хроноамперометрического анализа образцов хлорпромазина с различными концентрациями в ФБР (pH 7.0) продемонстрированы на рис. 6. Уравнение Коттрелла для хроноамперометрического анализа электроактивных частиц в условиях ограниченного массопереноса имеет следующий вид [49]:
Рис. 6.
Хроноамперограммы, полученные на La3+/Co3O4/СУЭ в 0.1 M ФБР (pH 7.0) для различных концентраций хлорпромазина. Кривые 1–5 представляют 0.1, 0.5, 1.0, 1.7 и 2.5 мМ хлорпромазина. Вставки: (а) графики зависимости I от t–1/2, полученные из хроноамперограмм 1–5. (б) График зависимости наклона прямых линий от концентрации хлорпромазина.
Калибровочный график и предел обнаружения
Ток пика окисления хлорпромазина на поверхности модифицированного электрода можно использовать для определения хлорпромазина в растворе. Таким образом, эксперименты методом ДИВ осуществляли для различных концентраций хлорпромазина (рис. 7) (I (мкА) = = 0.0139 ± 00003 c (мкМ) + 0.0539, R2 = 0.9989). Ток пика окисления хлорпромазина на поверхности модифицированного электрода оказался пропорциональным концентрации хлорпромазина в диапазоне от 0.5 до 400.0 мкМ при пределе обнаружения (3σ) 0.08 M. Таблица 1 представляет сравнение аналитических свойств для обнаружения хлорпромазина в полученном электроде в настоящей работе и на различных электродах.
Рис. 7.
ДИВ La3+/Co3O4/СУЭ в 0.1 M ФБР (pH 7.0), содержащем различные концентрации хлорпромазина. Кривые 1–16 соответствуют 0.5, 1.0, 5.0, 10.0, 20.0, 30.0, 40.0, 50.0, 60.0, 70.0, 80.0, 90.0, 100.0, 200.0, 300.0 и 400.0 мкМ хлорпромазина. Вставка: график тока пика в зависимости от концентрации хлорпромазина в диапазоне от 0.5 до 400.0 мкМ.
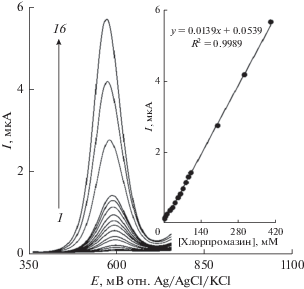
Таблица 1.
Сравнение эффективности различных модифицированных электродов, используемых в электроокислении хлорпромазина
| Электрод | Модификатор | Метод | Диапазон предела обнаружения, M | Предел обнаружения, M | Чувстви-тельность, мкА/мкМ | Литература |
|---|---|---|---|---|---|---|
| Стеклоуглерод | Композиционный материал, содержащий многостенные углеродные нанотрубки и полиэтиленимин | Вольтамперометрия | 1.9 × 10−8–9.2 × 10−6 | 1.0 × 10−8 | 0.0917 | 5 |
| Угольная паста | Ионная жидкость, содержащая CdO и наночастицы | Вольтамперометрия | 1.0 × 10−7–3.5 × 10−4 | 7.0 × 10−8 | 0.0885 | 6 |
| Стеклоуглерод | Политиофеновая нанопроволока | Вольтамперометрия | 1.0 × 10−7–1.3 × 10−4 | 3.0 × 10−8 | 0.207 | 16 |
| Стеклоуглерод | Наноцветки La3+/Co3O4 | Вольтамперометрия | 5.0 × 10−7–4.0 × 10−4 | 8.0 × 10−8 | 0.0139 | Настоящая работа |
Исследования помех
В некоторых случаях помехи от инородных соединений можно предотвратить посредством использования пика окисления для определения. Было исследовано воздействие неорганических ионов и органических соединений, которые обычно существуют в фармацевтических и биологических образцах, на определение 15.0 мкМ хлорпромазина. Предел допустимости был определен как соотношение концентраций добавки и хлорпромазина, вызывающее относительную ошибку менее ±5.0%.
Согласно результатам, Mg2+, Fe2+, Co2+, Cl–, ${\text{SO}}_{{\text{4}}}^{{{\text{2}} - }},$ Br–, глицин, глюкоза, сахароза, фруктоза, валин, аспарагиновая кислота, мочевина, аспирин, мочевая кислота, ацетаминофен, цистеин, аскорбиновая кислота, дофамин и насыщенный раствор крахмала не производили помех при определении хлорпромазина.
Воспроизводимость и устойчивость La3+/Co3O4/СУЭ
Для исследования долгосрочной устойчивости La3+/Co3O4/СУЭ его характеристики анализировали в течение трехнедельного периода. Для этой цели эксперименты повторяли после выдерживания модифицированного электрода при комнатной температуре в течение двух недель. Как продемонстрировали циклические вольтамперограммы, не наблюдались никакие существенные изменения потенциала пика окисления хлорпромазина за исключением уменьшения, составляющего менее чем 2.8% по сравнению с первоначальным откликом. Способность защиты модифицированного электрода от загрязнения при окислении хлорпромазина соответствующими продуктами окисления была исследована посредством анализа методом ЦВ.
Вольтамперограммы снимали в присутствии хлорпромазина после 15 циклов изменения потенциала при скорости развертки 50 мВ/с. Согласно результатам, потенциал пика оставался неизменным, если не считать уменьшения, составляющего менее чем 2.6%. Эти результаты подтвердили, что модифицированный La3+/Co3O4/СУЭ проявляет повышенную чувствительность и в меньшей степени подвергается загрязняющему воздействию хлорпромазина и продуктов его окисления.
Анализ реальных образцов
Применимость данного модифицированного электрода в исследовании реальных образцов оценивали посредством определения хлорпромазина в таблетке хлорпромазина и моче с использованием описанного метода. Для осуществления этого анализа был использован метод стандартных добавок, и результаты представлены в табл. 2. Соответственно, результаты извлечения хлорпромазина являются удовлетворительными, и воспроизводимость результатов доказана посредством относительного среднеквадратического отклонения (ОСО).
Таблица 2.
Применение La3+/Co3O4/СУЭ для определения хлорпромазина в таблетке хлорпромазина и моче (n = 5). Все концентрации выражены в мкМ
| Образец | Добавка | Найдено | Степень извлечения, % | ОСО, % |
|---|---|---|---|---|
| Таблетка хлорпромазина | 0 | 10.0 | – | 3.1 |
| 2.5 | 12.3 | 98.4 | 2.7 | |
| 7.5 | 17.6 | 100.5 | 1.8 | |
| 10.0 | 19.9 | 99.5 | 2.2 | |
| Моча 1 | 0 | – | – | – |
| 10.0 | 10.1 | 101.0 | 3.2 | |
| 20.0 | 20.6 | 103.0 | 1.9 | |
| Моча 2 | 0 | – | – | – |
| 5.0 | 4.9 | 98.0 | 2.8 | |
| 12.5 | 12.7 | 101.6 | 2.1 | |
| Моча 3 | 0 | – | – | – |
| 7.5 | 7.7 | 102.7 | 3.4 | |
| 17.5 | 17.4 | 99.4 | 2.3 |
ВЫВОДЫ
Таким образом, исследован La3+/Co3O4/СУЭ для быстрого определения хлорпромазина. Хлорпромазин может быть обнаружен с помощью La3+/Co3O4/СУЭ при концентрации в диапазоне от 0.5 до 400 мкМ с пределом обнаружения 0.08 мкМ при 3σ. Этот новый электрод демонстрирует очень большой отклик тока от электроактивных субстратов за счет своей высокой проводимости и биосовместимой контактной поверхности. Модифицированные электроды проявляют превосходный электрохимический отклик, высокую чувствительность, долгосрочную устойчивость и значительно сниженный предел обнаружения.
Список литературы
Ensafi, A.A. and Heydari, E., Determination of Some Phenothiazines Compounds in Pharmaceuticals and Human Body Fluid by Electrocatalytic Oxidation at a Glassy Carbon Electrode Using Methylene Blue as a Mediator. Anal. Lett., 2008, vol. 41, p. 2487.
Petković1, B.B., Kuzmanović, D., Dimitrijević, T., Krstić, M.P., and Stanković, D.M., Novel Strategy for Electroanalytical Detection of Antipsychotic Drugs Chlorpromazine and Thioridazine; Possibilities for Simultaneous Determination. Int. J. Electrochem. Sci., 2017, vol. 12, p. 3709.
Mielech-Łukasiewicz, K., Puzanowska-Tarasiewicz, H., and Panuszko, A., Electrochemical Oxidation of Phenothiazine Derivatives at Glassy Carbon Electrodes and Their Differential Pulse and Square-wave Voltammetric Determination in Pharmaceuticals. Anal. Lett., 2008, vol. 41, p. 789.
Parvin, M.H., Graphene paste electrode for detection of chlorpromazine. Electrochem. commun., 2011, vol. 13, p. 366.
Unnikrishnan, B., Pei-Chi, H., and Shen-Ming, C., A multipurpose voltammetric sensor for the determination of Cchlorpromazine in Ppresence of acetaminophen, uUric acid, dopamine and ascorbic acid. Int. J. Electrochem. Sci., 2012, vol. 7, p. 11414.
Ahmadzadeh, S., Karimi, F., Atar, N., Romao-Sartorid, E., Faghih-Mirzaei, E., and Afsharmanesh, E., Synthesis of CdO nanoparticles using direct chemical precipitation method; fabrication of novel voltammetric sensor for square wave Vvoltammetry determination of chlorpromazine in pharmaceutical samples. Inorg. Metal-Org. nano-Met. Chem., 2016, vol. 47. doi https://doi.org/10.1080/15533174.2016.1186049
Liu, Z., Zhang, F., Cui, L., Wang, K., and Zhan, H., Fabrication of a highly sensitive electrochemiluminescence chlorpromazine sensor using a ${\text{Ru}}\left( {{\text{bpy}}} \right)_{{\text{3}}}^{{{\text{2}} + }}$ incorporated carbon quantum dot–gelatin composite film. Anal. Methods, 2017, vol. 9, p. 1011.
Zhang, L., Wu, P., Zhang, Y., Jin, Q., Yang, D., Wang, L., and Zhang, J., A GC/MS method for the simultaneous determination and quantification of chlorpromazine and diazepam in pork samples. Anal. Methods, 2014, vol. 6, p. 503.
Aman, T., Rashid, A., Khokhar, I., and Iqbal, J., Spectrophotometric Determination of Chlorpromazine. Anal. Lett., 1997, vol. 30, p. 109.
Upadhyay, K., Asthana, A., and Tamrakar, R.K., Sensitive spectrophotometric method for determination of some phenothiazine drugs. Res. Chem. Intermed., 2015, vol. 41, p. 7481.
Shakir, I.M. and Hammood, M.K., New turbidimetric-continuous flow injection analysis method for the determination of chlorpromazine HCl in pharmaceutical preparation using linear array ayah 5SX1-T-1D-CFI analyser. Iraqi J. Sci., 2014, vol. 55, p. 594.
Lara, F.J., Campana, A.M.G., Barrero, F.A., and Sendra, J.M.B., Development and validation of a capillary electrophoresis method for the determination of phenothiazines in human urine in the low nanogram per milliliter concentration range using field amplified sample injection. Electrophoresis, 2005, vol. 26, p. 2418.
Yamini, Y. and Faraji, M., Extraction and determination of trace amounts of chlorpromazine in biological fluids using magnetic solid phase extraction followed by HPLC. J. Pharmaceut. Anal., 2014, vol. 4, p. 279.
Purushothama, H.T., Nayaka, Y.A., Vinay, M.M., Manjunatha, P., Yathisha, R.O., and Basavarajappa, K.V., Pencil graphite electrode as electrochemical sensor for the voltammetric determination of chlorpromazine. J. Sci. Adv. Mater. Dev., 2018. doi https://doi.org/10.1016/j.jsamd.2018.03.007
Palanisamy, S., Thirumalraj, B., Chen, S.M., Wang, Y.T., Velusamy, V., and Ramaraj, S.K., A facile electrochemical preparation of reduced graphene oxide@polydopamine composite: A novel electrochemical sensing platform for amperometric detection of chlorpromazine. Sci. Rep., 2016, vol. 6, p. 33599.
Hajian, A., Rafati, A.A., Afraz, A., and Najafi, M., Electrosynthesis of polythiophene nanowires and their application for sensing of chlorpromazine. J. The Electrochemical Society, 2014, vol. 161, p. B196.
Beitollahi, H., Hamzavi, M., Torkzadeh-Mahani, M., Shanesaz, M., and Karimi-Maleh, H., A Novel strategy for simultaneous determination of dopamine and uric acid using a carbon paste electrode modified with CdTe quantum dots. Electroanalysis, 2015, vol. 27, p. 524.
Brett, C.M.A. and Oliveira-Brett, A.M., Electrochemical sensing in solution-origins, applications and future perspectives,” J. Solid State Electrochemistry. J. Solid State Electrochem., 2011, vol. 15, p. 1487.
Beitollahi. H., Karimi-Maleh, H., and Khabazzadeh, H., Nanomolar and selective determination of epinephrine in the presence of norepinephrine using carbon paste electrode modified with carbon nanotubes and novel 2-(4-Oxo-3-phenyl-3,4-dihydroquinazolinyl)-N′-phenyl-hydrazinecarbothioamide. Anal. Chem., 2008, vol. 80, p. 9848.
Pashai, E., Darzi, G. N., Jahanshahi, M., Yazdian, F., and Rahimnejad, An electrochemical nitric oxide biosensor based on immobilized cytochrome c on a chitosan-gold nanocomposite modified gold electrode. M., Int. J. Biol. Macromol., 2018, vol. 108, p. 250.
Beitollahi, H., Nekooei, S., and Torkzadeh-Mahani, M., Amperometric immunosensor for prolactin hormone measurement using antibodies loaded on a nano-Au monolayer modified ionic liquid carbon paste electrode.Talanta, 2018, vol. 188, p. 701.
Valange, S., Beauchaud, A., Barrault, J., Gabelica, Z., and Daturi, M., Lanthanum oxides for the selective synthesis of phytosterol esters: Correlation between catalytic and acid–base properties. J. Catal., 2007, vol. 251, p. 113.
Wang, L.G., Ma, Y.B., Wang, Y., Liu, S.M., and Deng, Y.Q., Efficient synthesis of glycerol carbonate from glycerol and urea with lanthanum oxide as a solid base catalyst. Catal. Commun., 2011, vol. 12, p. 1458.
Ye, F., Feng, C., Jiang, J., and Han, S., Simultaneous determination of dopamine, uric acid and nitrite using carboxylated graphene oxide/lanthanum modified electrode. Electrochim. Acta, 2015, vol. 182, p. 935.
Zhang, W., Yuan, R., Chai, Y. Q., Zhang, Y., and Chen, S.H., A simple strategy based on lanthanum–multiwalled carbon nanotube nanocomposites for simultaneous determination of ascorbic acid, dopamine, uric acid and nitrite. Sens. Actuators B Chem., 2012, vol. 166, p. 601.
Elhag, S., HussainIbupoto, Z., Liu, X., Nur, O., and Willander, M., Dopamine wide range detection sensor based on modified Co3O4 nanowires electrode. Sens. Actuators B-Chem., 2014, vol. 203, p. 543.
Koumoto, K. and Yanagida, H., Electrical conduction in pure and Li substituted Co3O4, Commun. Am. Ceram. Soc., 1981, vol. 64, p. C-156.
Jansson, J., Palmqvist, A.E.C., Fridell, E., Skoglundh, M., Österlund, L., Thormählen, P., and Langer, V., On the catalytic activity of Co3O4 in low-temperature CO oxidation. J. Catal., 2002, vol. 211, p. 387.
Cao, A.M., Hu, J.S., Liang, H.P., Song, W.G., Wan, L.J., He, X.L., Gao, X.G., and Xia, S.H., Hierarchically Structured Cobalt Oxide (Co3O4): The Morphology Control and Its Potential in Sensors. J. Phys. Chem., B 2006, vol. 110, p. 15858.
Monk, P.M.S., Mortimer, R.J., and Rosseinsky, D.R., Cambridge University Press, 2007, ISBN-13 978-0-511-50806-6.
Bagheri, H., Arab, S.M., Khoshsafar, H., and Afkhami, A., A novel sensor for sensitive determination of atropine based on a Co3O4-reduced graphene oxide modified carbon paste electrode. New J. Chem., 2015, vol. 39, p. 3875.
Tajik, S., Taher, M.A., and Beitollahi, H., First report for simultaneous determination of methyldopa and hydrochlorothiazide using a nanostructured based electrochemical sensor. J. Electroanal. Chem., 2013, vol. 704, p. 137.
Lu, X.C., Song, L., Ding, T.T., Lin, Y.L., and Xu, C.X., CuS–MWCNT based electrochemical sensor for sensitive detection of bisphenol A. Russ. J. Electrochem., 2017, vol. 53, p. 366.
Beitollahi, H., Ghofrani Ivari, S., and Torkzadeh-Mahani, M., Application of antibody–nanogold–ionic liquid–carbon paste electrode for sensitive electrochemical immunoassay of thyroid-stimulating hormone. Biosens. Bioelectron., 2018, vol. 110, p. 97.
Asadian, E., Shahrokhian, S., Iraji-Zad, A., and Ghorbani-Bidkorbeh, F., Glassy carbon electrode modified with 3D graphene–carbon nanotube network for sensitive electrochemical determination of methotrexate. Sens. Actuators B-Chem., 2017, vol. 239, p. 617.
Baghayeri, M., Beitollahi, H., Akbari, A., and Farhadi, S., Highly Sensitive nanostructured electrochemical sensor based on carbon nanotubes-Pt nanoparticles paste electrode for simultaneous determination of levodopa and tyramine. Russ. J. Electrochem., 2018, vol. 54, p. 292.
Beitollahi, H. and Nekooei, S., Application of a modified CuO nanoparticles carbon paste Eelectrode for simultaneous determination of isoperenaline, acetaminophen and N-acetyl-L-cysteine., Electroanalysis, 2016, vol. 28, p. 645.
Mahmoudi Moghaddam, H., Beitollahi, H., Tajik, S., Jahani, Sh., Khabazzadeh, H., and Alizadeh, R., Voltammetric determination of droxidopa in the presence of carbidopa using a nanostructured base electrochemical sensor. Russ. J. Electrochem., 2017, vol. 53, p. 452.
Nantaphol, S., Chailapakul, O., and Siangproh, W., Sensitive and selective electrochemical sensor using silver nanoparticles modified glassy carbon electrode for determination of cholesterol in bovine serum. Sens. Actuators B-Chem., 2015, vol. 207, p. 193.
Beitollahi, H. and Garkani-Nejad, F., Graphene Oxide/ZnO Nano Composite for Sensitive and Selective Electrochemical Sensing of Levodopa and Tyrosine Using Modified Graphite Screen Printed Electrode. Electroanalysis, 2016, vol. 28, p. 2237.
Han, L., Tao, H., Huang, M., Zhang, Y., Qiao, S., and Shi, R., A hydrogen peroxide biosensor based on multiwalled carbon nanotubes-polyvinyl butyral film modified electrode. Russ. J. Electrochem., 2016, vol. 52, p. 115.
Tajik, S., Taher, M.A., and Beitollahi, H., First report for electrochemical determination of levodopa and cabergoline: application for determination of levodopa and cabergoline in human serum, urine and pharmaceutical formulations. Electroanalysis, 2014, vol. 26, p. 796.
Wang, Y., Wang, S., Tao, L., Min, Q., Xiang, J., Wang, Q., Xie, J., Yue, Y., Wu, S., Li, X., and Ding, H., A disposable electrochemical sensor for simultaneous determination of norepinephrine and serotonin in rat cerebrospinal fluid based on MWNTs-ZnO/chitosan composites modified screen-printed electrode. Biosens. Bioelectron., 2015, vol. 65, p. 31.
Jahani, Sh. and Beitollahi, H., Selective Detection of Dopamine in the Presence of Uric Acid Using NiO Nanoparticles Decorated on Graphene Nanosheets Modified Screen-printed Electrodes. Electroanalysis, 2016, vol. 28, p. 2022.
Idris, A.O., Mafa, J.P., Mabuba, N., and Arotiba, O.A., Nanogold modified glassy carbon electrode for the electrochemical detection of arsenic in water. Russ. J. Electrochem., 2017, vol. 53, p. 170.
Molaakbari, E., Mostafavi, A., and Beitollahi, H., Simultaneous electrochemical determination of dopamine, melatonin, methionine and caffeine, Sens. Actuators B, 2015, vol. 208, p. 195.
Xu, J., Huo, F., Zhao, Y., Liu, Y., Yang, Q., Cheng, Y., Min, S., Jin, Z., and Xiang, Z., In-situ La doped Co3O4 as highly efficient photocatalyst for solar hydrogen generation. Int. J. Hydrog. Energy, 2018, vol. 43, p. 8674.
Khorasani-Motlagh, M., Noroozifar, M., and Jahani, Sh., Preparation and Characterization of Nano-Sized Magnetic Particles LaCoO3 by Ultrasonic-Assisted Coprecipitation Method. Synth. React. Inorg. Met. Org. Chem., 2015, vol. 45, p. 1591.
Bard, A.J. and Faulkner, L.R., Electrochemical Methods: Fundamentals and Applications, second ed., Wiley, N.Y., 2001.
Дополнительные материалы отсутствуют.