Электрохимия, 2019, T. 55, № 5, стр. 587-598
Исследование электрохимическими, спектроскопическими и биологическими методами двух шиффовых оснований, полученных взаимодействием двух различных производных гидроксибензальдегида и сульфаметизола: их синтез, характеристики, in vitro противогрибковая активность и связывание с ДНК из зобной железы теленка
Э. Бичер a, *, В. Пехливан a, Е. Г. Бекироглу b
a Университет Ондокуз Майис
55139 Атакум-самсун, Турция
b Университет Ондокуз Майис
55400 Бафра-самсун, Турция
* E-mail: ebicer@omu.edu.tr
Поступила в редакцию 15.06.2018
После доработки 11.08.2018
Принята к публикации 20.09.2018
Аннотация
Шиффовы основания синтезированованы по реакции сульфаметизола и двух различных производных гидроксибензальдегида (2,3-дигидроксибензальдегид и 2,4,6-тригидроксибензальдегид). Они охарактеризованы методами элементного анализа, 1H-ЯМР и ИК-спектроскопии. На основании полученных данных предположено, что 4,6-дигидроксисалицилальдегид реагирует как с первичными, так и с вторичными аминогруппами сульфаметизола. Способность синтезированованных Шиффовых оснований к связыванию с ДНК из зобной железы теленка при физиологическом значении pH (7.4) исследована методами циклической вольтамперометрии и спектроскопии в УФ- и видимой областях спектра. Экспериментальные результаты подтвердили, что Шиффовы основания могут связываться с ДНК из зобной железы теленка посредством электростатических сил в стехиометрии 1 : 1. Была исследована противогрибковая активность синтезированованных Шиффовых оснований по отношению к Candida albicans (ATCC 10231), и определены минимальные концентрации ингибитора. У Шиффова основания 1, синтезированованного на основе 2,3-дигидроксибензальдегида, эта минимальная концентрация ингибитора меньше, чем у Шиффова основания 2, синтезированованного на основе 2,4,6- тригидроксибензальдегида. Несмотря на то, что Шиффово основание 2 связывается с ДНК из зобной железы теленка с бóльшим сродством, чем Шиффово основание 1, оно менее эффективно противt Candida albicans, чем Шиффово основание 1.
ВВЕДЕНИЕ
Шиффовы основания получают, как правило, по реакции первичных аминов с карбонильными соединениями [1, 2]. Лекарства, содержащие сульфонамидную группу, могут потенциально быть использованы для лечения ряда болезней. Шиффовы основания, синтезированные из сульфонамидов, привлекают большое внимание биохимиков [3, 4]. Особенно большое значение для лечения болезней имеет синтез более эффективных фармацевтических препаратов.
ДНК жизненно важна для живых организмов, благодаря передаче генетического кода при синтезе белков. Исследование взаимодействия лекарств с ДНК имеет большое значение в изучении их биологической активности; в последнее десятилетие это сделалось привлекательной областью исследований [5].
К тому же взаимодействия лекарств с ДНК очень важны для проектирования и синтеза новых лекарств, нацеленных на ДНК. Эффективность лекарств зависит как от типа процессов связывания, так и от их сродства [6, 7].
Электрохимические методы часто используют при исследовании взаимодействий между небольшими молекулами и ДНК [8]. Для оценки механизма взаимодействий особенно полезны вольтамперометрические методы [9–13].
Cульфаметизол – сульфонамидный антибиотик [14]. сульфонамиды – это синтетические бактериостатические антибиотики с широким спектром действия против большинства грамположительных и многих грамотрицательных организмов. сульфонамиды не эффективны в лечении вирусных инфекций [14]. Синтез и противогрибковую активность новых производных сульфаметизола исследовали в работе [15]. Было показано, что эти новые сульфониламидные производные обладают более высокой противогрибковой активностью in vitro по отношению к C. albicans, чем сульфаметизол [15]. В предшествующей работе [16] мы показали возможность синтеза Шиффовых оснований путем конденсации сульфаметизола с 3-метокси- и 5-нитросалицилальдегидами. Было исследовано их взаимодействие с ДНК из зобной железы теленка при физиологическом значении pH. В настоящей работе синтезированованы Шиффовы основания 2,3-дигидроксибензальдегида и 2,4,6-тригидроксибензальдегида с сульфаметизолом. Они охарактеризованы методами элементного анализа, 1H-ЯМР, ИК-спектроскопии с преобразованием Фурье и УФ-спектроскопии. В частности, мы уделили внимание интересному и необычному поведению 2,4,6-тригидроксибензальдегида. Кроме того, методами вольтамперометрии и спектроскопии в УФ- и видимой частях спектра было исследовано связывание Шиффовых оснований с ДНК из зобной железы теленка при физиологическом значении pH (7.4).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Приборы
Вольтамперометрические эксперименты проводили с помощью полярографического анализатора EG&G PAR 384B, укомплектованного стендом EG&G PARC 303A. Вольтамперограммы записывали в трехэлектродной ячейке с Ag|AgCl|KClsat-электродом сравнения, противоэлектродом в виде платиновой проволочки и рабочим электродом в виде висящей ртутной капли. Перед каждым электрохимическим измерением ячейку продували азотом для удаления растворенного кислорода из раствора. Циклические вольтамперограммы анализировали с помощью программы ECDSOFT [17]. Значение pH измеряли рН-метром Jenway 3010.
Точку плавления Шиффовых оснований измеряли прибором Stuart Melting Point 30. Элементный анализ проводили на анализаторе LECO, CHNS-932, а спектры 1H-NMR Шиффовых оснований снимали в ДМСОO-d6 на спектрометре Bruker Biospin (300 МГц), с использованием тетраметилсилана в качестве внутреннего стандарта, в Центральной лаборатории Средневосточного технического университета (METU, Анкара, Турция). ИК-спектры с преобразованием Фурье снимали с помощью спектрометра Bruker Vertex 80V в области волновых чисел от 650 до 4000 см–1. Электронные спектры соединений получали на спектрометре Thermo Scientific Evolution Array EA-1301005 UV-Vis.
Реактивы
Сульфаметизол был приобретен у компании Sigma–Aldrich и использовался без дополнительной очистки. ДНК из зобной железы теленка была приобретена также у компании Sigma–Aldrich. 2,3-дигидроксибензальдегид и 2,4,6-тригидроксибензальдегид были приобретены у компании Merck. Все остальные реактивы имели квалификацию “ч. д. а.” и использовались без дополнительной очистки. Все растворы готовили на деионизованной сверхчистой воде (удельное сопротивление 18.2 MΩ см), которую получали на системе очистки воды MINI PURE DEST-UP. Если не указано иное, исходные растворы Шиффовых оснований 1 и 2 готовили ежедневно, растворяя их, соответственно, в горячем метаноле и смеси вода–диметилформамид (1 : 1 по объему), а затем разбавляли теми же растворителями до нужной концентрации. 0.02 M фосфатный буферный раствор (pH 7.4) готовили из 0.5 M раствора H3PO4 и доводили до нужного значения pH с помощью 0.5 M раствора NaOH.
2.5 × 10–4 M раствор ДНК из зобной железы теленка
Исходный раствор ДНК из зобной железы теленка готовили, растворяя нужное количество (1 × 10–3 г) ДНК в сверхчистой воде (50 мл), и хранили при температуре 4°C. Согласно описанному в литературе методу [18], результирующую концентрацию раствора ДНК из зобной железы определяли методом УФ-спектроскопии по поглощению света с длиной волны 260 нм, с использованием молярного коэффициента поглощения (ε260 = 6600 M–1 см–1 в расчете на нуклеиновое основание). Также по спектру поглощения раствора ДНК из зобной железы теленка установлено, что отношение поглощениия при 260 нм к поглощению при 280 нм (A260/A280) превышает 1.8. Это означает, что ДНК из зобной железы теленка в достаточной мере свободно от белков [19–22].
Синтез и характеристики Шиффовых оснований
Для синтеза Шиффовых оснований смеси 2,3-дигидроксибензальдегида и 2,4,6-тригидроксибензальдегида с сульфаметизолом в нужных количествах (мольное отношение 1 : 1) кипятились с обратным холодильником в течение 4–5 ч при непрерывном помешивании в метаноле при 70–80°C (схема 1 ). По завершении реакции смесям давали остыть до комнатной температуры. Полученные твердые продукты красного цвета отфильтровывали, промывали холодным метанолом и сушили. Удивительным образом, элементный анализ показал, что Шиффовы основания 1 и 2 были получены при мольном отношении альдегид : амин равном, соответственно, 1 : 1 и 2 : 1.
Схема 1 . Предполагаемый механизм синтеза Шиффовых оснований 2,3-дигидроксибензальдегида и 2,4,6-тригидроксибензальдегида с сульфаметизолом.
Хорошо известно, что альдегиды реагируют как с первичными (RNH2), так и с вторичными аминами (R2NH), образуя карбиноламины, которые затем дегидратируются с образованием замещенных, соответственно, иминов и энаминов [23–25].
В настоящей работе отличие в стехиометрии реакции и устойчивости Шиффова основания 2 можно объяснить положением гидроксильных групп и структурой исходного альдегида. В дополнение можно сказать, что субъект совместного катализа метанол облегчает образование энамина [26]. С другой стороны, полученные Шиффовы основания демонстрируют различные таутомерные формы в растворе через гидроксильные группы [27–29].
Шиффово основание 1, выход: 74% (точка плавления 223–224°C); CHNS-анализ: найдено, %: C, 48.82; H, 3.79; N, 14.54; S, 16.75; расчет, %: C, 49.22; H, 3.61; N, 14.35; S, 16.43. 1H ЯМР (тетраметилсилан, ДМСО-d6) δ ppm: 2.2 (метильный протон, C–CH3), 6.5 – 7.9 (мультиплет, протоны ароматического ядра), 8.9 (синглет, –CH=N), 9.3 (синглет, фенольные протоны), 12.6 (яркий синглет, 1H, SO2–NH–). Полосы в ИК-спектрах с преобразованием Фурье (см–1): ν (O–H str) 3451; ν (N–H str) 3143; ν (–C=N–) 1622, 1548; ν (C–O) 1279; ν (C=N)кольцо 1461; ν (C–N) 1223; νa (SO2) 1318; νs (SO2) 1151; ν (S–N) 916; ν (C–S) 837. Электронные спектры (λmax/нм, в растворителе диметилформамиде): 260 (π → π*, ароматическое кольцо; ε260 = 918 M–1 см–1) и 319 (n → π*, фенол–иминная форма; ε319 = 745 M–1 см–1).
Шиффово основание 2, выход: 54% (точка плавления 275–276°C); CHNS-анализ: найдено, %: C, 47.48; H, 4.15; N, 9.90; S, 11.08; расчет, %: C, 47.74; H, 3.83; N, 9.68; S, 11.08. 1H ЯМР, (тетраметилсилан, ДМСО-d6) δ ppm: 2.4 (метильный протон, C–CH3), 5.5 – 8.0 (мультиплет, протоны ароматического ядра), 8.9 (синглет, –CH=N), 8.7 (дублет, =CH–NH), 8.2 (синглет, =CH–N<), 10.9 и 11.1 (синглет, фенольные протоны). Полосы в ИК-спектрах с преобразованием Фурье (см–1): ν (яркая, O–H str) 3350–3650; ν (C=O)водородная связь или (C=C)кольцо 1570; ν (–C=N–) 1611; 1544; ν (C–O) 1272; ν (C=N)кольцо 1442; ν (C–N) 1227; νa (SO2) 1353; νs (SO2) 1136; ν (S–N) 921; ν (C–S) 828. Электронные спектры (λmax/нм, в растворителе диметилформамиде): 278, 298 (π → π*, ароматическое кольцо, фенол–иминная форма; ε278 = 15 909 M–1 см–1, ε298 = = 15 669 M–1 см–1) и 518 (n → π*, кето-энаминная форма; ε518 = 6706 M–1 см–1).
In vitro антимикробный анализ
Для того, чтобы определить антимикробную активность полученных веществ, мы использовали метод минимальной концентрации ингибитора (Minimum Inhibitor Concentration), в соответствии с директивой Clinical and Laboratory Standards Institute (CLSI) в отношени образцов дрожжей [30]. В качестве работающего микроорганизма был быбран стандарт – дрожжевой штамм Candida albicans ATCC 10231, в качестве контрольного соединения – сульфаметизол.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Исследования противогрибковой активности
В табл. 1 показаны результаты метода минимальной концентрации ингибитора (МIC) для исходного соединения и синтезированых Шиффовых оснований. Из таблицы видно, что эффективная активность 2,3-дигидроксибензальдегида и 2,4,6-тригидроксибензальдегида по отношению к C. albicans ATCC 10231 выше, чем активность сульфаметизола: значения MIC равны, соответственно, 4 и 8 мкг/мл по сравнению с 32 мкг/мл. Одновременно Шиффовы основания 1 и 2 показали значительную противогрибковую активность по отношению к C. albicans: значения MIC равны, соответственно, 8 и 16 мкг/мл. Сравнительные результаты MIC показывают, что Шиффово основание, синтезированованное из 2,3-дигидроксибензальдегида (Шиффово основание 1), обладает большей ингибиторной активностью по отношению к C. albicans, чем Шиффово основание, синтезированованное из 2,4,6-тригидроксибензальдегида (Шиффово основание 2).
Таблица 1.
Результаты измерений минимальной концентрации ингибитора (MIC) исходных соединений и синтезированованных Шиффовых оснований
| Соединение | MIC, мкг/мл |
|---|---|
| Сульфаметизол | 32 |
| 2,3-Дигидроксибензальдегид | 4 |
| 2,4,6-Тригидроксибензальдегид | 8 |
| Шиффово основание 1 | 8 |
| Шиффово основание 2 | 16 |
Что касается механизма действия сульфонамидов и их производных на дрожжевые организмы, мы не нашли в литературе результатов соответствующих исследований. Однако, полученные в настоящей работе результаты показывают, что синтезированные производные (Шиффовы основания 1 и 2) эффективны по отношению к Candida albicans. Для полной оценки их эффективности потребуется дальнейшее экспериментальное исследование.
Исследования электрохимической активности
На циклической вольтамперограмме Шиффова основания 1 (рис. 1) на прямом ходе развертки потенциала можно видеть пять катодных пиков тока при потенциалах, соответственно, –0.172 (Ic), ‒0.288 (IIc), –1.148 (IIIc), –1.464 (IVc) и –1.560 В (Vc). Однако, при обратной развертке потенциала наблюдаются лишь два анодных пика при потенциалах –0.088 (Ia) и –0.236 В (IIa). Для первого окислительно-восстановительного процесса разность потенциалов анодного и катодного пиков тока (∆Ep = Ep, a – Ep, c) равняется 84 мВ, а отношение анодного пикового тока (Ip, a) к катодному пиковому току (Ip, c) меньше 1. Эти результаты отличаются от параметров обратимого процесса (∆Ep = = 59/n мВ и Ip, a/Ip, c = 1). Таким образом, первый окислительно-восстановительный процесс можно описать, как квазиобратимый одноэлектронный перенос, контролируемый адсорбцией. Для того, чтобы подтвердить адсорбционный контроль этого окислительно-восстановительного процесса на ртутном электроде, было изучено влияние скорости развертки потенциала ($\text{v}$) на пиковые токи. Зависимость тока от скорости развертки потенциала для первого катодного пика показано, что в области от 200 до 1000 мВ с–1 существует линейная зависимость (рис. 2а), типичная для процессов, контролируемых адсорбцией [31–33]. Эта зависимость выражается следующим выражением линейной регрессии:
Рис. 1.
Циклическая вольтамперограмма 1.67 × 10–4 M Шиффова основания 1 в 0.02 M фосфатном буферном растворе (pH 7.4). Другие экспериментальные условия: скорость развертки потенциала 500 мВ с–1; ступень потенциала 4 мВ; средний размер Hg-капли; время установления равновесия 5 с.
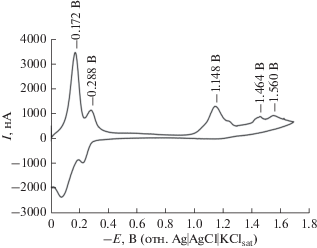
Рис. 2.
Графики (а) зависимости Ip от $v,$ (б) зависимости lgIp от $\lg v$ для катодного пика тока при –0.172 В на циклической вольтамперограмме Шиффова основания 1 в 0.02 M фосфатном буферном растворе (pH 7.4).
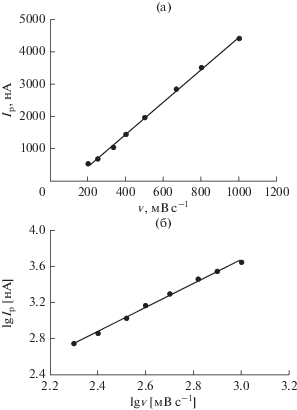
В дополнение к этому, график зависимости lgIp от $\lg \text{v}$ (рис. 2б) – это прямая с наклоном равным 1.3, что близко к теоретическому значению 1.0 для электродных процессов, контролируемых адсорбцией [31–33]. Получено следующее уравнение линейной регрессии:
Для другого окислительно-восстановительного процесса разность потенциалов анодного и катодного пиков тока (∆Ep = 52 мВ) очень близка к таковой для обратимого одноэлектронного перехода (59 мВ), и Ipa/Ipc ≅ 1.
Центрами высокой электронной плотности в молекулярной структуре Шиффова основания являются атомы O в гидроксильных группах и атомы N в группе –CH=N–. Поэтому эти атомы – активные центры и, как следует ожидать, они более эффективны в связывании с поверхностью ртути. Принимая во внимание электрохимическое поведение полифенольных соединений [34] и сульфадиазола [35] на ртутном электроде в виде висящей капли при физиолоическом значении pH, мы приписали катодные процессы при –0.172 и ‒0.288 В восстановлению, соответственно, комплекса Hg(II)–Шиффово основание 1 до комплекса Hg(I)–Шиффово основание 1 и этого последнего комплекса до Hg.
Потенциал –1.148 В и форма третьего катодного пика весьма похожи на таковые для восстановления групп –CH=N– в гидрохлориде буспирона [36] и лозартане [37]. Таким образом, можно утверждать, что пик тока при –1.148 В отвечает восстановлению иминогруппы в молекуле Шиффова основания 1.
В общем случае, арилсульфонамиды очень устойчивы по отношению к восстановлению; лишь при радикальных условиях связь S–N разрывается, и выделяется аммиак или анилин [38]. Однако, в водном растворе наблюдается иное поведение. В боратных буферных растворах на Hg-электродах разрыв происходит по связи ArS [39]. Реакция протекает по следующей схеме:
(3)
${\text{ArS}}{{{\text{O}}}_{2}}{\text{N}}{{{\text{H}}}_{2}} + 2{{{\text{e}}}^{ - }} + {{{\text{H}}}^{ + }} \to {\text{ArH}} + {\text{S}}{{{\text{O}}}_{2}}{\text{NH}}_{2}^{ - },$(4)
${\text{S}}{{{\text{O}}}_{{\text{2}}}}{\text{NH}}_{2}^{ - } + {{{\text{H}}}_{{\text{2}}}}{\text{O}} \to {\text{HSO}}_{3}^{ - } + {\text{N}}{{{\text{H}}}_{3}}.$Разрыв по связи имеет место, если бензольное кольцо замещено на группы, отнимающие электрон [39].
Сообщалось, что потенциалы полуволны (по шкале насыщенного каломельного электрода) замещенных бензосульфонамидов в боратном буферном растворе (pH 9.3) лежат в области от ‒1.589 до –1.860 В. Для некоторых сульфонамидных соединений наблюдалась одна двухэлектронная волна в области pH от 7 до 12. При более низких значениях pH эта волна перекрывается с волной восстановления индифферентного электролита [38]. Небольшие пики тока при –1.464 и –1.560 В можно приписать, соответственно, восстановлению группы Ar–SO2NH– [38, 40] и каталитическому выделению водорода [41].
С другой стороны, на прямом ходе кривой Шиффово основание 2 дает пять катодных пиков тока при –0.580, –1.138, –1.258, –1.428 и –1.554 В (рис. 3). На обратном ходе видны два анодных пика при –0.288 и –1.186 В.
Рис. 3.
Циклическая вольтамперограмма 9.10 × 10–5 M Шиффова основания 2 в 0.02 M фосфатном буферном растворе (pH 7.4). Другие экспериментальные условия: скорость развертки потенциала 500 мВ с–1; ступень потенциала 4 мВ; средний размер Hg-капли; время установления равновесия 5 с.
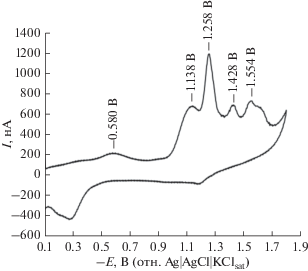
При сравнении с вольтамперограммой Шиффова основания 1 видно, что Шиффово основание 2 не образует электроактивных солей с ртутью. Невысокая волна при –0.580 В, плечо при –1.138 В и анодные пики при –0.288 и –1.186 В могут быть следствием адсорбционных процессов Шиффова основания 2 и продуктов электродных процессов с его участием, протекающих на поверхности ртутного электрода. Подобно случаю Шиффова основания 1, другие пики тока (при ‒1.258, –1.428 и –1.554 В) связаны с восстановлением групп –CH=N–, –SO2–NH– и каталитическим выделением водорода.
Исследовае связывания с ДНК из зобной железы теленка
Вольтамперометрия. В условиях нашего эксперимента ДНК из зобной железы теленка электрохимически не активна на ртутном электроде в виде висящей капли в области прикладываемых потенциалов. Мы исследовали связывание Шиффовых оснований 1 и 2 с ДНК из зобной железы теленка в физиологическом растворе (pH 7.4) методом циклической вольтамперометрии. С этой целью мы выбрали катодные пики при –1.148 и –1.258 В, связанные с восстановлением иминных групп в Шиффовых основаниях 1 и 2. На рис. 4 и 5 показаны изменения циклических вольтамперограмм Шиффовых оснований 1 и 2 в присутствии различных концентраций ДНК из зобной железы теленка. С ростом концентрации этой ДНК токи в главных пиках Шиффовых оснований 1 и 2 уменьшаются. Кроме того, потенциалы пиков тока Шиффового основания 1 сдвигаются к более отрицательным значениям (рис. 4). В то же время не наблюдается сколько-нибудь заметного сдвига потенциала пиков тока Шиффова основания 2 в присутствии ДНК из зобной железы теленка (рис. 5).
Рис. 4.
Циклические вольтамперограммы 1.25 × 10–4 M Шиффова основания 1 в фосфатном буферном растворе (pH 7.4) в отсутствие (a) и в присутствии (б) 1.05 × 10–7, (в) 3.14 × 10–7, (г) 7.20 × 10–7, (д) 1.02 × × 10–6, (е) 1.49 × 10–6, (ж) 1.95 × 10–6, (з) 2.82 × 10–6, (и) 3.63 × 10–6, (к) 4.38 × 10–6 M ДНК из зобной железы теленка. Другие экспериментальные условия: скорость развертки потенциала 500 мВ с–1; ступень потенциала 4 мВ; средний размер Hg-капли; время установления равновесия 5 с.

Рис. 5.
Циклические вольтамперограммы 8.81 × 10–5 M Шиффова основания 2 в фосфатном буферном растворе (pH 7.4) в отсутствие (a) и в присутствии (б) 1.15 × 10–7, (в) 2.29 × 10–7, (г) 3.42 × 10–7, (д) 4.54 × × 10–7, (е) 5.64 × 10–7, (ж) 6.74 × 10–7, (з) 7.83 × 10–7M ДНК из зобной железы теленка. Другие экспериментальные условия: скорость развертки потенциала 500 мВ с–1; ступень потенциала 4 мВ; средний размер Hg-капли; время установления равновесия 5 с.

Это заметное снижение пикового тока можно объяснить образованием медленно диффундирующих макромолекулярных комплексов Шиффово основание – ДНК из зобной железы теленка, в результате чего уменьшается концентрация свободного Шиффова основания (ответственного за протекание тока) [21].
Характер взаимодействия между Шиффовыми основаниями и ДНК из зобной железы теленка можно установить по изменению потенциалов. Если потенциал катодного пика тока становится отрицательнее вследствие взаимодействия небольшой молекулы с ДНК, то такое взаимодействие носит электростатический характер [42]. Таким образом, хорошо выраженный “катодный” сдвиг потенциала пиков тока Шиффова основания 1 при добавлении ДНК из зобной железы теленка следует приписать электростатическому взаимодействию между этими молекулами.
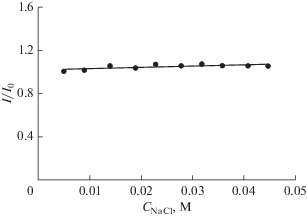
Мы также исследовали влияние ионной силы на связывание Шиффовых оснований с ДНК из зобной железы теленка. При изменении концентрации NaCl от 0.004 до 0.035 M наблюдались различные эффекты ионной силы на это взаимодействие. С ростом ионной силы главный пик тока Шиффова основания 1 в присутствии ДНК из зобной железы теленка снижался по экспоненциальному закону и в конце концов уменьшился приблизительно до 72% от его высоты в отсутствие NaCl (рис. 6).
Рис. 6.
График зависимости I/I0 от концентрации NaCl для пика на циклической вольтамперограмме Шиффова основания 1 при –1.148 В. Экспериментальные условия: 7.69 × 10–5 M Шиффово основание 1 + 2.93 × 10–6 M ДНК из зобной железы теленка в 0.02 M фосфатном буферном растворе (pH 7.4). I0 и I – значения пиковых токов, соответственно, в отсутствие и в присутствии NaCl. Другие экспериментальные условия: скорость развертки потенциала 500 мВ с–1; ступень потенциала 4 мВ; средний размер Hg-капли; время установления равновесия 5 с.
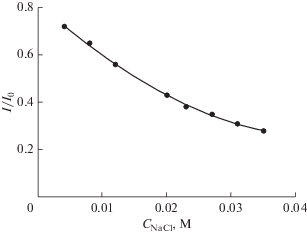
Этот результат указывает на электростатическое взаимодействие Шиффова основания 1 с ДНК из зобной железы теленка, поскольку ионное окружение может оказывать влияние на электрохимические взаимодействия через ионный экранирующий эффект [21]. Эффективность такого ионного экранирования увеличивается с ростом ионной силы раствора, так что следует ожидать снижения пикового тока при увеличении ионной силы раствора [21]. При электростатических взаимодействиях, когда Шиффово основание 1 остается в контакте со средой, это влияние ионной силы кажется вполне объяснимым [21].
В противоположность вышеописанному поведению, для комплекса Шиффово основание 2–ДНК из зобной железы теленка не наблюдалось сколько-нибудь существенного изменения тока в главном пике восстановления при увеличении ионной силы раствора (рис. 7). Эти данные подчеркивают, что взаимодействие Шиффова основания 2 с ДНК из зобной железы теленка не зависит от концентрации соли и носит характер, главным образом, комплексов включения [7]. В этом взаимодействии, где Шиффово основание 2 выходит из растворителя и включается внутрь “карманов” пары оснований ДНК, ионная сила среды с меньшей вероятностью может повлиять на вольтамперометрический ток [21].
Рис. 7.
График зависимости I/I0 от концентрации NaCl для пика на циклической вольтамперограмме Шиффова основания 2 при –1.258 В. Экспериментальные условия: 2.26 × 10–5 M Шиффово основание 2 + + 6.89 × 10–7 M ДНК из зобной железы теленка в 0.02 M фосфатном буферном растворе (pH 7.4). I0 и I – значения пиковых токов, соответственно, в отсутствие и в присутствии NaCl. Другие экспериментальные условия: скорость развертки потенциала 500 мВ с–1; ступень потенциала 4 мВ; средний размер Hg-капли; время установления равновесия 5 с.
На основе результатов, полученных как по влиянию концентрации соли, так и по изменению главных пиков тока восстановления Шиффовых оснований 1 и 2 в присутствии ДНК из зобной железы теленка, можно заключить, что взаимодействие между Шиффовыми основаниями 1 и 2 и ДНК из зобной железы теленка является электростатическим, несмотря на образование комплексов включения и не электроактивных комплексов Шиффова основания 2 с ДНК из зобной железы теленка
Исследование спектров поглощения. Взаимодействие между Шиффовыми основаниями 1 и 2 и ДНК из зобной железы теленка было исследовано также методом электроных спектров поглощения. На рис. 8 и 9 показаны спектры поглощения Шиффовых оснований 1 и 2 в отсутствие и в присутствии ДНК из зобной железы теленка. В фосфатном буферном растворе (pH 7.4) длины волн максимумов поглощения Шиффовых оснований 1 и 2 (рис. 8 и 9) отличаются от полученных в чистом диметилформамиде в качестве растворителя (см. раздел “Экспериментальная часть”). Это различие может быть вызвано средой. В случае Шиффова основания 1 поглощение при 319 нм (которое наблюдается в диметилформамиде с ε319 = 745 M–1 см–1) исчезает в фосфатном буфере (pH 7.4). Также максимум поглощения при 260 нм сдвинут в сторону более длинных волн (267 нм), предположительно из-за изменения полярности среды [43]. Более того, коэффициент поглощения при 267 нм (ε267 = 28 023 M–1 см–1) явно выше, чем в чистом диметилформамиде (ε260 = = 918 M–1 см–1). Шиффово основание 2 в фосфатном буфере (pH 7.4) демонстрирует полосы поглощения при 241, 273, 303 и 518 нм (соответственно, ε241 = 18 253 M–1 см–1, ε273 = 14 891 M–1 см–1, ε303 = = 15 216 M–1 см–1 и ε518 = 4642 M–1 см–1). Однако, полоса поглощения при 241 нм в чистом диметилформамиде не наблюдается. Полосы поглощения (в чистом диметилформамиде) при 278 и 298 нм сдвинуты, соответственно, к 273 и 303 нм (в фосфатном буферном растворе).
Рис. 8.
Спектры поглощения в УФ- и видимой областях 8.35 × 10–5 M Шиффова основания 1 в фосфатном буферном растворе (pH 7.4). I0 и I – значения пиковых токов, соответственно, в отсутствие (а) и в присутствии (б) 2.08 × 10–7, (в) 3.03 × 10–7, (г) 6.36 × × 10–7, (д) 8.46 × 10–7, (е) 1.06 × 10–6, (ж) 1.27 × 10–6, (з) 1.48 × 10–6, (и) 1.69 × 10–6 M ДНК из зобной железы теленка.
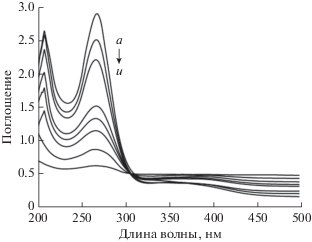
Рис. 9.
Спектры поглощения в УФ- и видимой областях 8.35 × 10–5 M Шиффова основания 2 в фосфатном буферном растворе (pH 7.4) в отсутствие (а) и в присутствии (б) 4.24 × 10–7, (в) 6.36 × 10–7, (г) 8.46 × × 10–7, (д) 1.48 × 10–6 M ДНК из зобной железы теленка.

Связывание Шиффовых оснований 1 и 2 с ДНК из зобной железы теленка вызывает изменения в спектрах. С ростом концентрации ДНК из зобной железы теленка, полосы поглощения при 267 и 241 нм, соответственно, Шиффовых оснований 1 и 2 демонстрируют значительный гипохромный эффект. Этот гипохромизм полосы поглощения Шиффова основания 1 при 267 нм достигает 94%, в то время как для полосы поглощения Шиффова основания 2 при 241 нм он равен 13%. Однако, в присутствии ДНК из зобной железы теленка не наблюдается сколько-нибудь значительного сдвига полос поглощения Шиффовых оснований 1 и 2. Обычно, когда небольшая молекула взаимодействует с ДНК, должны наблюдаться изменения в ее поглощении (гипохромизм) [44].
Вышеописанные спектральные изменения позволяют выявить особенности взаимодействия Шиффовых оснований 1 и 2 с ДНК из зобной железы теленка. Для того, чтобы получить константы связывания (K) и стехиометриию комплексов ДНК из зобной железы теленка с Шиффовыми основаниями, мы использовали как электрохимические, так и спектроскопические методы (см. следующий раздел).
Исследование констант связывания и стехиометрии. Принимается, что в результате связывания Шиффовых оснований с ДНК из зобной железы теленка образуются только комплексы с отношением компонентов 1 : 1. Поэтому константы связывания Шиффовых оснований с ДНК из зобной железы теленка можно получить из изменений пиковых токов с ростом концентрации ДНК из зобной железы теленка в соответствии со следующим уравнением [45]:
(5)
$\begin{gathered} {\text{lg}}\left( {{1 \mathord{\left/ {\vphantom {1 {\left[ {{\text{Д Н К и з з о б н о й ж е л е з ы т е л е н к а }}} \right]}}} \right. \kern-0em} {\left[ {{\text{Д Н К и з з о б н о й ж е л е з ы т е л е н к а }}} \right]}}} \right) = \\ = {\text{lg}}K + {\text{lg}}({I \mathord{\left/ {\vphantom {I {({{I}_{0}}--I)}}} \right. \kern-0em} {({{I}_{0}}--I)}}), \\ \end{gathered} $Рис. 10.
График зависимости lg(1/[ДНК из зобной железы теленка]) от lg(I/(I0 – I)) для Шиффова основания 1. Экспериментальные условия: 1.25 × 10–4 M Шиффово основание 1 в 0.02 M фосфатном буферном растворе (pH 7.4).
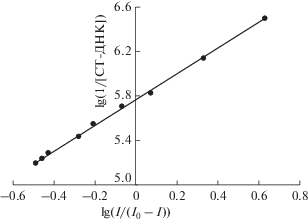
Рис. 11.
График зависимости lg(1/[ДНК из зобной железы теленка]) от lg(I/(I0 – I)) для Шиффова основания 2. Экспериментальные условия: 8.81 × 10–5 M Шиффово основание 2 в 0.02 M фосфатном буферном растворе (pH 7.4).
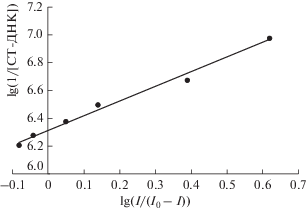
Таблица 2.
Константы связывания, вычисленные из данных циклической вольтамперометрии и спектроскопии в УФ- и видимой областях
| Взаимодействие в системе | K, M–1 | |
|---|---|---|
| циклическая вольтамперометрия | спектроскопия | |
| Шиффово основание 1 + ДНК из зобной железы теленка | 5.91 × 105 | 5.52 × 105 |
| Шиффово основание 2 + ДНК из зобной железы теленка | 2.08 × 106 | 1.77 × 106 |
Принимая наиболее обычное значение для отношения хозяин–гость равным 1 : 1 и основываясь на изменении концентрации ДНК из зобной железы теленка при постоянной концентрации Шиффового основания, мы определили константы связывания (K) также из спектров поглощения с помощью следующего уравнения [46]:
(6)
$\begin{gathered} \left[ {{{{{A}_{0}}} \mathord{\left/ {\vphantom {{{{A}_{0}}} {\left( {A--{{A}_{0}}} \right)}}} \right. \kern-0em} {\left( {A--{{A}_{0}}} \right)}}} \right] = [{{{{\varepsilon }_{G}}} \mathord{\left/ {\vphantom {{{{\varepsilon }_{G}}} {({{\varepsilon }_{{H - G}}}--{{\varepsilon }_{G}})}}} \right. \kern-0em} {({{\varepsilon }_{{H - G}}}--{{\varepsilon }_{G}})}}] + [{{{{\varepsilon }_{G}}} \mathord{\left/ {\vphantom {{{{\varepsilon }_{G}}} {({{\varepsilon }_{{H - G}}}--{{\varepsilon }_{G}})}}} \right. \kern-0em} {({{\varepsilon }_{{H - G}}}--{{\varepsilon }_{G}})}}] \times \\ \times \,\,\,({1 \mathord{\left/ {\vphantom {1 K}} \right. \kern-0em} K}\left[ {{\text{Д Н К и з з о б н о й ж е л е з ы т е л е н к а }}} \right]), \\ \end{gathered} $Рис. 12.
График зависимости A0/(A – A0) от [ДНК из зобной железы теленка]–1 для Шиффова основания 1. Экспериментальные условия: 8.35 × 10–5 M Шиффово основание 1 в 0.02 M фосфатном буферном растворе (pH 7.4) (поглощение измерено при длине волны 267 нм).

Рис. 13.
График зависимости A0/(A – A0) от [ДНК из зобной железы теленка]–1 для Шиффова основания 2. Экспериментальные условия: 8.35 × 10–5 M Шиффово основание 2 в 0.02 M фосфатном буферном растворе (pH 7.4) (поглощение измерено при длине волны 241 нм).

На основе результатов, полученных с использованием методов как циклических вольтамперограмм, так и спектров поглощения в УФ- и видимой областях (табл. 2), можно заключить, что константа связывания для Шиффова основания 2 больше, чем для Шиффова основания 1. Этот результат показывает, что Шиффово основание 2 обладает бóльшим сродством к ДНК из зобной железы теленка, чем Шиффово основание 1.
ЗАКЛЮЧЕНИЕ
В настоящей работе Шиффовы основания 1 и 2 были синтезированы по реакции сульфаметизола с 2,3-дигидроксибензальдегидом и 2,4,6-тригидроксибензальдегидом и охарактеризованы методами элементного анализа и спектроскопии. Исследована также их противогрибковая активность. Кроме того, мы исследовали связывание Шиффовых оснований 1 и 2 с ДНК из зобной железы теленка при физиологическом значении pH методами электронных спектров поглощения и циклической вольтамперометрии. Вольтамперометрические и спектроскопические (в УФ- и видимой областях спектра) данные подтверждают, что между Шиффовыми основаниями и ДНК из зобной железы теленка образуются комплексы со стехиометрией 1 : 1. Электрохимические измерения показали, что основную роль в связывании Шиффовых оснований с ДНК из зобной железы теленка играют электростатические силы. С другой стороны, в основе взаимодействия между Шиффовым основанием 2 и ДНК из зобной железы теленка может лежать образование комплексов включения и неэлектроактивных комплексов.
Константа связывания Шиффова основания 2 больше, чем константа связывания Шиффова основания 1, и это может указывать на то, что силы, связывающие ДНК из зобной железы теленка и Шиффово основание 2, сильнее сил, связывающих Шиффово основание 1. Однако, Шиффово основание 1 демонстрирует более сильную противогрибковую активность (MIC = 8 мкг мл–1), чем Шиффово основание 2 (MIC = 16 мкг мл–1), по отношению к Candida albicans. Наконец, сродство ДНК из зобной железы теленка при связывании с синтезированными Шиффовыми основаниями обратно пропорционально противогрибковой активности.
Часть данного исследования была представлена, как постер на Международной евразиатской конференции по биологическим и химическим наукам (EurasianBioChem 2018), 26–27 апреля 2018, Анкара, Турция).
Список литературы
Khan, F., Khan, S., Athar, A., Ahmed, W., Zia-ul-Haq, and Khan, Z., Synthesis, Spectral Characterization and Antibacterial Study of a Schiff Base Metal Complexes Derived from N-[(E)-(5-Chloro-2-Hydroxyphenyl)Methylidene]-4-Nitrobenzenesulfonamide, American-Eurasian J. Agric. Environ. Sci., 2015, vol. 15, p. 216.
Kumar, G., Kumar, D., Singh, C.P., Kumar, A., and Rana, V.B., Synthesis, physical characterization and antimicrobial activity of trivalent metal Schiff base complexes, J. Serb. Chem. Soc., 2010, vol. 75, p. 629.
Xiao, Y.-J., Diao, Q.-C., Liang, Y.-H., and Zeng, K., Two novel Co(II) complexes with two different Schiff bases: inhibiting growth of human skin cancer cells, Braz. J. Med. Biol. Res., 2017, vol. 50, p. e6390.
Han, R., Sun, Y., Kang, C., Sun, H., and Wei, W., Amphiphilic dendritic nanomicelle-mediated co-delivery of 5-fluorouracil and doxorubicin for enhanced therapeutic efficacy, J. Drug Target., 2017, vol. 25, p. 140.
Sohrabi, N., Rasouli, N., and Kamkar, M., Synthesis, Synthesis, Characterization and DNA Interaction Studies of (N,N'-Bis(5-phenylazosalicylaldehyde)-ethylenediamine) Cobalt(II) Complex, Bull. Korean Chem. Soc., 2014, vol. 35, p. 2523.
Ni, Y., Lin, D., and Kokot, S., Synchronous fluorescence and UV-vis spectrometric study of the competitive interaction of chlorpromazine hydrochloride and Neutral Red with DNA using chemometrics approaches, Talanta, 2005, vol. 65, p. 1295.
Temerk, Y. and Ibrahim, H., Electrochemical studies and spectroscopic investigations on the interaction of an anticancer drug flutamide with DNA and its analytical applications J. Electroanal. Chem., 2015, vol. 736, p. 1.
Carter, M.T. and Bard, A.J., Voltammetric studies of the interaction of tris(1,10-phenanthroline)cobalt(III) with DNA, J. Am. Chem. Soc., 1987, vol. 109, p. 7528.
Ahmadi, F., Alizadeh, A.A., Bakhshandeh-Saraskanrood, F., Jafari, B., and Khodadadian, M., Experimental and computational approach to the rational monitoring of hydrogen-bonding interaction of 2-Imidazolidinethione with DNA and guanine, Food Chem. Toxicol., 2010, vol. 48, p. 29.
Ahmadi, F. and Jafari, B., Voltammetry and Spectroscopy Study of In Vitro Interaction of Fenitrothion with DNA, Electroanalysis, 2011, vol. 23, p. 675.
Cox, P.J., Psomas, G., and Bolos, C.A., Characterization and DNA-interaction studies of 1,1-dicyano-2,2-ethylene dithiolate Ni(II) mixed-ligand complexes with 2-amino-5-methyl thiazole, 2-amino-2-thiazoline and imidazole. Crystal structure of [Ni(i-MNT)(2a-5mt)2], Bioorg. Med. Chem., 2009, vol. 17, p. 6054.
Gao, F., Wang, Q., Zheng, M., Li, S., Chen, G., Jiao, K., and Gao, F., Electrochemical Studies on the Recognition of a Ternary Copper Complex to Single-Stranded DNA and Double-Stranded DNA, Int. J. Electrochem. Sci., 2011, vol. 6, p. 1508.
Zhang, X., Li, M., Cui, Y., Zhao, J., Cui, Z., Li, Q., and Qu, K., Electrochemical Behavior of Calcein and the Interaction between Calcein and DNA, Electroanalysis, 2012, vol. 24, p. 1878.
https://pubchem.ncbi.nlm.nih.gov/compound/sulfamethizole#section=Pharmacology-and-Biochemistry (Accessed on Feb. 20, 2018).
Petrikaitė, V., Tarasevičius, E., and Pavilonis, A., New thiazolidones-4 with sulfamethizole-2 substituent as potential antifungal and antimicrobial preparations, Biologija, 2007, vol. 53, p. 45.
Pehlivan, V., Biçer, E., Genç Bekiroğlu, Y., and Dege, N., Synthesis, In Vitro Antibacterial Activity and Calf Thymus DNA Binding of Sulfamethizole-based Schiff Bases, Book of Abstracts, 4th International Türk-Pak Conference Chemical Sciences (ITPCCS 2017), October 26–28, 2017 Konya-TURKEY, PP017.
Omanović, D. and Branica, M., Automation of Voltammetric Measurements by Polarographic Analyser PAR 384B, Croat. Chem. Acta, 1998, vol. 71, p. 421.
Hajian, R., Ekhlasi, E., and Daneshvar, R., Spectroscopic and Electrochemical Studies on the Interaction of Epirubicin with Fish Sperm DNA, E.-J. Chem., 2012, vol. 9, p. 1587.
Naik, T.R.R. and Naik, H.S.B., Electrochemical Investigation of DNA Binding on Carbaldehyde Oxime by Cyclic Voltammetry, Int. J. Electrochem. Sci., 2008, vol. 3, p. 409.
Babkina, S.S. and Ulakhovich, N.A., Complexing of Heavy Metals with DNA and New Bioaffinity Method of Their Determination Based on Amperometric DNA-Based Biosensor, Anal. Chem., 2005, vol. 77, p. 5678.
Shah, A., Zaheer, M., Qureshi, R., Akhter, Z., and Nazar, M.F., Voltammetric and spectroscopic investigations of 4-nitrophenylferrocene interacting with DNA, Spectrochim. Acta Part A, 2010, vol. 75, p. 1082.
Asghar, F., Badshah, A., Shah, A., Rauf, M.K., Ali, M.I., Tahir, M.N., Nosheen, E., Zia-ur-Rehman, and Qureshi, R., Synthesis, characterization and DNA binding studies of organoantimony(V) ferrocenyl benzoates, J. Organometallic Chem., 2012, vol. 717, p. 1.
Hua, D. and Chung, T.-S., Universal surface modification by aldehydes on polymeric membranes for isopro-panol dehydration via pervaporation, J. Membrane Sci., 2015, vol. 492, p. 197.
Sprung, M.A., A summary of the reactions of aldehydes with amines, Chem. Rev., 1940, vol. 26, p. 297.
Huang, A. and Caro, J., Covalent post-functionalization of zeolitic imidazolate framework ZIF-90 membrane for enhanced hydrogen selectivity, Angew. Chem. Int. Ed., 2011, vol. 50, p. 4979.
Patil, M.P. and Sunoj, R.B., Insights on Co-Catalyst-Promoted Enamine Formation between Dimethylamine and Propanal through Ab Initio and Density Functional Theory Study, J. Org. Chem., 2007, vol. 72, p. 8202.
Chatziefthimiou, S.D., Lazarou, Y.G., Hadjoudis, E., Dziembowska, T., and Mavridis, I.M., Keto Forms of Salicylaldehyde Schiff Bases: Structural and Theoretical Aspects, J. Phys. Chem. B, 2006, vol. 110, p. 23701.
Filarowski A. and Majerz, I., AIM Analysis of Intramolecular Hydrogen Bonding in O-Hydroxy Aryl Schiff Bases, J. Phys. Chem. A, 2008, vol. 112, p. 3119.
Filarowski, A., Intramolecular hydrogen bonding in o-hydroxyaryl Schiff bases, J. Phys. Org. Chem., 2005, vol. 18, p. 686.
Clinical and Laboratory Standards Institute (CLSI). Reference method for broth dilution antifungal susceptibility testing of yeasts. 3rd ed. Wayne: Clinical and Laboratory Standards Institute; 2008 (Approved standard. M27-S3).
Meti, M.D., Abbar, J.C., Nandibewoor, S.T., and Chimatadar, S.A., Voltammetric oxidation of carbenicillin and its electro analytical applications at gold electrode, Cogent Chemistry, 2016, vol. 2, p. 1 doi https://doi.org/10.1080/ 23312009.2016.1235459
Gosser, D.K., Cyclic voltammetry: Simulation and analysis of reaction mechanisms, VCH, New York, 1993, p. 43.
Pedrero, M., de Villena, F.J.M., Pingarrón, J.M., and Polo, L.M., Determination of Dinoseb by Adsorptive Stripping Voltammetry, Electroanalysis, 1991, vol. 3, p. 419.
Giannakopoulos, E., Deligiannakis, Y., and Salahas, G., Electrochemical interfacial adsorption mechanism of polyphenolic molecules onto Hanging Mercury Drop Electrode surface (HMDE), J. Electroanal. Chem., 2012, vol. 664, p. 117.
Coşkun, E. and Biçer, E., Sülfatiazolün Ni(II) iyonlarıyla etkileşiminin voltametrik incelenmesi, Erciyes Univ. J. Inst. Sci. Technol., 2014, vol. 30, p. 296.
Sabry, S.M., Barary, M.H., Abdel-Hay, M.H., and Belal, T.S., Adsorptive stripping voltammetric behaviour of azomethine group in pyrimidine-containing drugs, J. Pharm. Biomed. Anal., 2004, vol. 34, p. 509.
Habib, I.H.I., Weshahyi S.A., Toubar, S., and El-Alamin, M.M.A., Cathodic Stripping Voltammetric Determination of Losartan in Bulk and Pharmaceutical Products, Portugaliae Electrochim. Acta, 2008, vol. 26, p. 315.
Manoušek, O., Exner, O., and Zuman, P., Fission of activated carbon-nitrogen and carbon-sulphur bonds. XI. Polarographic reduction of substituted benzenesulphoamides, in: Topics on Organic Polarography, Zuman, P. (Ed.), Plenum, London, 1970, p. 322.
Chambers, J.Q., Organic sulphur compounds, in: Encyclopedia of Electrochemistry of the Elements, Bard, A.J. and Lund, H. (Eds.), Organic section, Volume XII, Chapter XII-3, p. 371.
Smyth, M.R. and Smyth, W.F., Voltammetric methods for the determination of foreign organic compounds of biological significance, Analyst, 1978, vol. 103, p. 529.
Çakır, S. and Biçer, E., Synthesis, spectroscopic and electrochemical characteristics of a novel Schiff-base from saccharin and tryptophan, J. Iran. Chem. Soc., 2010, vol. 7, p. 394.
Carter, M.T., Rodriguez, M., and Bard, A.J., Voltammetric Studies of the Interaction of Metal Chelates with DNA. 2. Tris-Chelated Complexes of Cobalt(III) and Iron(II) with 1,10-Phenanthroline and 2,2/-Bipyridine J. Am. Chem. Soc., 1989, vol. 111, p. 8901.
Tung, Y.-L., Lee, S.-W., Chi, Y., Chen, L.-S., Shu, C.-F., Wu, F.-I., Carty, A.J., Chou, P.-T., Peng, S.-M., and Lee, G.-H., Organic Light-Emitting Diodes based on Charge-Neutral RuII Phosphorescent Emitters, Adv. Mater., 2005, vol. 17, p. 1059.
Pakravan, P. and Masoudian, S., Study on the Interaction between Isatin-β-Thiosemicarbazone and Calf Thymus DNA by Spectroscopic Techniques, Iran. J. Pharm. Res., 2015, vol. 14, p. 111.
Mallappa, M., Gowda, B.G., and Mahesh, R.T., Mechanism of interaction of antibacterial drug moxifloxacin with herring sperm DNA: Electrochemical and spectroscopic studies, Der Pharma Chemica, 2014, vol. 6, p. 398.
Jiang, Y., Yuan, Y., Wang, K., Li, H., Xu, C., and Yang, X., Spectroscopic and Electrochemical Studies on the Binding of Pyrocatechol Violet with Telomere DNA and Its Application, Int. J. Electrochem. Sci., 2012, vol. 7, p. 10933.
Дополнительные материалы отсутствуют.





