Электрохимия, 2019, T. 55, № 5, стр. 599-608
Легкий способ изготовления системы графен/Mn3O4/Cu(OH)2 на Cu-фольге в качестве электрода для суперконденсаторов
Х. Н. Мианкушки a, А. Седги a, *, С. Багшахи a
a Международный университет им. Имама Хомейни
34149-16818 Казвин, Иран
* E-mail: sedghi@eng.ikiu.ac.ir
Поступила в редакцию 21.04.2018
После доработки 26.08.2018
Принята к публикации 20.09.2018
Аннотация
Для повышения удельной емкости суперконденсаторов на основе графена был разработан двухстадийный синтез нового тройного композита графен/Mn3O4/Cu(OH)2. Вначале были синтезированы композиты графен/Mn3O4 с различным весовым отношением (G : Mn 1 : 1, G : Mn 1 : 4, G : Mn 1 : 7 и G : Mn 1 : 10) путем смешивания компонентов и отжига. Затем на медную фольгу были осаждены Cu(OH)2-стержни. После этого порошки композитов графен/Mn3O4 осаждались на Cu(OH)2/Cu с медным токоотводом, образуя рабочие электроды. Образцы были охарактеризованы методами рентгеновской дифракции, автоэлектронной сканирующей микроскопии, инфракрасной спектроскопии с преобразованием Фурье и рамановской спектроскопии. Рентгенодифракционный анализ выявил присутствие системы графен/Mn3O4. Присутствие Mn3O4 было также подтверждено методами инфракрасной спектроскопии с преобразованием Фурье и рамановской спектроскопии. Электрод из композита графен/Mn3O4/Cu(OH)2 с весовым отношением G : Mn 1 : 7 показал наилучшие эксплуатационные характеристики и самую большую удельную емкость: приблизительно 266 Ф/г при скорости сканирования 10 мВ/с в растворе электролита 6 M KOH. Дополнительные электрохимические измерения (кривые заряда–разряда и спектроскопия электрохимического импеданса) электродов G/Cu(OH)2/Cu и графен/Mn3O4/Cu(OH)2/Cu показали, что электрод графен/Mn3O4/Cu(OH)2/Cu – перспективный материал для применения в суперконденсаторах.
ВВЕДЕНИЕ
В последнее время разработка недорогих экологичных устройств для запасания энергии привлекает большое внимание [1, 2]. Среди них суперконденсаторы – наиболее интересный вариант, благодаря их высокой плотности мощности, большой скорости заряда–разряда и дешевизне [3, 4]. В достижении этой высокой плотности мощности, дешевизны и экологичности большую роль играют материалы электроактивного электрода, электролита и токоподвода суперконденсатора.
В производстве суперконденсаторов используются различные материалы, такие как углеродистые материалы, проводящие полимеры и оксиды металлов. Для улучшения свойств суперконденсаторов применяют сочетание углеродистых материалов с оксидами и гидроксидами металлов. Среди углеродистых материалов наиболее мотивационным кандидатом является графен, благодаря его уникальной морфологии, высокой химической устойчивости и электропроводности. Многочисленные исследования ставили своей задачей улучшить свойства графеновых электродов путем изготовления двойных композитов графен/оксид переходного металла [5–11]. Среди оксидов различных металлов оксиды марганца MnOx считаются конкурентоспособными с точки зрения внедрения в графен, благодаря их высокому выходу в производстве, дешевизне и нетоксичности. Mn, как элемент, проявляет различные химические валентности (Mn2+, Mn3+ и Mn4+), отсюда и различные оксиды марганца, такие как MnO, MnO2, Mn2O3 и Mn3O4. Среди них Mn3O4 очень подходит для применения в суперконденсаторах [11–18]. Недавно композиты графен/Mn3O4 были успешно синтезированы для использования в качестве электродов суперконденсаторов. Например, был разработан легкий метод синтеза материала с большой емкостью графен/Mn3O4; он показал емкость C равную 140 Ф/г при скорости развертки потенциала 10 мВ/с в 5 M растворе электролита KOH [15]. Тем временем, композит графен/Mn3O4 был приготовлен простым сольвотермическим способом; он достиг емкости 161 Ф/г при токе 1 A/г в 1 M растворе Na2SO4 [16]. Композит графен/Mn3O4 был также путем осаждения наночастиц Mn3O4 на нанолистки графена; удельная емкость такого композита оказалась равной 147 Ф/г в 1 M растворе Na2SO4 [17]. В работе [18] были получены композиты Mn3O4/графен.
Отметим, что в большинстве коммерческих суперконденсаторов электролиты органические. У них широкое “потенциальное окно” (приблизительно 2.7 В). Но они дороги, а в некоторых случаях и токсичны. У водных электролитов “потенциальное окно” ýже (приблизительно 1.23 В), они недороги, у них выше ионная проводимость и часто более высокая емкость, благодаря меньшему размеру ионов [19]. Поэтому перспективно использовать в суперконденсаторах именно водные электролиты, из-за их оптимальной стоимости и экологичности.
В дополнение к электролиту, для коммерциализации суперконденсатора важно использовать недорогой и коррозионностойкий в водных электролитах токоподвод, обладающий механической прочностью и высокой электропроводностью [20].
В различных работах материалом токоподвода служили Ni-пена, медь, алюминий, нержавеющая сталь, стеклоуглерод и графит. Среди них медь – подходящий кандидат для материала подложки электрода благодаря своим свойствам – дешевизне, низкому сопротивлению и высокой электропроводности, несмотря на то, что ее окисление и коррозия в водных электролитах очень чувствительна к их составу, и ее трудно контролировать. К счастью, гидроксид меди также является хорошим проводником и повышает устойчивость медной фольги, сохраняя высокую электропроводность [21]. Поэтому в настоящей работе в качестве токоподвода новый применен тройной нанокомпозит графен/Mn3O4/Cu(OH)2 на Cu-фольге, изготовленный простым и недорогим методом. Вначале двухстадийный метод, включающий смешивание и отжиг, использован для получения композитов графен/оксид марганца. Затем на Cu-фольгу осаждали Cu(OH)2-стержни, и на эту подложку – Cu(OH)2/Cu-фольга – осаждали порошки всех композитов, получая таким образом рабочие электроды. Электрохимические свойства этих электродов изучали методами циклической вольтамперометрии, гальваностатических кривых заряда–разряда и спектроскопия электрохимического импеданса.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Использовались реактивы высокой степени чистоты. Порошок графена был приобретен у компании XG Sciences, Inc., а ацетат марганца [Mn(CH3COO)2 ⋅ 4H2O], (NH4)2S2O8, NaOH и KOH – у Merck. Для очистки электродов использовали ацетон, этанол и дистиллированную воду. В качестве токоподвода применяли медную фольгу (1 × 2 см).
Синтез композитов графен/Mn3O4
Графен (50 мг) диспергировали в 100 мл этанола; для того, чтобы получить суспензию графена, раствор подвергали воздействию ультразвука на 1 ч. Затем к графеновой суспензии добавляли различные количества Mn(CH3COO)2 ⋅ 4H2O при перемешивании магнитной мешалкой в течение 1 ч при температуре 90°C, за этим следовала. Наконец, композиты графен/оксид Mn отжигали при 300°C с растущей скоростью нагрева (5°C/мин) в течение 3 ч в аргоне. Композиты графен/Mn3O4 (GMn), приготовленные с 50, 200, 350 и 500 мг Mn(CH3COO)2 ⋅ 4H2O, обозначены, соответственно, GMn 1 : 1, GMn 1 : 4, GMn 1 : 7 и GMn 1 : 10.
Приготовление подложки Cu(OH)2/Cu-фольга
Свежую Cu-фольгу (толщиной 0.05 см) разрезали на листки размером 1 см × 2 см и очищали в ультразвуковой ванне последовательно с ацетоном, этанолом и дистиллированной водой в течение 10 мин. Затем ее помещали в 1 M раствор HCl для удаления с поверхности загрязнений и оксидов. Очищенную таким образом Cu-фольгу погружали в водный раствор, содержащий 12 мл NaOH (10 M), 6 мл (NH4)2S2O8 (1 M), и 27 мл дистиллированной воды на 30 мин. Наконец, ее ополаскивали водой и этанолом и после извлечения из раствора сушили на воздухе.
Для электрохимических измерений все электроды были приготовлены смешиванием активного материала с поливинилиденфторидом с образованием кашицы. Эту кашицу наносили на листки Cu(OH)2/Cu-фольги, после чего полученные электроды сушили под вакуумом при 70°C в течение 24 ч.
Снятие характеристик и электрохимические измерения
Для изучения фазообразования и полос поглощения в синтезированных композитах мы использовали рентгенодифракционный анализ (дифрактометр PW1730 с CuKα-излучением, PHILIPS), рамановский спектрометр (Nicolet Almega XR, Thermo Fisher Scientific Co., Inc.) и инфракрасный спектрофотометр с преобразованием Фурье (Bruker TENSOR 27 FT-IR).
Морфологию поверхности электродов анализировали методом автоэлектронной сканирующей микроскопии (прибор MIRA 3, TESCAN). Электрохимические эксперименты, а именно циклические вольтамперограммы, гальваностатические кривые заряда–разряда и спектры электрохимического импеданса, выполняли на многоканальном потенциостате/гальваностате VSP-300-Biologic в стандартной трехэлектродной ячейке. Емкостное поведение и спектр электрохимического импеданса изучали в водном 6 M растворе электролита KOH.
В этой трехэлектродной системе циклические вольтамперограммы снимали в интервале потенциалов от 0 до 0.5 В при скорости развертки потенциала 10 мВ/с. По циклическим вольтамперограммам вычисляли удельную емкость, пользуясь следующим уравнением:
где I – плотность тока (A/cм2), V – потенциал (В), SR – скорость развертки потенциала (В/с), а m – вес осажденного на электрод материала (г) [22].Спектры электрохимического импеданса снимали в интервале частот от 0.01 Гц до 100 кГц при потенциале разомкнутой цепи.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На рис. 1а и 1б приведены рентгеновские дифрактограммы, соответственно, графена, композитов графен/оксид Mn, Cu-фольги и подложки Cu(OH)2/Cu-фольга. На рис. 1а для графена видны пики при 2θ = 26.3° и 2θ = 43°, которые соответствуют графитоподобной структуре [23]. Для композитов GMn, в сравнении с графеном, появляются ясно видные новые пики, которые можно приписать характеристическим пикам гаусманита – Mn3O4 с тетрагональной структурой. С ростом концентрации Mn(CH3COO)2 · 4H2O эти характеристические пики of Mn3O4 становятся интенсивнее, что указывает на увеличение количества Mn3O4 [24–26].
Рис. 1.
Рентгеновские дифрактограммы (a) графена и композитов графен/оксид Mn и (б) Cu и Cu/Cu(OH)2.
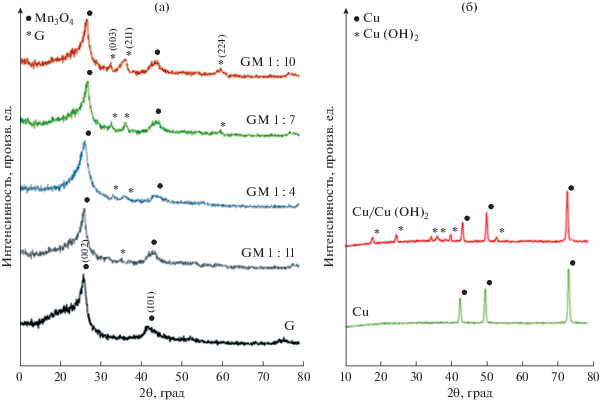
На рис. 1б видны три главных пика при 43.16°, 50.37° и 74.1°. Три “кристаллических” можно приписать кубической фазе меди с ориентацией плоскостей, соответственно, (111), (200) (220). Это находится в хорошем согласии со стандартом металлических частиц меди JCPDS file No. 01-085-1326 [27]. Рентгеновские дифрактограммы медной фольги после окисления также содержит эти три главных пика при тех же значениях 2θ, а также некоторые новые пики при значениях 2θ равных 16.81°, 23.81°, 34.08°, 35.83°, 39.77° и 53.32°. Эти значения 2θ, совпадают с таковыми для соответствующих кристаллических граней, согласно JCPDS file No. 00-003-310. Таким образом, можно заключить, что эти новые пики принадлежат нанолисткам Cu(OH)2 [27].
Образцы были охарактеризованы с помощью ИК-спектров с преобразованием Фурье, снятых в интервале волновых чисел 400–4000 cм–1. На рис. 2a показаны спектры графена и композитов GMn. Пики поглощения графена при 1570 и 1370 cм–1 отвечают колебаниям, соответственно, связи C=C и функциональных групп C–O на поверхности графена [28]. В ИК-спектрах с преобразованием Фурье композитов графен/оксид марганца пики при 500–700 cм–1 принадлежат тетра- и октаэдрическим связям Mn–O; это указывает на то, что, действительно, синтезирован композит графен/Mn3O4 [24–28].
Рис. 2.
ИК-спектры с преобразованием Фурье (a) графена и композитов графен/оксид Mn и (б) Cu и Cu(OH)2/Cu-фольга.

На рис. 2б для всех образцов полосы поглощения между 1300 и 3500 cм–1 можно приписать, главным образом, молекулам H2O и CO2, хемисорбированным или физически сорбированным на поверхности [29, 30]. У свежесинтезированного Cu(OH)2 пики при 3559 и 3292 cм–1 относятся к валентным колебаниям гидроксильных групп в Cu(OH)2. Валентные колебания связи Cu–O при 930 cм–1 могут относиться к катиону металла (Cu2+) в Cu(OH)2. Пик при 679 cм−1 соответствует изгибному колебанию водородной связи в группах OH [31].
На рис. 3 даны рамановские спектры композитов графена и GMn, снятые в интервале волновых чисел 500–3000 cм–1. Для всех композитов на основе графена характеристические пики вблизи 1570, 1340 и 2680 cм−1 принадлежат, соответственно, полосам D, G и 2D. Полосу D можно отнести к структурным дефектам и разупорядоченности в графене, в то время, как полоса G возникает на основе моды зонного центра E2g, отвечающей упорядоченного sp2-гибридизованного углерода. В случае композитов GMn полосу вблизи 640 cм–1 можно отнести к Mn3O4 [24, 25]. С ростом концентрации Mn(CH3COO)2 ⋅ 4H2O интенсивность этого пика тоже растет.
Морфологию поверхности графена, композитов GMn и подложки Cu(OH)2/Cu-фольга характеризовали методом автоэлектронной сканирующей микроскопии. Как видно из рис. 4a, пленка Cu(OH)2 на медной фольге состоит из стержней диаметром около 1 мкм, большинство из которых взаимно пересекаются. На рис. 4б можно видеть, что частицы графена агрегируются и образуют хлопьевидную структуру. На рис. 4в–4е показаны SEM-изображения композитов GMn 1 : 1, GMn 1 : 4, GMn 1 : 7 и GMn 1 : 10. Видно, что с ростом концентрации Mn(CH3COO)2 · 4H2O количество наночастиц Mn3O4 увеличивается, и что они “привязаны” к поверхности графена. Кроме того, средний размер частиц увеличивается с ростом доли Mn3O4 в композитах GMn. Как следует из рис. 4е, большие частицы агрегируются на графене, и это снижает емкость.
Рис. 4.
FESEM-микрофотографии (a) Cu(OH)2/Cu, (б) графена и композитов графен/оксид Mn: (в) GM 1 : 1, (г) GM 1: 4, (д) GM 1 : 7 и (е) GM 1 : 10.

Электрохимические измерения, а именно снятие циклических вольтамперограмм, гальваностатических кривых заряжения–разряда и спектров электрохимического импеданса, проводили в трехэлектродной системе с рабочим электродом, платиновым противоэлектродом и Ag/AgCl-электродом сравнения в 6 M растворе KOH при комнатной температуре.
На рис. 5a показаны циклические вольтамперограммы электродов графен/Cu(OH)2 и GMn/Cu(OH)2, снятые при скорости развертки потенциала 10 мВ/с. Циклические вольтамперограммы этих электродов имеют неправильную форму. Они отличаются от идеальных прямоугольных вольтамперограмм, обусловленных влиянием двойного электрического слоя. По своей форме они похожи на кривые, ранее описанные для электродов на медных подложках [32–34]. Это позволяют заключить, что в процессах заряда–разряда электродов преобладают фарадеевские реакции:
(2)
$\begin{gathered} {\text{2Cu(OH}}{{{\text{)}}}_{{\text{2}}}} + 2{\text{e}} \leftrightarrow {\text{2CuOH}} + {\text{2O}}{{{\text{H}}}^{{\text{--}}}} \leftrightarrow \\ \leftrightarrow \,\,{\text{C}}{{{\text{u}}}_{{\text{2}}}}{\text{O}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} + {\text{2O}}{{{\text{H}}}^{ - }}, \\ \end{gathered} $(3)
${\text{Mn}}{{{\text{O}}}_{x}}{{{\text{(OC)}}}_{\beta }} + \delta {{{\text{C}}}^{{ + \quad}}} + \delta {\text{e}} \leftrightarrow {\text{Mn}}{{{\text{O}}}_{{x\, - \,\beta }}}{{{\text{(OC)}}}_{{\beta \, + \,\delta }}}.$Рис. 5.
(a) Циклические вольтамперограммы графена (G) и композитов GMn, (б) циклические вольтамперограммы графена при различных скоростях развертки потенциала и (в) циклические вольтамперограммы композита GMn 1 : 7 при различных скоростях развертки потенциала.

На рис. 5a не видно хорошо выраженных анодных пиков, зато есть катодные. Катодные пики на кривой графенового электрода можно объяснить реакцией восстановления в Cu(OH)2-подложке по уравнению (2). У композитных электродов более широкие катодные пики, чем у графенового электрода, что связано с синергическим эффектом в системе графен, Cu(OH)2 и частицы Mn3O4 [реакции по уравнениям (2), (3)].
На этих кривых анодные пики отсутствуют по следующим причинам: (1) разложение воды не идет при потенциале отсечки 0.5 В; (2) обыкновенно вода разлагается при потенциале много выше, чем 0.5 В; и (3) благодаря высокой проводимости электроактивного материала, ионы быстро двигаются по поверхности электрода [32]. Кроме того, циклические вольтамперограммы композитного электрода GMn 1 : 7 охватывают гораздо бóльшую площадь, чем электроды из чистого графена или другие композитные электроды, при той же скорости развертки потенциала 10 мВ/с. Это указывает на то, что композит GMn 1 : 7 имеет бóльшую удельную емкость [8]. Полученные результаты показывают, что удельные емкости электродов из графена и композитов GMn 1 : 1, GMn 1 : 4, GMn 1 : 7 и GMn 1 : 10 равняются, соответственно, 170, 178, 194, 266 и 200 Ф/г при одинаковой скорости развертки потенциала 10 мВ/с. Повышенную емкость композитного электрода GMn 1 : 7 можно объяснить особенностями структуры композита графен/Mn3O4: (1) используется высокая емкость двойного электрического слоя графенового электрода, благодаря уменьшению агломерирования при осаждении наночастиц Mn3O4; (2) графен с его высокой проводимостью улучшает проводимость композита в целом, облегчая доступ электронов к большинству частиц Mn3O4 в процессах заряда–разряда; и (3) частицы Mn3O4 имеют наноразмер, что увеличивает площадь контакта Mn3O4/электролит при протекании окислительно-восстановительных реакций [35]. Рис. 5б и 5в показывают циклические вольтамперограммы электродов из графена и композита GMn 1 : 7 при скорости развертки потенциала от 5 до 100 мВ/с. Величины емкости этих электродов при различных скоростях развертки потенциала представлены в табл. 1 .
Таблица 1.
Удельная емкость электродов при различных скоростях развертки потенциала
| Образец | Токоподвод | Удельная емкость при (Ф/г) | |||||
|---|---|---|---|---|---|---|---|
| 5 мВ/с | 10 мВ/с | 20 мВ/с | 30 мВ/с | 50 мВ/с | 100 мВ/с | ||
| G | Cu(OH)2/Cu | 60 | 170 | 110 | 85 | 63 | 54 |
| GMn | Cu(OH)2/Cu | 104 | 266 | 128 | 120 | 118 | 98 |
На рис. 6a показаны годографы электрохимического импеданса (графики Найквиста) электродов из графена G и композита GMn 1 : 7. Все спектры электрохимического импеданса состоят из двух частей: высокочастотной полуокружности и прямой линии при низких частотах. Отрезок, отсекаемый на оси действительных сопротивлений, дает общее сопротивление Rs, т.е. сумму ионного сопротивления электролита, собственных сопротивлений электродных материалов и контактного сопротивления между токоподводом и собственно электродом. Диаметр полуокружности дает сопротивление переноса заряда Rct, демонстрируя емкостной характер поведения электродов и скорость переноса заряда на границе раздела электрод/электролит [36, 37]. Чем больше этот диаметр, тем больше Rct и тем яснее выражен псевдоемкостное поведение электрода [36–38]. Вычисленные значения Rs и Rct для электродов из графена и композита GMn 1 : 7 таковы: соответственно, 1.1, 0.01 и 1.8, 0.5 Ом.
Рис. 6.
(a) Годографы импеданса графена (G) и композита GMn 1:7, (б) кривые заряда–разряда графена (G) и композита GMn 1 : 7.

Величина Rs у графена меньше, чем у GMn-электрода по причине прекрасной электропроводности графена. На годографе графена полуокружность в области высоких частот исчезающе мала, что говорит о малой величине Rct, быстрой фарадеевской реакции и лучшем переносе заряда, чем у композита GMn. Исходя из уравнения Rct = = S/(σ × L), где S – площадь активного материала, L – его толщина, а σ – его проводимость, и поскольку значения S и L приблизительно одинаковы для всех образцов, мы отмечаем, что наибольшее влияние на величину Rct оказывает электропроводность материала [39].
Кривые заряда–разряда электродов из графена и композитов GMn снимали при плотности тока 1 A/г; они представлены на рис. 6б. Нелинейные кривые разряда со слабым закруглением указывают на псевдоемкостной характер электродов. Все кривые содержат IR-падение потенциала, из-за присутствия внутреннего сопротивления [40]. По сравнению с графеновым электродом, композитные электроды показывают большее время разряда при одинаковой плотности тока, что можно приписать их большей емкости.
Для практического применения суперконденсаторов большое значение имеет такое свойство, как устойчивость при циклировании. На рис. 7 показаны кривые циклирования электродов из графена и композита GMn 1 : 7 при плотности тока 1 A/г в электролите KOH. Видно, что емкость всех образцов по мере увеличения числа циклов постепенно снижается. При этом после 1000 циклов заряда–разряда емкость графена оказалась стабильнее, чем емкость GMn-композитов.
В табл. 2 проведено сравнение поведения электродов, изготовленных в настоящей работе и описанных в литературе. Можно видеть, что электрод графен/Mn3O4 с токоподводом Cu(OH)2/Cu вполне конкурентноспособен по отношению к электродам с другими токоподводами, в частности, из пеноникеля. Таким образом, вышеописанные новые недорогие электроды с хорошими свойствами годятся для электрохимических применений.
Таблица 2.
Сравнение свойств графеновых композитных электродов
| Активный материал | Токоподвод | Электролит | Удельная емкость, Ф/г | Ссылка |
|---|---|---|---|---|
| Mn3O4/G | Пеноникель | 1 M Na2SO4 | 171 | [41] |
| Mn3O4/G | То же | 1 M Na2SO4 | 194 | [24] |
| Mn3O4/G | То же | 1 M Na2SO4 | 147 | [17] |
| Mn3O4/G | То же | 5 M KOH | 140 | [15] |
| Mn3O4/G | Нерж. сталь | 1 M Na2SO4 | 344 | [42] |
| Mn3O4/G | Пеноникель | 1 M Na2SO4 | 88 | [18] |
| Mn3O4/G | Cu(OH)2/Cu | 6 M KOH | 266 | Настоящая работа |
ЗАКЛЮЧЕНИЕ
1. Композиты графен/оксид марганца с различным весовым отношением приготовлены путем смешивания и отжига. Структура и морфология этих композитов и чистого графена детально охарактеризованы рядом методов: ИК‑спектроскопия с преобразованием Фурье, рентгенодифракционный анализ, Рамановская спектроскопия и автоэлектронной сканирующей микроскопии.
2. Cu(OH)2-стержни успешно выращены на медной фольге при помощи реакции в жидкой и твердой фазах в качестве проводящего недорогого токоподвода для суперконденсаторов.
3. Композиты графен/оксид марганца осаждали на токоподвод Cu(OH)2/Cu-фольга; исследованы электрохимические свойства электродов.
4. Циклическая вольтамперометрия и другие электрохимические методы показали, что синергический эффект в системе графен, Cu(OH)2 и оксид марганца улучшает поверхность контакта, что в свою очередь улучшает электрохимические свойства электродов из композитов графен/оксид марганца.
5. Электрод из композита GMn 1 : 7 демонстрируетнаивысшую емкость 266 Ф/г при скорости развертки потенциала 10 мВ/с.
Список литературы
Wang, Z., Wang, C.Y., Ma, H.L., Liu, Z.H., and Hao, Z.P., Facilely synthesized Fe2O3-graphene nanocomposite as novel electrode materials for supercapacitors with high performance, J. Alloys Comp., 2013, vol. 552, p. 486.
Xiang, C., Li, M., Zhi, M., Manivannan, A., and Wu, N.Q., Reduced graphene oxide/titanium dioxide composite for supercapacitor electrodes: shape and coupling effects, J. Mater. Chem., 2012, vol. 22, p. 19161.
Conway, B.E., Electrochemical Supercapacitors, New York: Plenum, 1999.
Burke, A., Ultracapacitors: why, how, and where is the technology, J. Power Sources, 2000, vol. 91, p. 37.
Zheng, J.P., Cygan, P.J., and Jow, T.R., Hydrous ruthenium oxide as an electrode material for electrochemical capacitors, J. Electrochem. Soc., 1995, vol. 142, p. 2699.
Huang, C.-C., Hu, Y.-H., and Chang, K.-H., Annealing effects on the physicochemical characteristics of hydrous ruthenium and ruthenium-iridium oxides for electrochemical supercapacitors, J. Power Sources, 2002, vol. 108, p. 117.
Zhu, G., Li, H.J., Deng, L.J., and Liu, Z.H., Low-temperature synthesis of δ-MnO2 with large surface area and its capacitance, Mater. Lett., 2010, vol. 64, p. 1763.
Dubal, D.P., Dhawale, D.S., Salunkhe, R.R., Fulari, V.J., and Lokhande, C.D., Chemical synthesis and characterization of Mn3O4 thin films for supercapacitor application, J. Alloys Compd., 2010, vol. 497, p. 166.
Liu, T.-C., Pell, W.G., and Conway, B.E., Stages in the development of thick cobalt oxide films exhibiting reversible redox behavior and pseudocapacitance, Electrochim. Acta, 1999, vol. 44, p. 2829.
Yuan, C., Zhang, X., Su, L., Gao, B., and Shen, L., Facile synthesis and self-assembly of hierarchical porous NiO nano/micro spherical superstructures for high performance supercapacitors, Mater. Chem. A., 2009, vol. 19, p. 5772.
Lang, X., Hirata, A., Fujita, T., and Chen, M., Nanoporous metal/oxide hybrid electrodes for electrochemical supercapacitors, Nature Nanotechnology, 2011, vol. 6, p. 232.
Zhang, S.W. and Chen, G.Z., Manganese oxide based materials for supercapacitors, Energy Mater., 2008, vol. 3, p. 186.
Takahashi, K., Dry cell and battery industry and powder technology with emphasis on powdered manganese dioxide, Electrochim. Acta, 1981, vol. 26, p. 1467.
Chang, K.H., Lee, Y.F., Hu, C.C., Chang, C.I., Liu, C.L., and Yang, Y., A unique strategy for preparing single-phase unitary/binary oxides-graphene composites, Chem. Commun., 2010, vol. 46, p.7957.
Liu, Y., He, D., Wu, H., and Duan, J., Graphene and Nanostructured Mn3O4 Composites for Supercapacitors, Integrated Ferroelectrics, 2013, vol. 144, p. 118.
Wu, Y., Liu, S., Wang, H., Wang, X., Zhang, X., and Jin, G., A novel solvothermal synthesis of Mn3O4/graphene composites for supercapacitors, Electrochim. Acta, 2013, vol. 90, p. 210.
Zhang, X., Sun, X., Chen, Y., Zhang, D., and Ma, One-step solvothermal synthesis of graphene/Mn3O4 nanocomposites and their electrochemical properties for supercapacitors, Mater. Lett., 2012, vol. 68, p. 336.
Lee, J.W., Hall, A.S., Kim, J.-D., and Mallouk, T.E., A Facile and Template-Free Hydrothermal Synthesis of Mn3O4 Nanorods on Graphene Sheets for Supercapacitor Electrodes with Long Cycle Stability, Chem. Mater., 2012, vol. 24, p. 115.
Blomquist, N., Wells, T., Andres, B., Backstrom, J., Forsberg, S., and Olin, H., Metal-free supercapacitor with aqueous electrolyte and low-cost carbon materials, Sci. Reports, 2017.
Gheytani, S., Liang, Y., Jing Y., Xu J.Q., and Yao, Y., Chromate conversion coated aluminium as a light-weight and corrosion-resistant current collector for aqueous lithium-ion batteries, Mater. Chem. A., 2016, vol. 4, p. 395.
Wang, X., Chen, Ch., Chen, K., Chen, H., and Yuan, Sh. Jun., MnO2 Nanosheets-Decorated CuO Nanoneedles Arrays@Cu Foils for Supercapacitors, Int. J. Electrochem. Sci., 2016, vol. 11, p. 3425.
Bose, S., Kim, N.H., Kuila, T., Lau, K., Lee, J.H., Electrochemical performance ofa graphene-polypyrrole nanocomposite as a supercapacitor electrode, Nano-technology, 2011, vol. 22, p. 369502.
Kuilla, T., Bhadra, S., Yao, D., Kim, N.H., Bose, S., and Lee, J.H., Recent advances in graphene based polymer composites, Prog. Polym. Sci., 2010, vol. 35, p. 1350.
Rosaiah, P., Zhu, J., Shaik, Dadamiah P.M.D., Hussain, O.M., Qiu,Y., and Zhao, L., Reduced graphene oxide/Mn3O4 nanocomposite electrodes with enhanced electrochemical performance for energy storage applications, J. Electroanal. Chem., 2017.
Liao, Q.Y., Li, S.Y., Cui, H., and Wang, C.H., Vertically-aligned graphene@Mn3O4 nanosheets for a high-performance flexible all-solid-state symmetric supercapacitor, J. Mater. Chem. A, 2016, vol. 4, p. 8830.
Zhou, T., Mo, Sh., Zhou, Sh., Zou, W., Liu, Y., and Yuan, D., Mn3O4/worm-like mesoporous carbon synthesized via a microwave method for supercapacitors, J. Mater Sci., 2011, vol. 46, p. 3337.
P. Xu, K. Ye, M. Du, J. Liu, K. Cheng, J. Yin, G. Wang, and D. Cao, One-step synthesis of copper compounds on copper foil and their supercapacitive performance, RSC Adv., 2015, vol. 5, p. 36656.
Yang, Y., Zeng, B., Liu, J., Long, Y., Li, N., Wen, Z., and Jiang, Y., Graphene/MnO2 composite prepared by a simple method for high performance supercapacitor, Mater. React. Innovations, 2015.
Sathyamoorthy, R. and Mageshwari, K., Synthesis of hierarchical CuO microspheres: Photocatalytic and antibacterial activities, Physica E, 2013, vol. 47, p. 157.
Momeni, M.M., Nazari, Z., Kazempour, A., Hakimiyan, M., and Mirhoseini, S.M., Preparation of CuO nanostructures coating on copper as supercapacitor materials, Surf. Eng., 2014, vol. 30, p. 775.
Pramanik, A., Maiti, S., and Mahanty, S., Reduced graphene oxide anchored Cu(OH)2 as a high performance electrochemical supercapacitor, Dalton Trans., 2015, vol. 44, p. 14604.
Chen, J., Xu, J., Zhou, Sh., Zhao N., and Wong, C.P., J. Mater. Chem. A, 2015, vol. 3, p. 17385.
Yuan, R.M., Li, H.J., Yin, X.M., Lu, J.H., and Zhang, L., 3D CuO nanosheet wrapped nanofilm grown on Cu foil for high performance non-enzymatic glucose biosensor electrode, Talanta, 2017, vol. 174, p. 514.
Hsu, Y.K., Chen, Y.C., and Lin, Y.G., Characteristics and electrochemical performances of lotus-like CuO/Cu(OH)2 hybrid material electrodes, J. Electroanal. Chem., 2012, vol. 673, p. 43.
Zhang, F., Zhang, X.G., and Hao, L., Solution synthesis and electrochemical capacitance performance of Mn3O4 polyhedral nanocrystals via thermolysis of a hydrogen-bonded polymer, J. Mater. Chem. Phys., 2011, vol. 126, p. 853.
Lim, C.H., Ng, H.N., Lim, Y.S., Chee, W.K., and Huang, N.M., Fabrication of flexible polypyrrole/graphene oxide/manganese oxide supercapacitor, Int. J. Energy Res., 2014.
Wang, Y., Re. J., Huang, X., and Ding, J., The synthesis of polypyrrole Mn3O4/reduced graphene oxide anode with improved coulombic efficiency, Electrochim. Acta, 2015, vol. 186, p. 345.
Sun, W., Chen, L., Wang, Y., Zhou, Y., Meng, Sh., Li, H., and Luo, Y., Synthesis of Highly Conductive PPy/Graphene/ MnO2 Composite Using Ultrasonic Irradiation, J. Synth. React. Inorg. Metal Org. and Nano-Metal Chem., 2016, vol. 46, p. 437.
Fathi, M., Saghafi, M., Mahboubi, F., and Mohajerzadeh, S., Synthesis and electrochemical investigation of polyaniline/unzipped carbon nanotube composites as electrode material in supercapacitors, Synthetic Metals, 2014, vol. 198, p. 345.
Ng, C.H., Lim, H.N., Lim1, Y.S., Chee, W.K., and Huang, N.M., Fabrication of flexible polypyrrole/graphene oxide/manganese oxide supercapacitor, Int. J. Energy Res., 2015, vol. 39, p. 344.
Zhu, L., Zhang, S., Cui, Y., Song, H., and Chen, X., One step synthesis and capacitive performance of graphene nanosheets/Mn3O4 Composite, Electrochim. Acta, 2013, vol. 89, p. 18.
Gund, G.S., Dubal, D.P., Patil, B.H., Shindea, S.S., and Lokhandea, Ch.D., Enhanced activity of chemically synthesized hybrid graphene oxide/Mn3O4 composite for high performance supercapacitors, Electrochim. Acta, 2013, vol. 92, p. 205.
Дополнительные материалы отсутствуют.





