Электрохимия, 2019, T. 55, № 5, стр. 558-567
Электрохимическое поведение Si(IV) на Mo-электроде в расплаве CaCl2–CaF2–CaO–SiO2
Жидонг Ли a, *, Х. Рен a, С. Йин a, Ж. Лу a, Жинг Ли a
a Научно-технический Университет
114051 Ляонин, КНР
* E-mail: lijidong1014@163.com
Поступила в редакцию 25.01.2018
После доработки 11.07.2018
Принята к публикации 27.08.2018
Аннотация
Рассмотрено электрохимическое поведение кремния(IV) на молибденовом электроде в расплаве CaCl2–CaF2–CaO–SiO2 при температуре 1023 K методами вольтамперометрии при линейной развертке потенциала, квадратно-волновой вольтамперометрии, хроноамперометрии, хронопотенциометрии при потенциале разомкнутой цепи, хронопотенциометрии с обращением тока и поляризационных кривых. Результаты вольтамперометрии при линейной развертке потенциала показали, что восстановление ионов Si(IV) в расплаве CaCl2–CaF2–CaO–SiO2 протекает в одну стадию с переносом четырех электронов. Этот процесс обратим и контролируется диффузионным массопереносом; коэффициент диффузии ионов Si(IV) в расплаве CaCl2–CaF2–CaO (3.68 вес. %)–SiO2 (4 вес. %) при 1023 K составляет около 1.11 × 10–4 cм2 с–1. Обратимость окислительно-восстановительной пары Si(IV)/Si на молибденовом электроде подтверждена методом вольтамперометрии при линейной развертке потенциала. Хроноамперометрические измерения показали, что переходные токи (I–t) восстановления Si(IV) определяются моментальным зародышеобразованием с меняющимся перенапряжением. Рентгено-фазовый анализ показал, что осадок на молибденовом электроде, полученный в ходе потенциостатического электролиза, состоит из Si и MoSi2.
ВВЕДЕНИЕ
С развитием общества растет и потребность в энергии, проблема недостатка энергии охватила весь мир, и это ограничивает и затрудняет дальнейшее самоподдерживающееся развитие общества. Ключевая задача здесь – разработать и распространить чистые и возобновляемые источники энергии, чтобы заменить устаревшую “каменноугольную” технологию. Среди различных типов самоподдерживающейся возобновляемой энергии одним из перспективных является генерирование фотовольтаической мощности, которая удовлетворяет требованиям и энергетики, и экологии [1, 2]. Кремний высокой чистоты, известный базовый материал для фотовольтаических элементов, играет существенную роль в их производстве [3, 4]. Ожидается, что фотовольтаические элементы на основе кремния получат широкое распространение уже в недалеком будущем.
В настоящее время принятые способы производства кремния высокой чистоты – это, главным образом, модифицированный Сименс-процесс, силановый процесс и псевдоожиженный слой, причем модифицированный Сименс-процесс получил более широкое распространение благодаря меньшим энергозатратам, большей скорости осаждения и более высокой чистоте продукта [5–7]. Однако, он вряд ли способен к непрерывной автоматической работе, а также нуждается в устройстве для полной замены реагентов, что влечет за собой низкую энергетическую эффективность и требует больших вложений. Таким образом, одна из задач – получить кремний высокого качества. По сравнению с другими современными способами его производства, электроосаждение из солевого расплава имеет следующие преимущества: (1) более простое оборудование, (2) меньше стоимость, (3) проще обслуживание. Таким образом, использование этого подхода – хороший способ получения металлов и сплавов. Он применялся по отношению к многочисленным металлам и их сплавам, включая Ti, Nd, Mg–Li, Al–Sm, Al–Th, Al–Lu и Al–Eu [8–18].
Имеется много публикаций относительно исследований электрохимических свойств иона Si(IV) в различных солевых расплавах, например в CaCl2–SiO2 [19, 20], CaCl2–CaO–SiO2 [21, 22], FLINAK–K2SiF6 [23, 24], LiF–KF–K2SiF6 [25, 26] и NaCl–KCl–NaF–SiO2 [27]. Электрохимическое поведение ионов Si(IV) и механизм зародышеобразования исследован во многих расплавленных солях. В работе [28] исследовали реакции в окислительно-восстановительной паре Si(IV)/Si в расплаве BaF2–CaF2 методом циклической вольтамперометрии и квадратно-волновой вольтамперометрии. Было подтверждено, что электроосаждение кремния идет через одну волну восстановления под диффузионным контролем, и что коэффициент диффузии Si(IV) равняется 9.76 × 10−5 cм2 c–1 при 1573 K. Из расплава BaF2–CaF2–SiO2 на молибденовом электроде можно получить интерметаллическое соединение. В работе [29] описано электрохимическое поведение Si(IV) на серебряном электроде в эвтектическом расплаве NaF–KF в области температур 820–950°C, и с помощью уравнения Аррениуса вычислена энергия активации диффузии. Осаждение кремния включает моментальное зародышеобразование и диффузионно-контролируемый рост зародышей, с изменением температуры и концентрации ионов Si(IV) в расплаве. Кроме того, микроморфология получаемых осадков Si зависит от материала катода и плотности тока. При электрохимическом восстановлении Si(IV) из расплавов на основе криолита, как показано в работе [30], эти ионы восстанавливаются до кремния по двум последовательным реакциям восстановления. Во время этого процесса ионы Si(IV) вначале восстанавливаются до Si(II), а затем следует осаждение Si. Потенциалы восстановления Si(IV) и Si(II) были определены методом циклической вольтамперометрии, и было найдено напряжение разложения до кремния в зависимости от концентрации растворенного SiO2. В работе [31] описано катодное восстановление ионов Si(IV) в бинарном расплаве LiF–KF с добавкой K2SiF6 – это одностадийный процесс, контролируемый диффузией, с переходом четырех электронов. Si получается и при гальваностатическом электролизе с серебряным электродом, выход по току равняется 85–95%. Получение кремния электроосаждением на индикаторном Ag-электроде в среде KF–KCl описано в работе [32]. Восстановление Si(IV) на Ag-электроде – обратимый электрохимический процесс; коэффициент диффузии Si(IV), определенный хроноамперометрически, равняется 3.2 × 10–5 cм2 с–1. Морфология поверхности образца, полученного гальваностатическим электролизом, была охарактеризована методами Рамановской спектроскопии и сканирующей электронной микроскопии, которые подтвердили образование “металлического” Si. На сегодня никто еще не рассматривал расплавы, содержащие кальций и щелочноземельные металлы, из-за гигроскопического характера хлорида кальция. Более того, CaF2 легко растворяет оксиды, а большая разность потенциалов между кремнием и кальцием может оказывать благоприятное влияние на чистоту электролитического осадка в производстве кремния. Важно, что технологические затруднения при работе с супергигроскопическими материалами весьма существенны.
В настоящей работе для исследования электрохимического поведения и явлений зародышеобразования кремния в смеси эвтектического расплава CaCl2–CaF2 и CaO–SiO2 использованы такие методы, как вольтамперометрия с линейной разверткой потенциала, хронопотенциометрия с обращением тока, квадратно-волновая вольтамперометрия, хроноамперометрия, хронопотенциометрия при потенциале разомкнутой цепи и поляризационные кривые. Полученный осадок был также охарактеризован с помощью рентгено-дифракционного анализа.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Безводный CaCl2 (Sinopharm Chemical Reagent Co., Ltd., КНР, ≥96%), CaF2 (Sinopharm Chemical Reagent Co. Ltd., КНР, ≥98.5%), CaO (Sinopharm Chemical Reagent Co. Ltd., КНР, ≥98%) и SiO2 (Тяньцзиньский научно-исследовательский институт тонкой химической технологии, КНР, ≥99.99%) использовались без дополнительной очистки. Поскольку у SiO2 относительно высокая точка плавления и плохая электропроводность, добавление CaO и SiO2 в определенной пропорции для того, чтобы образовался CaSiO3 с более низкой точкой плавления, решает проблему медленности реакции и плохой проводимости диоксида кремния. Принимая во внимание более высокую растворимость оксида во фториде, мы использовали в качестве электролита систему CaCl2–CaF2. Все операции с реактивами и приготовление образцов проводили в перчаточном боксе в атмосфере аргона (концентрация кислорода и влаги не превышала 1 ppm). Эту эвтектику CaCl2–CaF2 (CaCl2 : CaF2 = 80 : 20 вес. %) вначале обезвоживали в вакууме в течение более 48 ч при температуре 573 K для того, чтобы удалить остаточную влагу, а затем измельчали в атмосфере Ar в тигле из особо-чистого графита, помещенном в герметичную ячейку из нержавеющей стали, находящуюся в электрической печи. Температуру ячейки измеряли хромель-алюмелевой термопарой и поддерживали с точностью до ±2 K. После полного расплавления солевой смеси проводили предэлектролиз при потенциале –1.9 В относительно Pt-проволочки в течение 6 ч для того, чтобы удалить из расплава примеси ионов металлов. Все опыты проводили в инертной аргоновой атмосфере. В расплавленную систему вносили кремний в форме порошков CaO и SiO2 при перемешивании.
Все электрохимические измерения проводили с помощью комплекса Autolab (Metrohm, PGSTAT302N, Швейцария), управляемого при помощи программного обеспечения Nova 1.11 для квадратно-волновой вольтамперометрии и снятия поляризационных кривых или GPES для вольтамперометрии с линейной разверткой потенциала, хроноамперометрии, хронопотенциометрии при потенциале разомкнутой цепи и хронопотенциометрии с обращением тока. Экспериментальная установка изображена на рис. 1. Молибденовая проволока диаметром 1 мм и вольфрамовый стержень диаметром 3 мм служили, соответственно, рабочим электродом и противоэлектродом. В качестве квазиэлектрода сравнения использовали платиновую проволочку диаметром 1 мм, погруженную в расплав CaCl2–CaF2–CaO–SiO2. Перед каждым электрохимическим измерением рабочий молибденовый электрод полировали наждачными бумагами последовательно 360#, 600#, 1200# и 2000#, промывали деионизованной водой в ультразвуковой ванне и сушили на воздухе.
Рис. 1.
Схема электролитической ячейки: (1) рабочий электрод, (2) электрод сравнения, (3) термопара, (4) противоэлектрод, (5) вход Ar, (6) выход газа, (7) реактор из нержавеющей стали, (8) огнеупорная пластинка, (9) графитовый тигель, (10) солевой расплав.

Образцы осажденного кремния на молибденовом электроде получали при температуре 1023 K в результате потенциостатического электролиза в течение 1 ч с приложением потенциала, предварительно определенного в ходе вольтамперометрии с линейной разверткой потенциала. При тестировании процесса электролиза использовали молибденовый электрод в форме пластины (длиной 26, шириной 13 и толщиной 2 мм). Фазовый состав полученного осадка анализировали методом рентгеновской дифракции на приборе PANalytical B.V., X’Pert Powder, Нидерланды.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Вольтамперометрия с линейной разверткой потенциала
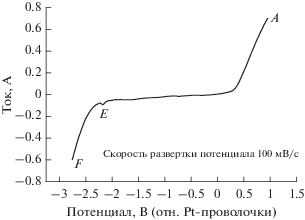
На рис. 2 приведен типичный пример вольтамперограммы с линейной разверткой потенциала, снятой на молибденовом рабочем электроде в чистом эвтектическом расплаве CaCl2–CaF2 при 1023 K. Катодная граница области идеальной поляризуемости – это пик F, его потенциал равен приблизительно –2.75 В относительно Pt-проволочки. Эта характеристика пика тока восстановления соответствует образованию новой фазы, которая, как считается, является металлическим кальцием, электроосажденным при восстановлении ионов Ca(II). Катодный пик E, наблюдающийся приблизительно при –2.18 , связан с осаждением CaC2 в результате так называемого субпотенциального осаждения (underpotential deposition, UPD) Ca(II) в расплаве, где CaC2 генерируется с участием растворенного графитового углерода из графитового тигля. Резкий пик окисления A приблизительно при 1 В, т.е. анодная граница области идеальной поляризуемости в расплаве CaCl2–CaF2, отвечает окислению хлорид-ионов, т.е. выделению Cl2. Каких-либо других видимых признаков реакций, связанных с восстановлением электроактивных частиц в пределах исследованной области идеальной поляризуемости в расплаве не наблюдается, так что реакциями примесей в исследованном диапазоне потенциалов можно пренебречь.
Рис. 2.
Вольтамперограмма с линейной разверткой потенциала молибденового электрода в расплаве CaCl2–CaF2 при 1023 K.
На рис. 3 представлена серия вольтамперограмм с линейной разверткой потенциала, снятых при различных скоростях развертки потенциала в системе CaCl2–CaF2 после добавления к ней CaO–SiO2. Потенциал сканировали в интервале от –0.35 к отрицательным значениям до –0.95 В относительно Pt-проволочки со скоростью 20–100 мВ/с. Как видно, на этих вольтамперограммах есть два пика катодного тока, отвечающих, соответственно, образованию сплава MoSi2 и восстановлению Si(IV). Было исследовано также влияние скорости развертки потенциала на потенциал пика тока восстановления Si(IV) (врезка на рис. 3). Потенциал пика окислительно-восстановительной пары Si(IV)/Si не сдвигается сколько-нибудь значительно с ростом скорости развертки потенциала, подтверждая этим, что электрохимическая реакция в паре Si(IV)/Si полностью обратима.
Рис. 3.
Вольтамперограммы с линейной разверткой потенциала на молибденовом электроде в расплаве CaCl2–CaF2–CaO–SiO2 при 1023 K, снятые при различных скоростях развертки потенциала.

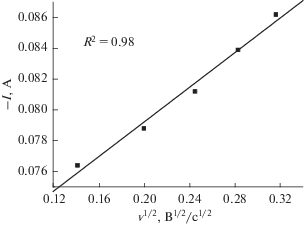
Из рис. 4 видно, что катодные пиковые токи в паре Si(IV)/Si прямо пропорциональны корню квадратному из скорости развертки потенциала, что указывает на то, что электрохимическая реакция в этой паре в области исследованных скоростей развертки потенциала контролируется диффузией ионов Si(IV). Для обратимой электрохимической реакции, контролируемой процессом массопереноса (при линейной диффузии), можно вычислить коэффициент диффузии по формуле Берзиньса–Делахея [33]:
(1)
${{I}_{{\text{p}}}} = 0.61{{{{{\left( {nF} \right)}}^{{3/2}}}} \mathord{\left/ {\vphantom {{{{{\left( {nF} \right)}}^{{3/2}}}} {{{{\left( {RT} \right)}}^{{1/2}}}}}} \right. \kern-0em} {{{{\left( {RT} \right)}}^{{1/2}}}}}A{{C}_{0}}{{\left( {Dv} \right)}^{{1/2}}}.$Оценка коэффициента диффузии ионов Si(IV) в расплаве CaCl2–CaF2–CaO–SiO2 дала значение 1.11 × 10–4 cм2 с–1 при 1023 K. В таблице 1 дается сравнение коэффициента диффузии, полученного в настоящей работе, с некоторыми литературными данными. Различия в значениях коэффициента диффузии можно объяснить различиями в температуре и влиянием солевого расплава.
Хронопотенциометрия с обращением тока
Мы снимали хронопотенциограммы с обращением тока на полированном Mo-электроде в расплаве CaCl2–CaF2–CaO–SiO2 при температуре 1023 K. Вначале через Mo-электрод попускали ток –60 мA, а затем через 4.2 с ток меняли на 60 мA. На хронопотенциограмме с обращением тока имеется четыре плато потенциала (рис. 5). На кривой после обращения тока имеется плато потенциала 1 приблизительно при –0.69 В, вызванное образованием интерметаллического соединения MoSi2. После плато 1 потенциал электрода резко уменьшается, и если пропускать ток –60 мA в течение более продолжительного времени, измеряемый потенциал достигает своего предельного значения, соответствующего осажденному “металлическому” Si. Соответственно, если пропускать ток 60 мA, на обратной хронопотенциограмме имеются еще два плато потенциала (плато 3 и плато 4), которые можно интерпретировать, как повторное окисление, соответственно, осажденного “металлического” Si и сплава MoSi2. Измеренное переходное время (τred = τox ≈ 1.7 с) для плато 2 и плато 3 подтверждает, что образованный на Mo-электроде Si не растворяется. Это явление показывает, что пик катодного тока окислительно-восстановительной пары Si(IV)/Si на рис. 3 может отвечать образованию “металлического” Si на Mo-электроде по одностадийной реакции восстановления с переносом четырех электронов.
Квадратно-волновые вольтамперограммы
Число электронов, участвующих в электрохимической реакции, определяли также методом квадратно-волновой вольтамперометрии. На рис. 6 представлены квадратно-волновые вольтамперограммы, записанные в расплаве CaCl2–CaF2, содержащем CaO (3.68 вес. %)–SiO2 (4 вес. %), снятые при температуре 1023 K и частоте 20 Гц. На них имеется два пика катодного процесса. Пик B, находящийся приблизительно при –0.89 В, относится к электронному обмену в паре Si(IV)/Si. Пик A, предшествующий сигналу B, со всей очевидностью относится к образованию сплава MoSi2, и подтверждает, что электрохимическое восстановление Si(IV)/Si на молибденовом рабочем электроде есть одностадийная четырехэлектронная реакция.
Пик B не вполне симметричен, что можно объяснить образованием твердого “металлического” Si, это ведет к возникновению перенапряжения “бестокового” зародышеобразования и уменьшает рост тока, а также влияет на форму Гауссовой кривой сигнала B. Аналогичные наблюдения известны из литературы [35, 36]. Необходимо было сделать математический анализ для катодного пика B, чтобы определить ширину пика на половине его высоты. Вычисленное значение числа переносимых электронов в реакции восстановления ионов Si(IV) равняется n = 4.36, согласно следующему уравнению [37–39]:
Здесь W1/2 – полуширина пика восстановления в B, R – универсальная газовая константа, n – число перенесенных электронов, T – абсолютная температура в градусах Кельвина, а F константа Фарадея, 96 485 Кл моль–1. Другими словами, здесь переносятся практически четыре электрона. Это однозначно доказывает, что пик тока B относится к одностадийному восстановлению ионов Si(IV) до металлического кремния: Si(IV) + + 4e = Si.Хроноамперометрия
Для дальнейшего изучения характера зародышеобразования и процесса роста кремния в расплаве CaCl2–CaF2–CaO–SiO2 мы использовали хроноамперометрию процесса осаждения Si на полированном молибденовом электроде при различных приложенных импульсах потенциала. Эксперименты проводили, меняя потенциал ступенчатым образом от такого его значения, при котором не происходит электроосаждения Si(IV), до весьма отрицательных значений потенциала, при которых начинается зародышеобразование и вслед за этим растет осадок кремния. Как показано на рис. 7, зародышеобразование и рост Si хорошо видны на хроноамперограммах, когда приложенный отрицательный потенциал достигает значения –0.81 В. Это происходит потому, что осаждение новой фазы на рабочем электроде требует достаточного перенапряжения.
Рис. 7.
Хроноамперограммы, снятые при различных приложенных потенциалах, отвечающих осаждению Si на Mo-электроде в расплаве CaCl2–CaF2–CaO–SiO2 при 1023 K.

В зоне I каждой кривой переходного тока последний вначале резко спадает во времени, что соответствует образованию зародышей кремния на поверхности электрода. Быстрый спад тока объясняется заряжением двойного слоя, поэтому ток и уменьшается со временем после ступенчатого изменения потенциала, и в это время образуются зародыши Si. За этим следует рост тока, соответствующий росту кристаллов, до тех пор, пока он не достигнет максимума при достижении значений, соответственно, Im и tm. За очень короткое время заряжение двойного слоя на поверхности электрода завершается, зародыши Si в основном возникли. Затем при приложенном потенциале площадь активной поверхности молибденового электрода растет с ростом зародышей Si. С ростом отрицательного приложенного потенциала скорость зародышеобразования в результате восстановления ионов Si(IV) все увеличивается. В области роста тока (зона II) он достигает максимума Im, в то время как tm уменьшается из-за приложенного потенциала при его более отрицательных значениях. Например, если приложенный потенциал равняется –0.81 В, Im и tm принимают значения, соответственно, –0.0722 A и 1.75 с, а когда приложенный потенциал вырастает до –0.89 В, значения Im и tm могут достичь, соответственно, –0.0889 A и 0.85 с. Наконец, измеряемый ток имеет тенденцию к снижению во времени, после чего выходит на плато, поскольку находится под диффузионным контролем (зона III).
Что касается связи числа образованных зародышей со временем, следует различать две моды: мгновенное зародышеобразование и прогрессирующее зародышеобразование. Если в начале кристаллизации мгновенно образуются все места зародышеобразования, то такое зародышеобразование называется мгновенным. Напротив, при прогрессирующем зародышеобразовании число новых зародышей продолжает увеличиваться в течение всего процесса осаждения.
Эти переходные токи (I–t) при измерениях до момента перекрытия диффузионных зон вокруг отдельных зародышей Si можно использовать для определения кинетики роста зародышей кристаллизации. Согласно литературе [40], связь между током и временем для постоянных импульсов приложенного потенциала описывается следующим соотношением:
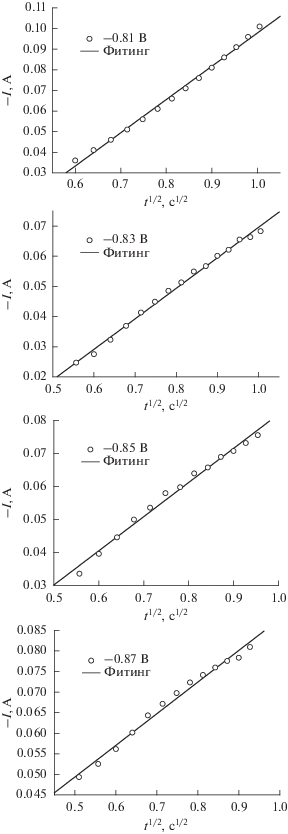
где I соответствует измеренному току в амперах, α – размер зародыша и тип зародышеобразования и роста, t означает время в секундах, а x – функция, зависящая от типа зародышеобразования: при мгновенном зародышеобразовании x равняется1/2, а при прогрессирующем – 3/2. Рисунок 8 демонстрирует пропорциональность между I и t1/2 на восходящем участке экспериментальных токов при различных перенапряжениях. Мы видим хорошее линейное соотношение, свидетельствующее о том, что зародышеобразование кремния протекает в моде мгновенного зародышеобразования.Рис. 8.
Графики зависимости I от t1/2, построенные по восходящим ветвям кривых на рис. 7, для потенциалов –0.81, –0.83, –0.85 и –0.87 В относительно Pt‑проволочки.
Хронопотенциометрия при потенциале разомкнутой цепи
Метод хронопотенциометрии при потенциале разомкнутой цепи был использован в приложении к Mo-электроду с целью изучить равновесные потенциалы образования интерметаллических соединений в расплаве CaCl2–CaF2–CaO–SiO2. Измерения проводили следующим образом: тонкослойный образец был приготовлен приложением катодного потенциала к молибденовому рабочему электроду в расплаве CaCl2–CaF2–CaO–SiO2 в течение короткого промежутка времени, затем потенциал отключали. В течение этого процесса окисления регистрировали зависимость изменения потенциала разомкнутой цепи во времени; получили переходную кривую, похожую на ту, что изображена на рис. 9. Изменение потенциала проходит через ряд плато и участки растущего потенциала; каждое плато отвечает равновесию между двумя интерметаллическими соединениями.
Рис. 9.
Хронопотенциограммы в эвтектическом расплаве CaCl2–CaF2, содержащем CaO (3.68 вес. %)–SiO2 (4 вес. %), снятые на молибденовом электроде после электроосаждения при –1.5 В в течение 10 с.
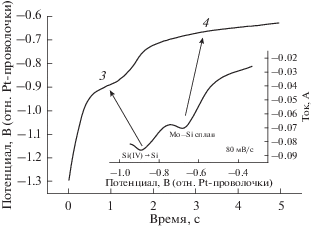
На рис. 9 показаны переходные кривые потенциала разомкнутой цепи Mo-электрода после потенциостатического электролиза в течение 20 с при потенциале –1.5 В относительно Pt-проволочки. На кривых видны два плато при потенциалах –0.77 В и –0.89 В относительно Pt-проволочки (при 1023 K). Плато 1 в начале кривой приблизительно при –0.77 В связано с двумя сосуществующими состояниями интерметаллического соединения – сплава Mo–Si. Задержка потенциала приблизительно при –0.89 В (плато 2) соответствует двухфазному равновесию окислительно-восстановительной системы Si(IV)/Si. В сочетании с результатами вольтамперометрии при линейной развертке потенциала и квадратно-волновой вольтамперометрии, два плато на переходной кривой, полученной при потенциале разомкнутой цепи, соответствуют именно осадкам Si и MoSi2.
Поляризационные кривые
Метод поляризационных кривых используется при определении взаимосвязи между стационарным током, генерируемым только электродной реакцией, и потенциалом. Обычно он разделяется на метод заданного тока и метод заданного потенциала. Если поляризационные кривые содержат плато или максимум тока, то применяться может только метод заданного потенциала. Этот метод мы и использовали в нашем эксперименте. Более того, поляризационная кривая отражает кинетические параметры электродного процесса; ее также можно использовать в исследовании динамики электродного процесса и факторов, оказывающих на него влияние.
Мы измеряли поляризационные кривые на молибденовом электроде в расплаве CaCl2–CaF2 с добавкой CaO (3.68 вес. %)–SiO2 (4 вес. %) при температуре 1023 K и скорости развертки потенциала 5 мВ с–1; они представлены на рис. 10. Видно, что ток, измеренный в начальный период, очень мал из-за слишком положительного значения потенциала, который не достигает потенциала осаждения MoSi2, поэтому реакция на молибденовом электроде практически не идет, и ток составляет 0 A. В процессе катодного сканирования первая поворотная точка A, быстро возрастающая приблизительно от –0.69 В, относится к получению интерметаллического соединения MoSi2. Однако, если катодный потенциал достигает –0.91 В, появляется вторая поворотная точка B, которую можно связать с образованием металлического Si в результате прямого восстановления Si(IV). Плато тока b показывает, что восстановление Si(IV) достигает диффузионного предела, и непрерывное возрастание тока связано с осаждением кремния, так что плато b соответствует предельному диффузионному току в паре Si(IV)/Si [41]. Этот предельный диффузионный ток наблюдается, когда приложенный катодный потенциал оказывается достаточно отрицательным; это – важная черта массопереноса при линейной диффузии. На этой поляризационной кривой проявляется явление флуктуаций тока, которое может быть связано с постоянными изменениями площади активной поверхности Mo-электрода в ходе электролиза. Взаимодействие между постоянно увеличивающейся площадью поверхности Mo-электрода вследствие роста зародышей MoSi2 или Si и постоянно уменьшающейся площадью поверхности Mo-электрода вследствие удаления MoSi2 или Si с электрода и приводит к флуктуациям тока поляризационной кривой, что согласуется с флуктуациями тока на кривых переходных токов, показанных на рис. 7.
Электроосаждение и характеристики осадков
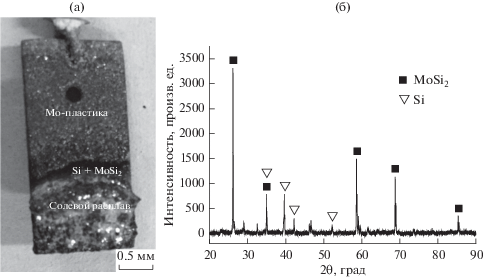
Электроосаждение кремния проводили на молибденовой пластинке в расплаве CaCl2–CaF2, содержащем CaO (3.68 вес. %)–SiO2 (4 вес. %) при 1023 K с целью идентификации фаз в образовавшемся осадке. Потенциостатический электролиз выполняли при потенциале –1.0 В относительно Pt-проволочки в течение 2 ч; эти условия были определены ранее с помощью вольтамперометрических измерений при линейно растущем потенциале и при потенциале разомкнутой цепи. По окончании электрохимической реакции молибденовую пластинку с прилипшей солью вынули из расплава; ее фотография приведена на рис. 11a. Образовавшийся в расплаве CaCl2–CaF2–CaO–SiO2 слой кремния и интерметаллического соединения окрашен в черный цвет. Состав образца анализировали рентгено-дифракционным методом (рис. 11б). Как следует из рентгеновской дифрактограммы, осадок состоит из MoSi2 и Si. Пиков, отвечающих оксиду кремния, на дифрактограмме не видно.
ЗАКЛЮЧЕНИЕ
Электрохимическое поведение ионов Si(IV) в эвтектическом расплаве CaCl2–CaF2, содержащем CaO (3.68 вес. %)–SiO2 (4 вес. %), исследовано при температуре 1023 K несколькими электрохимическими методами. Пики тока восстановления в расплаве CaCl2–CaF2, за исключением пика восстановления, отвечающего осаждению Ca(II), следует приписать электрогенерированному CaC2. Восстановление Si(IV) до Si протекает в ходе одностадийного процесса с переносом четырех электронов. Определен коэффициент диффузии Si(IV), равный 1.11 × 10–4 cм2 с–1 при 1023 K. Реакция в окислительно-восстановительной паре Si(IV)/Si на молибденовом электроде полностью обратима (согласно данным вольтамперометрии с линейной разверткой потенциала). Хроноамперометрические эксперименты показали, что ключевую роль во всем процессе играет электрокристаллизация, а процесс осаждения кремния протекает через мгновенное зародышеобразование при изменении приложенного потенциала. Наконец, согласно данным рентгеновской дифракции, осадок, полученный при потенциостатическом электролизе при –1.0 В (относительно Pt-проволочки) состоит из Si и MoSi2.
Настоящая работа поддержана Национальным фондом естественных наук КНР (проект № 51774180), Национальным фондом естественных наук провинции Ляонин (проект № 201602394) и Фондом университетских преподавателей и основных разработчиков проекта Ляонинского научно-технического университета (проект № 2015RC05).
Список литературы
Nohira, T., Ido, A., Shimao, T., Yang, X., Yasuda, K., Hagiwara, R., and Homma, T., A new electrolytic production process of silicon using liquid Zn alloy cathode in molten salt, Ecs. Trans., 2016, vol. 75, no. 15, p. 17.
Ergül, E., Karakaya, I., and Erdoğan, M., Electrochemical decomposition of SiO2 pellets to form silicon in molten salts, J. Alloys Compd., 2011, vol. 509, no. 3, p. 899.
Mazumder, B., Silicon and Its Compounds, Science Publishers, USA, 2001.
Cho, S.K., Fan, F.R., and Bard, A.J., Electrodeposition of crystalline and photoactive silicon directly from silicon dioxide nanoparticles in molten CaCl2, Angew. Chem. Int. Ed., 2012, vol. 124, no. 51, p. 12740.
Woditsch, P. and Koch, W., Solar grade silicon feedstock supply for PV industry, Sol. Energ. Mat. Sol. C., 2002, vol. 72, no. 1–4, p. 11.
Loutzenhiser, P.G., Tuerk, O., and Steinfeld, A., Production of Si by vacuum carbothermal reduction of SiO2 using concentrated solar energy, JOM, 2010, vol. 62, no. 9, p. 49.
Müller, A., Ghosh, M., Sonnenschein, R., and Woditsch, P., Silicon for photovoltaic application, Mater. Sci. Eng. B, 2006, vol. 134, no. 2–3, p. 257.
Chen, G.Z., Fray, D.J., and Farthing, T.W., Direct electrochemical reduction of titanium dioxide to titanium in molten calcium chloride, Nature, 2000, vol. 407, no. 6802, p. 361.
Bukatova, G.A., Kuznetsov, S.A., and Gaune, E.M., Electrochemical synthesis of rare-earth metal (Eu, Nd) borides in molten salts, Russ. J. Electrochem., 2007, vol. 43, no. 8, p. 929.
Liu, K., Tang, H.-B., Pang, J.-W., Liu, Y.-L., Feng, Y.-X., Chai, Z.-F., and Shi, W.-Q., Electrochemical properties of uranium on the liquid gallium electrode in LiCl–KCl eutectic, J. Electrochem. Soc., 2016, vol. 163, no. 9, p. D554.
Yan, Y.-D., Zhang, M.-L., Han, W., Cao, D.-X., Yuan, Y., Xue, Y., and Chen, Z., Electrochemical formation of Mg–Li alloys at solid magnesium electrode from LiCl–KCl melts, Electrochim Acta, 2008, vol. 53, no. 8, p. 3323.
Castrillejo, Y., Bermejo, M.R., Barrado, E., and Martínez, A.M., Electrochemical behaviour of erbium in the eutectic LiCl–KCl at W and Al electrodes, Electrochim Acta, 2006, vol. 51, no. 10, p. 1941.
Castrillejo, Y., Fernández, P., Medina, J., Hernández, P., and Barrado, E., Electrochemical extraction of samarium from molten chlorides in pyrochemical processes, Electrochim Acta, 2011, vol. 56, no.24, p. 8638.
Liu, Y.-L., Yan, Y.-D., Han, W., Zhang, M.-L., Yuan, L.-Y., Liu, K., Ye, G.-A., He, H., Chai, Z.-F., and Shi, W.-Q., Extraction of thorium from LiCl–KCl molten salts by forming Al–Th alloys: a new pyrochemical method for the reprocessing of thorium-based spent fuels, RSC Adv., 2013, vol. 3, no. 45, p. 23539.
Liu, Y.-L., Yan, Y.-D., Han, W., Zhang, M.-L., Yuan, L.-Y., Lin, R.-S., Ye, G.-A., He, H., Chai, Z.-F., and Shi, W.-Q., Electrochemical separation of Th from ThO2 and Eu2O3 assisted by AlCl3 in molten LiCl–KCl, Electrochim. Acta, 2013, vol. 114, p. 180.
Novoselova, A.V. and Smolenskii, V.V., Electrochemical study of the properties of Nd(III) and Nd(II) ions in molten LiCl–KCl–CsCl eutectic and individual CsCl, Russ. J. Electrochem., 2013, vol. 49, no. 10, p. 931.
Barrado, E., Castrillejo, Y., Bermejo, M.R., and Rosa, F.D.L., Cathodic behaviour of europium (III) on glassy carbon, electrochemical formation of Al4Eu, and oxoacidity reactions in the eutectic LiCl–KCl, J. Electroanal. Chem., 2007, vol. 603, no. 1, p. 81.
Gibilaro, M., Massot, L., Chamelot, P., Cassayre, L., and Taxil, P., Electrochemical extraction of europium from molten fluoride media, Electrochim. Acta, 2009, vol. 55, no. 1, p. 281.
Nohira, T., Yasuda, K., and Ito, Y., Pinpoint and bulk electrochemical reduction of insulating silicon dioxide to silicon, Nat. Mater., 2003, vol. 2, no. 6, p. 397.
Jin, X.-B., Gao, P., Wang, D.-H., Hu, X.-H., and Chen, G.-Z., Electrochemical preparation of silicon and its alloys from solid oxides in molten calcium chloride, Angew. Chem., 2004, vol. 43, no. 6, p. 733.
Yang, X., Ji, L., Zou, X., Lim, T., Zhao, J., Yu, E.T., and Bard, A.J., Effective Manufacturing of Silicon Solar Cells: Electrodeposition of High-Quality Si Films in a CaCl2-based Molten Salt, Angew. Chem., 2017, vol. 56, no. 74 p. 15078.
Cai, J., Luo, X.-T., Haarberg, G.M., Kongstein, O.E., and Wang, S.L., Electrorefining of metallurgical grade silicon in molten CaCl2 based salts, J. Electrochem. Soc., 2012, vol. 159, no. 3, p. D155.
Elwell, D. and Rao, G.M., Mechanism of electrodeposition of silicon from K2SiF6–flinak, Electrochim. Acta, 1982, vol. 27, no. 6, p. 673.
Rao, G.M., Elwell, D., and Feigelson, R.S., Electrowinning of silicon from K2SiF6-molten fluoride systems, J. Electrochem. Soc., 1980, vol. 127, no.9, p. 1940.
Cohen, U., Silicon epitaxial growth by electrodeposition from molten fluorides, J. Electrochem. Soc., 1976, vol. 123, no. 3, p. 381.
Boen, R. and Bouteillon, J., The electrodeposition of silicon in fluoride melts, J. Appl. Electrochem., 1983, vol. 13, no. 3, p. 277.
Cai, Z.-Y., Li, Y.-G., He, X.-F., and Liang, J.-L., Electrochemical behavior of silicon in the (NaCl–KCl–NaF–SiO2) molten salt, Metall. Mater. Trans. B, 2010, vol. 41, no. 5, p. 1033.
Hu, Y.-J., Wang, X., Xiao, J.-S., Hou, J.-G., Jiao, S.-Q., and Zhu, H.-M., Electrochemical behavior of silicon(IV) ion in BaF2–CaF2–SiO2 melts at 1573 K, J. Electrochem. Soc., 2013, vol. 160, no. 3, p. D81.
Bieber, A.L., Massot, L., Gibilaro, M., Cassayre, L., Taxil, P., and Chamelot, P., Silicon electrodeposition in molten fluorides, Electrochim. Acta, 2012, vol. 62, p. 282.
Sokhanvaran, S. and Barati, M., Electrochemical behavior of silicon species in cryolite melt, J. Electrochem. Soc., 2014, vol. 161, no. 1, p. E6.
Haarberg, G.M., Famiyeh, L., Martinez, A.M., and Osen, K.S., Electrodeposition of silicon from fluoride melts, Electrochim. Acta, 2013, vol. 100, p. 226.
Maeda, K., Yasuda, K., Nohira, T., Hagiwara, R., and Homma, T., Silicon electrodeposition in water–Soluble KF–KCl molten salt: investigations on the reduction of Si (IV) ions, J. Electrochem. Soc., 2015, vol. 162, no. 9, p. D444.
Галюс, З. Теоретические основы электрохимического анализа. Москва, Мир, 1974. 552 с.
Kuznetsova, S.V., Dolmatov, V.S., and Kuznetsov, S.A., Voltammetric study of electroreduction of silicon complexes in a chloride–fluoride melt, Russ. J. Electrochem., 2009, vol. 45, no. 7, p. 742.
Xu, L., Xiao, Y.-P., Xu, Q., Sandwijk, A.V., Li, J.-D., Zhao, Z., and Yang, Y.-X., Electrochemical behavior of zirconium in molten LiF–KF–ZrF4 at 600°C, RSC Adv., 2016, vol. 6, no. 87, p. 84472.
Liu, Y.-L., Yuan, L.-Y., Ye, G.-A., Zhang, M.-L., He, H., Tang, H.-B., Lin, R.-S., and Shi, W.-Q., Electrochemical extraction of samarium from LiCl–KCl melt by forming Sm–Zn alloys, Electrochim. Acta, 2014, vol. 120, p. 369.
Chamelot, P., Taxil, P., and Lafage, B., Voltammetric studies of tantalum electrodeposition baths, Electrochim. Acta, 1994, vol. 39, no. 17, p. 2571.
Luo, L.-X., Liu, Y.-L., Liu, N., Liu, K., Yuan, L.-Y., Chai, Z.-F., and Shi, W.-Q., Electroreduction-based Tb extraction from Tb4O7 on different substrates: understanding Al–Tb alloy formation mechanism in Li–Cl–KCl melt, RSC Adv., 2015, vol. 5, no. 85, p. 69134.
Serrano, K. and Taxil, P., Electrochemical reduction of trivalent uranium ions in molten chlorides, J. Appl. Electrochem., 1999, vol. 29, no. 4, p. 497.
Allongue, P. and Souteyrand, E., Experimental investigation of charge transfer at the semiconductor/electrolyte junction, Electrochim. Acta, 1992, vol. 37, no. 5, p. 781.
Zhou, B.Z. and Chen, Y.Y., Basic Tutorial of Electrode Process Dynamics, Wuhan: Wuhan University Press, 1987.
Дополнительные материалы отсутствуют.