Электрохимия, 2019, T. 55, № 5, стр. 609-618
Электродиализное извлечение цинка(II) жидкими мембранами на основе ди-(2-этилгексил)фосфорной кислоты
Т. Ж. Садырбаева *
Институт неорганической химии Рижского технического университета
Рига, Латвия
* E-mail: sadyrbaeva@hotmail.com
Поступила в редакцию 12.07.2018
После доработки 31.10.2018
Принята к публикации 27.11.2018
Аннотация
В данной статье представлен новый процесс извлечения ионов цинка(II) c помощью жидких мембран в условиях гальваностатического электродиализа с электроосаждением металла в катодном растворе. В качестве жидких мембран использовали растворы ди-(2-этилгексил)фосфорной кислоты с добавками три-н-октиламина в 1,2-дихлорэтане. Изучено влияние плотности тока электродиализа, состава водных растворов и органических мембран на скорость извлечения, трансмембранного переноса и электроосаждения ионов металла. Получены мелкокристаллические катодные осадки цинка из растворов соляной, серной, хлорной и уксусной кислот. Показано, что в исследованном процессе достигается практически полное (>99.9%) извлечение ионов цинка(II) жидкими мембранами из исходного раствора, содержащего 0.01 М ZnSO4, за 1–2.5 ч электродиализа. Полученная максимальная степень реэкстракции металла составляет 98%, а степень электроосаждения – 78%. Показано, что форма хронопотенциограмм может служить критерием полноты извлечения цинка(II) из исходного раствора.
ВВЕДЕНИЕ
Цинк широко используется в промышленности в качестве антикоррозионного покрытия железа и стали, в производстве аккумуляторов и батареек, в полиграфии, в органическом синтезе в качестве восстановителя, а также в сплавах с медью (латуни), алюминием и магнием. Сульфат и хлорид цинка применяют в медицине в качестве антисептических средств. Оксид цинка является вулканизатором в резиновой промышленности и применяется в качестве белого пигмента красок. Сульфид цинка используется в качестве люминофоров [1]. Таким образом, ионы цинка(II) содержатся в сточных водах многих предприятий, в том числе гальванических производств, предприятий цветной металлургии, лакокрасочной промышленности, производства вискозного волокна, фибры, стекла. Несмотря на то, что цинк является необходимым для человека микроэлементом и входит в состав различных ферментов, все соли этого металла токсичны, и сточные воды должны быть очищены от ионов цинка(II).
Для извлечения тяжелых металлов из водных растворов применяют различные методы: осаждение, сорбцию, ионный обмен, гальванокоагуляцию, экстракцию, электродиализ [2]. К недостаткам этих методов относится высокая стоимость реагентов, большое количество использующихся органических растворителей и экстрагентов. Метод мембранной экстракции перспективен для извлечения ионов металлов из разбавленных растворов [3]. Жидкая мембрана – это слой органического растворителя, содержащего селективный переносчик, разделяющий два водных раствора. Мембранная экстракция имеет ряд преимуществ по сравнению с жидкостной экстракцией: одновременная экстракция и реэкстракция в одну стадию процесса, высокая скорость переноса, минимальное количество органических реагентов.
В процессах жидкостной и мембранной экстракции из слабокислых и нейтральных растворов широко используется катионообменный экстрагент ди-(2-этилгексил)фосфорная кислота (Д2ЭГФК) [4]. Для мембранной экстракции цинка с помощью Д2ЭГФК применяли различные типы жидких мембран: импрегнированные [5, 6], комбинацию импрегнированной и эмульсионной жидких мембран [7], эмульсионные мембраны в экстракторе с полыми волокнами [8], объемные жидкие мембраны [9]. В этих процессах движущей силой переноса является градиент pH между отдающим и принимающим водными растворами. Указывается на селекивность извлечения цинка(II) и возможность его отделения от кальция(II), магния(II), меди(II) и частичную соэкстракцию железа(II).
Движущей силой переноса при электродиализе в системе с жидкой мембраной является градиент электрического потенциала [10]. Наложение электрического поля интенсифицирует перенос ионов через мембрану и облегчает реэкстракцию металлов из органической фазы. Процесс электродиализного транспорта может быть объединен с электроосаждением металла в принимающем растворе. При этом в отличие от традиционной мембранной экстракции не требуется высокая кислотность принимающего раствора, так как транспорт катионов металла сонаправлен с переносом ионов водорода. Процесс электродиализа через жидкие мембраны с одновременным катодным выделением металла был изучен нами ранее при извлечении ионов серебра(I) из азотнокислых растворов [11] и кобальта(II) из сернокислых растворов [12]. В литературе отсутствуют данные о применении мембранной экстракции в электрическом поле для извлечения цинка(II). Целью данной работы является изучение процесса извлечения цинка(II) из сернокислых растворов жидкими мембранами на основе Д2ЭГФК в условиях гальваностатического электродиализа с электроосаждением металла из принимающего катодного раствора.
МЕТОДИКА ЭКСПЕРИМЕНТА
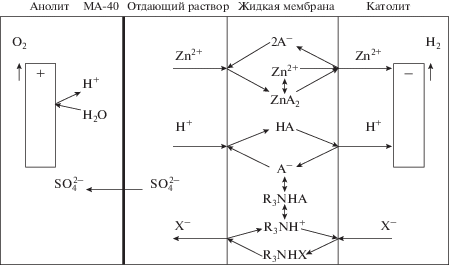
В экспериментах использовали четырехкамерную ячейку из фторопласта, состоящую из двух электродных камер, камеры отдающего раствора и жидкой мембраны, заключенной между вертикальными целлофановыми пленками. Объем жидкой мембраны составлял 2 см3, ее толщина – 0.2 см, площадь контакта фаз – 7.1 см2. Электродные камеры имели объем 17 см3, объем отдающего раствора – 13 см3. Анодная камера была отделена от камеры отдающего раствора твердой анионообменной мембраной МА-40. Целлофановые пленки и твердые анионообменные мембраны предварительно вымачивали в дистиллированной воде. Постоянный ток подавали на плоские платиновые электроды в гальваностатическом режиме с помощью источника постоянного тока AX‑12001 DBL. Эксперименты проводили при комнатной температуре, растворы не перемешивались.
В качестве жидких мембран использовали растворы технической Д2ЭГФК с добавками три-н-октиламина (ТОА) в 1,2-дихлорэтане. Содержание основного вещества в технической Д2ЭГФК составляет ~63%, кроме того экстрагент содержит ~16% моноалкилфосфорной кислоты и ~6% триалкилфосфорной кислоты, а также спирты. В большинстве экспериментов применяли 0.19 М (10 об. %) растворы Д2ЭГФК с добавкой 0.05 M ТОА. Отдающий раствор готовили растворением навески сульфата цинка ZnSO4 ∙ 7H2O (марка “х. ч.”) в серной кислоте нужной концентрации, как правило 0.01 М H2SO4. Исходная концентрация соли цинка обычно составляла 0.01 M. Концентрацию ионов цинка в водных растворах определяли спектрофотометрическим методом с ксиленоловым оранжевым при 570 нм [13]. Измерения оптической плотности проводили на спектрофотометре Jenway 6300.
Скорость экстракции ионов цинка(II) из отдающего раствора в жидкую мембрану характеризуется степенью извлечения Е:
(1)
$E = \left( {1 - {{{{C}_{{\text{f}}}}} \mathord{\left/ {\vphantom {{{{C}_{{\text{f}}}}} {{{C}_{0}}}}} \right. \kern-0em} {{{C}_{0}}}}} \right) \times 100\% ,$Степень электроосаждения цинка рассчитывали в соответствии с выражением:
(2)
$D = {{\left( {m100\% } \right)} \mathord{\left/ {\vphantom {{\left( {m100\% } \right)} {\left( {M{{C}_{0}}{{V}_{{\text{f}}}}} \right)}}} \right. \kern-0em} {\left( {M{{C}_{0}}{{V}_{{\text{f}}}}} \right)}},$Степень реэкстракции металла из жидкой мембраны R вычисляли, учитывая концентрацию ионов цинка(II) в катодном растворе, а также количество осажденного на катоде металла:
(3)
$R = \left( {{{\left( {{{C}_{{\text{k}}}}{{V}_{{\text{k}}}}} \right)} \mathord{\left/ {\vphantom {{\left( {{{C}_{{\text{k}}}}{{V}_{{\text{k}}}}} \right)} {\left( {{{C}_{0}}{{V}_{{\text{f}}}}} \right) \times 100\% }}} \right. \kern-0em} {\left( {{{C}_{0}}{{V}_{{\text{f}}}}} \right) \times 100\% }}} \right) + D,$Для характеристики скорости переноса цинка(II) через жидкую мембрану рассчитывали величину потока J:
(4)
$J = {{\left( {{{C}_{{\text{k}}}}{{V}_{{\text{k}}}}} \right)} \mathord{\left/ {\vphantom {{\left( {{{C}_{{\text{k}}}}{{V}_{{\text{k}}}}} \right)} {\left( {St} \right)}}} \right. \kern-0em} {\left( {St} \right)}},$Выход по току η для катионов цинка(II) определяли как:
где F – число Фарадея (96 485 Кл/моль), I – сила тока (А), t – продолжительность процесса (с).МЕХАНИЗМ МАССОПЕРЕНОСА
Из литературных данных известно, что Д2ЭГФК существует в димерной форме в малополярных растворителях, образует мономеры в спиртах и промежуточные комплексы в хлороформе и ацетоне [14]. Можно предположить, что в достаточно полярном растворителе 1,2-дихлорэтане (ε > 10), который использовался в данной работе, мономеры и димеры Д2ЭГФК существуют в сравнимых количествах. В присутствии в органической фазе примеси три-н-октиламина в результате реакции переноса протона образуется ионная пара R3NH+A−, которая является бинарным экстрагентом [15]:
(6)
${\text{HA + }}{{{\text{R}}}_{{\text{3}}}}{\text{N }} \leftrightarrow {{{\text{R}}}_{{\text{3}}}}{\text{N}}{{{\text{H}}}^{{\text{ + }}}}{{{\text{A}}}^{ - }},$Без учета частичной димеризации экстрагента Д2ЭГФК извлечение ионов цинка(II) можно представить следующими уравнениями катионообменной экстракции:
(7)
${\text{Zn}}_{{\left( {\text{в }} \right)}}^{{2 + }} + {\text{2H}}{{{\text{A}}}_{{{\text{(o)}}}}} \leftrightarrow {\text{Zn}}{{{\text{A}}}_{{{\text{2(}}}}}_{{{\text{o)}}}} + {\text{2H}}_{{\left( {\text{в }} \right)}}^{ + },$(8)
${\text{Zn}}_{{\left( {\text{в }} \right)}}^{{2 + }} + {\text{2}}{{{\text{R}}}_{{\text{3}}}}{\text{NH}}{{{\text{A}}}_{{{\text{(o)}}}}} \leftrightarrow {\text{Zn}}{{{\text{A}}}_{{{\text{2(}}}}}_{{{\text{o)}}}} + {\text{2}}{{{\text{R}}}_{{\text{3}}}}{\text{NH}}_{{{\text{(o)}}}}^{ + },$Катионы Zn2+ за счет диффузии и электро-миграции транспортируются из объема отдающего раствора к границе раздела фаз с органической жидкой мембраной и взаимодействуют с экстрагентом. Экстрагируемый комплекс ZnA2 диффундирует через слой жидкой мембраны, разрушается на границе раздела фаз по реакциям обратным реакциям экстракции (7), (8), и катионы цинка(II) транспортируются в объем принимающего раствора и далее к поверхности катода, где восстанавливаются до металла. Экстрагируемый комплекс цинка может частично диссоциировать в 1,2-дихлорэтане. Катионы Zn2+, которые появляются в органической фазе в результате частичной диссоциации экстрагируемого комплекса, переносятся через жидкую мембрану за счет электромиграции. Молекулы переносчика (R3NHA, HA) диффундируют обратно к границе раздела фаз с отдающим раствором по градиенту их концентрации. Ионы водорода транспортируются через жидкую мембрану в принимающий раствор в том же направлении, что и катионы цинка(II), взаимодействуя с переносчиком по межфазной реакции катионного обмена:
(9)
${\text{H}}_{{\left( {\text{в }} \right)}}^{ + } + {{{\text{R}}}_{{\text{3}}}}{\text{NH}}{{{\text{A}}}_{{{\text{(o)}}}}} \leftrightarrow {\text{H}}{{{\text{A}}}_{{\text{(}}}}_{{{\text{o)}}}} + {{{\text{R}}}_{{\text{3}}}}{\text{NH}}_{{{\text{(o)}}}}^{ + }.$В отличие от традиционной мембранной экстракции Д2ЭГФК, при которой потоки ионов металла и катионов водорода направлены противоположно и необходимы высокая кислотность принимающего раствора и корректировка pH отдающего раствора [3], при электродиализе возможно извлечение металла в слабокислые и нейтральные водные растворы.
Если в принимающем катодном растворе содержится кислота HX, ее анионы взаимодействуют с бинарным экстрагентом на границе с жидкой мембраной:
(10)
${\text{X}}_{{\left( {\text{в }} \right)}}^{ - } + \quad\,{{{\text{R}}}_{{\text{3}}}}{\text{NH}}{{{\text{A}}}_{{\left( {\text{o}} \right)}}} \leftrightarrow {{{\text{R}}}_{{\text{3}}}}{\text{NH}}{{{\text{X}}}_{{\left( {\text{o}} \right)}}}{\;} + {\text{А }}_{{{\text{(o)}}}}^{ - }.$Затем образовавшаяся соль амина R3NHX переносится через слой органической фазы в обратном направлении по отношению к катионам цинка и водорода, и анионы X− реэкстрагируются из жидкой мембраны в отдающий раствор.
Окислительно-восстановительные реакции на платиновых электродах сопряжены с переносом ионов через жидкую мембрану и твердую анионообменную мембрану. На катоде в растворах серной или соляной кислоты, обычно использовавшихся в экспериментах, происходит выделение водорода и электроосаждение цинка:
(11)
${\text{2}}{{{\text{H}}}^{{\text{ + }}}} + {\text{2}}{{{\text{e}}}^{ - }}\,\,\quad \to {\text{ }}{{{\text{H}}}_{{\text{2}}}} \uparrow ,$(12)
${\text{Z}}{{{\text{n}}}^{{{\text{2 + }}}}} + {\text{ }}2{{{\text{e}}}^{ - }}\,\,\quad \to {\text{Zn}} \downarrow .$На инертном аноде в сернокислом растворе выделяется кислород в результате окисления молекул воды:
(13)
${\text{2}}{{{\text{H}}}_{{\text{2}}}}{\text{O}} \to {\text{ }}{{{\text{O}}}_{2}} \uparrow + {\text{ }}4{{{\text{H}}}^{ + }} + 4{{{\text{e}}}^{ - }}.$Процесс электродиализного извлечения цинка(II) в системе с жидкой мембраной схематически изображен на рис. 1.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Влияние состава катодного раствора
В экспериментах было установлено, что при наложении постоянного электрического поля на систему с жидкой мембраной происходит перенос ионов цинка(II) в катодный сернокислый раствор, и в определенных условиях наблюдается электроосаждение цинка на катоде. При плотности тока 5.7 мA/см2 полное извлечение цинка(II) из отдающего раствора достигается за 1–1.5 ч электродиализа при использовании в качестве католита разбавленных (<0.1 M) растворов H2SO4. Повышение концентрации серной кислоты в катодном растворе в пределах 0.01–0.1 М оказывает негативное влияние на степень экстракции цинка(II) в органическую фазу и степень электроосаждения металла (табл. 1). Это связано, вероятно, с усилением противонаправленного потока анионов ${\text{SO}}_{4}^{{2 - }}$ через жидкую мембрану, что приводит к снижению выхода по току для катионов Zn2+. Увеличение продолжительности электродиализа способствует более полной реэкстракции металла из органической фазы. Наиболее высокая степень электроосаждения цинка(II) была достигнута в системе с 0.01 М H2SO4 в католите, однако в этих условиях извлечение металла сопровождается негативными явлениями, такими как образование темного осадка, возможно, восстановленного цинка на целлофановой пленке на границе жидкой мембраны с католитом и помутнение католита из-за выхода органических катионов R3NH+ в объем водной фазы. Органические катионы начинают участвовать в переносе тока через границу раздела фаз жидкая мембрана/катодный раствор при недостаточном количестве электролита в катодной камере. В последующих экспериментах использовали в качестве католита растворы кислот с концентрацией 0.02 М.
Таблица 1.
Влияние концентрации серной кислоты в катодном растворе на степень извлечения ионов цинка(II) в жидкую мембрану (Е), степень реэкстракции (R), степень электроосаждения (D) и поток (J). i = = 5.7 мА/см2, СZn = 0.01 М, СД2ЭГФК = 0.19 М, СTOA = = 0.05 М
| ${{C}_{{{{{\text{H}}}_{{\text{2}}}}{\text{S}}{{{\text{O}}}_{{\text{4}}}}}}}$, М | t, мин | Е | R | D | J, мкмоль/(м2 с) |
|---|---|---|---|---|---|
| % | |||||
| 0.01 | 77 | 100 | 42 | 23 | 18 |
| 0.02 | 66 | 100 | 54 | 6 | 27 |
| 0.03 | 67 | 100 | 59 | – | 29 |
| 0.05 | 90 | 99 | 76 | – | 29 |
| 0.1 | 150 | 63 | 55 | – | 12 |
Напряжение в системе в ходе гальваностатического электродиализа изменяется по-разному в зависимости от условий эксперимента (рис. 2). При низкой концентрации серной кислоты в католите (<0.05 M) продолжительность электродиализа ограничена резким подъемом напряжения (кривые 1, 2), в то время как в системах с более концентрированным раствором H2SO4 наблюдается непрерывное снижение напряжения (кривые 3, 4). Снижение напряжения в ходе электродиализа обычно связано с накоплением воды в фазе жидкой мембраны. Было установлено, что резкое падение электропроводности и повышение напряжения в системе соответствует практически полному (≥99%) извлечению цинка(II) в жидкую мембрану и вызвано обессоливанием отдающего раствора в результате экстракции катионов металла и водорода в органическую фазу и переноса анионов ${\text{SO}}_{4}^{{2 - }}$ через твердую анионообменную мембрану в анодную камеру. При более высокой концентрации серной кислоты в католите количественное извлечение цинка(II) из отдающего раствора не достигается, и подъем напряжения не происходит. Таким образом, форма хронопотенциограмм может служить критерием полноты извлечения металла в жидкую мембрану.
Рис. 2.
Влияние концентрации серной кислоты в католите на кинетические зависимости изменения напряжения. i = 5.7 мА/см2; ${{C}_{{{{{\text{H}}}_{{\text{2}}}}{\text{S}}{{{\text{O}}}_{{\text{4}}}}}}}$, M: 1 – 0.01; 2 – 0.02; 3 – 0.05; 4 – 0.1.

В табл. 2. показано влияние состава катодного раствора на транспорт и электроосаждение цинка(II). В качестве католита использовали разбавленные растворы соляной, серной, хлорной и уксусной кислот. Из данных табл. 2 следует, что во всех случаях происходит полное извлечение ионов цинка(II) из отдающего раствора. Система с серной кислотой отличается более низкой скоростью экстракции металла, но увеличение продолжительности электродиализа приводит к практически полной реэкстракции цинка(II) и повышению степени электроосаждения до 78%. В случае использования в качестве католита уксусной кислоты, являющейся слабым электролитом, напряжение в ходе электродиализа значительно выше, чем в других системах. Процесс извлечения цинка(II) в хлорнокислые растворы может осложняться образованием белого осадка ZnA2 на целлофановой пленке на границе с катодным раствором и появлением органической фазы с образованием эмульсии в католите в ходе продолжительных экспериментов. Таким образом, для изучения закономерностей электродиализного транспорта был выбран катодный раствор, содержащий соляную кислоту.
Таблица 2.
Влияние природы кислоты в катодном растворе на скорость извлечения и электроосаждения ионов цинка(II). i = 2.8 мА/см2
| Кислота (С = 0.02 М) | t, ч | Е | R | D | J, мкмоль/(м2 с) |
|---|---|---|---|---|---|
| % | |||||
| HCl | 2.5 | 100 | 37 | 18 | 8 |
| HClO4 | 2.8 | 100 | 34 | 26 | 6 |
| H2SO4 | 2.5 | 76 | 41 | 10 | 8 |
| H2SO4 | 5.0 | 98 | 98 | 78 | 10 |
| CH3COOH | 2.5 | 100 | 43 | 37 | 9 |
Осадки цинка, полученные из растворов соляной кислоты, имеют вид матовых, темно-серых, мелкокристаллических, достаточно прочно сцепленных с электродом покрытий. Структура осадка представлена на рис. 3.
Влияние плотности тока
Повышение плотности тока в интервале от 1.4 до 4.2 мА/см2 приводит к значительному увеличению скорости извлечения цинка(II) в жидкую мембрану, а также степени реэкстракции и величины потока ионов металла в катодный раствор (рис. 4). Дальнейшее увеличение плотности тока в условиях экспериментов ограничено полной экстракцией цинка(II) из отдающего раствора и резким повышением напряжения в системе. Наиболее высокая скорость трансмембранного переноса цинка(II), полученная при плотности тока 4.2 мА/см2, достигает 22 мкмоль/(м2 с).
Рис. 4.
Степень извлечения цинка(II) в жидкую мембрану Е (1), степень реэкстракции R (2), а также скорость переноса металла J (3) в зависимости от плотности тока. СZn = 0.01 M, t = 1 ч, СД2ЭГФК = 0.19 М, СТОА = 0.05 M, католит – 0.02 M HCl.

Кинетические зависимости извлечения, трансмембранного переноса и электроосаждения ионов цинка(II) из 0.02 М раствора HCl при плотности тока 2.8 мА/см2 представлены на рис. 5. В этих условиях полное извлечение металла из отдающего раствора достигается за 2–2.5 ч электродиализа. Около половины цинка(II) реэкстрагируется в катодный раствор, и такое же количество металла остается после электродиализа в жидкой мембране. Электроосаждение цинка(II) начинается примерно через 1 ч и к концу эксперимента составляет 23%. Процесс заканчивается резким ростом напряжения в системе. Надо отметить, что после 2 ч электродиализа в условиях обеднения отдающего раствора по катионам цинка(II) и водорода может происходить выход органических катионов три-н-октиламмония из жидкой мембраны в водную фазу с образованием эмульсии. Ранее было показано, что достижение практически полной реэкстракции цинка(II) (98%) и повышение степени электроосаждения до 78% возможно в ходе 5-часового электродиализа в системе с сернокислым катодным раствором, в которой скорость извлечения металла в жидкую мембрану ниже, чем в случае солянокислого католита (табл. 2).
Измерения рН растворов
Было показано, что мембранная экстракция цинка(II) в условиях электродиализа сопровождается значительным повышением величины pH катодного и отдающего растворов и некоторым снижением pH анодного сернокислого раствора (табл. 3). Повышение величины pH отдающего раствора, содержащего цинк(II), обусловлено извлечением ионов водорода в жидкую мембрану. Сульфат-ионы из отдающего раствора, а также хлорид-ионы, которые переносятся через жидкую мембрану в отдающий раствор из католита, транспортируются через твердую анионообменную мембрану МА-40 в анолит. Перенос сульфат-ионов и хлорид-ионов в анолит сопряжен с образованием ионов водорода в ходе анодной реакции (13). Таким образом, в ходе электродиализа происходит накопление серной кислоты в анолите и обессоливание отдающего раствора. Сильное повышение величины pH и снижение кислотности катодного раствора связано с участием катионов H+ в электродной реакции выделения газообразного водорода (11). В католите в начале процесса накапливается раствор хлорида цинка(II), из которого затем происходит электроосаждение металла.
Влияние состава исходного раствора
При повышении концентрации цинка(II) в отдающем растворе от 6 × 10–3 до 0.12 М поток ионов металла через жидкую мембрану возрастает, но степени извлечения и реэкстракции снижаются (рис. 6). Увеличение исходной концентрации цинка(II) приводит к повышению величины выхода по току, рассчитанной по видимой площади жидкой мембраны, однако при максимальной концентрации металла выход по току составляет 10% (табл. 4). Таким образом, ток через жидкую мембрану переносят главным образом ионы водорода из отдающего раствора и хлорид-ионы из католита. Величина выхода по току зависит также от силы тока и продолжительности процесса. Наблюдается некоторое увеличение выхода по току при повышении силы тока электродиализа. Надо отметить, что при силе тока 30 мА (4.2 мА/см2) происходит предельный рост напряжения в системе после 53 мин процесса, вызванный обессоливанием отдающего раствора. Повышенное напряжение приводит к увеличению потока ионов цинка(II) через жидкую мембрану и к повышению выхода по току. Выход по току возрастает также при увеличении продолжительности процесса до 2 ч. В начальный период электродиализа происходит преимущественно перенос ионов водорода через жидкую мембрану.
Рис. 6.
Степень извлечения цинка(II) в жидкую мембрану Е (1), степень реэкстракции R (2), а также скорость переноса J (3) в зависимости от исходной концентрации металла. i = 2.8 мА/см2, t = 1 ч; католит – 0.02 M HCl.

Таблица 4.
Влияние силы тока и концентрации цинка(II) в отдающем растворе на выход по току (η). СД2ЭГФК = 0.19 М, СTOA = 0.05 М, католит – 0.02 M HCl
| t, мин | I, мA | С0, М | η, % |
|---|---|---|---|
| 60 | 10 | 0.01 | 5 |
| 60 | 20 | 0.01 | 7 |
| 53 | 30 | 0.01 | 10 |
| 40 | 20 | 0.01 | 4 |
| 80 | 20 | 0.01 | 8 |
| 120 | 20 | 0.01 | 8 |
| 60 | 20 | 0.006 | 4 |
| 60 | 20 | 0.04 | 9 |
| 60 | 20 | 0.12 | 10 |
Повышение кислотности отдающего раствора от 5 × 10–3 до 1.0 М при постоянной концентрации цинка(II) приводит к снижению степеней извлечения, реэкстракции, а также электроосаждения металла (рис. 7). Из одномолярной серной кислоты цинк(II) практически не извлекается. Такое значительное влияние кислотности цинксодержащего раствора на эффективность электродиализного извлечения связано со снижением экстракционной способности Д2ЭГФК при повышении кислотности водной фазы [4], а также с повышением потока катионов водорода через жидкую мембрану при увеличении содержания фонового электролита. Напряжение в ходе электродиализа при минимальной концентрации серной кислоты (5 × 10–3 М) непрерывно возрастает из-за снижения содержания электролита в отдающем растворе, в то время как в системах, содержащих растворы H2SO4 с концентрацией выше 0.01 М, значительного изменения напряжения не происходит. Оптимальная кислотность исходного раствора цинка(II) – 5 × 10–3 – 0.01 М H2SO4.
Влияние состава жидкой мембраны
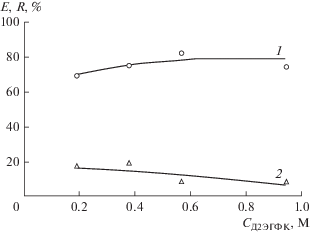
Повышение содержания технической Д2ЭГФК в жидкой мембране от 0.19 до 0.95 М (10–50 об. %) при постоянной концентрации три-н-октиламина 0.05 М приводит к незначительному увеличению степени извлечения цинка(II) из отдающего раствора и к некоторому снижению степени реэкстракции металла (рис. 8). Наблюдающееся негативное влияние избытка переносчика Д2ЭГФК на скорость трансмембранного переноса цинка(II) может быть обусловлено повышением вязкости органического раствора. Оптимальная концентрация Д2ЭГФК – 0.2–0.4 М.
Рис. 8.
Зависимости степени извлечения цинка(II) в жидкую мембрану Е (1) и в принимающий раствор R (2) от концентрации Д2ЭГФК в жидкой мембране. i = 2.8 мА/см2, t = 1 ч, католит – 0.02 M HCl.
Из литературы известно, что экстракция цинка Д2ЭГФК характеризуется быстрым установлением равновесия за 30 с [16] или, по другим данным, в течение 5 мин [17]. Скорость переноса цинка(II) через импрегнированную жидкую мембрану, содержащую Д2ЭГФК, в основном контролируется диффузией в мембране [18]. Учитывая, что перенос цинка(II) через жидкую мембрану в условиях электродиализа происходит частично за счет электромиграции, а реэкстракция в разбавленные растворы кислот в отсутствие электрического поля незначительна, можно предположить, что скоростьопределяющей стадией трансмембранного переноса цинка(II) является реэкстракция металла из органической фазы.
Растворы технической Д2ЭГФК, которые использовались в качестве жидких мембран, характеризуются низкой электропроводностью из-за содержания в них значительного количества сильно ассоциированной моноалкилфосфорной кислоты [4]. Это затрудняет применение в электродиализе индивидуальных растворов Д2ЭГФК. Для повышения электропроводности органических растворов в них вводили добавки три-н-октиламина. При изучении влияния количества добавки на скорость мембранной экстракции цинка(II) было показано, что повышение содержания ТОА в жидкой мембране в интервале 0.05–0.5 М при постоянной концентрации Д2ЭГФК 0.19 М мало влияет на степень реэкстракции, но значительно снижает степень извлечения ионов металла в органическую фазу (рис. 9). Избыток анионообменного переносчика ТОА способствует интенсификации переноса хлорид-ионов из католита через жидкую мембрану, и это приводит к снижению выхода по току для катионов цинка(II). Оптимальная концентрация добавки ТОА – 0.05–0.1 М.
Рис. 9.
Зависимости степени извлечения цинка(II) в жидкую мембрану Е (1) и в принимающий раствор R (2) от концентрации ТОА в жидкой мембране. i = = 2.8 мА/см2, t = 1 ч, католит – 0.02 M HCl.
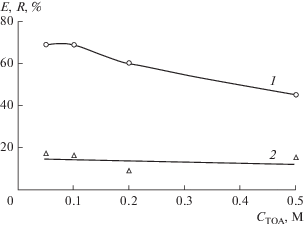
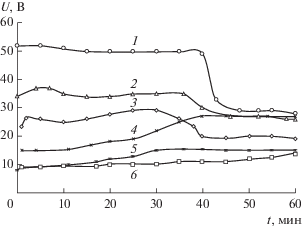
Рисунок 10 иллюстрирует изменение формы хронопотенциограмм в зависимости от состава жидкой мембраны. Увеличение концентрации переносчика Д2ЭГФК в органической фазе приводит к снижению электропроводности системы и увеличению начального напряжения электродиализа (кривые 1–3). Увеличение содержания ТОА повышает электропроводность и способствует снижению начального напряжения (кривые 3–6). В ходе экспериментов напряжение в системе может скачкообразно снижаться после нескольких десятков минут электродиализа, а в других условиях наблюдается непрерывный рост напряжения. Электропроводность системы с жидкой мембраной, как правило, определяется составом органической фазы. Снижение напряжения в ходе электродиализа связано с накоплением воды в фазе жидкой мембраны. Вода переносится в жидкую мембрану в составе гидратно-сольватных оболочек экстрагируемых ионов и за счет электроосмоса [19]. После длительных экспериментов наблюдается накопление воды в органической фазе в количестве до 0.5 мл при общем объеме жидкой мембраны 2 мл. Непрерывное повышение напряжения в течение электродиализа можно объяснить экстракцией цинка(II) с образованием в органической фазе нейтрального комплекса ZnA2.
Рис. 10.
Влияние концентрации Д2ЭГФК и ТОА в жидкой мембране на кинетику изменения напряжения. i = 2.8 мА/см2; католит – 0.02 M HCl; СД2ЭГФК, М: 1 – 0.95; 2 – 0.57; 3, 4. 5, 6 – 0.19; СТОА, М: 1, 2, 3 – 0.05; 4 – 0.1; 5 – 0.2; 6 – 0.5.
На рис. 11 приведена вольтамперная характеристика жидкой мембраны, содержащей 10 об. % (0.19 М) Д2ЭГФК и 0.05 М ТОА, а также показано влияние состава органической фазы на величину начального напряжения электродиализа. Некоторая нелинейность вольтамперограммы (1) может быть связана с использованием органических растворов, хранившихся до эксперимента различное время, а также разных образцов анионообменных мембран и целлофана. Начальное напряжение в системе значительно повышается при увеличении концентрации Д2ЭГФК в жидкой мембране до 50 об. % (0.95 М), что связано с низкой электропроводностью растворов технического экстрагента. Увеличение концентрации ТОА в органической фазе до 0.2 М приводит к понижению начального напряжения, но при дальнейшем повышении содержания амина изменения начального напряжения не происходит, так как при стехиометрическом соотношении реагентов Д2ЭГФК полностью переходит в ионную форму R3NH+A−. Данные рис. 11 показывают, что в целях снижения напряжения при гальваностатическом электродиализе желательно использовать оптимальные концентрации переносчика и добавки амина.
Рис. 11.
Зависимость начального напряжения от силы тока (1), концентрации Д2ЭГФК (2) и ТОА (3) в жидкой мембране. t = 1 ч, католит – 0.02 M HCl.

Таким образом, изученный процесс обеспечивает одностадийную экстракцию, реэкстракцию и катодное электроосаждение цинка(II) из разбавленных растворов серной, соляной, хлорной и уксусной кислот. Наложение электрического поля интенсифицирует перенос цинка(II) через жидкую мембрану и облегчает реэкстракцию металла по сравнению с традиционной мембранной экстракцией. Жидкие мембраны, ограниченные целлофановыми пленками, использованные в данной работе, стабильнее чем импрегнированные и эмульсионные жидкие мембраны, применяющиеся в настоящее время. Испарение органической фазы, которое является одной из причин нестабильности импрегнированных мембран, не имеет существенного значения в случае объемной жидкой мембраны. В предложенном методе отсутствуют недостатки эмульсионных жидких мембран – коалесценция эмульсии, а также трудность разрушения эмульсии [3]. Время работы использованных в экспериментах жидких мембран достигает 5 ч. Компоненты жидкой мембраны не выходят из органической фазы при электродиализе, если концентрация фонового электролита (кислоты) в водных растворах достаточно высока. Путем изменения параметров электродиализа: плотности тока, времени, концентрации компонентов, можно достигнуть полного извлечения металла из исходного раствора и повысить степени реэкстракции и электроосаждения. Дополнительной возможностью повышения стабильности объемной жидкой мембраны является увеличение ее толщины. Преимуществом метода электродиализа по сравнению с традиционным электролизом является возможность получать катодные осадки металла из растворов, отличающихся по составу от исходного раствора цинка(II).
ЗАКЛЮЧЕНИЕ
Метод мембранной экстракции в условиях гальваностатического электродиализа позволяет осуществить одностадийное извлечение ионов Zn2+ из сернокислых растворов, перенос через жидкие мембраны на основе Д2ЭГФК и электроосаждение цинка из католитов, содержащих разбавленные растворы различных кислот. Получены мелкокристаллические катодные осадки цинка, достаточно хорошо сцепленные с электродом, при осаждении из растворов 0.02 М HCl, H2SO4, HClO4, CH3COOH. Показано, что в ходе электродиализа полное извлечение цинка(II) из отдающего раствора в жидкую мембрану происходит за 1–2.5 ч процесса. Наиболее высокая степень электроосаждения металла составляет 78%, и степень реэкстракции цинка(II) в католит достигает 98%. Резкий рост напряжения в системе может служить критерием полноты извлечения металла в жидкую мембрану и обессоливания отдающего раствора. Степени извлечения и реэкстракции металла возрастают при повышении плотности тока, продолжительности процесса, снижении исходной концентрации цинка(II) и серной кислоты в отдающем растворе, снижении концентрации кислоты в католите. Изменение содержания переносчика Д2ЭГФК и добавки ТОА в органической фазе слабо влияет на скорость переноса цинка(II) через жидкую мембрану. В ходе электродиализа происходит значительное снижение кислотности католита и отдающего раствора и некоторое повышение кислотности анолита.
Список литературы
Живописцев, В.П., Селезнева, Е.А. Аналитическая химия цинка. М.: Наука, 1975. 200 с. [Zhivopistsev, V.P. and Selezneva, E.A., Analytical chemistry of zinc (in Russian), Moscow: Nauka, 1975. 200 p.]
Долина, Л.Ф. Современная техника и технологии для очистки сточных вод от солей тяжелых металлов. Днепропетровск: Континент, 2008. 254 с. [Dolina, L.F., Modern techniques and technologies for purification of wastewater from salts of heavy metals (in Russian), Dnepropetrovsk: Kontinent, 2008. 254 p.]
Ивахно, С.Ю., Юртов, Е.В. Мембранная экстракция. М.: ВИНИТИ, 1990. 174 с. [Ivakhno, S.Yu. and Yurtov, E.V., Membrane extraction (in Russian), Moscow: VINITI, 1990. 174 p.]
Ягодин, Г.А., Каган, С.З., Тарасов, В.В. и др. Основы жидкостной экстракции. М.: Химия, 1981. 400 с. [Yagodin, G.A., Kagan, S.Z., Tarasov, V.V. et al., Fundamentals of liquid-liquid extraction (in Russian), Moscow: Khimiya, 1981. 400 p.]
Ata, O.N., Bese, A.V., Colak, S., et al., Effect of parameters on the transport of zinc ion through supported liquid membrane, Chem. Eng. Process., 2004, vol. 43, p. 895.
Ata, O.N. and Colak, S., Modelling of zinc transport through a supported liquid membrane, Hydrometallurgy, 2005, vol. 80, p. 155.
He, D., Luo, X., Yang, Ch. et al., Study of transport and separation of Zn(II) by a combined supported liquid membrane/strip dispersion process containing D2EHPA in kerosene as the carrier, Desalination, 2006, vol. 194, p. 40.
Fouad, E.A. and Bart, H.-J., Emulsion liquid membrane extraction of zinc by a hollow-fiber contactor, J. Membr. Sci., 2008, vol. 307, p. 156.
Singh, R., Mehta, R., and Kumar, V., Simultaneous removal of copper, nickel and zinc metal ions using bulk liquid membrane system, Desalination, 2011, vol. 272, p. 170.
Popov, A., Electrodialysis through Liquid Ion-exchange Membranes and the Oil-water Interface, in Liquid-liquid Interface: Theory and Methods, Volkov, A. and Deamer, D., Eds, New York, London, Tokyo: CRC Press, 2006, p. 333.
Sadyrbaeva, T.Zh., Liquid membrane system for extraction and electrodeposition of silver(I), J. Electroanal. Chem., 2010, vol. 648, no. 2, p. 105.
Sadyrbaeva, T.Zh., Recovery of cobalt(II) by the hybrid liquid membrane - electrodialysis - electrolysis process, Electrochim. Acta., 2014, vol. 133, p. 161.
Булатов, М.И., Калинкин, И.П. Практическое руководство по фотоколориметрическим и спектрофотометрическим методам анализа, изд. 2-е. Ленинград: Химия, 1968. С. 215–224. [Bulatov, M.I. and Kalinkin, I.P., Practical guide to photometric and spectrophotometric methods of analysis, 2nd ed. (in Russian), Leningrad: Khimiya, 1968. p. 215-224.]
Михайлов, В.А. Химия экстракции металлов диалкилфосфорными кислотами и их солями, в сб.: Современные проблемы химии и технологии экстракции. М.: РАН, 1999. Т. 1. С. 72. [Mikhailov, V.A., Chemistry of extraction of metals by dialkyl phosphoric acids and their salts, in: Modern problems of extraction chemistry and technology (in Russian), Moscow: RAN, 1999. vol. 1, p. 72.]
Kholkin, A.I., Belova, V.V., Pashkov G.L. et al., Solvent binary extraction, J. Molec. Liq., 1999, vol. 82, nos. 1–2, p. 131.
Jafari, H., Abdollahi, H., Gharabaghi, M., and Balesini, A.A., Solvent extraction of zinc from synthetic Zn–Cd–Mn chloride solution using D2EHPA: optimization and thermodynamic studies, Separ. Purif. Technol., 2018, vol. 197, p. 210.
Pereira, D.D., Rocha, S.D.F., and Mansur, M.B., Recovery of zinc sulphate from industrial effluents by liquid-liquid extraction using D2EHPA (di-2-ethylhexylphosphoric acid), Separ. Purif. Technol., 2007, vol. 53, p. 89.
Huang, T.C. and Juang, R.S., Transport of zinc through a supported liquid membrane using D2EHPA as a mobile carrier, J. Membr. Sci., 1987, vol. 31, nos. 2–3, p. 209.
Голубев, В.Н., Пурин, Б.А. Исследование электрического пробоя жидкостных мембран при переносе через них некоторых анионов. ДАН СССР. 1977. Т. 232. № 6. С. 1340. [Golubev, V.N. and Purin, B.A., Investigation of the Electrical Breakdown of the Liquid Membranes during Anions Transfer, Doklady AN SSSR (in Russian), 1977, vol. 232, no. 6, p. 1340.]
Дополнительные материалы отсутствуют.