Электрохимия, 2019, T. 55, № 7, стр. 825-831
Добавка нового синтезированного карбазола к электролиту литий-ионных аккумуляторов для их защиты от перезаряда
А. Р. Мадрам a, *, М. Заранди b, **, А. С. Бени c, Я. Баят a
a Технологический Университет Малека Аштара
15875-1774 Тегеран, Иран
b Исламский Университет Азад
Кум, Иран
c Ясуджский Университет
75918-74831 Ясудж, Иран
* E-mail: ar.madram@gmail.com
** E-mail: Maryam.zarandi88@gmail.com
Поступила в редакцию 16.01.2018
После доработки 09.07.2018
Принята к публикации 27.08.2018
Аннотация
Исследован органический мономер 9-фенил-9H-карбазол, содержащий фенильный остаток, который был использован в качестве новой добавки к электролиту для защиты литий-ионных LiFePO4-аккумуляторов от перезаряда. Результаты исследований, проведенных методом циклической вольтамперометрии, показали, что этот мономер способен к электрополимеризации с образованием проводящего полимера на поверхности катода. Поэтому он может предотвращать уход напряжения в результате перезаряда. Тесты заряда–разряда исследованных LiFePO4/C-аккумуляторов показали, что добавка 9-фенил-9H-карбазола позволяет поддерживать напряжение исследованных литий-ионных аккумуляторов на уровне ниже 4.2 В. Важно, что 9-фенил-9H-карбазол не оказывает существенного влияния на характеристики заряда–разряда аккумуляторов при нормальных условиях циклирования в течение 50 циклов.
ВВЕДЕНИЕ
Литий-ионные аккумуляторы – очень перспективные устройства для запасания энергии. Они получили широкое распространение как источники тока для портативной электроники и, в особенности, для электромобилей, благодаря их высокой плотности энергии, высокому напряжению разряда и хорошей циклируемости [1–6]. Типичный литий-ионный аккумулятор содержит неводный органический электролит, графитовый анод и катод из оксида переходного металла (такого, как LiFePO4, LiMn2O4, LiCoO2, LiNiO2 и т.д.). Обычно используемый электролит для коммерческих литий-ионных аккумуляторов состоит из соли LiPF6 и смеси карбонатов, включая диметилкарбонат, этилметилкарбонат, диэтилкарбонат и этиленкарбонат [7]. В последние годы огромные усилия в науке и технологии были направлены на безопасность литий-ионных аккумуляторов из-за их эксплуатации с нарушением установленных норм или режимов, таких как уход температуры, вызывающий растрескивание элементов, возгорание и даже взрыв [8, 9]. Одна из обычных причин неправильной эксплуатации элементов – это их перезаряд (избыточный заряд аккумуляторной батареи) [10, 11]. В условиях перезаряда электролит экзотермически реагирует с электродами, результатом чего является термическая нестабильность или уход параметров литий-ионного аккумулятора из-за изменения температуры [12]. Одним из многообещающих решений этой проблемы может стать подбор химических соединений для реализации внутреннего самосрабатывающего механизма защиты отдельного элемента. Поэтому исследования в этой области – это глобальная потребность [13]. Соответственно, химические соединения, которые являются внутренней самосрабатывающей защитой от перезаряда – это важный класс добавок к электролиту [14, 15]. Для повышения безопасности литий-ионных аккумуляторов по отношению к перезаряду были предложены два важнейших типа веществ для использования в качестве добавок к электролиту – это мономеры, склонные к полимеризации [12–15], и окислительно-восстановительные переносчики [16–22].
В настоящей работе в продолжение наших исследований электрохимии соединений на основе карбазолов [23] мы описываем синтез и характеристики новой добавки к электролиту на основе карбазолов для защиты литий-ионных аккумуляторов от перезаряда. Мы также исследовали ключевые факторы и соответствующие механизмы работы литий-ионных аккумуляторов для того, чтобы лучше понять вопросы защиты литий-ионных аккумуляторов от перезаряда.
МЕТОДИКА ЭКСПЕРИМЕНТА
Материалы
Все растворители и остальные реактивы были приобретены у компаний Merck и Sigma Aldrich, имели квалификацию “ч. д. а.” и использовались без дополнительной очистки. Точки плавления измеряли электротермическим прибором KSB1N. В измерениях методом тонкослойной хроматографии были использованы пластинки силикагеля квалификации “для тонкослойной хроматографии” G/UV 254 нм, н-гексан и этилацетат. 1H‑ЯМР- и 13C-ЯМР-исследования проводили на спектрометре FT-NMR Bruker advance (частота 400 МГц в случае 1H ЯМР и 100 МГц в случае 13C ЯМР; растворитель: диметилсульфоксид, ДМСО-d6). ИК-спектры с преобразованием Фурье записывали в матрице KBr на спектрометре JASCO FT-IR-680 plus. Для исследования механизма действия добавок к электроду для защиты от перезаряда наблюдали изменения морфологии катода после перезаряда с помощью сканирующего электронного микроскопа (SEM) Philips XL30 на образцах с золотым покрытием. В настоящей работе использовали электролит 1 M LiPF6 в смеси этилкарбонат + диметилкарбонат + этилметилкарбонат (1 : 1 : 1 по объему).
Синтез 9-фенил-9H-карбазола
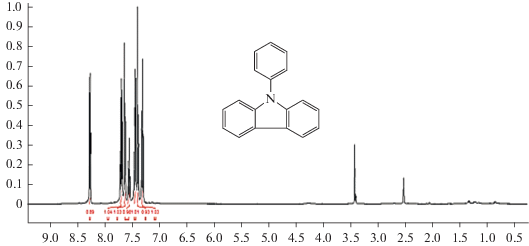
В круглодонной колбе на 100 мл растворяли карбазол (1.67 г, 10 ммоль) в диметилсульфоксиде (20 мл), добавляли CaCO3 (3.84 г, 30 ммоль), 18‑краун-6 эфир (0.2 г, 1 ммоль), CuI (0.57 г, 3 ммоль), а затем (по каплям) иодбензол (13.6 г, 15 ммоль). Полученную смесь нагревали при 190°C в течение ночи. Затем отделяли органический слой, трижды промывали 50 мл деионизованной воды, сушили над MgSO4 и концентрировали. Наконец, чистый продукт получали очисткой в хроматографической колонке с силикагелем (с н‑гексаном) в виде твердого вещества белого цвета. Синтез 9-фенил-9H-карбазола иллюстрирует схема 1 . Белый порошок, точка плавления = 94–96°C. Спектры 9-фенил-9H-карбазола (ИК с преобразованием Фурье, 1H ЯМР и 13C ЯМР) представлены на рис. 1, 2 и 3.
Схема 1 . Синтез 9-фенил-9H-карбазола.
ИК-спектр с преобразованием Фурье (KBr/cм–1): 3039.3, 1594.84, 1500.35, 1452.14, 1452.14, 1234.22.
1H ЯМР (400 МГц, ДМСО-d6), δ (ppm): 8.25(d, J = 8 Гц, 2H), 7.67 (t, J = 8 Гц, 2H), 7.61(d, J = 8 Гц, 2H), 7.53 (t, J = 12 Гц,1H), 7.42 (t, J = 12 Гц, 2H), 7.37 (d, J = 12 Гц, 2H), 7.29 (t, J = 12 Гц, 2H).
13C ЯМР (100 МГц, ДМСО-d6), δ (ppm): 140.1, 136.8, 130.2, 127.6, 126.7, 126.2, 122.6, 120.5, 120.0, 109.5.
Электрохимические измерения
Циклические вольтамперограммы снимали в трехэлектродной ячейке с использованием гальваностата/потенциостата Biologic Sp-150. Рабочим электродом был платиновый микродиск (диаметром 100 мкм), а полоска металлического лития служила как вспомогательным электродом, так и электродом сравнения. Для того, чтобы исследовать влияние добавки на функционирование аккумулятора, изучали поведение призматического аккумулятора LiFePO4/C в условиях перезаряда, сравнивая кривые заряда–разряда и циклические вольтамперограммы в отсутствие и в присутствии добавки 9-фенил-9H-карбазола. В этом исследовании испытывались призматические аккумуляторы LiFePO4/графит с номинальной емкостью 140 мА ч г–1.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При подборе добавки, которая должна защитить аккумулятор от перезаряда, наиболее важное ее свойство – это электроактивность вещества при потенциале несколько выше некоторого значения, при котором завершается заряжение катода, но ниже потенциала разложения электролита [16]. Для литий-ионных аккумуляторов на основе LiFePO4 потенциал полностью заряженного катода составляет около 3.6 В. На рис. 4 показаны циклические вольтамперограммы Pt-микроэлектродов в 1 M растворе LiPF6 в смеси этилкарбонат + диметилкарбонат + этилметилкарбонат (1 : 1 : 1 по объему) с добавлением 4 вес. % 9‑фенил-9H-карбазола, снятые при скорости развертки потенциала 10 мВ с−1. Из рисунка видно, что при 3.0–3.5 В появляется небольшой ток окисления, который может быть вызван полимеризацией адсорбированного 9-фенил-9H-карбазола на поверхности Pt-микроэлектрода. Сильный ток окисления с пиком при 4.2 В может быть вызван окислением на электроде 9-фенил-9H-карбазола, находящегося в электролите; этот ток контролируется диффузией.
Рис. 4.
Циклические вольтамперограммы Pt-микроэлектрода в электролите 1 M LiPF6/этилкарбонат + + диметилкарбонат + этилметилкарбонат, содержащем 4 вес. % 9-фенил-9H-карбазола, снятые при скорости развертки потенциала 10 мВ с−1.
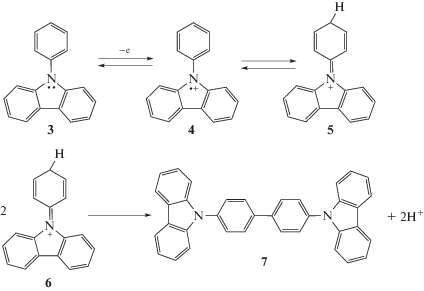
На схеме 2 представлен предлагаемый механизм полимеризации 9-фенил-9H-карбазола. Ясно, что потенциал полимеризации 9-фенил-9H-карбазола хорошо подходит для использования этого вещества в качестве добавки для защиты литий-ионных аккумуляторов на основе LiFePO4 от перезаряда.
Схема 2 . Предлагаемый механизм полимеризации 9-фенил-9H-карбазола.
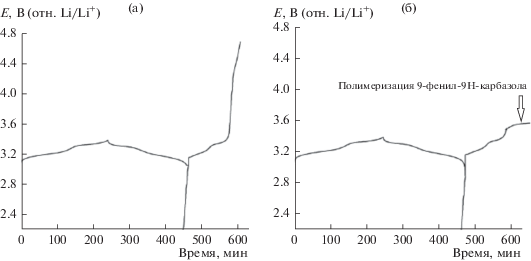
Для того, чтобы исследовать влияние 9-фенил-9H-карбазола на поведение призматического литий-ионного аккумулятора на основе LiFePO4 в условиях перезаряда, мы снимали кривые заряда–разряда. Вначале аккумулятор циклировали током 1 C до потенциала 3.4 В, а затем следовал перезаряд тем же током до 4.8 В. На рис. 5 показаны результаты для призматического литий-ионного аккумулятора LiFePO4/C в отсутствие (a) и в присутствии (б) 9-фенил-9H-карбазола в электролите. Как видно из рисунка, в обоих электролитах (рис. 5a и 5б) появляются два типичных окислительно-восстановительных плато, относящихся к интеркаляции/деинтеркаляции ионов лития в ходе первого нормального процесса заряда–разряда. Емкость первого цикла для LiFePO4-электрода в электролите с добавкой 4% 9-фенил-9H-карбазола равняется 139 мА ч, что приближается к емкости LiFePO4-электрода в обычном электролите (140 мА ч). Это показывает, что 9-фенил-9H-карбазол не оказывает сколько-нибудь существенного отрицательного влияния на LiFePO4-электроды в ходе нормального процесса заряда–разряда. Однако, в условиях перезаряда аккумулятор ведет себя по-другому. На стадии перезаряда используемого аккумулятора без 9‑фенил-9H-карбазола его напряжение очень быстро растет до 4.8 В (рис. 5a). Но у аккумулятора с добавкой 4% 9-фенил-9H-карбазола появляется плато заряжения при 3.6 В (рис. 5б), которое может быть связано с электрополимеризацией 9‑фенил-9H-карбазола на LiFePO4-электроде. Для исследования механизма действия добавки 9-фенил-9H-карбазола мы исследовали изменения морфологии катода при перезаряде методом сканирующей электронной микроскопии.
Рис. 5.
Кривые перезаряда аккумулятора (a) в отсутствие и (б) в присутствии 4 вес. % 9-фенил-9H-карбазола.
На рис. 6 показаны СЭМ-изображения катода в условиях перезаряда в отсутствие (a) и в присутствии (б) добавки 9-фенил-9H-карбазола в электролите. Ясно видно, что в “чистом” электролите поверхность катода чистая и однородная. Напротив, у катода в электролите, содержащем 9-фенил-9H-карбазол, структура поверхности отличается. Это наблюдение показывает, что на поверхности катода нарастает продукт полимеризации мономера 9-фенил-9H-карбазола.
Рис. 6.
SEM-микрофотографии LiFePO4-электрода LiFePO4/C-аккумулятора после перезаряда аккумулятора (a) в отсутствие и (б) в присутствии 4 вес. % 9-фенил-9H-карбазола.

Одно из наиболее существенных обстоятельств применения добавок к электролиту аккумуляторов – это поведение аккумулятора при циклировании. Поэтому для изучения влияния добавки на нормальное поведение призматического литий-ионного аккумулятора на основе LiFePO4 его циклировали в “нормальном” интервале напряжений 2.0–3.6 В током 1 C в электролите содержащем (a) 0 вес. % и (б) 4 вес. % 9-фенил-9H-карбазола (см. рис. 7). Видно, что в обоих электролитах поведение аккумулятора при циклировании почти одинаково; снижение емкости после 50 циклов составляет ~95%. После 50 циклов разрядная емкость все еще держится на уровне 135 мА ч, т.е. аккумулятор демонстрирует хорошую циклируемость. Поэтому можно заключить, что 9-фенил-9H-карбазол, как безопасная добавка к электролиту, предотвращающая перезаряд литий-ионных аккумуляторов, оказывает лишь пренебрежимо малое влияние на эксплуатационные характеристики призматического литий-ионного аккумулятора на основе LiFePO4/С при нормальных условиях.
ЗАКЛЮЧЕНИЕ
Предложен, синтезирован и испытан способный к полимеризации мономер 9-фенил-9H-карбазола в качестве безопасной добавки к электролиту, предотвращающей перезаряд литий-ионных аккумуляторов класса “3.6 В”. Экспериментальные результаты показали образование проводящего полимера из этого мономера по ЭХЭ-механизму (“электрохимический–химический–электрохимический”). Этот проводящий полимер создает внутренний шунт для тока, предохраняющий аккумулятор от ухода напряжения. К тому же 9-фенил-9H-карбазол не оказывает отрицательного влияния на эксплуатационные характеристики аккумулятора. Соответственно, это – хорошая добавка, защищающая литий-ионные LiFePO4/C-аккумуляторы от перезаряда.
Список литературы
Kulova, T.L., New electrode materials for lithium-ion batteries (Review), Russ. J. Electrochem., 2013, vol. 49, p. 1.
Jiang, H., Zhou, X., Liu, G., Zhou, Y., Ye, H., Liub, Y., and Han, K., Free-Standing Si/Graphene Paper Using Si Nanoparticles Synthesized by Acid-Etching Al–Si Alloy Powder for High-Stability Li-Ion Battery Anodes, Electrochim. Acta, 2016, vol. 188, p. 777.
Vargas, Ó., Caballero, Á., and Morales, J., Deficiencies of Chemically Reduced Graphene as Electrode in Full Li-Ion Cells, Electrochim. Acta, 2015, vol. 165, p. 365.
Kulova, T.L. and Skundin, A.M., High-voltage materials for positive electrodes of lithium ion batteries (review), Russ. J. Electrochem., 2016, vol. 52, p. 501.
Marom, R., Francis Amalraj, S., Leifer, N., Jacob, D., and Aurbach, D., A review of advanced and practical lithium battery materials, J. Mater. Chem., 2011, vol. 21, p. 9938.
Hofmann, A., Schulz, M., Indris, S., Heinzmann, R., and Hanemann, T., Mixtures of Ionic Liquid and Sulfolane as Electrolytes for Li-Ion Batteries, Electrochim. Acta, 2014, vol. 147, p. 704.
Schaefer, J.L., Lu, Y., Moganty, S.S., Agarwal, P., Jayaprakash, N., and Archer, L.A., Electrolytes for high-energy lithium batteries, Appl. Nanosci., 2012, vol. 2, p. 91.
Rao, Z. and Wang, S., A review of power battery thermal energy management (Renew), Sust. Energ. Rev, 2011, vol. 15, p. 4554.
Balakrishnan, P.G., Ramesh, R., and Prem Kumar, T., Safety mechanisms in lithium-ion batteries, J. Power Sources, 2006, vol. 155, p. 401.
Nurullah Ates, M., Allen, C.J., Mukerjee, S., and Abraham, K.M., Electronic effects of substituents on redox shuttles for overcharge protection of li-ion batteries, J. Electrochem. Soc., 2012, vol. 159, p. 1057.
Shui Zhang, S., A review on electrolyte additives for lithium-ion batteries, J. Power Sources, 2006, vol. 162, p. 1379.
Xua, J., Thomas, H.R., Francis, R.W., Lumb, K.R., Wang, J., and Liang, B., A review of processes and technologies for the recycling of lithium-ion secondary batteries, J. Power Sources, 2008, vol. 177, p. 512.
Lee, M.-L., Li, Y.-H., Yeh, J.-W., and Shih, H., Improvement in safety and cycle life of lithium-ion batteries by employing quercetin as an electrolyte additive, J. Power Sources, 2012, vol. 214, p. 251.
Cha, C.S., Ai, X.P., and Yang, H.X., Polypyridine complexes of iron used as redox shuttles for overcharge protection of secondary lithium batteries, J. Power Sources, 1995, vol. 54, p. 255.
Feng, J.K., Ai, X.P., Cao, Y.L., and Yang, H.X., A highly soluble dimethoxybenzene derivative as a redox shuttle for overcharge protection of secondary lithium batteries, Electrochem. Commun., 2007, vol. 9, p. 5.
Li, S.L., Ai, X.P., Feng, J.K., Cao, Y.L., and Yang, H.X., Diphenylamine: A safety electrolyte additive for reversible overcharge protection of 3.6 V-class lithium ion batteries, J. Power Sources, 2008, vol. 184, p. 553.
Zhang, Z., Zhang, L., Schlueter, J.A., Redfern, P.C., Curtiss, L., and Amine, K., Understanding the redox shuttle stability of 3, 5-di-tert-butyl-1, 2-dimethoxybenzene for overcharge protection of lithium-ion batteries, J. Power Sources, 2010, vol. 195, p. 4957.
Adachi, M., Tanaka, K., and Sekai, K., Aromatic compounds as redox shuttle additives for 4 V class secondary lithium batteries, J. Electrochem. Soc., 1999, vol. 146, p. 1256.
Dahn, J.R., Junwei Jiang, Z., Moshurchak, L.M., Fleischauer, M.D., Buhrmester, C., and Krause, L.J., High-rate overcharge protection of LiFePO4-based Li-ion cells using the redox shuttle additive 2, 5-ditertbutyl-1, 4-dimethoxybenzene, J. Electrochem. Soc., 2005, vol. 152, p. 1283.
Dahn, J.R., Chen, J., and Buhrmester, C., Redox shuttle for rechargeable lithium-ion cell, 2004, PCT/US2005/010993.
Dahn, J.R., Chen, J., and Buhrmester, C., Redox shuttle for rechargeable lithium-ion cell, 2005, US7811710 B2.
Zhang, L., Zhang, Z., and Amine, K., Redox shuttle additives for lithium-ion batteries, 2012, US20140234703 A1.
Salimi Beni, A., Zarandi, M., Madram, A.R., Bayat, Y., Najafi Chermahini, A., and Ghahary, R., Synthesis and characterization of organic dyes bearing new electron-withdrawing group for dye-sensitized solar cells, Electrochim. Acta, 2015, vol. 186, p. 504.
Дополнительные материалы отсутствуют.