Электрохимия, 2019, T. 55, № 7, стр. 832-840
Исследование коэффициента диффузии протонов в PbO2, приготовленном из оксидов промежуточной валентности
Л. Рахмани a, Р. Фитас a, А. Мессаи b, **, А. И. Айеш c, *
a Университет им. Ферхата Аббаса
19000 Сетиф, Алжир
b Университет им. аббатисы Лагрур
40000 Кэнчела, Алжир
c Катарский Университет
Доха, Катар
** E-mail: Messamel1@gmail.com
* E-mail: ayesh@qu.edu.qa
Поступила в редакцию 29.03.2018
После доработки 28.07.2018
Принята к публикации 27.08.2018
Аннотация
Оксиды свинца с промежуточной валентностью (Pb12O19, Pb12O17 и Pb3O4) синтезированы из диоксида свинца, извлеченного из использованных аккумуляторов, путем его нагревания при различных температурах. Каждый из приготовленных промежуточных оксидов был обработан серной кислотой (1.28 г см–3). Результаты рентгенодифракционного анализа показали, что только образец, приготовленный из Pb12O19, имеет дифрактограмму, подобную дифрактограмме исходного PbO2 и содержит фазы α-PbO2 и β-PbO2. Измерения коэффициента диффузии протона H+ в различных образцах показали, что этот образец демонстрирует лучшее электрохимическое поведение, чем исходный PbO2. Кинетика процесса отражает механизм внедрения протонов в PbO2, другими словами, образец, приготовленный из Pb12O19, содержит большее количество структурной воды в форме гидроксила OH–. Эта вода дает вклад в механизм восстановления PbO2. К тому же величина коэффициента диффузии протона в образце, приготовленном из Pb12O19, значительно больше, чем в исходном PbO2, что подтверждает высказанную гипотезу. Приготовленные образцы охарактеризованы методами рентгенодифракционного анализа, термогравиметрического и дифференциального термогравиметрического анализа и восстановительной циклической вольтамперометрии. Настоящая работа – вклад в охрану окружающей среды, она предлагает способ утилизации отработанного диоксида свинца и уменьшения его вредного воздействия.
ВВЕДЕНИЕ
Диоксид свинца (PbO2) – ключевой элемент положительных пластин свинцово-кислотных аккумуляторов. Текстура и структура диоксида свинца оказывает большое влияние на электрохимические и электрические свойства аккумулятора. В положительных пластинах свинцово-кислотных аккумуляторов присутствуют две фазы PbO2: α-PbO2, кристаллизующийся в орторомбической структуре, и β-PbO2, кристаллизующийся в тетрагональной структуре. К тому же, эти α- и β-фазы PbO2 не соответствуют стехиометрической формуле PbO2 [1, 2]. Поэтому присутствие любой из этих разновидностей диоксида в различных пропорциях влияет на электрохимическое поведение положительной пластины. Надлежащее функционирование свинцового аккумулятора связано с отношением содержаний α‑PbO2 и β-PbO2, присутствующих в пластине.
Многочисленные авторы исследовали кристаллическую структуру α-PbO2 и β-PbO2 методами рентгенофазового анализа [3–5] и дифракции нейтронов [6, 7]. В ряде работ [8–10] было обнаружено присутствие в решетке PbO2 протонсодержащих частиц, но их структурное положение так и не было выявлено. В наших предшествующих работах [1, 2, 11–13] мы показали, что электрохимическая активность оксида PbO2, составляющего активную массу положительной пластины, зависит от наличия структурной воды на поверхности. Поэтому срок хранения свинцово-кислотных аккумуляторов зависит от природы и количества этих водородсодержащих частиц. Активная масса – это система гель–кристалл (водородсодержащие частицы), в которой электрический ток переносят как электроны, так и (в гидратированных областях зоны геля) протоны [14‒17]. Используя рентгеновскую фотоэлектронную спектроскопию, Павлов [14, 18] показал, что больше 30% поверхности PbO2 находится в гидратированном состоянии.
Диоксид свинца может быть получен в лаборатории либо химическим, либо электрохимическим способом. Известно, что PbO2, полученный химическим способом, неактивен, в то время как PbO2, полученный электрохимическим способом, напротив, очень активен [11, 19–22]. Электрохимическая активность PbO2 напрямую связана с существованием протонированных частиц в зоне геля. Это обстоятельство заставило многих авторов предложить различные формальные объяснения. Например, в работах [19, 23] была предложена модель, предполагающая существование оксида состава PbO2 – δmH2O, где δ обозначает недостаток кислорода, а m – количество воды. В работах [24, 25] предложена другая модель замещения в PbO2, предполагающая, что вся вода находится в форме ионов OH–, связанных с лакунами ионов Pb4+ или Pb2+. На основе это модели для PbO2 была предложена следующая химическая формула: ${\text{Pb}}_{{1 - y}}^{{4 + }}{\text{Pb}}_{y}^{{2 + }}{\text{O}}_{{2 - 2y}}^{{2 - }}{\text{OH}}_{{2y}}^{ - }.$ Здесь y означает долю ионов Pb2+, замещенных ионами OH–.
Источник электрохимической активности связывают главным образом с существованием водородсодержащих частиц. Несколько авторов [26, 27], используя методы ядерного магнитного резонанса и неупругого [28, 29] и квазиупругого рассеяния нейтронов [30, 31], показали наличие, по крайней мере, двух конфигураций протонов в электрохимически активном PbO2 и только одну конфигурацию в химически приготовленном неактивном PbO2. Эти водородсодержащие соединения в PbO2 были идентифицированы, как H2O и группы OH–.
В настоящей работе мы ставили своей целью сравнить значения коэффициентов диффузии протонов (DH+) в PbO2, регенерированном из оксидов свинца с промежуточной валентностью PbOX (1.33 < x < 2) после обработки серной кислотой. Эти новые оксиды вступают в спонтанные реакции, приводящие к образованию новых фаз PbO2, и таким образом демонстрируют неустойчивость оксидов в серной кислоте. Эти новые активные массы положительных пластин охарактеризованы методами рентгенофазового и термогравиметрического анализа. Дополнительно мы использовали метод вольтамперометрии для определения коэффициента диффузии H+ в PbO2.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Приготовление образцов
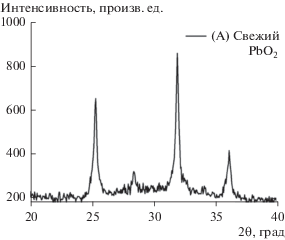
Свежий оксид PbO2 был взят из промышленных положительных пластин отработанных свинцово-кислотных аккумуляторов. Затем PbO2 промывали водой и сушили при 105°C в течение 24 ч. Полученный порошок PbO2 при необходимости промывали горячим насыщенным раствором ацетата аммония для удаления оставшихся сульфатов свинца и сушили на воздухе в течение ночи. Такой образец мы обозначили как образец A. Этот материал размалывали и просеивали сквозь сито с отверстиями диаметром 50 мкм. На рис. 1 представлены рентгеновские дифрактограммы образца. Анализ этих дифрактограмм проводили по методу Дебая–Шеррера [32]. Заметим, что экспериментальные дифракционные пики для этого образца в точности совпадают с пиками для α-PbO2 и β-PbO2 согласно американской системе тестирования металлов (ASTM), соответственно, сards No 11-549 и 25-447, что подтверждает чистоту приготовленного образца.
Рис. 1.
Рентгеновские дифрактограммы свежего PbO2, извлеченного из использованного аккумулятора (образец A).
Образец подвергли термогравиметрическому анализу, а затем дифференциальному термогравиметрическому анализу с помощью анализаторов для термобалансных испытаний (SETARAM, модели RT 3000 и PRT 540). Анализ проводили при температурах от комнатной до 700°C при скорости нагрева 10°C/мин.
На термогравиметрической кривой (рис. 2) можно выявить три отчетливых температурных зоны. Первая зона между 20 и 230°C соответствует уменьшению веса за счет удаления воды. Вторая зона между 230 и 450°C с резким уменьшением веса соответствует потере кислорода, сопровождающейся появлением следующих один за другим оксидов с промежуточной валентностью свинца. Этим объясняется уменьшение отношения кислород : свинец в зависимости от температуры нагрева. Значения отношения O : Pb показаны на правой оси y на рисунке. Третья зона относится к разложению оксидов с образованием Pb3O4 приблизительно при 480°C. Между первым и вторым переходами происходит образование оксидов с промежуточной валентностью PbOx (1.33 ≤ x < 2).
На кривой дифференциального термогравиметрического анализа (рис. 3) имеется несколько эндо- и экзотермических пиков: (1) широкий эндотермический пик и уплощение, связанные с поверхностной водой, (2) экзотермический пик от структурной воды (ему предшествует небольшое плечо); и (3) три пика от эндотермического перехода в области температур между 300 и 550°C, отвечающие образованию Pb12O19, Pb12O17 и Pb3O4. Температуры этих переходов находятся в хорошем согласии с результатами термогравиметрического анализа (рис. 2).
Рис. 3.
Кривая дифференциального термогравиметрического анализа свежего PbO2 (образец A). Показаны переходные температуры для оксидов с промежуточной валентностью свинца.

Свежий PbO2 (образец A) был взят из промышленных положительных пластин отработанных свинцово-кислотных аккумуляторов. Оксиды с промежуточной валентностью были приготовлены нагреванием образцов свежего PbO2 в течение до 8 ч при 330, 430 и 516°C (эти температуры взяты из кривой дифференциального термогравиметрического анализа (рис. 3)) для получения оксидов, соответственно, Pb12O19, Pb12O17 и Pb3O4, согласно следующим уравнениям реакций:
Фазовый состав различных образцов определяли с помощью рентгенофазового анализа (рис. 4a). Этот рисунок также показывает, что нагревание образца при температуре до 230°C вызывает потерю воды при сохранении первоначальной структуры и уменьшает интенсивность линий. В табл. 1 суммированы составы различных образцов. Таблица показывает, что для полного превращения в оксиды Pb12O19, Pb12O17 и Pb3O4 необходимо нагревание продолжительностью до 8 ч.
Рис. 4.
(a) Рентгеновские дифрактограммы свежего PbO2 (образец A) и оксидов промежуточной валентности (Pb12O19, Pb12O17 и Pb3O4); (б) рентгеновские дифрактограммы свежего PbO2 (образец A) и образцов, синтезированных из оксидов промежуточной валентности после реакции с серной кислотой (образцы B, C и D).
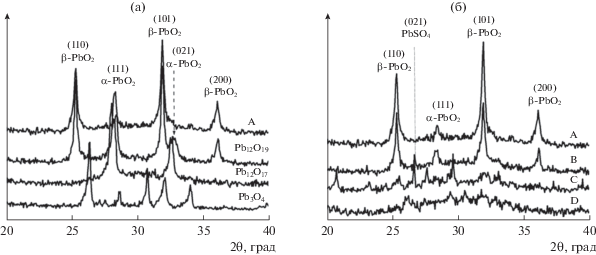
Таблица 1.
Составы различных образцов оксидов свинца, приготовленных нагреванием при различных температурах с различной продолжительностью
| T, °C | Продолжительность нагрева | ||
|---|---|---|---|
| 4 ч | 6 ч | 8 ч | |
| 330 | 55.14% Pb12O19; 44.86% α-PbO2 |
74.2% Pb12O19; 25.8% α-PbO2 |
99.11% Pb12O19; 0.89% α-PbO2 |
| 430 | 64.66% Pb12O17; 35.34% Pb3O4 |
80% Pb12O17; 20% Pb3O4 |
100% Pb12O17 |
| 516 | 71.88% Pb3O4; 28.12% PbO | 94.92% Pb3O4; 5.08% PbO |
100% Pb3O4 |
Оксиды с промежуточной валентностью смешивали в течение 1 ч. Порошки PbO2, полученные реакцией оксидов с промежуточной валентностью с серной кислотой (1.28 г см–3), промывали кипящим насыщенным раствором ацетата аммония, чтобы удалить следы PbSO4, фильтровали, промывали дистиллированной водой и сушили в течение ночи при 105°C. Эти образцы обозначим следующим образом: (A) свежий PbO2; (B), (C) и (D) – образцы, полученные после реакции с серной кислотой, т.е., соответственно, Pb12O19, Pb12O17 и Pb3O4. Ниже приведены уравнения реакций оксидов с серной кислотой; образцы, полученные в результате их протекания, были идентифицированы методом рентгенофазового анализа (рис. 4б).
Электрохимические исследования
Электрохимические измерения проводили в стандартной трехэлектродной ячейке. Рабочим электродом служил PbO2, а противоэлектродом – большой лист платиновой фольги. Потенциалы измеряли по отношению к Hg/Hg2SO4-электроду сравнения. Электролитом служил раствор серной кислоты (1.28 г см–3). Для определения значения коэффициента диффузии протонов в образцах PbO2, образованных из оксидов с промежуточной валентностью, мы использовали метод восстановительной вольтамперометрии при различной скорости развертки потенциала. Потенциодинамические циклические вольтамперограммы получали сканированием потенциала между 500 и 1400 мВ по отношению к Hg/Hg2SO4-электроду при скорости развертки потенциала 5, 25, 50 и 100 мВ/с.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На рис. 4a показаны рентгеновские дифрактограммы свежего PbO2 (образец A) и оксидов с промежуточной валентностью, полученных нагреванием (Pb12O19, Pb12O17 и Pb3O4). Свежий оксид представляет собой фазу β-PbO2 с небольшой примесью α-фазы. Еще отметим, что, с одной стороны, Pb12O19 сохраняет почти ту же структуру, что и свежий PbO2, и дает дифрактограмму близкую к β-PbO2 с увеличенным содержанием α‑PbO2. С другой стороны, оксиды с промежуточной валентностью, а именно Pb12O17 и Pb3O4, демонстрируют дифрактограммы, совершенно не похожие на дифрактограмму свежего PbO2. Это означает, что температура прогрева играет важную роль в процессе приготовления оксидов с промежуточной валентностью. В свете вышесказанного мы предлагаем следующий механизм термического разложения массы PbO2:
На рис. 4б показаны рентгеновские дифрактограммы порошков PbO2, синтезированных по реакции оксидов промежуточной валентности с серной кислотой, в сравнении с дифрактограммой свежего диоксида свинца. Отсюда можно заключить, что образец B (PbO2, приготовленный из Pb12O19) имеет дифрактограмму, подобную дифрактограмме образца A (свежий PbO2). Этот рисунок показывает, что образец B демонстрирует те же особенности дифрактограммы, что и образец A, с пиками как α-, так и β-фаз PbO2. Дополнительно, наблюдается новый пик при 2θ = 26.8°, который, вероятно, связан с присутствием кристаллов PbSO4. Средний размер кристаллов в образцах A и B был определен с помощью уравнения Шеррера по полной ширине на половине высоты (ПШПВ) дифракционной линии [110]. У образца B средний размер кристаллов равняется 14.85 нм, а у образца A – 22.30 нм. Соответственно, образец B имеет более аморфный характер, чем свежий PbO2. Дифрактограммы других образцов (C и D) отличаются от дифрактограммы референтного образца. Это можно объяснить тем, что эти оксиды были приготовлены, соответственно, из Pb12O17 и Pb3O4, синтезированных из свежего оксида PbO2 при высокой температуре. Эти образцы уже потеряли некоторое количество своего кислорода в дополнение к структурной воде, и эту потерю трудно восполнить из водного раствора при обработке с помощью H2SO4.
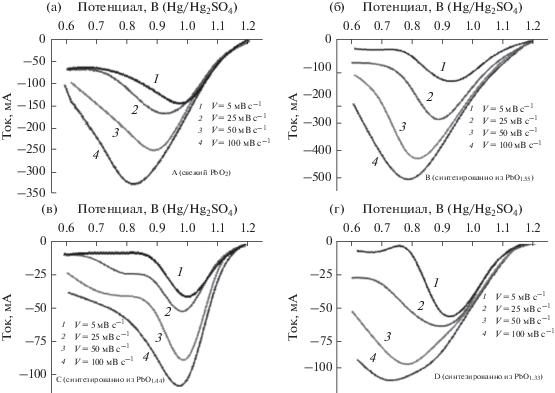
На рис. 5 даны вольтамперограммы для различных образцов, снятые при скорости развертки потенциала от 5 до 100 мВ/с. Из рисунка видно, что (1) плотность тока в катодном пике увеличивается с ростом скорости развертки потенциала, и (2) потенциал катодного пика тока сдвигается к катодным (менее положительным) значениям потенциала.
Рис. 5.
Вольтамперограммы, снятые при различных скоростях развертки потенциала, (a) образца A (свежий PbO2), (б) образца B, синтезированного из оксида Pb12O19, (в) образца C, синтезированного из оксида Pb12O17, и (г) образца D, синтезированного из оксида Pb3O4.
Механизмы переноса электрона
Анализ различных пиков тока на вольтамперограммах, снятых при разной скорости развертки потенциала, может дать информацию о природе замедленной стадии электрохимического процесса. Это, во-первых, изменение плотности тока в пике (Ipeak) в зависимости от корня квадратного из скорости развертки потенциала (Ipeak = f(V 1/2)); во-вторых, изменение потенциала пика (Epeak) с логарифмом скорости развертки потенциала (Epeak = f(lg V)).
На рис. 6a показано изменение Ipeak в зависимости от V 1/2 для различных образцов. Видно, что Ipeak растет с V 1/2 по линейному закону. Изменение Epeak в зависимости от lg V для различных образцов дано на рис. 6б. Мы видим, что кривые вогнуты книзу. Это согласуется с заключением о достаточно быстром или квазиобратимом электрохимическом процессе, для которого зависимость Ipeak = f(V 1/2) линейна; здесь пиковый ток имеет диффузионную природу [33].
Определение коэффициента диффузии
Для процесса, контролируемого диффузией, общее выражение для пикового тока в квазиобратимой системе таково [33]:
(1)
${{I}_{{{\text{peak}}}}} = \left[ {\left( {{\text{2}}.{\text{69}} \times {\text{1}}{{0}^{{\text{5}}}}} \right){{n}^{{{3 \mathord{\left/ {\vphantom {3 2}} \right. \kern-0em} 2}}}}AD_{{{{{\text{H}}}^{ + }}}}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}{{c}_{{{{{\text{H}}}^{ + }}}}}K(\Lambda ,\alpha )} \right]{{V}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}.$Таблица 2.
Уравнения зависимости Ipeak от V 1/2 для различных образцов (полученных в результате реакции оксидов промежуточной валентности с серной кислотой)
| Образец | Уравнение | Наклон, A/(В с–1)1/2 |
|---|---|---|
| A | Ipeak = 1.1547V 1/2 + 0.0905 | 1.15 |
| B | Ipeak = 1.573V 1/2 + 0.1211 | 1.57 |
| C | Ipeak = 0.280V 1/2 + 0.0316 | 0.28 |
| D | Ipeak = 0.718V 1/2 + 0.0635 | 0.72 |
На рис. 7 даны зависимости коэффициента диффузии иона H+ от величины константы K(Λ,α) для образцов A, B, C и D. Этот рисунок показывает, что, во-первых, значение коэффициента диффузии иона H+ уменьшается, когда величина K(Λ,α) растет, в частности, для образцов A и B; во-вторых, для образца С коэффициент диффузии иона H+ почти не зависит от величины K(Λ,α); и, в-третьих, при малых значениях K(Λ,α) для образцов A, B и C наблюдается большая разница величин ${{D}_{{{{{\text{H}}}^{ + }}}}}.$ С ростом K(Λ,α) эта разница постепенно уменьшается. В табл. 3 приведены значения коэффициента диффузии иона H+ как функция константы K(Λ,α). Здесь следует отметить, что оценочные значения ${{D}_{{{{{\text{H}}}^{ + }}}}}$ из табл. 3 близки к найденным в работе [34] (где была слелана оценка коэффициента диффузии H+ в PbO2 электрохимическим методом для различных значений pH и концентраций Pb2+; эта величина менялась в пределах от 0.4 × 10–7 до 4.9 × 10–7 cм2 с–1). Следует отметить, что в работе [35] приводились значения ${{D}_{{{{{\text{H}}}^{ + }}}}}$ для α- и β-PbO2, равные, соответственно, 9.6 × 10−10 и 2.2 × 10−9 cм2 с–1; в работе [36] приведены значения, соответственно, 5 × 10−13 и 10−14 cм2 с−1. Таблица показывает, что у образца B самое высокое значение ${{D}_{{{{{\text{H}}}^{ + }}}}}$ по сравнению с другими образцами независимо от величины K(Λ,α). Например, при K(Λ,α) = 0.6 значение ${{D}_{{{{{\text{H}}}^{ + }}}}}$ для образца B выше, чем для образца A, на 0.98 × × 10–7 cм2 с–1, что составляет рост на ~86%. Это можно объяснить присутствием воды, физически адсорбированной на группах OH. Согласно работам [1, 2, 12, 13], отсутствие физически адсорбированной воды оказывает большое влияние на кинетику переноса заряда. Очевидно, такая вода совершенно отсутствует в кристаллической структуре образца C, чем и объясняется очень низкое значение коэффициента диффузии H+ в его структуре и его почти полная независимость от K(Λ,α).
Рис. 7.
Изменение коэффициента диффузии ${{D}_{{{{{\text{H}}}^{ + }}}}}$ в зависимости от константы K(Λ,α) для образцов A, B, C и D.
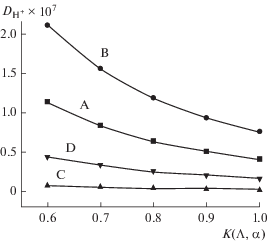
Таблица 3.
Значения коэффициента диффузии ${{D}_{{{{{\text{H}}}^{ + }}}}}$ в зависимости от величины константы K(Λ,α)
| K(Λ,α) | ${{D}_{{{{{\text{H}}}^{ + }}}}}$ × 10+7, cм2 с–1 | |||
|---|---|---|---|---|
| A | B | C | D | |
| 0.6 | 1.14 | 2.12 | 0.07 | 0.44 |
| 0.7 | 0.84 | 1.56 | 0.05 | 0.33 |
| 0.8 | 0.64 | 1.19 | 0.04 | 0.25 |
| 0.9 | 0.51 | 0.94 | 0.03 | 0.2 |
| 1.0 | 0.41 | 0.76 | 0.02 | 0.16 |
Общая потеря электрохимической активности PbO2 связана главным образом с отсутствием групп OH–, как это следует из кривой термогравиметрического анализа (рис. 2). С целью лучше осветить такое поведение PbO2, связанное с водой, мы исследовали влияние скорости развертки потенциала на емкость, определяемую из вольтамперограмм (рис. 5). Эту емкость вычисляли интегрированием площади под вольтамперограммой для каждой использованной скорости развертки потенциала (5, 25, 50 и 100 мВ/с). Влияние скорости развертки потенциала на емкость образцов A, B, C и D показано на рис. 8. Рисунок ясно показывает разницу в значениях емкостей образцов A, B и D. Для образца С емкость почти не зависит от скорости развертки потенциала, в особенности при ее больших значениях (при небольших скоростях развертки потенциала это различие для образца C несколько больше). Поэтому можно заключить, что отсутствие гидроксильных групп OH– оказывает большое влияние на емкость образца C. К тому же описанные выше результаты указывают на то, что емкостное поведение частиц PbO2, синтезированных на основе оксида Pb12O19, превосходит поведение PbO2, извлеченного из активной массы положительных пластин использованных аккумуляторов. Другими словами, кинетика восстановления в случае частиц PbO2 в оксидах Pb3O4 и Pb12O17 самая медленная.
Поскольку эта кинетика представляет механизм внедрения протонов в PbO2, это означает, что образец Pb12O19 содержит наибольшее количество структурной воды в форме гидроксильных групп OH–. Это количество дает большой вклад в механизм восстановления в случае PbO2, полученного из Pb12O19, по сравнению с PbO2 из активной массы, полученной из Pb3O4 и Pb12O17. И значения емкости наибольшие при низких скоростях развертки потенциала. Такое поведение можно объяснить тем, что низкие значения скорости развертки потенциала лучше подходят для процесса в твердой фазе, на что указывают сравнительно низкие значения коэффициента диффузии, представленные на рис. 7.
ЗАКЛЮЧЕНИЕ
Исследование рентгеновских дифракционных спектров различных оксидов свинца показало, что оксиды с промежуточной валентностью Pb12O19, Pb12O17 и Pb3O4 неустойчивы. Для превращения этих оксидов с промежуточной валентностью в более устойчивые формы была использована реакция с H2SO4. В частности, Pb12O19 был преобразован в PbO2 после удаления сульфатов. Оценка коэффициента диффузии протона H+$\left( {{{D}_{{{{{\text{H}}}^{ + }}}}}} \right)$ для PbO2 методом вольтамперометрии показала, что величина ${{D}_{{{{{\text{H}}}^{ + }}}}}$ для PbO2, синтезированного из оксида Pb12O19, гораздо больше, чем для PbO2, извлеченного из пластин отработанного аккумулятора.
Большое значение ${{D}_{{{{{\text{H}}}^{ + }}}}}$ в структуре PbO2 делает возможным восстановление Pb4+ до Pb2+. Поскольку механизм внедрения протона в PbO2 предполагает восстановительную кинетику, это указывает на то, что образец PbO2, синтезированный из оксида Pb12O19, содержит большое количество структурной воды в форме гидроксила OH–. Эта вода служит переносчиком протонов из электролита и в ходе процесса восстановления внедряется в глубину материала. Это создает дефицит Pb4+ в структуре PbO2, который заполняется протонированными частицами, присутствующими в форме гидроксильных групп. Этим объясняется большое содержание OH– в образце PbO2, синтезированном из оксида Pb12O19, по сравнению с исходным PbO2.
Гидратация оксида со стехиометрией Pb12O19 дает диоксид свинца, содержащий структурную воду. Количество этой воды дает больший вклад в механизм восстановления PbO2, полученного из Pb12O19, по сравнению с другими формами оксидов свинца. Это подтверждается величинами емкости, полученными интегрированием площади под вольтамперограммами, снятыми при различной скорости развертки потенциала, которые указывают на превосходство емкостного поведения частиц PbO2, синтезированных на основе оксида Pb12O19, над другими формами PbO2. Таким образом, мы утверждаем, что на диффузию влияет количество воды, присутствующей в PbO2, так что утилизация диоксида свинца с помощью оксидов с промежуточной валентностью вполне возможна. Диоксид свинца, извлеченный из использованных аккумуляторов, может быть утилизирован, что снижает риск воздействия его утилизации на грунтовые воды.
Список литературы
Fitas, R., Zerroual, L., Chelali, N., and Djellouli, B., Role of hydration water in the reduction process of PbO2 in lead/acid cells, J. Power Sources, 1997, vol. 64, p. 57.
Lin Wei, Xuhui Mao, An Lin, and Fuxing Gan, PbO2–SnO2 composite anode with interconnected structure for the electrochemical incineration of phenol, Russ. J. Electrochem., 2011, vol. 47, p. 1394.
Brosset, A., Arkiv Kemi. Mineral, Band, Geol., 1945, vol. A20, p. 11.
Pascal, P., Nouveau Traité Chimie Minérale, vol. VIII, Paris: Masson, 1960, p. 618.
Wyckoff, R.W.G., The Structure of Crystals, vol. 1, New York: Interscience, 1963.
Antonio, P.D. and Santoro, A., Powder neutron diffraction study of chemically prepared β-lead dioxide, Acta Crystallogr., 1980, vol. B36, p. 2394.
Santoro, A., Antonio, P.D., and Caulder, S.M., A Neutron Powder Diffraction Study of α- and β-PbO2 in the Positive Electrode Material of Lead – Acid Batteries, J. Electrochem. Soc., 1983, vol. 13, p. 1451.
Gavarri, J.R., Garnier, P., and Boher, P., Proton motions in battery lead dioxides, J. Solid State Chem., 1988, vol. 75, p. 251.
Hill, R.J., The crystal structures of lead dioxides from the positive plate of the lead/acid battery, Mater. Res. Bull., 1982, vol. 17, p. 769.
Moseley, P.T., Hutchison, J.L., and Bourke, M.A.M., The Defect Structure of Lead Dioxide, J. Electrochem. Soc., 1982, vol. 129, p. 876.
Fitas, R., Zerroual, L., Chelali, N., and Djellouli, B., Thermal degradation of α- and β-PbO2 and its relationship to capacity loss, J. Power Sources, 2000, vol. 85, p. 56.
Fitas, R., Zerroual, L., Chelali, N., and Djellouli, B., Heat treatment of α- and β-battery lead dioxide and its relationship to capacity loss, J. Power Sources, 1996, vol. 58, p. 225.
Fitas, R., Zerroual, L., Chelali, N., and Djellouli, B., Mechanism of the reduction of α- and β-PbO2electrodes using an all-solid-state system, Solid State Ionics, 2000, vol. 127, p. 49.
Pavlov, D., The Lead-Acid Battery Lead Dioxide Active Mass: A Gel-Crystal System with Proton and Electron Conductivity, J. Electrochem. Soc., 1992, vol. 139(11), p. 3075.
Chahmana, N., Matrakova, M., Zerroual, L., and Pavlov, D., Influence of some metal ions on the structure and properties of doped β-PbO2, J. Power Sources, 2009, vol. 191, p. 51.
Chahmana, N., Zerroual, L., and Matrakova, M., Physicochemical and electrochemical study of lead acid battery positive active mass (PAM) modified by the addition of bismuth, Bulg. Chem. Commun., 2016, vol. 48, no. 2, p. 285.
Foudia, M., Matracova, M., and Zerroual, L., Effect of a mineral additive on the electrical performances of the positive plate of lead acid battery, J. Power Sources, 2015, vol. 279, p. 146.
Pavlov, D., Hydration and Amorphization of Active Mass PbO2 Particles and Their Influence on the Electrical Properties of the Lead-Acid Battery Positive Plate, J. Electrochem. Soc., 1989, vol. 136(11), p. 3189.
Pohl, J.P. and Shendler, W., The electronic conductivity of compact lead dioxide samples with various stoichiometric compositions, J. Power Sources, 1981, vol. 6, p. 245.
Foudia, M., Zerroual, L., and Matracova, M., PbSO4 as a precursor for positive active material electrodes, J. Power Sources, 2012, vol. 207, p. 51.
Noufel, K., Bouzid, A., Chellali, N., and Zerroual, L., Electrochemical performance of γMnO2 prepared from the active mass of used batteries, Russ. J. Appl. Chem., 2015, vol. 88(10), p. 1711.
Dilmi, O. and Benaicha, M., Electrodeposition and characterization of red selenium thin film—effect of the substrate on the nucleation mechanism, Russ. J. Electrochem., 2017. vol. 53(2), p. 140.
Pohl, J.P. and Rickert, H., Elektrochemische Untersuchungen zur Permeation und Löslichkeit von Wasserstoff in Bleidioxid, J. Phys. Chem., 1978, vol. 112, p. 117.
Rüetschi, P. and GIovanoli, R., On the presence of OH− ions, Pb2+ ions and cation vacancies in PbO2, J. Power Sources, 1991, vol. 13, p. 81.
Rüetschi, P., Influence of Crystal Structure and Interparticle Contact on the Capacity of PbO2 Electrodes, J. Electrochem. Soc., 1992, vol. 139(5), p. 1347.
Caulder, S.M., Murday, J.S., and Simon, A.C., ChemInform Abstract: the hydrogen loss concept of battery failure, the PbO2 electrode, J. Electrochem.Soc., 1973, vol. 120, p. 1515.
Hill, R.J. and Jessel, A.M., The Electrochemical Activity of PbO2: A Nuclear Magnetic Resonance Study of Hydrogen in Battery and Chemically Prepared Material, J. Electrochem. Soc., 1987, vol. 134, p. 1326.
Samoro, A., D’Amonio, P., and Caulder, S.M., A Neutron Powder Diffraction Study of α- and β-PbO2 in the Positive Electrode Material of Lead-Acid Batteries, J. Electrochem. Soc., 1983, vol. 130, p. 1451.
Moseley, P.T., Hutchison, J.L., Wright, C.J., Bourke, M.A.M., Hill, R.I., and Rainey, V.S., Inelastic Neutron Scattering and Transmission Electron Microscope Studies of Lead Dioxide, J. Electrochem. Soc., 1983, vol. 130, p. 829.
Boiler, P., Gamier, P., and Gavarri, J.R., Mise en evidence et localisation des protons dans les bioxydes de plomb PbO2α et β chimiques et électrochimiques, J. Solid State Chem., 1984, vol. 52, p. 146.
Gavani, J.R., Gamier, P., Boher, P., Dianoux, A.J., Chedeville, G., and Jacq, B., Proton motions in battery lead dioxides, J. Solid State Chem., 1988, vol. 75, p. 251.
Scherrer, P., Bestimmung der inneren Struktur und der Größe von Kolloidteilchen mittels Röntgenstrahlen, Gttinger Nachrichten, 1918, vol. 2, p. 98.
Matsuda, H. and Ayabe, Y., The theory of the cathode-ray polarography of Randles-Sevcik, Z. Elektrochem. Angew. Phys. Chem. 1955, vol. 59, p. 494.
Münzberg, R. and Pohl, J.P., 15th International Power Sources Symposium, 1986.
Chelali, N. and Guitton, J., Electrochemical behavior of α- and β-PbO2. Part I: Proton diffusion from “all solid-state” protonic electrolyte, Solid State Ionics, 1994, vol. 73, p. 227.
Chelali, N., Zerroual, L., Hammouche, A., Kahoul, A., and Guitton, J., Electrochemical behaviour of α- and β-PbO2: Part II: lithium diffusion from non-aqueous electrolyte, Solid State Ionics, 1996, vol. 91, p. 289.
Дополнительные материалы отсутствуют.





