Электрохимия, 2019, T. 55, № 8, стр. 961-966
Влияние природы галогена-допанта (F–, Cl–) на транспортные свойства протонных проводников на основе Ba4In2Zr2O11
Н. А. Тарасова a, *, А. О. Галишева a, И. Е. Анимица a
a Уральский федеральный университет им. первого Президента России Б.Н. Ельцина
620002 Екатеринбург, ул. Мира, 19, Россия
* E-mail: Natalia.Tarasova@urfu.ru
Поступила в редакцию 20.09.2018
После доработки 24.10.2018
Принята к публикации 12.03.2019
Аннотация
В работе проведен анализ влияния F–- и Cl–-допирования на транспортные свойства протонного проводника Ba4In2Zr2O11. Установлено, что галогензамещенные фазы способны к интеркаляции воды и проявлению протонного переноса. Показано, что введение малых концентраций галогенид-ионов приводит к росту кислородно-ионной и протонной проводимости.
ВВЕДЕНИЕ
Одной из актуальных задач современного материаловедения является исследование и разработка новых протонпроводящих электролитов, обладающих комплексом функциональных свойств – высокими и стабильными значениями протонной проводимости, химической и механической стойкостью. Такие системы могут найти применение в качестве электролитической мембраны в среднетемпературных твердооксидных топливных элементах (ТОТЭ) (500–700°C), являющихся перспективными и экологически безопасными источниками энергии высокой эффективности [1–4].
Одним из путей создания материалов с высокой протонной проводимостью в области средних температур является модифицирование фаз, характеризующихся структурным разупорядочением кислородной подрешетки. В таких соединениях вакансии кислорода генетически присущи структуре, поэтому их следует рассматривать как незанятые кристаллографические позиции. Возможность поглощения воды из газовой фазы с последующей генерацией протонных носителей тока определяется кристаллохимическим фактором, поскольку процесс гидратации сопровождается трансформацией координационно-ненасыщенных полиэдров в октаэдры.
Наиболее распространенным способом оптимизации транспортных свойств таких материалов является изо- и гетеровалентное допирование катионных подрешеток [5–10]. Новым направлением оптимизации свойств кислородно-ионных и протонных проводников с перовскитоподобной структурой является метод анионного гетеровалентного допирования. Так, в литературе описан эффект роста электропроводности при малых концентрациях допанта для фтор- и хлорзамещенных фаз на основе браунмиллерита Ba2In2O5 и двойного перовскита Ba2CaNbO5.5 [11–13]. Однако комплексного анализа влияния степени разупорядочения кислородной подрешетки, концентрации вакансий кислорода и природы галогена-допанта на основные параметры кислородно-ионного и протонного переноса (концентрация и подвижность носителей заряда, взаимодействие кислородной и протонной подсистем) до настоящего времени не проводилось.
В настоящей работе впервые получены фтор- и хлорзамещенные составы Ba4In2Zr2O10.9F0.1 и Ba4In2Zr2O10.9Cl0.1 на основе протонного проводника Ba4In2Zr2O11, характеризующегося структурой одинарного перовскита [14]; выполнено исследование их транспортных свойств, установлено влияние природы галогена-допанта на подвижность ионов кислорода и протонов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Составы Ba4In2Zr2O10.95F0.1 и Ba4In2Zr2O10.95Cl0.1 были получены методом твердофазного синтеза из предварительно осушенных BaCO3, In2O3, ZrO2, BaF2, BaCl2. Синтез проводили на воздухе при ступенчатом повышении температуры (800–1300°С) и многократных перетираниях в агатовой ступке в среде этилового спирта. Время отжига на каждой стадии составляло 24 ч. Состав Ba4In2Zr2O11 синтезирован для сравнения по аналогичной схеме.
Рентгенографический анализ был выполнен на дифрактометре Bruker Advance D8 в СuКα-излучении при напряжении на трубке 40 кВ и токе 40 мА. Съемка производилась в интервале 2θ = = 20°–80° с шагом 0.05°θ и экспозицией 1 с на точку. Расчеты параметров решетки проводили с помощью программы FullProf Suite.
Морфология поверхности порошковых и таблетированных образцов и локальный химический состав исследовались с помощью рабочей станции AURIGA CrossBeam (Carl Zeiss NTS), а также электронного микроскопа JEOL JSM-6390LA c приставкой рентгеновского энергодисперсионного микро-анализатора JEOL JED-2300. Используемые стандарты (образцы сравнения) BaF2, BaCl2, Zr, InAs, SiO2 (стандарт на кислород). Предел детектирования при обычных энергиях (5–20 кВ) составлял ~0.5 ат. %, ошибка измерения концентрации ±2%.
Термический анализ проводили на приборе NETZSCH STA 409 PC в комплекте с квадрупольным масс-спектрометром QMS 403C Aëolos (NETZSCH), позволяющем одновременно выполнять термогравиметрические измерения (ТГ), дифференциальную сканирующую калориметрию (ДСК) и анализ отходящих газов (масс-спектрометрия МС), в интервале температур 25–1000°С и скоростью нагрева 10°/мин. Перед измерениями образцы подвергались термической обработке во влажной атмосфере (рН2О = 2 × 10–2 атм) путем медленного охлаждения от 1000 до 200°C со скоростью 1°/мин с целью получения гидратированных форм образцов.
Электропроводность исследуемых фаз изучалась в атмосферах различной влажности. Влажную атмосферу получали барботированием воздуха при комнатной температуре последовательно через дистиллированную воду и насыщенный раствор бромида калия KBr (pH2O = 2 × 10–2 атм). Сухую атмосферу задавали циркуляцией газа через порошкообразный оксид фосфора P2O5 (pH2O = 3.5 × 10–5 атм). Кроме того, для предотвращения возможной карбонизации керамики проводилось предварительное удаление углекислого газа СО2 из воздуха, для влажной атмосферы – с помощью 20%-ного раствора NaOH, для сухой – с использованием реактива “Аскарит”. Влажность газов контролировали измерителем влажности газов ИВГ-1 МК-С.
Для измерений электрических свойств образцы готовили в виде таблеток, спекание проводили при температуре 1300°С в течение 24 ч. Плотность образцов составляла ~90–93%. Припекание платиновых электродов проводили при температуре 900°С в течение 3 ч.
Изучение электропроводности проводили методом электрохимического импеданса в частотном диапазоне 1 Гц–1 МГц с амплитудой сигнала 15 мВ с использованием измерителя параметров импеданса Elins Z-1000P. Все электрохимические измерения были выполнены в условиях равновесия с T, pH2O, pO2. Расчет объемного сопротивления проводили с использованием программного обеспечения Zview software fitting.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Методом рентгенофазового анализа было установлено, что составы Ba4In2Zr2O10.95F0.1 и Ba4In2Zr2O10.95Cl0.1 являются однофазными, характеризуются структурой одинарного перовскита (пространственная группа $Pm3m$) и изоструктурны матричному составу Ba4In2Zr2O11. В качестве примера обработки рентгенограммы методом полнопрофильного анализа на рис. 1 представлены результаты для образца Ba4In2Zr2O10.95Cl0.1.
Рис. 1.
Рентгенограмма образца Ba4In2Zr2O10.95Cl0.1, показаны экспериментальные (точки), расчетные (линия), разностные (внизу) данные и угловые положения рефлексов (штрихи).
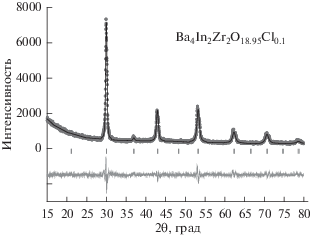
Параметры а элементарной ячейки составляли 4.203(5) Å и 4.205(2) Å для фтор- и хлорзамещенного составов соответственно. Для недопированного образца Ba4In2Zr2O11 параметр а составлял 4.204(3) Å, что хорошо соотносится с ранее полученными данными [14]. Как видно, введение в кислородную подрешетку иона с меньшим радиусом (F–) приводит к уменьшению параметров ячейки, а введение иона с большим радиусом (Cl–) – к увеличению параметров (${{r}_{{{{{\text{O}}}^{{2 - }}}}}}$ = 1.40 Å, ${{r}_{{{{{\text{F}}}^{ - }}}}}$ = 1.33 Å, ${{r}_{{{\text{C}}{{{\text{l}}}^{ - }}}}}$ = 1.81 Å [15]).
Морфология поверхности порошковых образцов была изучена с помощью метода сканирующей электронной микроскопии. Было установлено, что порошки состояли из пористых агломератов неправильной формы размером 5–10 мкм, состоящих из мелких частиц ~1 мкм, в межзеренной области не выявлено наличие примесных фаз. Для определения химического состава были сняты изображения в рентгеновском излучении при сканировании по поверхности образца. На рис. 2 представлено изображение поверхности образца Ba4In2Zr2O10.95Cl0.1 в отраженных электронах.
Анализ химического состава проводился на сколах таблетированных образцов. Колебания состава по металлическим компонентам не превышали 1%, наблюдалось равномерное распределение элементов. Результаты исследования элементного состава приведены в табл. 1. Как видно, наблюдалось хорошее соответствие зашихтованного (теоретического) состава и составов, полученных после твердофазного синтеза.
Таблица 1.
Содержание элементов в образце Ba4In2Zr2O10.95Cl0.1 (1 – теоретические значения, мас. %; 2 – экспериментальные значения, мас. %)
| Элемент | Содержание элемента, массовая доля, % | |
|---|---|---|
| 1 | 2 | |
| Ba | 55.26 | 54.77–55.73 |
| In | 8.06 | 8.34–7.83 |
| Zr | 18.70 | 18.21–19.05 |
| O | 17.62 | 18.30–17.12 |
| Cl | 0.36 | 0.38–0.27 |
Для определения возможности диссоциативного поглощения воды из газовой фазы для предварительно гидратированных образцов Ba4In2Zr2O11 ∙ nH2О, Ba4In2Zr2O10.95F0.1 ∙ nH2О и Ba4In2Zr2O10.95Cl0.1 ∙ nH2О были проведены термические и масс-спектрометрические исследования. По убыли массы гидратированных составов была определена степень гидратации. Для удобства сравнения данные приведены в пересчете на число молей воды на формульную единицу сложного оксида (рис. 3). Совместно с ТГ-кривыми представлены результаты масс-спектрометрии для состава Ba4In2Zr2O10.95Cl0.1 ∙ nH2О. Основная потеря массы наблюдается в температурном интервале 250–500°С, что, согласно результатам масс-спектрометрического анализа, обусловлено выходом H2O. Выделения других возможных летучих веществ (СО2, HF, HCl) не было обнаружено.
Рис. 3.
Данные термогравиметрии для образцов Ba4In2Zr2O11 ∙ nH2О (1), Ba4In2Zr2O10.95F0.1 ∙ nH2О (2) и Ba4In2Zr2O10.95Cl0.1 ∙ nH2О (3), а также данные масс-спектрометрии для образца Ba4In2Zr2O10.95Cl0.1 ∙ nH2О.

Иными словами, исследуемые в работе галогензамещенные перовскиты Ba4In2Zr2O10.95F0.1 и Ba4In2Zr2O10.95Cl0.1 способны к поглощению воды из газовой фазы. Однако введение допанта приводит к снижению степени гидратации относительно матричного состава Ba4In2Zr2O11. Можно предположить, что, как и для ранее изученных галогензамещенных составов на основе Ba2In2O5 и Ba2CaNbO5.5, введение галогенид-ионов приводит к образованию галогенсодержащих полиэдров [(In/Zr)O3F]/[(In/Zr)O3Cl], не способных к трансформации в октаэдры при гидратации [12, 13].
Поскольку было установлено, что исследуемые галогензамещенные составы способны к интеркаляции воды и, как следствие, для них может быть реализована протонная проводимость, исследования электрических свойств проводились в атмосферах с контролируемой влажностью.
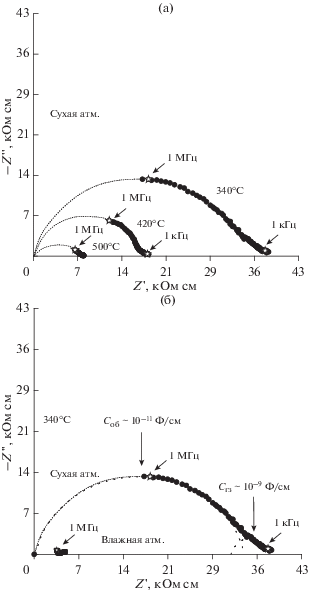
На рис. 4 приведены типичные годографы импеданса для состава Ba4In2Zr2O10.95Cl0.1 при варьировании температур в сухой атмосфере (рис. 4а), а также в атмосферах различной влажности при 340°С (рис. 4б). На рис. 4б представлено разложение полуокружности на компоненты, отвечающие объемному (Соб ~ 10–11 Ф/см) и зернограничному (Сгз ~ 10–9 Ф/см) сопротивлению образца. В области низких частот наблюдалась слабо разрешенная, очень небольшая полуокружность, соответствующая электродному отклику. Для расчетов удельной проводимости использовали значение сопротивления образца, полученное путем экстраполяции высокочастотной полуокружности на ось абсцисс.
Рис. 4.
Эволюция годографов импеданса для образца состава Ba4In2Zr2O10.95Cl0.1 в сухой атмосфере при различных температурах (а), а также в сухой (закрытые знаки) и влажной (открытые знаки) атмосферах при 300°С (б).
Температурные зависимости общей электропроводности в атмосферах различной влажности для галогензамещенных и недопированного составов представлены на рис. 5. Как видно, политермы проводимости галогензамещенных составов имеют вид, аналогичный зависимости, полученной для Ba4In2Zr2O11. В области высоких температур (700–1000°С) влияние допанта оказывает не столь значимое влияние на электропроводность по сравнению с более низкими температурами. Поскольку интерес представляет температурная область, где фазы потенциально способны к внедрению паров воды и проявлению протонного переноса, то дальнейшее обсуждение результатов (как в сухой, так и влажной атмосферы) будет касаться области температур Т < 700°С. Как видно, в сухой атмосфере для галогензамещенных составов при Т < 700°С наблюдается рост значений проводимости относительно матричного состава. Так как Ba4In2Zr2O11 характеризуется доминирующим ионным переносом при низких температурах (ниже 600°C) [14], мы можем считать, что значения электропроводности для Ba4In2Zr2O10.95F0.1 и Ba4In2Zr2O10.95Cl0.1, полученные в сухой атмосфере, соответствуют значениям кислородно-ионной проводимости. Таким образом, можно заключить, что допирование как фтором, так и хлором перовскита Ba4In2Zr2O11 приводит к увеличению кислород-ионной проводимости, которая увеличивается в ряду фаз Ba4In2Zr2O11–Ba4In2Zr2O10.95Cl0.1–Ba4In2Zr2O10.95F0.1.
Рис. 5.
Температурные зависимости общей электропроводности в сухой (закрытые знаки) и влажной (открытые знаки) атмосферах для составов Ba4In2Zr2O11, Ba4In2Zr2O10.95F0.1 и Ba4In2Zr2O10.95Cl0.1.

На рис. 6 представлены полученные данные в виде зависимости кислород-ионной проводимости от электроотрицательности галогена (по Оллреду–Рохову [16]) в сравнении с кислородом. Как видно, минимум на кривых соответствует значениям кислородной проводимости для матричного состава Ba4In2Zr2O11, при этом не наблюдается корреляции с электроотрицательностью галогена. Очевидно, для малых концентраций допантов ни различия в геометрических (размерных) характеристиках, ни различия в электоотрицательностях галогенов-допантов и, соответственно, в изменении степени ионности связи M–O, не являются определяющими факторами, влияющими на кислородный транспорт. Можно предположить, что появление в кислородной подрешетке малых концентраций аниона иной природы, приводит к эффектам дополнительного электростатического отталкивания, и, как следствие, к увеличению подвижности вакансий кислорода, обуславливающей увеличение кислородной проводимости.
Рис. 6.
Зависимости кислородно-ионной проводимости от электроотрицательности для составов Ba4In2Zr2O11, Ba4In2Zr2O10.95F0.1 и Ba4In2Zr2O10.95Cl0.1.

В области высоких температур (650–1000°С) влажность атмосферы не оказывает влияния на величину электропроводности. При Т < 650°С наблюдается рост значений проводимости во влажной атмосфере относительно значений в сухой атмосфере. Разница в величинах электропроводности в сухой и влажной атмосферах достигает ~0.8 порядка при температуре ~300°С, что предполагает появление доминирующей протонной проводимости и подтверждается значением энергии активации Ea ~ 0.5 эВ.
Для понимания механизма влияния допанта на протонную проводимость была рассчитана подвижность протонов:
(1)
${{\mu }_{{{{{\text{H}}}^{ + }}}}} = {{{{\sigma }_{{{{{\text{H}}}^{ + }}}}}} \mathord{\left/ {\vphantom {{{{\sigma }_{{{{{\text{H}}}^{ + }}}}}} {Ze{{c}_{{{{{\text{H}}}^{ + }}}}}}}} \right. \kern-0em} {Ze{{c}_{{{{{\text{H}}}^{ + }}}}}}},$На рис. 7 представлены зависимости протонной проводимости и подвижности протонов от электроотрицательности элементов. Как видно, минимум на зависимостях соответствует значениям для матричного состава Ba4In2Zr2O11, увеличение протонной проводимости обусловлено увеличением подвижности протонов.
Рис. 7.
Зависимости протонной проводимости и подвижности протонов от электоотрицательности для составов Ba4In2Zr2O11, Ba4In2Zr2O10.95F0.1 и Ba4In2Zr2O10.95Cl0.1.

Необходимо отметить, что для протонной проводимости наблюдается симбатная зависимость с кислородной проводимостью (рис. 6). Очевидно, динамика кислородной подрешетки влияет на подвижность протонов, поскольку перескок протона происходит на фоне колебаний системы атомов кислорода [17]. Другими словами, для галоген-замещенных составов для Ba4In2Zr2O10.95F0.1 и Ba4In2Zr2O10.95Cl0.1 на основе двойного перовскита Ba4In2Zr2O11 увеличение подвижности протонов можно рассматривать как результат увеличения подвижности вакансий кислорода.
ЗАКЛЮЧЕНИЕ
В работе методом твердофазного синтеза получены галогензамещенные перовскиты Ba4In2Zr2O10.95F0.1 и Ba4In2Zr2O10.95Cl0.1, рентгенографически подтверждена их однофазность. Установлено, что данные фазы способны к диссоциативному поглощению воды из газовой фазы и проявлению протонного переноса. Установлено, что введение небольших концентраций галогенид-ионов (F–, Cl–) приводит к росту кислородно-ионной и протонной проводимости вследствие увеличения подвижности ионов кислорода и протонов.
Список литературы
Iwahara, H., Asakura, Y., Katahira, K., and Tanaka, M., Prospect of hydrogen technology using proton-conducting ceramics, Solid State Ionics, 2004, vol. 168, p. 299.
Tao, S. and Irvine, J.T.S., A stable, easily sintered proton-conducting oxide electrolyte for moderate-temperature fuel cells and electrolyzers, Advanced Materials, 2006, vol. 18, p. 1581.
Fabbri, E., Bi, L., Pergolesi, D., and Traversa, E., Towards the next generation of solid oxide fuel cells operating below 600°C with chemically stable proton-conducting electrolytes, Advanced Materials, 2012, vol. 24, p. 195.
Marrony, M. and Dailly, J., Proton Conducting Ceramic Cell as Energy Storage Device, ECS Transactions, 2017, vol. 78, p. 3349.
Mather, G.C. and Islam, M.S., Defect and dopant properties of the SrCeO3-based proton conductor, Chemistry of Materials, 2005, vol. 17, p. 1736.
Trequattrini, F., Cordero, F., Deganello, F., La Parola, V., Roncari, E., and Sanson, A., Influence of doping on the structural transformations of the proton conducting perovskite BaCe1 –xYxO3 – δ, Solid State Phenomena, 2011, vol. 172–174, p. 1296.
Han, D., Nose, Y., Shinoda, K., and Uda, T., Site selectivity of dopants in BaZr1 –yMyO3 – δ (M = Sc, Y, Sm, Eu, Dy) and measurement of their water contents and conductivities, Solid State Ionics, 2012, vol. 213, p. 2.
Wang, S., Chen, Y., Fang, S., Zhang, L., Tang, M., An, K., Brinkman, K.S., and Chen, F., Novel chemically stable Ba3Ca1.18Nb1.82 –xYxO9 – δ proton conductor: Improved proton conductivity through tailored cation ordering, Chemistry of Materials, 2014, vol. 6, p. 2021.
Choi, S.M., Lee, J.-H., Choi, M.-B., Hong, J., Yoon, K.J., Kim, B.-K., Lee, H.-W., and Lee, J.-H., Determination of electronic and ionic partial conductivities of BaCeO3 with Yb and in doping, J. Electrochem. Soc., 2015, vol. 162, p. F789.
Weston, L., Janotti, A., Cui, X.Y., Stampfl, C., and Van De Walle, C.G., Acceptor doping in the proton conductor SrZrO3, Phys. Chemistry Chem. Physics, 2017, vol. 19, p. 11485.
Тарасова, Н.А., Анимица, И.Е., Синтез, гидратация и электрические свойства хлорзамещенного браунмиллерита Ba1.95In2O4.9Cl0.1. Электрохимия. 2017. Т. 53. С. 127. [Tarasova, N. and Animitsa, I., Synthesis, Hydration, and Electric Properties of Chlorine-Substituted Brownmillerite Ba1.95In2O4.9Cl0.1, Russ. J. Electrochem., 2017, vol. 53, p. 913.]
Tarasova, N. and Animitsa I., The influence of anionic heterovalent doping on transport properties and chemical stability of F-, Cl-doped brownmillerite Ba2In2O5, J. Alloys and Compounds, 2018, vol. 739, p. 353.
Tarasova, N. and Animitsa I., Anionic doping (F−, Cl−) as the method for improving transport properties of proton-conducting perovskites based on Ba2CaNbO5.5, Solid State Ionics, 2018, vol. 317, p. 21.
Анимица, И.Е., Догодаева, Е.Н., Нохрин, С.С., Косарева, О.А., Нейман, А.Я. Синтез, структура и электрические свойства кислород-дефицитных перовскитов Ba3In2ZrO8 и Ba4In2Zr2O11. Электрохимия. 2010. Т. 46. С. 785. [Animitsa, I.E., Dogodaeva, E.N., Nokhrin, S.S., Kosareva, O.A., and Neiman, A.Ya., Synthesis, Structure, and Electric Properties of Oxygen–Deficient Perovskites Ba3In2ZrO8 and Ba4In2Zr2O11, Russ. J. Electrochem., 2010, vol. 46, p. 734.]
Shannon, R.D., Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides, Acta Crystallographica, 1976, vol. A32, p. 751.
Allred, A.L., Electronegativity values from thermochemical data, J. Inorg. Nucl.Chem., 1961, vol. 7, p. 215.
Kreuer, K.D., Proton-conducting oxides, Ann. Rev. Mat. Res., 2003, vol. 33, p. 333.
Дополнительные материалы отсутствуют.



