Электрохимия, 2019, T. 55, № 9, стр. 1124-1132
Уголь, активированный KOH и NaOH: получение и электрохимическое поведение в электролитах K2SO4 и Na2SO4
Ху Ле Ван a, *, Туй Ленг Ти Ту a, Ха Нгуен Ти Ту a, Хунг Ван Хоанг a
a Отделение физической и теоретической химии, химический факультет,
Ханойский национальный педагогический университет
Ханой, 136 Ксюн ТуиКау Гяй, Вьетнам
* E-mail: khulv@hnue.edu.vn
Поступила в редакцию 04.08.2018
После доработки 03.12.2018
Принята к публикации 18.01.2019
Аннотация
Активированные угли успешно получены из рисовой шелухи (РШ) посредством химической активации с использованием KOH (РШ-K4) или NaOH (РШ-N3) в качестве активаторов и исследованы методами СЭМ, ЭРС, ИК-ПФ, КР, титрования по Бему и ТГА. Полученные образцы активированного угля представляют собой сферические частицы, содержащие многочисленные трещины и щели, которые показывают снятые методом СЭМ изображения. Они содержат многочисленные поверхностные функциональные группы, о чем свидетельствуют результаты, полученные методами ИК-ПФ и титрования по Бему. Результаты КР показали, что размер кристаллита в направлении базовой плоскости (La) РШ-K4 и РШ-N3 составляет 3.27 и 3.46 нм соответственно, что демонстрирует более высокую степень разупорядоченности РШ-K4 по сравнению с РШ-N3. Циклическая вольтамперометрия и испытания на заряд-разряд показывают электрические двойнослойные емкостные характеристики электродов. РШ-K4 проявляет лучшие характеристики при низкой скорости развертки потенциала и плотности тока, в то время как РШ-N3 является превосходным при высокой скорости развертки потенциала и плотности тока. При всех исследованных экспериментальных условиях полученные электроды проявляют лучшие характеристики в электролите K2SO4, чем в электролите Na2SO4.
ВВЕДЕНИЕ
С ростом информированности о необходимости охраны окружающей среды во всем мире возрастает привлекательность переработки сельскохозяйственных отходов в активированный уголь (АУ) и его применения [1, 2]. В ряду доступных богатых лигноцеллюлозой предшественников находится рисовая шелуха (РШ), которая производится в больших количествах во Вьетнаме, занимающем третье место в мире по производству и экспорту риса. Активированный уголь, полученный из РШ, обычно производят посредством химической и физической активации. Химическая активация имеет многочисленные преимущества, такие как низкая температура, короткое время, высокая удельная площадь поверхности и высокоразвитая пористость, которые делают ее предпочтительной по сравнению с физической активацией.
В ряду экспериментальных условий, которые значительно воздействуют на свойства получаемого активированного угля, такие как время активации, активатор и температура, активатор производит существенное влияние на развитие пор и характеристики поверхности получаемого активированного угля. Активаторы могут способствовать устранению примесей, таких как спирты, кислоты, альдегиды и другие вещества, которые присутствуют в углеродистых исходных материалах, что, в свою очередь, открывает поры и увеличивает их диаметр, а также удельную площадь поверхности. Наиболее часто используемые активаторы представляют собой кислоты (HNO3, H2SO4, H3PO4…), гидроксиды щелочных металлов (KOH, NaOH…) и соли (ZnCl2, MgCl2, FeCl3, NaCl…). Недостаток кислотных активаторов заключается в том, что они легко вызывают проблемы коррозии оборудования, а недостаток солей заключается в том, что активированный уголь легко загрязняется солью [3]. Кроме того, в случае использования рисовой шелухи в качестве источника исходного материала высокое содержание диоксида кремния в рисовой шелухе все же представляет собой препятствие для синтеза чистого активированного угля. Щелочная активация может быть весьма эффективной для удаления диоксида кремния посредством образования силиката натрия, и щелочь может быть легко удалена в процессе промывания. Кроме того, активированный уголь, полученный посредством щелочной активации, является в высокой степени микропористым и содержит многочисленные функциональные группы –OH на поверхности углерода [4].
В случае щелочной активации высокая площадь поверхности активированного угля может быть достигнута посредством реакции твердых и жидких веществ, в которой гидроксиды превращаются в водород, щелочные металлы и карбонаты щелочных металлов и некоторые остаточные углеродные соединения. Гидроксид калия и гидроксид натрия широко используются в качестве активатора. Оказалось, что активация с помощью KOH производит активированный уголь с большей удельной площадью поверхности и развитостью пор, чем активация с помощью NaOH [5]. Однако существует недостаток аналитической информации о взаимосвязи между активатором и электрохимическими характеристиками получаемого активированного угля.
В настоящей работе активированные угли получали с помощью KOH или NaOH и исследовали методами СЭМ, ЭРС, ИК-ПФ, КР, титрования по Бему и ТГА. Кроме того, была исследована взаимосвязь между электрохимическими свойствами и активаторами в электролитах K2SO4 и Na2SO4.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Получение активированного угля
В качестве исходного материала была использована рисовая шелуха из вьетнамской провинции Виньфук. Активированный уголь получали согласно процедуре, описанной в предшествующей работе [6]. Рисовую шелуху нагревали со скоростью 30°C/мин в атмосфере азота при скорости потока от 300 мл мин–1 до 500°C и обугливали в течение 90 мин. Уголь собирали и пропитывали KOH или NaOH (массовое соотношение уголь/KOH и уголь/NaOH составляло 1/4 и 1/3 соответственно) в течение 15 ч. После этого температуру повышали до 400°C в течение 20 мин, чтобы удалить избыток воды; затем температуру повышали до 800°C при скорости нагревания 10°C/мин и поддерживали в течение 60 мин в атмосфере азота при скорости потока 300 мл/мин. Полученные в результатe образцы промывали 2M HCl, а затем теплой дистиллированной водой (около 70°C) до pH 6.6–7.0. Наконец, образцы высушивали на воздухе при 120°C в течение 15 ч. Полученные активированные угли обозначали РШ-K4 и РШ‑N3, где РШ означает рисовую шелуху, буквы означают активатор, а числа означают массовое соотношение.
Исследование активированного угля
Морфологию образцов АУ иллюстрировали с помощью прибора S4800 (Hitachi). Элементный анализ осуществляли с помощью прибора SM‑6510LV (Jeol). Спектры ИК-ПФ регистрировали в таблетках, содержащих KBr, используя спектрометр Nexus 670 (Nicolet). Спектры КР регистрировали, используя микроскоп КР (Renishaw). Размер кристаллита в направлении базовой плоскости (La) вычисляли по следующему уравнению [7]:
где IG и ID представляют собой интенсивности полос D и G соответственно.Поверхностные функциональные группы определяли методом титрования по Бему [8]. Смешивали 0.5 г каждого углеродного материала и 25 мл раствора 0.1 M NaOH, 0.1 M NaHCO3, 0.1 M Na2CO3 или 0.1 HCl. Смеси встряхивали в течение 48 ч, удаляли углерод, а затем титровали раствором 0.1 M HCl или 0.1 M NaOH. Кислотные числа определяли в предположении, что NaOH нейтрализует карбоксильные, фенольные и лактонные группы; Na2CO3 нейтрализует карбоксильные и лактонные группы, и NaHCO3 нейтрализует только карбоксильные группы. Число основных групп определяли по требуемому количеству HCl.
Термогравиметрический анализ осуществляли, используя прибор DTG-60H (Shimadzu). Перед измерением образцы АУ высушивали на воздухе при 120°C в течение 2 ч для удаления адсорбированной воды. Термогравиметрический анализ осуществляли при скорости нагревания 10°C/мин от 120 до 650°C на воздухе.
Получение и емкостные характеристики электродов
Электрод получали, используя 10 мас. % политетрафторэтилена, 10 мас. % технического углерода и 80 мас. % активного материала. Материалы смешивали в этаноле, намазывали на пеноникель ракельным ножом и высушивали в печи при 120°C в течение 15 ч. Полученный в результате образец прессовали под давлением 80 Н м–2 в течение 30 мин.
Электрохимические измерения осуществляли на потенциостате Autolab 302N, используя платиновый лист в качестве противоэлектрода, насыщенный каломельный электрод в качестве электрода сравнения и нанесенный на пеноникель активированный уголь (геометрическая площадь 1 см2) в качестве рабочего электрода. Исследования методом циклической вольтамперометрии (ЦВ) осуществляли в диапазоне от –1.0 до 0.0 В при скорости развертки потенциала в диапазоне от 2 до 100 мВ с–1. Гальваностатические исследования заряда-разряда осуществляли в том же диапазоне потенциала при плотности тока от 0.2 до 3 А г–1. Все измерения осуществляли при комнатной температуре в электролите 0.5 M K2SO4 и 0.5 M Na2SO4. Значения емкости вычисляли по результатам измерений методом ЦВ (CCV) и исследований заряда–разряда (CCP), используя следующие уравнения:
где $\sum {\left| I \right|\Delta t} $ представляет собой площадь под кривой зависимости тока (А) от времени (с), m – массу активного материала в электроде (г), Id – ток разряда (А), Δtd– продолжительность разряда (с), и ΔV представляет собой интервал потенциала (В).ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Исследование активированного угля
Полученные методом сканирующей электронной микроскопии изображения на рис. 1 представляют морфологию образцов АУ, активированных с помощью KOH или NaOH. Образцы АУ состоят из сферических частиц, которые образуют неплотную структуру, содержащую трещины и щели. Размер частиц РШ-K4 составляет от 40 до 80 нм, превышая размер частиц РШ-N3, который составляет приблизительно от 20 до 50 нм.
Элементный анализ РШ-K4 и РШ-N3 и их атомные соотношения представлены в табл. 1. Содержание углерода составляет 95.55% в РШ-K4 и 96.01% в РШ-N3. Ни один из образов не содержит ни калия, ни натрия, и остаточное содержание Si составляет менее чем 0.05%, свидетельствуя, что в процессе получения и промывания успешно удаляются соединения калия или натрия, а также силикаты (которыми обогащена рисовая шелуха). Источник следовых примесей Cr и Fe может представлять собой контейнер реактора в течение процесса синтеза.
Таблица 1.
Элементный анализ РШ-K4 и РШ-N3
| Образец | Элементный состав, % | ||||||
|---|---|---|---|---|---|---|---|
| C | O | Si | Cl | Cr | Fe | сумма | |
| РШ-K4 | 95.55 | 4.21 | 0.04 | 0.13 | 0.07 | 0.07 | 100 |
| РШ-N3 | 96.01 | 3.67 | 0.03 | 0.11 | 0.09 | 0.09 | 100 |
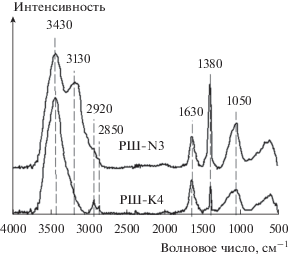
Анализ методом ИК-ПФ использовали для получения информации о поверхностных функциональных группах, присутствующих в двух образцах, и результаты представлены на рис. 2. Спектры ИК-ПФ имеют аналогичные формы, в которых большинство полос расположено в одном диапазоне волновых чисел. Широкая полоса при 3430 см–1 соответствует валентным колебаниям связей O–H фенольных и карбоксильных групп, а также адсорбированных молекул воды [9]. Пик при 1630 см–1 может соответствовать полосам поглощения связи C=O в лактонных, карбоксильных и ангидридных группах [10]. Сильный пик при 1380 см–1 соответствует валентным колебаниям –CH3 [11]. Пик при 1050 см–1 соответствует валентным колебаниям связей C–O сложных эфиров, фенолов, спиртов или простых эфиров [9, 12]. Для образца РШ-K4 существуют два пика при 2920 и 2580 см–1, которые могут соответствовать асимметричным и симметричным колебаниям CH2. С другой стороны, РШ-N3 имеет единственный пик при 3130 см–1, который соответствует валентным колебаниям C–H в ароматическом скелете [13]. Здесь отсутствуют пики поглощения SiO2 (при 1101, 944 и 789 см–1 [14]), свидетельствуя, что диоксид кремния успешно удален из образцов.
Спектроскопию КР использовали для получения информации о структурной разупорядоченности в образцах активированного угля. Две характеристические полосы углеродистых материалов наблюдаются в спектрах КР, представленных на рис. 3. Полоса D при 1350 см–1 свидетельствует о структурных дефектах вследствие колебаний sp3-связанного атома углерода, в то время как полоса G при 1580 см–1 соответствует упорядоченным sp2-связанным атомам углерода [15]. Здесь отсутствуют значительные различия между положениями двух полос. Соотношение интенсивностей полос D и G (ID/IG) представляет собой показатель разупорядоченности, которую обуславливают вакансии, краевые дефекты и аморфные углеродные частицы [7]. Соотношение ID/IG для РШ-K4 (табл. 2) составляет 1,329 и превышает соответствующее значение для РШ-N3 (1.258), свидетельствуя о разупорядоченности РШ-K4 по сравнению с РШ-N3. Кроме того, РШ-K4 имеет размер кристаллита в направлении базовой плоскости (La), который составляет 3.27 нм, менее чем соответствующее значение для РШ-N3 (3.46 нм).
Таблица 2.
ID, IG, ID/IG и La
| Образец | ID, у. е. | IG, у. е. | ID/IG | La, нм |
|---|---|---|---|---|
| РШ-K4 | 2300 | 1731 | 1.329 | 3.27 |
| РШ-N3 | 1900 | 1510 | 1.258 | 3.46 |
Поверхностные функциональные группы, такие как фенольные, лактонные, и карбоксильные, определяли методом титрования по Бему. Как представлено в табл. 3, результаты титрования по Бему показывают, что кислотные группы преобладают по сравнению с основными группами для обоих образцов АУ. Однако сумма кислотных групп и сумма основных групп РШ-K4 всегда составляют более чем соответствующие суммы РШ-N3. Этот результат хорошо согласуется с результатом ЭРС, что содержание кислорода выше в РШ-K4, чем в РШ-N3. Высокое содержание поверхностных функциональных групп РШ-K4 может также объяснить более высокий уровень разупорядоченности РШ-K4.
Таблица 3.
Результаты титрования по Бему
| Образец | Функциональные группы | ||||
|---|---|---|---|---|---|
| карбоксил, ммоль/г | лактон, ммоль/г | фенол, ммоль/г | сумма кислот, ммоль/г | сумма оснований, ммоль/г | |
| РШ-K4 | 0.59 | 0.16 | 0.79 | 1.54 | 0.50 |
| РШ-N3 | 0.52 | 0.50 | 0.20 | 1.22 | 0.40 |
Термогравиметрический анализ осуществляли, чтобы определить термическую устойчивость образцов АУ, что представлено на рис. 4. Наблюдаются две основных стадии потери массы от 120 до 630°C: 1) первая потеря массы составляет менее, чем 5%, происходит приблизительно от 120 до 350°C и обусловлена разложением некоторых кислородсодержащих групп (карбоксил 100–250°C, лактон 200–400°C [16]). Методом титрования по Бему обнаружено, что суммарное содержание карбоксильных и лактонных групп составляет 1.02 ммоль г–1 для РШ-N3 и 0.75 ммоль г–1 для РШ-K4. В результате этого потеря массы РШ-K4 в данном диапазоне (3.92%) составляет менее чем потеря массы РШ-N3 (4.99%). 2) Вторая потеря массы, которая наблюдается от 350 до 630°C и сопровождается экзотермическим пиком приблизительно при 500°C, может быть обусловлена удалением более устойчивых групп, а именно фенольных, карбонильных и хиноновых, а также сгоранием углерода.
В итоге, структурный анализ показал, что АУ, полученный из рисовой шелухи посредством активации NaOH или KOH, состоит из сферических наночастиц (менее 80 нм), причем размер частиц уменьшается, когда активацию осуществляют с помощью NaOH. Полученный АУ содержит кислотные и основные поверхностные функциональные группы при большинстве кислотных групп. Суммарное количество кислотных и основных групп увеличивается в случае активации с помощью KOH, что, в свою очередь, приводит к большей разупорядоченности в образце, активированном с помощью KOH.
Электрохимические свойства образцов АУ
Чтобы оценить электрохимические характеристики образцов АУ, исследование методом циклической вольтамперометрии (ЦВ) осуществляли при потенциалах в диапазоне от –1.0 до 0.0 В относительно НКЭ в двух электролитах, включая 0.5 M K2SO4 и 0.5 Na2SO4 (рис. 5). Кривые ЦВ двух электродов проявляют близкую к прямоугольной форму, что предполагает характеристики электрического двойнослойного конденсатора (ЭДСК). Однако существует небольшой горб, наблюдаемый на кривой ЦВ для РШ-K4, который объясняется реакцией поверхностных функциональных групп [17]. Для образцов РШ-N3 этот горб не наблюдается вследствие малочисленности поверхностных функциональных групп.
Рис. 5.
Циклические вольтамперограммы РШ-K4 и РШ-N3 в 0.5 M K2SO4 (a) и 0.5 M Na2SO4 (б) при различных скоростях развертки потенциала.

При более высокой скорости развертки потенциала наблюдается отклонение, которое может быть обусловлено ограниченной диффузией. Очевидно, что: 1) в том же электролите отклонение в случае РШ-K4 является более выраженным, чем в случае РШ-N3. Это можно объяснить согласно литературе тем, что активированный уголь, полученный с помощью KOH, является менее мезопористым, чем в случае активации с помощью NaOH [5], что, в свою очередь, уменьшает миграцию ионов электролита и вызывает увеличение времени отклика для приема/высвобождения заряда; 2) при одинаковой скорости развертки потенциала степень отклонения кривой ЦВ в электролите Na2SO4 является выше, чем в электролите K2SO4. Это может быть обусловлено меньшим радиусом гидратированного иона K+ (3.31 Å), чем Na+ (3.53 Å) [18, 19], а также более высокой ионной проводимостью в случае K+ (73.5 См см2 моль–1), чем в случае Na+ (50.11 См см2 моль–1) [20]. В результате этого ионы K+ могут легче мигрировать в поры и принимать участие в образовании электрохимического двойного слоя.
Чтобы лучше понимать электрохимическое поведение электродных материалов в двух электролитах, емкость РШ-K4 и РШ-N3 при различных скоростях развертки потенциала в двух электролитах вычислена согласно уравнению (2) и проиллюстрирована на одном чертеже (рис. 6). Электроды РШ-K4 и РШ-N3 проявляют наиболее высокую удельную емкость, составляющую 196 и 159 Ф г–1 соответственно, при скорости развертки потенциала 2 мВ с–1. Эти значения составляют приблизительно в два раза выше, чем в случае активированного угля PICATIF при той же скорости развертки потенциала [21]. В исследуемом диапазоне скорости развертки потенциала от 2 до 100 мВ с–1 удельная емкость уменьшается при увеличении скорости развертки потенциала, но она всегда выше в электролите K2SO4, чем в электролите Na2SO4. Это уменьшение удельной емкости может быть обусловлено ограничением диффузии. При повышенной скорости развертки потенциала задерживается миграция ионов K+ и Na+ в поровые каналы. Кроме того, радиус гидратированного иона Na+ составляет более чем в случае иона K+, что затрудняет миграцию ионов Na+ в поры (особенно в микропоры). В результате этого удельная емкость является выше в электролите K2SO4, чем в электролите Na2SO4.
Рис. 6.
Изменения емкости электродов РШ-K4 и РШ-N3 при различных скоростях развертки потенциала в 0.5 M K2SO4 и 0.5 M Na2SO4.

На рис. 6 можно также видеть, что при скорости развертки потенциала, составляющей менее чем 30 мВ с–1, электрод РШ-K4 в обоих электролитах проявляет более высокую удельную емкость, чем РШ-N3. Высокая удельная емкость РШ-K4 может быть вызвана фарадеевской окислительно-восстановительной реакцией благодаря высокому содержанию поверхностных функциональных групп. Когда скорость развертки потенциала увеличивается, удельная емкость уменьшается с различными наклонами для двух электролитов. Интересно, что при скорости развертки потенциала, составляющей более чем 30 мВ с–1 в электролите Na2SO4 и более чем 50 мВ с–1 в электролите K2SO4, удельная емкость РШ-N3 является выше, чем в случае РШ-K4. Удельная емкость РШ-K4 и РШ-N3 составляет, соответственно, 126 и 132 Ф г–1 при скорости развертки потенциала 30 мВ с–1 в электролите Na2SO4 и 116 и 122 Ф г–1 при скорости развертки потенциала 50 мВ с–1 в электролите K2SO4. Это может быть обусловлено влиянием различного содержания мезопор, как объясняется выше. Кроме того, радиус гидратированного иона Na+ составляет более чем в случае K+, и в результате этого явление, согласно которому удельная емкость РШ-N3 является выше, чем в случае РШ‑K4, возникает раньше в электролите Na2SO4 (при 30 мВ с–1), чем в электролите K2SO4 (50 мВ с–1).
Характеристики заряда-разряда полученных электродов измеряли при плотностях тока от 0.2 до 3.0 А г–1 в диапазоне потенциалов от –1.0 до 0.0 В. Кривые заряда–разряда РШ-K4 и РШ-N3 в электролитах K2SO4 и Na2SO4 при двух типичных плотностях тока представлены на рис. 7.
Рис. 7.
Кривые заряда–разряда РШ-K4 (a) и РШ-N3 (б) при 0.5 и 1.0 А г–1 в электролитах 0.5 M K2SO4 и 0.5 M Na2SO4.

Можно видеть, что все представленные кривые заряда–разряда являются линейными и образуют симметричный треугольник, свидетельствуя о хорошей емкости ЭДСК. Изображения на вставках представляют падение потенциала в начале разряда постоянного тока. Следует отметить, что падение IR в случае РШ-N3 составляет менее чем в случае РШ-K4 в обоих электролитах, что свидетельствует о низком внутреннем сопротивлении РШ-N3. Это могут обуславливать различные скорости миграции ионов, степени поверхностной разупорядоченности и размеры кристаллитов в направлении базовой плоскости (La) образцов. РШ-N3 имеет ID/IG = 1.258, что составляет менее чем в случае РШ-K4 (1.329), а также имеет La = 3.46 нм, что составляет более чем в случае РШ-K4 (3.27 нм), приводя к более высокой электропроводности, т.е. меньшему внутреннему сопротивлению.
Удельные емкости, вычисленные по кривым заряда–разряда согласно уравнению (3), представлены на рис. 8.
Рис. 8.
Изменения емкости электродов РШ-K4 и РШ-N3 при различных плотностях тока в 0.5 M K2SO4 и 0.5 M Na2SO4.
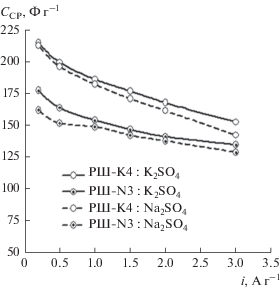
На рис. 8 можно видеть, что в диапазоне плотностей тока от 0.2 до 3.0 А г–1, удельная емкость обоих электродов уменьшается при увеличении плотности тока. Кроме того, удельная емкость РШ-K4 всегда является выше, чем в случае РШ-N3 в обоих электролитах. При плотности тока 0.2 А г–1 удельная емкость РШ-K4 и РШ-N3 составляет 215 и 178 Ф г–1 в электролите K2SO4 и составляет 213 и 162 Ф г–1 в электролите Na2SO4. В то же время при плотности тока 3.0 А г–1 получаемые значения составляют, соответственно, 153 и 135 Ф г–1 в электролите K2SO4 и 143 и 129 Ф г–1 в электролите Na2SO4. Этот результат может обуславливать решающая роль адсорбции ионов электролита на поверхности углерода в порах активированного угля. На рис. 8 также можно видеть, что удельная емкость двух электродов АУ в электролите K2SO4 всегда выше, чем в случае электролита Na2SO4. Это подтверждает, что полученные электроды проявляют более высокую электрохимическую активность в электролите K2SO4, чем в электролите Na2SO4.
ВЫВОДЫ
Образцы активированного угля получены посредством химической активации с использованием KOH или NaOH в качестве активаторов. Измерение методом ЭРС показывает, что содержащийся диоксид кремния успешно устраняется. Анализ методом ИК-ПФ и титрование по Бему свидетельствуют, что полученный активированный уголь содержит многочисленные поверхностные функциональные группы. Спектры КР показывают, что РШ-K4 имеет более высокую степень разупорядоченности, чем РШ-N3. Электрохимические свойства АУ исследовали в электролитах 0.5 M K2SO4 и 0.5 M Na2SO4 методами циклической вольтамперометрии и испытаниями на заряд-разряд. При низкой скорости развертки потенциала и плотности тока РШ-N3 обладает меньшей емкостью, чем РШ-K4. При этом, при высокой скорости развертки потенциала и плотности тока более высокой емкостью обладает РШ-N3. Наиболее высокая полученная емкость составляла 196 Ф г–1 при 2 мВ с–1 и 215 Ф г–1 при 0.2 А г–1 в 0.5 M K2SO4. Результаты также показали, что два электрода на основе АУ имеют лучшие эксплуатационные характеристики в электролите K2SO4, чем в электролите Na2SO4, что обусловлено высокой скоростью миграции и малым радиусом иона K+.
Список литературы
Doczekalska, B., Kusmierek, K., Swiatkowski, A., and Bartkowiak, M., Adsorption of 2,4-dichlorophenoxyacetic acid and 4-chloro-2-metylphenoxyacetic acid onto activated carbons derived from various lignocellulosic materials, J. Environ. Sci. Health, Part B, 2018, vol. 53(5), p. 290.
Li, B., Zhang, H., Wang, D., and Lv, H., Agricultural waste-derived activated carbon for high performance lithium-ion capacitors, RSC Advances, 2017, vol. 7, p. 37923.
Buczed, B., Preparation of active carbon by additional activation with potassium hydroxide and characterization of their properties, Adv. Mater. Sci. Eng., 2016, vol. 2016, p. 5819208.
Chen, J.P. and Wu, S., Acid/Base-treated activated carbons: Characterization of functional groups and metal adsorptive properties, Langmuir, 2004, vol. 20, p. 2233.
Muniandy, L., Adam, F., Mohamed, A.R., and Ng, E.P., The synthesis and characterization of high purity mixed microporous/mesoporous activated carbon from rice husk using chemical activation with NaOH and KOH, Microporous Mesoporous Mater., 2014, vol. 197, p. 316.
Le Van, K. and Luong, T.T.T., Activated carbon derived from rice husk by NaOH activation and its application in supercapacitor, Prog. Nat. Sci-Mater, 2014, vol. 24, p. 191.
Tuinstra, F. and Koenig, J.L., Raman spectrum of graphite, J. Chem. Phys., 1970, vol. 53, p. 1126.
Boehm, H.P., Some aspects of the surface chemistry of carbon blacks and other carbons, Carbon, 1994, vol. 32, p. 759.
Puziy, A.M., Poddubnaya, O.I., Martínez-Alonso, A., and Suárez-García, F., Synthetic carbons activated with phosphoric acid: I. Surface chemistry and ion binding properties, Carbon, 2002, vol. 40, p. 1493.
Li, L., Liu, S., and Liu, J., Surface modification of coconut shell based activated carbon for the improvement of hydrophobic VOC removal, J. Hazard. Mater., 2011, vol. 192, p. 683.
Hadoun, H., Sadaouib, Z., Souami, N., and Sahel, D., Characterization of mesoporous carbon prepared from date stems by H3PO4 chemical activation, Appl. Surf. Sci., 2013, vol. 280, p. 1.
Tongpoothorn, W., Sriuttha, M., Homchan, P., and Chanthai, S., Preparation of activated carbon derived from Jatropha curcas fruit shell by simple thermo-chemical activation and characterization of their physico-chemical properties, Chem. Eng. Res. Des., 2011, vol. 89(3), p. 335.
Subrahmanyam, C., Bulushev, D.A., and Kiwi-Minsker, L., Dynamic behavior of activated car bon catalysts during ozone decomposition at room temperature, Appl. Catal. B, 2005, vol. 61, p. 98.
An, D., Guo, Y., Zou, B., and Zhu, Y., A study on the consecutive preparation of silica powders and active carbon from rice husk ash, Biomass Bioenergy, 2011, vol. 35, p. 1227.
Kumar, S.V., Huang, N.M., Lim, H.N., and Zainy, M., Preparation of highly water dispersible functional graphene/silver nanocomposite for the detection of melanie, Sens. Actuat. B-Chem., 2013, vol. 181, p. 885.
Figueiredo, J.L., Pereira, M.F.R., Freitas, M.M.A., and Orfao, J.J.M., Modification of the surface chemistry of activated carbons, Carbon, 1999, vol. 37, p. 1379.
Zhang, M., Li, Y., Si, H., and Wang, B., Preparation and electrochemical performance of coconut shell activated carbon produced by the H3PO4 activation with rapid cooling method, Int. J. Electrochem. Sci., 2017, vol. 12, p. 7844.
Qu, Q.T., Wang, B., Yang, L.C., and Shi, Y., Study on electrochemical performance of activated carbon in aqueous Li2SO4, Na2SO4 and K2SO4 electrolytes, Electrochem. Commun., 2008, vol. 10, p. 1652.
Reddy, R.N. and Reddy, R.G., Sol–gel MnO2 as an electrode material for electrochemical capacitors, J. Power Source, 2003, vol. 124, p. 330.
Zhong, C., Deng, Y., Hu, W., and Qiao, J., A review of electrolyte materials and compositions for electrochemical supercapacitors, Chem. Soc. Rev., 2015, vol. 44, p. 7484.
Brouse, T., Taberna, P.L., Crosnier, O., and Dugas, R., Long-term cycling behavior of asymmetric activated carbon/MnO2 aqueous electrochemical supercapacitor, J. Power Sources, 2007, vol. 173, p. 633.
Дополнительные материалы отсутствуют.