Электрохимия, 2020, T. 56, № 1, стр. 87-91
Электродные потенциалы сурьмы в смеси хлоридов калия и свинца
П. А. Архипов a, *, А. С. Холкина a, b, **, Ю. П. Зайков a, b, Н. Г. Молчанова a
a Институт высокотемпературной электрохимии УрО РАН
620137 Екатеринбург, ул. Академическая, 20, Россия
b Уральский Федеральный Университет им. первого Президента России Б.Н. Ельцина
620002 Екатеринбург, ул. Мира, 19, Россия
* E-mail: arh@ihte.uran.ru
** E-mail: a.kholkina@mail.ru
Поступила в редакцию 20.03.2019
После доработки 28.06.2019
Принята к публикации 29.07.2019
Аннотация
Методом ЭДС измерены равновесные потенциалы сурьмы в расплаве KCl–PbCl2–SbCl3 в зависимости от температуры и содержания хлорида сурьмы. Получены эмпирические уравнения изотерм и политерм равновесных потенциалов сурьмы. Рассчитаны условные стандартные потенциалы сурьмы в расплавленной смеси хлоридов калия и свинца. Рассчитаны величины изменения энергии Гиббса при образовании трихлорида сурьмы из элементов в исследованном расплаве. Проведена оценка коэффициентов разделения металлов из сплавов. Полученные результаты свидетельствуют о перспективности процессов разделения свинца и сурьмы в хлоридных расплавах.
ВВЕДЕНИЕ
Электрохимические технологии, широко применяющиеся при многотоннажном производстве металлов [1, 2], могут быть перспективными для получения редких [3] и цветных металлов [4, 5], включающих свинец [6, 7]. Изначально извлекаемый с помощью восстановительной плавки свинец из исходного сырья (конверторные пыли, возгоны, свинцовые кеки, шламы электролитного производства, пыли электрофильтров, аккумуляторный лом) содержат в своем составе примеси сопутствующих цветных металлов. Нередко в результате технологических операций получают сплавы с соизмеримым содержанием ценных металлов. В этих случаях их подвергают электрохимическому рафинированию или разделению на компоненты в расплавленных электролитах [8, 9]. Основные требования, предъявляемые к данным процессам, – высокая интенсивность и чистота получаемых на катоде металлов при низких удельных расходах материалов и электроэнергии. Для разработки технологии разделения сплавов свинца необходимы фундаментальные знания об электрохимических свойствах и взаимодействии металлов с расплавленными хлоридными электролитами. В литературе имеются сведения об электродных потенциалах сурьмы в смеси хлоридов лития и калия [10, 11], хлоридов натрия и алюминия [8], хлоридов натрия, калия и свинца [9]. Однако в литературе отсутствуют данные об электродных потенциалах сурьмы в расплавленной смеси хлоридов калия и свинца.
Цель настоящей работы – исследование электрохимического и термодинамического поведения сурьмы в расплавленной смеси хлоридов калия и свинца.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исследования проводили методом измерения равновесных потенциалов сурьмы в гальваническом элементе:
(1)
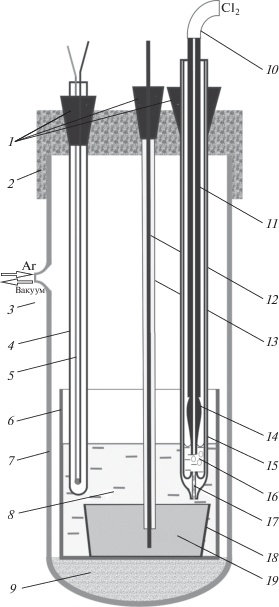
$\left( {{\text{СУ}}} \right){\text{Sb}}\left( {\text{ж}} \right){\text{|}}\,{\text{(X)(SbC}}{{{\text{l}}}_{{\text{3}}}}{\text{)--(1 --}}\,{\text{X)(KCl--PbC}}{{{\text{l}}}_{{\text{2}}}})||{\text{KCl--PbC}}{{{\text{l}}}_{{\text{2}}}}|{\text{C}}{{{\text{l}}}_{{\text{2}}}}\left( {\text{г}} \right){\text{, }}\left( {\text{С}} \right),$Ячейка (рис. 1) для измерения электродвижущих сил (ЭДС) гальванического элемента (1) представляет собой кварцевую пробирку, заполненную аргоном, в которую на подставку из огнеупорного кирпича помещен алундовый тигель. На дне тигля находится расплавленный металлический электрод, закрытый электролитом. В качестве электролита применили расплав, состоящий из 50 мол. % PbCl2 и 50 мол. % KCl. Для его приготовления использовали реактивы марки “ч. д. а.”, дополнительно очищенные от кислородсодержащих примесей электролизом с нерастворимым углеродным анодом. Концентрацию ионов сурьмы в электролите задавали анодным растворением элементарной сурьмы. Количество пропущенного электричества контролировали медным кулонометром. Металлические электроды готовили из сурьмы марки Су00. Токоподвод к электроду из сурьмы осуществляли при помощи стержня из стеклоуглерода, защищенного от расплава алундовой трубкой. В качестве электрода сравнения использовали хлорный электрод [12]. Температуру расплава контролировали платинородиевой–платиновой термопарой. Ячейку помещали в массивный блок, который нагревали до заданной температуры в печи сопротивления. Блок выполнял роль термостата. Заданное значение температуры поддерживали с точностью ±1°C с помощью регулятора температуры Варта ТП707 (ООО “НПК “ВАРТА”, г. Санкт-Петербург, Россия). Значение ЭДС регистрировали мультиметром APPA-109 (компания “APPA Technology Corporation”, Тайвань) с входным сопротивлением ~10 МОм. Для каждой заданной концентрации ионов сурьмы измеряли равновесный потенциал гальванического элемента (1) при нескольких температурах. За установившиеся значения равновесного потенциала считали такие, которые в течение 30 минут оставались постоянными в пределах ±1 мВ. Состав потенциалопределяющих ионов в электролите контролировали методом атомно-эмиссионной спектроскопии с помощью оптического эмиссионного спектрометра с индуктивно-связанной плазмой OPTIMA 4300 DV (“Perkin Elmter”, США) до и после измерения.
Рис. 1.
Измерительная ячейка: 1 – пробки из резины; 2 – пробка из фторопласта; 3 – вакуум/Ar; 4 – алундовый чехол для термопары; 5 – термопара ТПП; 6 – тигель из Al2O3; 7 – ячейка из кварца; 8 – электролит; 9 – огнеупорный кирпич; 10 – трубка из фторопласта для подвода Cl2; 11 – графитовая трубка; 12 – токоподвод из СУ; 13 – трубка из Al2O3; 14 – наконечник из графита спектральной чистоты; 15 – кварцевая капсула; 16 – расплавленный KCl–PbCl2; 17 – диафрагма из асбеста; 18 – тигель из Al2O3; 19 – сурьма.
Степень окисления ионов сурьмы, переходящих в раствор, определяли по убыли массы анодно растворенного металла и по углу наклона прямолинейной части изотерм.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
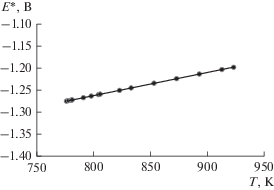
Равновесные ЭДС ячейки с сурьмяным и хлорным электродами измеряли в области концентраций потенциалопределяющих ионов 0.01–1.6 мол. % в температурном интервале 740–890 К. На рис. 2 приведены политермы равновесных потенциалов сурьмы для нескольких концентраций (кривые 2, 3, 4, 5) и политерма условного стандартного потенциала сурьмы (кривая 1) в данном расплаве.
Рис. 2.
Температурная зависимость электродных потенциалов сурьмы в расплаве KCl–PbCl2. 1 – условный стандартный потенциал сурьмы; равновесные потенциалы при концентрациях трихлорида висмута в расплаве, мол. %: 2 – 1.60; 3 – 0.90; 4 – 0.43; 5 – 0.17.
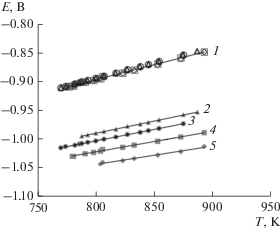
Видно, что потенциал линейно меняется с температурой во всем исследуемом интервале. На основании политерм для температур 775, 800, 825 и 875 К рассчитаны уравнения изотерм равновесных потенциалов сурьмы.
Экспериментальные точки во всем исследованном интервале концентраций ионов сурьмы располагаются на прямых линиях. Из прямолинейного хода изотерм следует, что степень окисления сурьмы во всем изученном диапазоне концентраций постоянна. Эмпирические уравнения, полученные аппроксимацией экспериментальных точек, приведены в табл. 1. Там же приведены коэффициенты детерминации R2.
Таблица 1.
Уравнения Нернста и степень окисления сурьмы в эквимолярном расплаве KCl–PbCl2
| T, К | E = E* + (RT/nF)ln ${{c}_{{{\text{SbC}}{{{\text{l}}}_{{\text{3}}}}}}}$ | R2 | N | nанод. раст |
|---|---|---|---|---|
| 775 | Е = 0.906 – 0.0219ln${{c}_{{{\text{SbC}}{{{\text{l}}}_{{\text{3}}}}}}}$ | 0.99 | 3.04 | 2.99 |
| 800 | Е = 0.881 – 0.0231ln${{c}_{{{\text{SbC}}{{{\text{l}}}_{{\text{3}}}}}}}$ | 0.98 | 2.98 | 2.98 |
| 825 | Е = 0.875 – 0.0240ln${{c}_{{{\text{SbC}}{{{\text{l}}}_{{\text{3}}}}}}}$ | 0.99 | 2.96 | 2.98 |
| 875 | Е = 0.860 – 0.0254ln${{c}_{{{\text{SbC}}{{{\text{l}}}_{{\text{3}}}}}}}$ | 0.98 | 2.97 | 3.00 |
Проведенные расчеты средней валентности ионов сурьмы по угловым коэффициентам уравнений изотерм (N) и данные по анодному растворению (nанод. раст) сурьмы (табл. 1) показали, что в исследованном расплаве в изученном интервале концентраций и температур сурьма находится преимущественно в трехвалентном состоянии. Так как сурьма в расплаве имеет в основном одну валентную форму, то для определения условного стандартного потенциала можно использовать уравнение Нернста.
Температурная зависимость условного стандартного потенциала сурьмы $E_{{{{{\text{S}}{{{\text{b}}}^{{3 + }}}} \mathord{\left/ {\vphantom {{{\text{S}}{{{\text{b}}}^{{3 + }}}} {{\text{Sb}}}}} \right. \kern-0em} {{\text{Sb}}}}}}^{*}$ представлена уравнением:
(2)
$E_{{{{{\text{S}}{{{\text{b}}}^{{{\text{3 + }}}}}} \mathord{\left/ {\vphantom {{{\text{S}}{{{\text{b}}}^{{{\text{3 + }}}}}} {{\text{Sb}}}}} \right. \kern-0em} {{\text{Sb}}}}}}^{*} = - 1.307 + 5.1 \times {{10}^{{ - 4}}}T,\,\,\,\,\,\,\,{{R}^{2}} = 0.998,$Измеренная ЭДС гальванического элемента соответствует реакции образования в данном расплаве трихлорида сурьмы из простых веществ:
(3)
${\text{S}}{{{\text{b}}}_{{\left( {{\text{тв}}} \right)}}} + {\text{ }}{3 \mathord{\left/ {\vphantom {3 2}} \right. \kern-0em} 2}{\text{C}}{{{\text{l}}}_{{{\text{2}}\left( {\text{г}} \right)}}} = {\text{SbC}}{{{\text{l}}}_{{{\text{3}}\left( {{\text{раств}}} \right)}}}{\text{.}}$Отсюда парциальное изменение энергии Гиббса при образовании трихлорида сурьмы по реакции (3) равно:
(4)
$\begin{gathered} \Delta G_{{{\text{SbC}}{{{\text{l}}}_{{\text{3}}}}{\text{(расп)}}}}^{*} = - nFE_{{{{{\text{S}}{{{\text{b}}}^{{{\text{3 + }}}}}} \mathord{\left/ {\vphantom {{{\text{S}}{{{\text{b}}}^{{{\text{3 + }}}}}} {{\text{Sb}}}}} \right. \kern-0em} {{\text{Sb}}}}}}^{*} = - 378.4 + 0.147T,\,\, \\ {{R}^{2}} = 0.99. \\ \end{gathered} $Первый член уравнения (4) является энтальпией реакции образования трихлорида сурьмы из элементов в виде разбавленного раствора (ΔH* = = –378.4 кДж/моль), а сомножитель перед температурой во втором члене уравнения (4) – стандартной энтропией реакции (S* = –147 Дж/(моль град)). Стандартная теплота образования твердого трихлорида сурьмы составляет –381.2 кДж/моль [13]. Отсюда можно определить теплоту растворения SbCl3 в расплавленном электролите, которая равна 2.8 кДж/моль. В свою очередь, теплота растворения трихлорида сурьмы складывается из теплоты плавления этой соли (ΔHпл = 12.5 кДж/моль [13]) и теплоты смешения жидкого трихлорида сурьмы с эквимолярной смесью хлоридов калия и свинца. Следовательно, энтальпия смешения жидкого трихлорида сурьмы с эквимолярным расплавом KCl–PbCl2 составляет ΔHсмеш = 15.3 кДж/моль. На основании полученных данных можно предположить, что имеется взаимодействие при растворении жидкого трихлорида сурьмы с эквимолярной смесью хлоридов калия и свинца.
Используя данные по равновесным потенциалам сплавов Pb–Sb [14] и условные стандартные потенциалы сурьмы и свинца в данном расплаве можно рассчитать термодинамические коэффициенты разделения этих металлов [15]:
(5)
$\theta = \frac{{{{c}_{{{\text{P}}{{{\text{b}}}^{{{\text{2 + }}}}}}}}{{c}_{{{\text{Sb(Pb--Sb}})}}}}}{{{{c}_{{{\text{Pb(Pb--Sb}})}}}{{c}_{{{\text{S}}{{{\text{b}}}^{{{\text{3 + }}}}}}}}}},$При выполнении условия равновесия сплава свинец–сурьма в расплаве KCl–PbCl2 можно записать обменную реакцию сурьмы с хлоридом свинца:
(6)
$2{\text{S}}{{{\text{b}}}_{{{\text{(Pb--Sb}})}}} + 3{\text{PbC}}{{{\text{l}}}_{{\text{2}}}} \to 2{\text{SbC}}{{{\text{l}}}_{{\text{3}}}} + 3{\text{P}}{{{\text{b}}}_{{{\text{(Pb--Sb}})}}}.$В этом случае, из равенства электродных равновесных потенциалов, используя условные стандартные потенциалы сурьмы и свинца, получаем связь между концентрациями металлов в сплаве и концентрациями ионов сурьмы и свинца в расплаве:
(7)
$\begin{gathered} {{E}_{{\text{p}}}} = E_{{{{{\text{P}}{{{\text{b}}}^{{{\text{2 + }}}}}} \mathord{\left/ {\vphantom {{{\text{P}}{{{\text{b}}}^{{{\text{2 + }}}}}} {{\text{Pb}}}}} \right. \kern-0em} {{\text{Pb}}}}}}^{*} + \frac{{RT}}{{2F}}\ln \frac{{c_{{{\text{P}}{{{\text{b}}}^{{{\text{2 + }}}}}}}^{3}}}{{c_{{{\text{Pb(Pb--Sb}})}}^{3}}} = \\ = E_{{{{{\text{S}}{{{\text{b}}}^{{{\text{3 + }}}}}} \mathord{\left/ {\vphantom {{{\text{S}}{{{\text{b}}}^{{{\text{3 + }}}}}} {{\text{Sb}}}}} \right. \kern-0em} {{\text{Sb}}}}}}^{*} + \frac{{RT}}{{3F}}\ln \frac{{c_{{{\text{S}}{{{\text{b}}}^{{{\text{3 + }}}}}}}^{2}}}{{c_{{{\text{Sb(Pb--Sb}})}}^{2}}}, \\ \end{gathered} $Выполнив некоторые математические преобразования уравнения (7) получаем выражение для расчета концентрации ионов сурьмы в солевом расплаве:
(8)
${{c}_{{{\text{S}}{{{\text{b}}}^{{{\text{3 + }}}}}}}} = \sqrt {\exp \left[ {\frac{{3F}}{{RT}}\left( {E_{{{{{\text{P}}{{{\text{b}}}^{{{\text{2 + }}}}}} \mathord{\left/ {\vphantom {{{\text{P}}{{{\text{b}}}^{{{\text{2 + }}}}}} {{\text{Pb}}}}} \right. \kern-0em} {{\text{Pb}}}}}}^{*} - E_{{{{{\text{S}}{{{\text{b}}}^{{{\text{3 + }}}}}} \mathord{\left/ {\vphantom {{{\text{S}}{{{\text{b}}}^{{{\text{3 + }}}}}} {{\text{Sb}}}}} \right. \kern-0em} {{\text{Sb}}}}}}^{*} + \frac{{RT}}{{2F}}\ln \frac{{c_{{{\text{Pb(Pb--Sb}})}}^{3}}}{{c_{{{\text{P}}{{{\text{b}}}^{{{\text{2 + }}}}}}}^{3}}}} \right) + \ln c_{{{\text{Sb(Pb--Sb}})}}^{2}} \right]} \,{\kern 1pt} .$Коэффициент активности хлорида свинца в данном расплаве брали из работы [16]. Температурная зависимость условного стандартного потенциала свинца в расплаве KCl–PbCl2 описывается уравнением $E_{{{{{\text{P}}{{{\text{b}}}^{{{\text{2 + }}}}}} \mathord{\left/ {\vphantom {{{\text{P}}{{{\text{b}}}^{{{\text{2 + }}}}}} {{\text{Pb}}}}} \right. \kern-0em} {{\text{Pb}}}}}}^{*}$ = –(1.679) + (5.0 × 10–4)Т [17] и представлен на рис. 3. Результаты расчета концентраций ионов сурьмы в солевом расплаве по уравнению (8) в зависимости от содержания его в сплаве со свинцом приведены в табл. 2. Расчетные концентрации ионов сурьмы в расплаве увеличиваются при увеличении электроположительного металла в сплаве со свинцом, но не превышают 10–3 мол. %.
Таблица 2.
Расчетная концентрация ионов сурьмы в солевом расплаве
| cPb(Pb–Sb), м. д. | ${{c}_{{{\text{S}}{{{\text{b}}}^{{{\text{3}} + }}}}}},$ м. д. |
|---|---|
| 0.9 | 3.8 × 10–06 |
| 0.8 | 1.1 × 10–05 |
| 0.7 | 2.1 × 10–05 |
| 0.47 | 8.8 × 10–05 |
| 0.35 | 2.0 × 10–04 |
| 0.2 | 9.3 × 10–04 |
На рис. 4 представлены результаты расчета коэффициентов разделения сплавов свинца и сурьмы в широкой области концентраций компонентов в сплаве.
Рис. 4.
Зависимость коэффициента разделения от мольно-долевой концентрации компонентов в сплаве Pb–Sb.
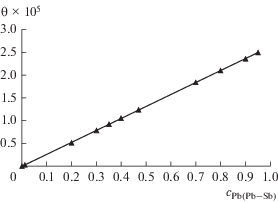
В результате термодинамической оценки разделения двойных сплавов Pb–Sb, содержащих, например, 20 мол. % свинца, коэффициенты разделения составили 5.2 × 104. Полученные данные свидетельствуют о термодинамической возможности электрохимического разделения сплавов свинца и сурьмы в хлоридном расплаве с использованием жидкометаллических электродов. В работе [6] показано, что при электролитическом рафинировании чернового свинца, содержащего 2.0 мас. % сурьмы был получен катодный свинец марки С1 по ГОСТ 3778–98, а на аноде содержание сурьмы при этом увеличилось до 34 мас. %. Это подтверждает термодинамические оценки.
ЗАКЛЮЧЕНИЕ
Методом ЭДС измерены равновесные потенциалы сурьмы в эквимолярном расплаве KCl–PbCl2 в интервале температур от 760 до 890 К для широкой области составов. Двумя методами установлено, что в исследованном диапазоне температур и концентраций трихлорида сурьмы в расплаве сурьма в электролите KCl–PbCl2 находится преимущественно в трехвалентном состоянии. В исследуемом расплаве рассчитаны условные стандартные потенциалы сурьмы и термодинамические характеристики процесса растворения трихлорида сурьмы. Проведена термодинамическая оценка разделения двойных сплавов Pb–Sb в широкой области концентраций компонентов в сплаве. Полученные результаты свидетельствуют о перспективности разработки технологии по переработке вторичного сырья, содержащего металлические свинец и сурьму, электролитическим способом в расплавленных хлоридах.
Список литературы
Борисоглебский, Ю.В., Галевский, Г.В., Минцис, М.Я., Сиразутдинов, Г.А. Металлургия алюминия, Новосибирск: Наука. Сибирская издательская фирма РАН. 1999. [Borisoglebskij, Yu.V., Galevskij, G.V., Mincis, M.Ya., and Sirazutdinov, G.A., Metallurgiya alyuminiya, Novosibirsk: Nauka, Sibirskaya izdatel’skaya firma RAN, 1999.]
Зайков, Ю.П., Шуров, Н.И., Суздальцев, А.В. Высокотемпературная электрохимия кальция. Екатеринбург: РИО УрО РАН, 2013. [Zajkov, Yu.P., Shurov, N.I., and Suzdal’cev, A.V., Vysokotemperaturnaya ehlektrohimiya kal’ciya, Ekaterinburg: RIO UrO RAN, 2013.]
Boyd, S. and Taylor, C., Chemical fundamentals and applications of molten salts, In: Molten Salt Reactors and Thorium Energy, Dolan, T.J., Ed., Amsterdam: Elsevier Science Ltd., 2017, p. 29. https://doi.org/10.1016/B978-0-08-101126-3.00003-8
Омельчук, А.А. Электрохимическое рафинирование тяжелых цветных металлов. Электрохимия. 2010. Т. 46. С. 723. [Omel’chuk, A.A., Electrorefining of Heavy Nonferrous Metals in Molten Electrolytes, Russ. J. Electrochem., 2010, vol. 46, p. 680.]
Омельчук, А.А. Тонкослойный электролиз в расплавленных электролитах. Электрохимия. 2007. Т. 43. С. 1060. [Omel’chuk, A.A., Thin-layered Electrolysis in Molten Electrolytes, Russ. J. Electrochem., 2007, vol. 43, p. 1060.]
Arkhipov, P., Zaykov, Yu., Khalimullina, Yu., and Kholkina, A., Electrolytic Refining of Lead Molten Chloride Electrolytes, Intern. J. Technol., 2017, vol. 8, p. 572.
Архипов, П.А., Зайков, Ю.П., Халимуллина, Ю.Р. Электролизер для тонкослойного рафинирования свинца в солевых расплавах. Пат. 2522920 (Россия), 2014. [Arkhipov, P.A., Zaykov, Yu.P., and Khalimullina, Yu.R., Electrolyzer for thin layer metallic lead electrolytic refining. Patent 2522920 (Russia), 2014.]
Делимарский, Ю.К., Марков, Б.Ф. Электрохимия расплавленных солей. М.: Металлургиздат. 1960. [Delimarskiy, Yu.K. and Markov, B.F. Electrochemistry of molten salts, M.: Metallurgizdat, 1960.]
Делимарский, Ю.К., Зарубицкий, О.Г. Электролитическое рафинирование тяжелых металлов в ионных расплавах. М.: Металлургия. 1975. [Delimarskiy, Yu.K. and Zarubitskiy, O.G., Electrolytic refining of heavy metals in ionic melts, M.: Metallurgy, 1975.]
Laitinen, H.A. and Lui, C.H., An Electromotive Force Series in Molten Lithium Chloride-Potassium Chloride Eutectic, J. Amer. Chem. Soc., 1958, vol. 80, p. 1015.
Барабошкин, А.Н. Электрокристаллизация металлов из расплавленных солей, М.: Наука, 1976. [Baraboshkin, A.N., Electrocrystallization of metals from molten salts, M.: Nauka, 1976.]
Смирнов, М.В. Электродные потенциалы в расплавленных хлоридах. М.: Наука. 1973. [Smirnov, M.V., Electrode potentials in chloride melts, M.: Nauka, 1973.]
Рабинович, В.А., Хавин, З.Я. Краткий химический справочник. Л.: Химия. 1977. [Rabinovich, V.A. and Khavin, Z.Ya., Short reference guide on chemistry, L: Khimiya, 1977.]
Зайков, Ю.П., Архипов, П.А., Плехнов, К.А., Ашихин, В.В., Халимуллина, Ю.Р. Термодинамические характеристики сплавов Pb–Sb. Изв. Вузов. Цветная металлургия. 2007. № 2. С. 11. [Zaikov, Yu.P., Arkhipov, P.A., Plekhanov, K.A., Ashikhin, V.V., and Khalimullina, Yu.R., Thermodynamic Characteristics of the Pb–Sb Alloys, Russ. J. Non-Ferrous Metals, 2007, vol. 48, p. 92.]
Лебедев, В.А. Избирательность жидкометаллических электродов в расплавленных галогенидах. Челябинск: Металлургия. Челябинское отделение. 1993. [Lebedev, V.A., Selectivity of liquid metal electrodes in molten halides, Chelyabinsk: Metallurgy, Chelyabinskaya Branch, 1993.]
Лантратов, М.Ф., Алабышев, А.Ф. Активность хлористого свинца в растворах с хлоридами щелочных и щелочноземельных металлов. Журн. прикл. химии. 1953. Т. 26. № 3. С. 263. [Lantratov, M.F. and Alabyshev, A.F., Activity of chlorine lead in alkali and alkali-earth metal chloride solutions, Russ. J. Appl. Chem., 1953, vol. 26, no. 3, p. 263.]
Халимуллина, Ю.Р., Зайков, Ю.П., Архипов, П.А., Ашихин, В.В., Скопов, Г.В., Холкина, А.С., Молчанова, Н.Г. Равновесные потенциалы сплавов Pb–Bi в расплаве KCl–PbCl2. Расплавы. 2010. № 5. С. 32.
Дополнительные материалы отсутствуют.