Электрохимия, 2020, T. 56, № 10, стр. 896-908
Углеродные нанотрубки, модифицированные кислород- и азотсодержащими группами, – перспективные катализаторы электровосстановления кислорода
В. А. Богдановская a, *, М. В. Радина a, О. В. Корчагин a, Н. А. Капустина a, Л. П. Казанский a
a Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Ленинский просп., 31, Россия
* E-mail: bogd@elchem.ac.ru
Поступила в редакцию 25.08.2019
После доработки 08.02.2020
Принята к публикации 20.02.2020
Аннотация
Реакция электровосстановления кислорода является ключевой в ряде важных в практическом отношении процессов и устройств. В связи с этим усилия исследователей направлены на создание катализаторов катодного восстановления О2, обеспечивающих эффективное восстановление кислорода и коррозионную устойчивость. В значительной степени этим требованиям отвечают углеродные нанотрубки (УНТ), подвергнутые модификации кислород- и азотсодержащими группами. Модифицирование поверхности УНТ этими группами обеспечивает значительное увеличение активности в реакции восстановления кислорода (РВК), что выражается в смещении потенциала полуволны на поляризационной кривой в положительную сторону на 0.40 В по сравнению с УНТ без обработки (кислый электролит). По активности в РВК модифицированные УНТ приближаются к коммерческому моноплатиновому катализатору (щелочной электролит). Стабильность модифицированных УНТ (по результатам тестирования методом циклирования потенциала) выше, по сравнению с нанотрубками без обработки. Полученные данные свидетельствует о перспективности применения модифицированных УНТ в качестве носителей для катодных катализаторов низкотемпературных водородо-воздушных топливных элементов (ТЭ). Как собственно катализаторы, модифицированные УНТ могут быть использованы в прямых щелочных спиртово-воздушных ТЭ и металл-воздушных источниках тока типа литий–воздух. Высказано предположение, что целенаправленный синтез заданного типа и количества азотсодержащих групп можно осуществить после предварительной модификации УНТ кислородсодержащими группами.
ВВЕДЕНИЕ
В настоящее время при разработке каталитических систем, в первую очередь для реакции электровосстановления кислорода, которая является лимитирующей в широком круге электрохимических устройств, значительное внимание уделяется углеродным материалам (УМ). Наиболее интенсивно исследуются УНТ, которые благодаря уникальным свойствам в ряде случаев могут выступать как собственно катализаторы и широко применяются в качестве носителя. От свойств носителя в значительной степени зависит морфология и структура катализатора, его активность, а также устойчивость к деградации системы в целом. УНТ привлекательны для создания безметалльных катализаторов и использования их в качестве носителя металлических наночастиц, поскольку они имеют свободные π-электроны. Однако требуется дополнительная обработка (функционализация и/или допирование адатомами), модифицирующая электронную структуру УНТ, которая облегчает перенос электрона и ускоряет реакцию электровосстановления кислорода [1, 2]. Наличие на поверхности УНТ различных групп и дефектов обуславливает особенности их электрохимических свойств. В работах [1–4 и ссылки в них] представлены данные, показывающие, что активность УНТ связана с увеличением электронной плотности на sp2-уровне при модифицировании богатым электронами азотом. При этом повышается электропроводность УНТ, что важно для электрокатализа. Высокая активность УНТ, обогащенных кислородсодержащими группами, сохраняется в водных [3–6] и апротонных электролитах [7]. В последнем случае повышается электрокаталитическая активность как в реакции электровосстановления, так и выделения кислорода.
В зависимости от реагента, температуры и времени обработки могут быть получены различные группы и их количество. УНТ с превалирующим содержанием карбоксильных групп [4, 8] демонстрируют наиболее высокую активность в РВК. По активности в этой реакции, селективности процесса в отношении восстановления кислорода до воды (число переносимых электронов n = 4), а также устойчивости к деградации, нанотрубки, содержащие различные группы на поверхности располагаются в ряд: УНТCOOH > УНТOH > ${\text{УН}}{{{\text{Т}}}_{{{\text{N}}{{{\text{H}}}_{{\text{2}}}}}}}$ [8]. В этой же работе показано, что при увеличении содержания карбоксильных групп активность в РВК возрастает в большей степени в щелочных электролитах. УНТ, содержащие карбоксильные группы, имеют высокую активность в РВК, что является результатом благоприятной системы сопряжения между π-электронами функциональных групп и электронами на sp2-орбитали УНТ [4, 8]. Экспериментальные результаты и теоретическое обоснование эффекта увеличения активности в реакции восстановления О2 при наличии на поверхности УНТ кислородсодержащих групп представлено в работах [1–3, 8]. Функциональные группы обеспечивают развитую поверхность и необходимы для присоединения различных модификаторов (наночастиц металлической фазы, оксидов и др.) [9, 10]. Показано, что функционализация УНТ приводит к гидрофилизации поверхности, при этом суммарная удельная поверхность по октану [6] уменьшается за счет перекрывания внутренних каналов кислородсодержащими группами, образовавшимися на концах нанотрубок.
Наряду с функционализацией, обеспечивающей образование кислородсодержащих групп, рассматривается также возможность повышения активности и устойчивости к деградации за счет введения в структуру нанотрубок атомов азота, серы, бора и фосфора [11, 12]. Для допирования азотом, как правило, используют два метода. Первый – допирование УНТ во время их синтеза посредством дугового разряда или химического осаждения из паровой фазы (ХОП). Второй путь – допирование УНТ, синтезированных ранее, путем обработки прекурсорами с большим содержанием азота (мочевина, меламин, пиридин, аммиак и др.) [12–15 и ссылки в них]. Взаимосвязь количества и типа образующегося при допировании азота с количеством и природой кислородсодержащих групп на поверхности УНТ рассмотрена в [8]. Показано, что С=О и –СООН группы способствуют преимущественному получению азота в пиридиновой форме. Группы –ОН и –С(О)С облегчают образование графитового азота. В табл. 1 представлены некоторые кислород- и азотсодержащие группы, которые образуются в процессе функционализации и/или допирования УМ, и соответствующие им величины энергии связи электронов.
Таблица 1.
| Группы, содержащие кислород | Хинонная, карбонильная | Карбоксильная | Фенольная | Нитритная, вода |
|---|---|---|---|---|
| Энергия связи, эВ | 530.7, 531.4 | 532.4 | 533.7 | 533.2, 536.0 |
| Группы, содержащие азот | Пиридиновый, аминный | Пиррольный | Кватернальный (графитовый) | Нитрогруппа, амидный |
| Энергия связи, эВ | 399.4 | 400.5 | 401.3 | 403–404, 406.1 |
Близкие по размерам к атомам углерода атомы азота достаточно легко замещают атомы углерода в кристаллической решетке [11, 16]. Когда азот включен в углеродную решетку, π-электроны атомов углерода сопряжены с неподеленной парой электронов атома азота [15, 16]. В этом случае азот выступает донором электронов по отношению к углеродному материалу [17]. Как правило, на поверхности УМ азот представлен широким спектром форм (табл. 1), из которых пиридиновый и графитовый наиболее активны в РВК в щелочной среде, в отличие от пиррольного азота [12, 18, 19].
Пока не существует надежного способа допирования только одним типом азота, и нет возможности достоверно оценить влияние каждого из них на активность и стабильность, в результате чего приводятся противоречивые данные [11, 19, 20]. Предпочтительной является точка зрения, что на образующуюся при допировании форму азота влияет количество и тип кислородсодержащих групп, предварительно полученных на поверхности УМ. В работе [21] показано, что образованию пиридиновой формы азота способствуют карбонильные и карбоксильные группы, а графитовой формы азота – гидроксильные и эпоксидные.
Значительно меньше внимания уделяют вопросам деградации УНТ, подвергнутых функционализации и/или допированию. Не установлена степень допирования, достаточная для повышения активности и стабильности при сохранении структуры. Как правило, во внимание не принимают также дефекты на поверхности УНТ, которые могут возникать в процессе жестких условий обработки. Можно только отметить работы [22, 23], в которых предпринята попытка оценить вклад дефектности структуры в характеристики УМ и показано, что атомы азота как правило закрепляются на концевых дефектах УНТ [24].
В данной работе исследовано влияние природы, количества и соотношения кислород- и азотсодержащих групп при их совместном присутствии на поверхности УНТ на активность в РВК и стабильность в кислых и щелочных электролитах. Проведен анализ полученных результатов с точки зрения перспективности применения УНТ, модифицированных кислородом и азотом, как в качестве катализаторов, так и носителей при синтезе металлсодержащих катодных каталитических систем для ТЭ и металл-воздушных источников тока.
МЕТОДИКА ЭКСПЕРИМЕНТА
Материалы. В работе использовали УНТ (марка УНТ-Таунит М производства “ООО НаноТехЦентр”, Тамбов, Россия), в дальнейшем обозначенные как УНТ. Реактивы для допирования азотом (меламин и мочевина) использовали без дополнительной очистки. Электролиты готовили на основе деионизованной воды и Н2SO4 (ос. ч.) или КOH (ос. ч.).
Методики функционализации УНТ. Исходные нанотрубки (2 г) смешивали с 250 мл пероксида водорода в круглодонной колбе с обратным холодильником и нагревали в течение 5 ч при 60°С. Затем раствор декантировали, а осадок промывали несколько раз деионизованной водой и сушили в вакуумном шкафу в течение ночи при температуре 80°С. В результате такой обработки на поверхности отмечается увеличение числа кислородсодержащих групп.
Второй метод функционализации исходных УНТ включал обработку в концентрированной HNO3. УНТ в количестве 500 мг смешивали с 50 мл HNO3. Смесь медленно нагревали до 120°С и выдерживали в течение часа. После охлаждения до комнатной температуры смесь отмывали деионизованной водой до нейтрального значения рН и сушили в вакуумном шкафу при 80°С.
Допирование УНТ азотом осуществляли с использованием прекурсоров: мочевины 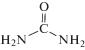 или меламина
или меламина 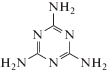 , значительно (в 3 раза) отличающихся по содержанию азота, по методике подобной, представленной
в работах [24–28]. Предварительно обработанные УНТ (как показано выше) в количестве 0.6 г размалывали
на шаровой мельнице с определенным количеством прекурсора, содержащего азот (1 ч при
800 об/мин). Затем полученную смесь подвергали термической обработке в атмосфере аргона
при 600°С и выдерживали при этой температуре в течение 1 ч. Изготовлены образцы при
отношении УНТ и прекурсора: 1 : 0.7 при использовании 0.4 г меламина или 1 : 0.8 в
случае 0.5 г мочевины.
, значительно (в 3 раза) отличающихся по содержанию азота, по методике подобной, представленной
в работах [24–28]. Предварительно обработанные УНТ (как показано выше) в количестве 0.6 г размалывали
на шаровой мельнице с определенным количеством прекурсора, содержащего азот (1 ч при
800 об/мин). Затем полученную смесь подвергали термической обработке в атмосфере аргона
при 600°С и выдерживали при этой температуре в течение 1 ч. Изготовлены образцы при
отношении УНТ и прекурсора: 1 : 0.7 при использовании 0.4 г меламина или 1 : 0.8 в
случае 0.5 г мочевины.
Электрохимические измерения. Измерения проводили в трехэлектродной электрохимической ячейке с использованием потенциостата IPC-Pro-L (ООО “Вольта”, г. Санкт-Петербург, Россия). Измерения проводили на дисковом электроде из углеситалла (УС) площадью 0.126 см2, на который наносили 150 мкг/см2 углеродного материала. Для нанесения на электрод готовили суспензию дисперсного УМ в изопропиловом спирте. С этой целью 2 мг материала помещали в пробирку объемом 2 мл с плотно защелкивающейся крышкой (эппендорф), добавляли 0.5 мл изопропилового спирта и 0.5 мл спирта, содержащего 1 мкл 5%-ного раствора нафиона в смеси низкомолекулярных алифатических спиртов (Ion Power, Inc.). Смесь обрабатывали ультразвуком в течение 30 мин.
Оценку электрохимически активной поверхности (Sэап) УМ проводили по величине заряда (в виде Кл/г или Кл/см2), пошедшего на заряжение поверхности материала активного слоя, нанесенного на дисковый электрод, путем интегрирования площади вольт-амперной кривой (ЦВА), которую записывали в 0.5 М H2SO4 или 0.1 М КОН при комнатной температуре в атмосфере аргона при скорости изменения потенциала 0.10 В/с.
Поляризационные кривые электровосстановления кислорода записывали на дисковом электроде при различных скоростях вращения в потенциодинамическом режиме (0.010 В/с). Активность в РВК оценивали по величине потенциала полуволны на поляризационной кривой.
Экспресс-тестирование устойчивости исследуемых УНТ. Для определения коррозионной устойчивости модифицированных УНТ использовали метод ускоренного тестирования, которое заключалось в циклировании потенциала электрода в интервале 0.6–1.3 В (о. в. э) при скорости развертки потенциала 0.10 В/с в течение 1500 циклов. После каждых 500 циклов записывали ЦВА в атмосфере аргона, рассчитывали по ней величину заряда, по которой судили о электрохимически активной поверхности (SЭАП), и поляризационную кривую в атмосфере кислорода, по которой судили об активности в РВК. В качестве электролита при тестировании использовали 0.5 М H2SO4. Циклирование проводили в инертной атмосфере при комнатной температуре.
РФЭ-спектроскопия (РФЭС). Для качественного и количественного анализа состава поверхности УНТ использовали рентгенофотоэлектронный спектрометр OMICRON ESCA+ (ФРГ). Давление в камере анализатора не превышало 8 × 10–8 мбар. Источником излучения служил Al-анод (энергия излучения 1486.6 эВ и мощность 250 Вт). Энергия пропускания анализатора составляла 20 эВ. Дисперсные образцы наносили на одну сторону двусторонней липкой ленты, которую помещали на стальной держатель. Положение РФЭ-пиков стандартизировали по пику C1s, энергия связи (Есв) которого устанавливалась равной 284.4 эВ, что соответствует углероду, находящемуся в sp2-гибридизации. Разложение спектров на составляющие проводили после вычитания фона, определенного по методу Ширли [29]. Положение пика определяли с точностью ±0.1 эВ. Соотношения элементов в области пика вычисляли с учетом сечений фотоионизации σ соответствующих электронных оболочек, используя интегральные интенсивности под пиками [30]. Для определения количественного и качественного состава образцов анализировали спектры C1s, O1s, N1s. Спектры обрабатывали при использовании программы Unifit© 2009.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Результаты исследований методом РФЭС. Для повышения активности УНТ как правило проводят функционализацию их поверхности, в результате которой образуются кислородсодержащие группы, обеспечивающие увеличение SЭАП и активности в РВК. В данной работе использовали два метода функционализации: мягкий (Н2О2) и жесткий (НNO3).
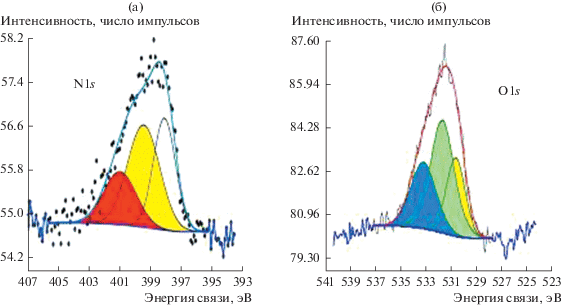
В РФЭ-спектрах поверхности исходных УНТ содержится ~0.46 ат. % (преимущественно с энергией связи Есв = 533.7 эВ) кислорода. После обработки в Н2О2 доля кислородсодержащих групп на поверхности ${\text{УН}}{{{\text{Т}}}_{{{{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}}}}$ растет и составляет 1.2 ат. % (табл. 2). В РФЭ-спектре поверхности ${\text{УН}}{{{\text{Т}}}_{{{\text{HN}}{{{\text{O}}}_{{\text{3}}}}}}}$ уже на стадии функционализации при использовании азотной кислоты в незначительном количестве наблюдаются и азотсодержащие группы (рис. 1а). При этом практически на порядок увеличивается количество кислорода по сравнению с его содержанием на поверхности исходных УНТ. Спектр N1s компонента, максимум которого находится при 399.9 эВ, можно отнести к азоту аминного типа, но большая часть (основной пик) соответствует нитрогруппе. В спектре O1s можно выделить три основных типа кислородсодержащих групп: С=О, С–О–С, СООН (рис. 1б, табл. 2).
Таблица 2.
Характеристики поверхности по данным РФЭС для УНТ, подвергнутых различным обработкам. Приведены величины энергии связи электронов элемента в максимуме (эВ) и его содержание на поверхности в атомных процентах (в скобках)
| Группы | Н2О2 | H2O2 + + мочевина | Н2О2 + + меламин | HNO3 | HNO3 + + мочевина | HNO3 + + меламин |
|---|---|---|---|---|---|---|
| Углерод | ||||||
| С, sp2 | 284.4 | 284.4 | 284.4 | 284.4 | 284.4 | 284.4 |
| π−π* | 291(3.3) | 291.3 (4.0) | 291.2 (4.3) | 291.2 (4.5) | 290.8(5.0) | 291.0 (3.1) |
| Кислородсодержащие группы | ||||||
| Карбонильная | – | 530.7 (0.4) | 530.8 (0.4) | 531.4 (1.2) | 531.0 (0.5) | 531.0 (0.2) |
| Карбоксильная | 532.2(0.2) | 531.8 (0.5) | 531.9(0.4) | 532.9 (2.9) | 532.5 (1.0) | 532.3 (0.3) |
| Гидроксильные, эпоксидные | 533.5(0.9) 535.3(0.1) | 533.2 (0.4) | 533.4 (0.2) | 535.4 (0.5) | 533.8 (0.5) | 533.6 (0.2) |
| Азотсодержащие группы | ||||||
| Пиридиновый азот | – | 398.4 (0.4) | 398.6 (0.5) | 398.7 (0.8) | 398.3 (1.3) | |
| Аминный азот | – | 399.8 (0.4) | 399.7 (0.4) | 400.0 (0.3) | 400.2 (0.6) | 399.6 (1.1) |
| Кватернальный, графитовый азот | – | 401.4 (0.2) | 401.1 (0.2) | 401.3 (0.1) | 401.1 (0.5) | |
| Закись азота | – | 403.6 (0.1) | 406.0 (0.5) | 403.8 (0.2) | ||
| ΣО | 1.2 | 1.3 | 1.0 | 4.6 | 2.0 | 0.7 |
| ΣN | – | 1.0 | 1.2 | 0.8 | 1.5 | 3.1 |
* Величины энергии связи электронов, несколько отличаются от представленных в табл. 1, что связано с количеством групп и их совместным присутствием.
Рис. 1.
РФЭ-спектры: а – азота и б – кислорода, полученные на ${\text{УН}}{{{\text{Т}}}_{{{\text{НN}}{{{\text{O}}}_{{\text{3}}}}}}}{\text{.}}$
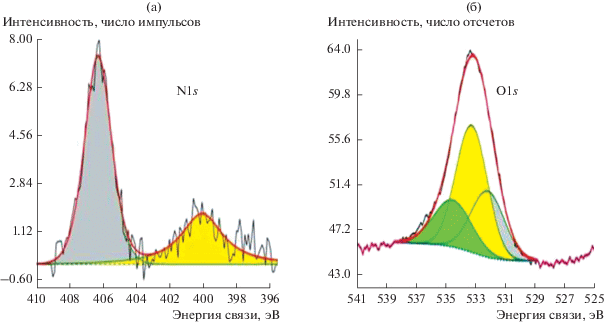
Таким образом, анализ РФЭ-спектров образцов, обработанных в Н2О2 или HNO3, показывает, что более высокое в процентном отношении количество кислорода в виде кислородсодержащих групп образуется после обработки азотной кислотой. При этом группы при разных обработках отличаются как по количеству, так и составу (табл. 2).
Допирование азотом предварительно функционализованных УНТ при использовании в качестве прекурсора мочевины или меламина приводит к накоплению азота на поверхности. При этом в спектрах N1s и О1s электронов (рис. 2, 3) можно выделить ряд максимумов, характеризующих различные группы. Максимум величины энергии связи электронов и их атомная доля на поверхности для групп, содержащих кислород и азот, представлены в табл. 2. Следует отметить, что количество кислорода на поверхности УНТ после допирования азотом снижается (табл. 2). На основании этого можно предположить, что часть кислорода замещается на азот. Уменьшение количества кислородсодержащих групп в большей степени выражено при допировании азотом УНТ, обработанных в кислоте (${\text{УН}}{{{\text{Т}}}_{{{\text{HN}}{{{\text{O}}}_{3}}}}}$), что согласуется с данными работы [19]. Наиболее высокое содержание азота в виде групп различных типов (табл. 2) наблюдается при допировании ${\text{УН}}{{{\text{Т}}}_{{{\text{HN}}{{{\text{O}}}_{{\text{3}}}}}}}$ меламином. Как следует из рис. 2 и 3, количества кислород- и азотсодержащих групп на ${\text{УН}}{{{\text{Т}}}_{{{{{\text{Н}}}_{{\text{2}}}}{{{\text{О}}}_{{\text{2}}}}}}}$ после допирования азотом (как при использовании мочевины, так и меламина) близки по величине, в то время как доля кислорода в ряду ${\text{УН}}{{{\text{Т}}}_{{{\text{HN}}{{{\text{O}}}_{{\text{3}}}}}}}$ > ${\text{УН}}{{{\text{Т}}}_{{{\text{HN}}{{{\text{O}}}_{{\text{3}}}} + {\text{моч}}}}}$ > ${\text{УН}}{{{\text{Т}}}_{{{\text{HN}}{{{\text{O}}}_{{\text{3}}}} + {\text{мел}}}}}$ уменьшается, а доля азота на поверхности увеличивается (табл. 2). Следовательно, при использовани для допирования азотом ${\text{УН}}{{{\text{Т}}}_{{{{{\text{Н}}}_{{\text{2}}}}{{{\text{О}}}_{{\text{2}}}}}}},$ содержащих на поверхности небольшое количество кислорода (1.2%), приводит к тому, что содержание азота в прекурсоре (мочевина или меламин) не оказывает существенного влияния как на количество образующихся азотсодержащих групп, так и на снижение доли кислородсодержащих групп, в отличие от ${\text{УН}}{{{\text{Т}}}_{{{\text{HN}}{{{\text{O}}}_{{\text{3}}}}}}}.$ Этот результат указывает на необходимость синтеза на поверхности УНТ кислородсодержащих групп для последующего допирования их азотом.
Рис. 2.
РФЭ-спектры: а – азота и б – кислорода, полученные на ${\text{УН}}{{{\text{Т}}}_{{{\text{НN}}{{{\text{O}}}_{{\text{3}}}}}}}$ после допирования азотом с использованием меламина.
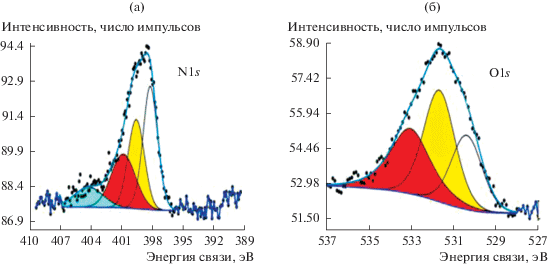
Рис. 3.
РФЭ-спектры: а – азота и б – кислорода, полученные на ${\text{УН}}{{{\text{Т}}}_{{{{{\text{Н}}}_{2}}{{{\text{O}}}_{{\text{2}}}}}}}$ после допирования азотом с использованием меламина.
Найти корреляцию между количеством азота и кислорода с интенсивностью пика π–π*-взаимодействий, характеризующих дефектность структуры, как это было сделано в работе [31], не удалось. Требуются дополнительные исследования для установления природы дефектности структуры и ее влияния на интенсивность π–π*-взаимодействий.
На основании результатов измерений РФЭ-спектров (табл. 2) и литературных данных [31–33] можно предположить, что наиболее активными в РВК будут нанотрубки с наибольшим содержанием кислород- и/или азотсодержащих групп. Для установления влияния природы групп и их количества на величину электрохимически активной поверхности, активность в РВК и устойчивость к деградации были проведены исследования электрохимических свойств модифицированных УНТ.
Электрохимические характеристики УНТ, подвергнутых функционализации и допированию азотом. ЦВА, приведенные на рис. 4, получены в инертной атмосфере на дисковом электроде с нанесенным тонким слоем различных УНТ. Видно, что на модифицированных УНТ величина поляризационной емкости больше по сравнению с поляризационной емкостью на УНТ без обработки. Кроме того, отчетливо выражены анодный и катодный максимумы (рис. 4а, кривая 2), которые характеризуют редокс-превращения кислородсодержащих групп, образовавшихся на поверхности после жесткой обработки в HNO3 и их большом суммарном количестве (4.6 ат. %. табл. 2). Допированные азотом ${\text{УН}}{{{\text{Т}}}_{{{\text{HN}}{{{\text{O}}}_{{\text{3}}}}}}}$ (рис. 4а), кривые 3, 4) имеют близкие величины поляризационной емкости (табл. 3) и качественно близки. Обработка в пероксиде водорода приводит к увеличению кислородсодержащих групп (1.2 ат. %) на УНТ без обработки (~0.46 ат. %) (табл. 2). Вероятность образования такой системы обусловлена включением в углеродную структуру атомов кислорода и формированием дефектов. В совокупности, несмотря на увеличение доли атомов кислорода в ${\text{УН}}{{{\text{Т}}}_{{{{{\text{H}}}_{2}}{{{\text{O}}}_{{\text{2}}}}}}},$ их поляризационная емкость (рис. 4б, кривая 2) значительно ниже поляризационной емкости нанотрубок, обработанных азотной кислотой (рис. 4а, кривая 2 и табл. 3). Представленные данные позволяют сделать вывод, что величина поляризационной емкости изменяется после функционализации, что связано с образованием определенного количества и типа кислородсодержащих групп. В первую очередь это относится к карбоксильным группам. Наличие карбоксильных групп приводит к увеличению поляризационной емкости и активности в РВК и способствует синтезу пиридинового азота, что согласуется с данными работы [19, 21]. Действительно, доля кислородсодержащих групп существенно больше на ${\text{УН}}{{{\text{Т}}}_{{{\text{HN}}{{{\text{O}}}_{{\text{3}}}}}}},$ по сравнению с ${\text{УН}}{{{\text{Т}}}_{{{{{\text{H}}}_{2}}{{{\text{O}}}_{{\text{2}}}}}}}$ (табл. 2). Следует также отметить, что при окислении Н2О2 образуется только незначительное количество (0.2 ат. %) карбоксильных групп (Есв = 532.2 эВ), ответственных за увеличение поляризационной емкости, как показано в работе [33].
Рис. 4.
ЦВА на дисковом электроде с нанесенными УНТ (150 мкг/см2): (а) УНТисх – 1, ${\text{УН}}{{{\text{Т}}}_{{{\text{НN}}{{{\text{O}}}_{{\text{3}}}}}}}$ – 2, ${\text{УН}}{{{\text{Т}}}_{{{\text{НN}}{{{\text{O}}}_{{\text{3}}}} + {\text{моч}}}}}$ – 3, ${\text{УН}}{{{\text{Т}}}_{{{\text{НN}}{{{\text{O}}}_{{\text{3}}}} + {\text{мел}}}}}$ – 4; (б) УНТисх –1, ${\text{УН}}{{{\text{Т}}}_{{{{{\text{Н}}}_{{\text{2}}}}{{{\text{О}}}_{{\text{2}}}}}}}$ – 2, ${\text{УН}}{{{\text{Т}}}_{{{{{\text{Н}}}_{{\text{2}}}}{{{\text{О}}}_{{\text{2}}}} + {\text{моч}}}}}$ – 3, ${\text{УН}}{{{\text{Т}}}_{{{{{\text{Н}}}_{{\text{2}}}}{{{\text{О}}}_{{\text{2}}}} + {\text{мел}}}}}$ – 4. 0.5 М Н2SO4, атмосфера Ar, 25°С, 0.10 В/с.
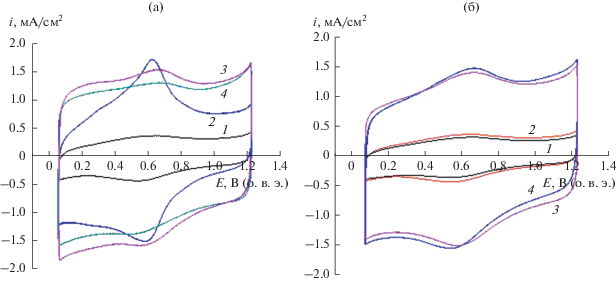
Таблица 3.
Электрохимические характеристики УНТисх и после модифицирования. 0.5 М H2SO4, на электроде с УНТ (0.150 мг/см2)
| Углеродные нанотрубки | 1/2(Qa + Qк), Кл/г | Ест, В | j, А/г (0.00 В (о. в. э.)) | j, А/г (0.10 В (о. в. э.)) |
|---|---|---|---|---|
| УНТисх | ||||
| УНТисх | 20.3 | 0.68 | 4.35 | 1.9 |
| УНТисх +моч* | 23.5 | 0.71 | 11.0 | 9.5 |
| $УН{{Т}_{{{{H}_{2}}{{O}_{2}}}}}$ | ||||
| ${\text{УН}}{{{\text{Т}}}_{{{{{\text{Н}}}_{{\text{2}}}}{{{\text{О}}}_{{\text{2}}}}}}}$ | 21.5 | 0.75 | 4.25 | 3.05 |
| ${\text{УН}}{{{\text{Т}}}_{{{{{\text{Н}}}_{{\text{2}}}}{{{\text{О}}}_{{\text{2}}}} + {\text{моч}}}}}$ | 82.5 | 0.95 | 16.6 | 15.0 |
| ${\text{УН}}{{{\text{Т}}}_{{{{{\text{Н}}}_{{\text{2}}}}{{{\text{О}}}_{{\text{2}}}} + {\text{мел}}}}}$ | 80.5 | 0.90 | 17.3 | 16.1 |
| $УН{{Т}_{{{{H}_{2}}N{{O}_{3}}}}}$ | ||||
| ${\text{УН}}{{{\text{Т}}}_{{{\text{НN}}{{{\text{O}}}_{{\text{3}}}}}}}$ | 65.2 | 0.72 | 12.1 | 8.7 |
| ${\text{УН}}{{{\text{Т}}}_{{{\text{НN}}{{{\text{O}}}_{{\text{3}}}} + {\text{моч}}}}}$ | 87.0 | 0.95 | 16.6 | 15.0 |
| ${\text{УН}}{{{\text{Т}}}_{{{\text{НN}}{{{\text{O}}}_{{\text{3}}}} + {\text{мел}}}}}$ | 82.5 | 0.87 | 16.8 | 15.2 |
Допирование азотом приводит к дальнейшему увеличению поляризационной емкости характеризующей поверхность УНТ. Изменяется так же тип и количество кислородсодержащих групп (табл. 2 и 3). В результате допирования ${\text{УН}}{{{\text{Т}}}_{{{\text{HN}}{{{\text{O}}}_{{\text{3}}}}}}}$ азотом при использовании меламина формируются группы, содержащие азот пиридинового типа, который проявляет высокую каталитическую активность в отношении РВК [12]. Если оценивать влияние количества кислород- и азотсодержащих групп при их совместном присутствии на величину поляризационной емкости (приведена в скобках по табл. 3) и расположить УНТ в порядке уменьшения количества кислородсодержащих групп то получим ряд, ат. %: 2.0 > 1.3 > 1.0 > 0.7 (табл. 2), соответствующий величине, характеризующей электрохимически активную поверхность, Кл/г: ${\text{УН}}{{{\text{Т}}}_{{{\text{HN}}{{{\text{O}}}_{{\text{3}}}} + {\text{моч}}}}}$(87.0) > ${\text{УН}}{{{\text{Т}}}_{{{{{\text{H}}}_{2}}{{{\text{O}}}_{{\text{2}}}} + {\text{мел}}}}}$(82.5) ≥ ≥ ${\text{УН}}{{{\text{Т}}}_{{{{{\text{H}}}_{2}}{{{\text{O}}}_{{\text{2}}}} + {\text{моч}}}}}$ (82.5) > ${\text{УН}}{{{\text{Т}}}_{{{\text{HN}}{{{\text{O}}}_{{\text{3}}}} + {\text{мел}}}}}$(80.5) (табл. 3). По величине доли азотсодержащих групп исследованные УНТ располагаются в другой последовательности, ат. %: 3.1 > 1.5 > 1.1 > 1.0 (табл. 2). При этом не наблюдается пропорциональной зависимости величины поляризационной емкости от содержания азота. При содержании азота 3.1 ат. % величина поляризационной емкости составляет 82.5, а для заполнения 0.98 эта величина достигает 87.0 (табл. 3). Вероятно, поляризационная емкость в значительной степени определяется не общим содержанием азота, а количеством групп определенного типа. Следует также отметить, что чем больше кислородсодержащих групп на поверхности УНТ, тем больше образуется азотсодержащих групп. Это свидетельствует о важной роли функционализации, которая обеспечивает образование кислородсодержащих групп на поверхности УНТ. Таким образом нельзя утверждать, что существует прямая корреляция между количеством кислород- и азотсодержащих групп и величиной поляризационной емкости, характеризующей величину SЭАП. Можно отметить, что модифицирование УНТ кислород- и азотсодержащими группами при их совместном присутствии способствует значительному увеличению электрохимически активной поверхности и активности в РВК (табл. 3).
На рис. 5 представлены поляризационные кривые электровосстановления кислорода на УНТ после различных обработок. Видно, что функционализация, обеспечивающая образование кислородсодержащих групп на поверхности, приводит к увеличению активности только УНТ, обработанных азотной кислотой (рис. 5а и 5б, кривая 3). Активность (рис. 5б, кривая 2), и поляризационная емкость (рис. 4б, кривая 2) после обработки пероксидом водорода практически не изменяется по сравнению с УНТ без обработки (для сравнения на рис. 5б приведены поляризационные кривые на ${\text{УН}}{{{\text{Т}}}_{{{{{\text{H}}}_{2}}{{{\text{O}}}_{{\text{2}}}}}}}$ (кривая 2) и на ${\text{УН}}{{{\text{Т}}}_{{{\text{HN}}{{{\text{O}}}_{{\text{3}}}}}}}$ (кривая 3)).
Рис. 5.
Поляризационные кривые электровосстановления кислорода на электроде с нанесенными УНТ (0.150 мг/см2). Вращающийся дисковый электрод: (а) УНТисх. – 1, УНТисх + моч. – 2, ${\text{УН}}{{{\text{Т}}}_{{{\text{НN}}{{{\text{O}}}_{{\text{3}}}}}}}$ – 3, ${\text{УН}}{{{\text{Т}}}_{{{\text{НN}}{{{\text{O}}}_{{\text{3}}}} + {\text{моч}}}}}$ – 4, ${\text{УН}}{{{\text{Т}}}_{{{\text{НN}}{{{\text{O}}}_{{\text{3}}}} + {\text{мел}}}}}$ – 5; (б) УНТисх – 1, ${\text{УН}}{{{\text{Т}}}_{{{{{\text{Н}}}_{{\text{2}}}}{{{\text{О}}}_{{\text{2}}}}}}}$ – 2, ${\text{УН}}{{{\text{Т}}}_{{{\text{НN}}{{{\text{O}}}_{{\text{3}}}}}}}$ – 3, 3' (980 об/мин), 3" (650 об/мин), ${\text{УН}}{{{\text{Т}}}_{{{{{\text{Н}}}_{{\text{2}}}}{{{\text{О}}}_{{\text{2}}}} + {\text{моч}}}}}$ – 4, ${\text{УН}}{{{\text{Т}}}_{{{{{\text{Н}}}_{{\text{2}}}}{{{\text{О}}}_{{\text{2}}}} + {\text{мел}}}}}$ – 5. 0.5 М Н2SO4, атмосфера О2, 25°С, 0.010 В/с. Кривые 1–5 – 1500 об/мин.
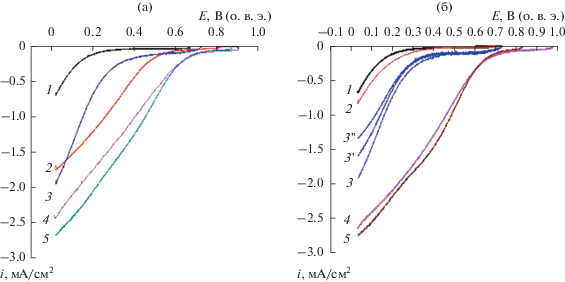
Допирование азотом приводит к увеличению активности в РВК (рис. 5а и 5б). Следует отметить, что при допировании азотом УНТисх их активность увеличивается (рис. 5а, кривая 2), но в меньшей степени, чем активность допированных азотом УНТ после предварительной функционализации (табл. 3). Анализ полученных данных свидетельствует о том, что увеличение активности обусловлено увеличением SЭАП благодаря функционализации и наблюдается в ряду: УНТисх < < ${\text{УН}}{{{\text{Т}}}_{{{{{\text{H}}}_{2}}{{{\text{O}}}_{{\text{2}}}}}}}$ < ${\text{УН}}{{{\text{Т}}}_{{{\text{HN}}{{{\text{O}}}_{{\text{3}}}}}}}$ при активности, А/г: 1.9, 3.5 и 8.7, поверхность изменяется от 20.3 до 21.5 и 65.2 Кл/г соответственно (табл. 3). Отклонение активности при Е = 0.10 В для допированных азотом УНТ от среднего значения не превышает ±3%, что укладывается в погрешность при проведении измерений. Следует отметить, что близкие характеристики УНТ, модифицированных кислородом и азотом (табл. 3), наблюдаются при отношении количества кислородсодержащих групп к азотсодержащим близком к 1.3 и не зависят от суммарной доли кислорода и азота на поверхности при измерениях в кислом электролите. На поляризационных кривых электровосстановления кислорода для всех исследованных УНТ в кислом электролите наблюдается только слабая зависимость от скорости вращения электрода (в качестве примера на рис. 5б) приведены данные при различных скоростях вращения электрода, кривые 3, 3 ', 3 '') и отсутствует площадка предельного диффузионного тока. Допирование поверхности УНТ меламином предпочтительно в силу образования большего количества пиридинового и графитового типа азота, проявляющего наиболее высокую активность в отношении РВК, как показано в работах [12, 34, 35]. Следует также отметить, что допирование азотом оказывает большее влияние на увеличение активности и поверхности, если УНТ были предварительно подвергнуты функционализации, в результате которой на поверхности образовались кислородсодержащие группы (рис. 5, сравнение кривой 2 и кривых 4 и 5).
Согласно данным, представленным в табл. 3, видно, что кислород и азотсодержащие группы оказывают различное влияние на величину SЭАП и активность в РВК в кислых электролитах. Вероятно, при функционализации повышение активности достигается за счет увеличения поверхности, а допирование азотом обеспечивает рост поверхности и ускорение РВК (рис. 5а, кривая 2) и эти характеристики значительно ниже, чем у УНТ с кислород- и азотсодержащими группами на поверхности (сравнение кривой 2 и кривых 4 и 5 на рис. 5а). Однако активность модифицированных УНТ в этих условиях остается значительно ниже, чем у платиносодержащих катализаторов. В связи с этим УНТ, модифицированные кислородом и азотом могут рассматриваться только в качестве носителей при создании катализатора РВК для кислых сред в низкотемпературных ТЭ.
Электрохимические характеристики УНТ в щелочной среде. В ряде работ [35–41] было показано, что наибольшую активность допированные азотом УНТ проявляют в щелочных средах. В связи с этим модифицированные кислородом и азотом УНТ были испытаны в щелочном электролите.
Качественно ЦВА на исходных и модифицированных нанотрубках близки. Различия относятся к величине поляризационной емкости (рис. 6а). Функционализация и допирование азотом, как и в кислом электролите, приводят к увеличению поляризационной емкости. По величине Sэап в кислом (табл. 3) и щелочном (рис. 6а) электролитах исследуемые углеродные материалы располагаются в ряд: ${\text{УН}}{{{\text{Т}}}_{{{{{\text{Н}}}_{{\text{2}}}}{{{\text{О}}}_{{\text{2}}}} + {\text{моч}}}}}$ > ${\text{УН}}{{{\text{Т}}}_{{{\text{НN}}{{{\text{O}}}_{{\text{3}}}} + {\text{моч}}}}}$ > ${\text{УН}}{{{\text{Т}}}_{{{\text{НN}}{{{\text{O}}}_{{\text{3}}}} + {\text{мел}}}}}$ > > ${\text{УН}}{{{\text{Т}}}_{{{{{\text{Н}}}_{{\text{2}}}}{{{\text{О}}}_{{\text{2}}}} + {\text{мел}}}}}$ > ${\text{УН}}{{{\text{Т}}}_{{{\text{НN}}{{{\text{O}}}_{{\text{3}}}}}}}$ > ${\text{УН}}{{{\text{Т}}}_{{{{{\text{Н}}}_{{\text{2}}}}{{{\text{О}}}_{{\text{2}}}}}}}.$
Рис. 6.
ЦВА и поляризационные кривые электровосстановления O2 на электроде с нанесенными УНТ (150 мкг/см2), 0.1 М KOH, 25°С: а – ЦВА на ${\text{УН}}{{{\text{Т}}}_{{{{{\text{Н}}}_{{\text{2}}}}{{{\text{О}}}_{{\text{2}}}}}}}$ – 1, ${\text{УН}}{{{\text{Т}}}_{{{\text{НN}}{{{\text{O}}}_{{\text{3}}}}}}}$ – 2, ${\text{УН}}{{{\text{Т}}}_{{{{{\text{Н}}}_{{\text{2}}}}{{{\text{О}}}_{{\text{2}}}} + {\text{мел}}}}}$ – 3, ${\text{УН}}{{{\text{Т}}}_{{{{{\text{Н}}}_{{\text{2}}}}{{{\text{О}}}_{{\text{2}}}} + {\text{моч}}}}}$ – 4. 0.05 В/с, атмосфера Ar; б – поляризационные кривые на электроде с нанесенными УНТ: ${\text{УН}}{{{\text{Т}}}_{{{{{\text{Н}}}_{{\text{2}}}}{{{\text{О}}}_{{\text{2}}}}}}}$ – 1, ${\text{УН}}{{{\text{Т}}}_{{{\text{НN}}{{{\text{O}}}_{{\text{3}}}}}}}$ – 2, 2 ' (980 об/мин), 2 " (650 об/мин) ${\text{УН}}{{{\text{Т}}}_{{{{{\text{Н}}}_{{\text{2}}}}{{{\text{О}}}_{{\text{2}}}} + {\text{мел}}}}}$ – 3, ${\text{УН}}{{{\text{Т}}}_{{{{{\text{Н}}}_{{\text{2}}}}{{{\text{О}}}_{{\text{2}}}} + {\text{моч}}}}}$ – 4. Для сравнения приведена поляризационная кривая, измеренная на коммерческом катализаторе 20% Pt/C (HiSPEC) – 5. 10 мВ/с; атмосфера – O2. 25°С. Кривые 1–5 (1530 об/мин).
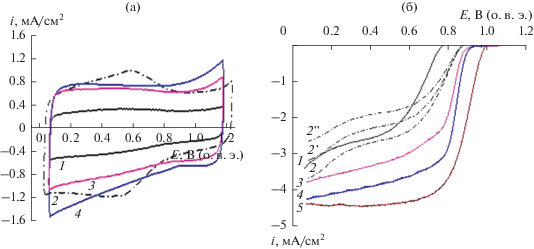
Активность в РВК повышается на УНТ, допированных азотом (рис. 6б). При допировании азотом с использованием мочевины УНТ имеют наибольшую поверхность и проявляют, соответственно, большую активность в РВК в щелочном (рис. 6б) электролите. Следует отметить, что в щелочном электролите на поляризационных кривых наблюдаются качественные изменения поляризационных кривых по сравнению с поляризационными кривыми в кислом электролите. На поляризационных кривых наблюдается участок предельного диффузионного тока, величина плотности тока на этом участке близка к предельному току 2-электронного восстановления кислорода (iпр = 2.6 мА/см2 при скорости вращения электрода 500 об/мин) или превосходит его. В кислом электролите поляризационные кривые на УНТ после допирования азотом значительно (около 0.40 В) смещаются в сторону положительных значений (рис. 5, кривые 4 и 5) по сравнению с УНТисх. Однако слабо выраженная зависимость от концентрации кислорода (рис. 5б) затрудняет определение числа переносимых электронов. В щелочном электролите при поляризации 0.40 В величина n достигает 2.3–2.8 (рис. 6б) на УНТ, допированных азотом, и приближается по активности к коммерческому платиновому катализатору (рис. 6б, кривая 5), величина n на коммерческом катализаторе 20 мас. % Pt/C (HiSPEC) составляет 3.8 [35, 38, 39]. Потенциал полуволны на наиболее активных модифицированных УНТ составляет 0.82 В, что только на 0.05 В ниже, чем на коммерческом катализаторе. Механизм РВК в кислом и щелочном электролитах отличается, что обусловлено состоянием поверхности УНТ. Модифицированная поверхность обогащена кислород- и азотсодержащими группами, взаимодействие которых с УМ приводит к повышению отрицательного заряда на ней. В щелочном электролите адсорбция ОН–-ионов на такой поверхности затруднена и молекулярный кислород адсорбируется на свободных активных центрах, благодаря чему увеличивается вероятность разрыва молекулы кислорода с электровосстановлением ее до воды. Вероятно, увеличение n до 3 (рис. 6б, кривая 4) можно объяснить вкладом прямой реакции восстановления кислорода до воды. Однако основной путь многостадийной реакции электровосстановления кислорода в щелочной среде связан с 2-электронным восстановлением кислорода с образованием пероксида водорода. Влияние рН раствора на путь и механизм реакции электровосстановления кислорода рассмотрено, например, в [42].
Коррозионная устойчивость модифицированных УНТ. Особое внимание при модифицировании УНТ кислородсодержащими группами и азотом уделяется вопросу устойчивости к деградации. С одной стороны, функционализация и допирование направлены на создание на поверхности УНТ активных центров, обеспечивающих повышение каталитической активности в РВК и электрохимически активной поверхности. С другой стороны, в процессе обработки возможно образование дефектов, которые могут приводить к снижению устойчивости УНТ [43]. Считается [44], что углеродный носитель в катализаторе подвергается наибольшей деградации при циклировании в области потенциалов 0.6–1.3 В (о. в. э). Результаты экспресс-тестирования путем циклирования потенциала в этой области представлены на рис. 7.
Рис. 7.
Величина электрохимически активной поверхности УНТ различных типов в виде Q, Кл/г. Приведены величины поляризационной емкости на УНТ после функционализации и допирования азотом. На поверхность электрода нанесено 0.10 мг/см2. Циклирование осуществляли в 0.5 М H2SO4 в атмосфере аргона, амплитуда циклирования 0.6–1.3 В.
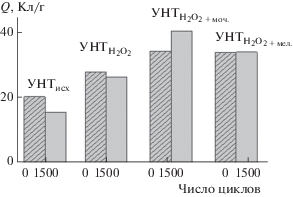
Выбраны достаточно жесткие условия циклирования, которые приводят к окислению углеродных материалов. Как видно, в процессе экспресс-тестирования площадь поверхности уменьшается с увеличением количества циклов. При этом снижение величины поверхности (деградация) наблюдается преимущественно на исходных УНТ, не подвергнутых модифицированию. После допирования УНТ азотом циклирование потенциала не приводит к снижению величины поляризационной емкости, за исключением УНТ, допированных мочевиной, где величина поверхности даже несколько увеличивается. Возможно, это связано с частичной десорбцией кислорода, что приводит к доступности электролита в нанопоры и увеличению поверхности. Таким образом, показано, что выбранные условия модифицирования УНТ обеспечивают рост величины электрохимически активной поверхности, активности в РВК и устойчивости к деградации, что свидетельствует о перспективности их применения на практике.
ЗАКЛЮЧЕНИЕ
Показано, что модифицирование поверхности УНТ кислородсодержащими и азотсодержащими группами обеспечивает значительное увеличение активности в РВК и стабильности. Максимальная эффективность достигается при синтезе на УНТ двух типов групп при отношении их количеств (кислород/азот) на поверхности близком к 1.3.
Для целенаправленного модифицирования поверхности азотом в пиридиновой и/или графитовой форме, которые активируют РВК, на УНТ должны быть предварительно сформированы карбоксильные или карбонильные группы с последующим замещением кислорода на азот.
Полученные результаты свидетельствуют о том, что УНТ, допированные азотом, по своей активности в РВК и устойчивости к деградации могут быть рекомендованы в качестве носителей наночастиц платины при синтезе катодных катализаторов для низкотемпературных водородо-воздушных ТЭ.
Наиболее перспективной областью применения УНТ, модифицированных кислород- и азотсодержащими группами, в качестве материала катода являются низкотемпературные прямые спиртово-воздушные щелочные ТЭ, а также металл-воздушные источники тока типа литий–воздух с апротонным растворителем, поскольку по активности в реакции электровосстановления кислорода в щелочных средах модифицированные кислородом и азотом УНТ приближаются к платиновым катализаторам.
Список литературы
Бржезинская, М.М., Байтингер, Е.М., Беленков, Е.А., Свирская, Л.М. Дефектные электронные состояния в углеродных нанотрубках и графите по данным NEXAFS-спектроскопии. Физика твердого тела. 2013. Т. 55(4). С. 779.
Dang Sheng Su, Perathoner, S., and Centi, G., Nanocarbons for Development of Advanced Catalysts, Chem. Rev., 2013, vol. 113, no. 8, p. 5782.
Dang Sheng Su, Guodong Wen, Shuchang Wu, Feng Peng, and Robert Schlçgl, Carbocatalysis in Liquid-Phase Reactions, Angew.Chem.Int. Ed., 2017, vol. 56, p. 936.
Sharma, S., Groves, M.N., Fennell, J., Soin, N., Horswell, S.L., and Malardier-Jugroot, C.,Carboxyl group enhanced CO tolerant GO supported Pt catalysts: DFT and electrochemical analysis., Chem.Mater., 2014, vol. 26(21), p. 6142.
Bogdanovskaya, V.A., Tarasevich, M.R., Radina, M.V., Zhutaeva, G.V., Kuzov, A.V., Kol’tsova, E.M., and Gavrilova, N.N., Highly active and stable catalysts based on nanotubes and modified platinum for fuel cells, Russ. J. Electrochem., 2016, vol. 52, no. 8, p. 723.
Майорова, Н.А., Тусеева, Е.К., Сосенкин, В.Е., Рычагов, А.Ю., Вольфкович, Ю.М., Крестинин, А.В., Зверева, Г.И., Жигалина, О.М., Хазова, О.А. Влияние функционализации УНТ на структуру и каталитические свойства электроосажденных катализаторов. Электрохимия. 2009. Т. 45. С. 1168. [Maiorova, N.A., Tuseeva, E.K., Sosenkin, V.E., Richagov, A.Yu., Vol’fkovich, Yu.M.,Krestinin, A.V., Zvereva, G.I., Zhigalina, O.M., and Khazova, O.A., Influence of CNT functionalization on the structure and catalytical properties of electrodeposition catalysts, Russ. J. Electrochem., 2009, vol. 45, p. 1108.
Lei Qin, Wei Lv, Wei Wei, Feiyu Kang, Dengyun Zhai, and Quan-Hong Yang. Oxygen-enriched carbon nanotubes as a bifunctional catalyst promote the oxygen reduction/evolution reactions in Li–O2 batteries, Carbon, 2019, vol.141, p. 561.
Sang, Y., Fu, A., Li, H., Zhang, J., Li, Z., Li, H., Zhao, X.S., and Guo, P., Experimental and theoretical studies on the effect of functional groups on carbon nanotubes to its oxygen reduction reaction activity, Colloids and Surfaces A: Physicochem. Eng. Aspects., 2016, vol. 506, p. 476.
Likodimos, V., Steriotis, T.A., Papageorgiou, S.K., Romanos, G.Em., Marques, R.R.N., Rocha, R.P., Faria, J.L., Pereira, M.F.R., Figueiredo, J.L., Silva, A.M.T., and Falaras, P., Controlled surface functionalization of multiwall carbon nanotubes by HNO3 hydrothermal oxidation, Carbon, 2014, vol. 69, p. 311.
Moraitis, G., Špitalský, Z., Ravani, F., Siokou, A., and Galiotis, C. Electrochemical oxidation of multi-wall carbon nanotubes, Carbon, 2011, vol. 49, no. 8, p. 2702.
Nanocarbon for Advanced Energy Conversion. Ed. Xinliang Feng. 2015. Wiley-VCH VerlagGmbH&Co. KGaA
In Electrocatalysis for Low Temperature Fuel Cells: Fundamentals and Recent Trends, Ed.by T. Maiyalagan and V.S. Saji. 2017. Maiyalagan, T., Maheswari, S., Saji, V.S., Heteroatom-doped Nanostructured Carbon Materials as ORR Electrocatalysts for Low-temperature Fuel Cells. Ch. 13, p. 401.
Rocha, R.P., Soares, O., Goncalves, A.G., Pereira, M., and Figueiredo, J.L. Different methodologies for synthesis of nitrogen doped carbon nanotubes and their use in catalytic wet air oxidation, Appl. Catal. A: General., 2017, vol. 548, no. 25, p. 62.
Ratso, S., Kruusenberg, I., Joost, U., Saar, R., and Tammeveski, K., Enhanced oxygen reduction reaction activity of nitrogen-doped graphene/multi-walled carbon nanotube catalysts in alkaline media, Int. J. Hydrog. Energy, 2016, p. 1.
Wei, Q., Tong, X., Zhang, G., Qiao, J., Gong, Q., and Sun, S., Nitrogen-Doped Carbon Nanotube and Graphene Materials for Oxygen Reduction Reaction, Catalysts, 2015, vol. 5, p. 1574.
Arrigo, R., Hävecker, M., Wrabetz, S., Blume, R., Lerch, M., McGregor, J., Parrott, E.P.J., Zeitler, J.A., Gladden, L.F., Knop-Gericke, A., Schlögl, R., and Su, D.S., Tuning the Acid/Base Properties of Nanocarbons by Functionalization via Amination, J. Am.Chem. Soc., 2010, vol. 132, p. 9616.
Wepasnick, K.A., Smith, B.A., Bitter, J.L., and Fairbrother, D.H., Chemical and structural characterization of carbon nanotube surfaces, Anal. Bioanal. Chem., 2010, vol. 396, no. 3, p. 1003.
Lin, He, Weniger, F., Neumann, H., and Beller, M., Synthesis, Characterization, and Application of Metal Nanoparticles Supported on Nitrogen-Doped Carbon Catalysis, Angewandte Chemie, 2016. https://doi.org/10.1002/anie.201603198
Huang, Z., Liao, Z., Yang, W., Zhou, H., Fu, C., Gonga, Y., Chen, L., and Kuang, Y., Different types of nitrogen species in nitrogen-doped carbon material: The formation mechanism and catalytic role on oxygen reduction reaction, Electrochim. Acta, 2017, vol. 245, p. 957.
Huang, S.F., Terakura, K., Ozaki, T., Ikeda, T., Boero, M., Oshima, M., and Ozaki, J., Miyata, S., First-principles calculation of the electronic properties of graphene clusters doped with nitrogen and boron: Analysis of catalytic activity for the oxygen reduction reaction, Phys. Rev. B., 2009, vol. 80, no. 23, p. 1.
Arkhipova, E.A., Ivanov, A.S., Strokova, N.E., Chernyak, S.A., Shumyantsev, A.V., Maslakov, K.I., Savilov, S.V., and Lunin, V.V., Structural evolution of nitrogen-doped carbon nanotubes: From synthesis and oxidation to thermal defunctionalization, Carbon, 2017, vol. 125, p. 20.
Guo, D., Shibuya, R., Akiba, C., Saji, S., Kondo, T., and Nakamura, J., Active sites of nitrogen-doped carbon materials for oxygen reduction reaction clarified using model catalysts, Science, 2016, vol. 351(6271), p. 361.
Liu, Yang, Zhuang, Cai, Liang, Hao, Lingling, Ran, Xin, Xu, Ying, Dai, Siyu, Pan, Baojian, and Jing, Jinlong, Zou, Increase of structural defects by N doping in MoS2 cross-linked with N-doped CNTs/carbon for enhancing charge transfer in oxygen reduction, Electrochim. Acta. 2018, vol. 283, p. 448.
Qing, Lv, Wenyan, Si, Jianjiang, He, Lei, Sun, Chunfang, Zhang, Ning, Wang, Ze, Yang, Xiaodong, Li, Xin, Wang, Weiqiao, Deng, Yunze, Long, Changshui, Huang, and Yuliang, Li., Selectively nitrogen-doped carbon materials as superior metal-free catalysts for oxygen reduction. Nature Communications, 2018, vol. 9. Article number: 3376.
Inagaki, M., Toyoda, M., Soneda, Y., and Morishita, T., Nitrogen-doped carbon materials. Carbon, 2018, vol.132, p. 104.
Wepasnick, K.A., Smith, B.A., Schrote, K.E., Wilson, H.K., and Diegelmann, S.R., Fairbrother D.H., Surface and structural characterization of multi-walled Carbon nanotubes following different oxidative treatments, Carbon., 2011, vol. 49, p. 24.
Rocha, R.P., Soares, O.S.G.P., Goncalves, A.G., Orfao, J.J.M., Pereira, M.F.R., Figueiredo, J.L., Different methodologies for synthesis of nitrogen doped carbon nanotubes and their use in catalytic wet air oxidation, Appl. catalysis a: general, 2017, vol. 548, p. 62.
Soares, O.S.G.P., Rocha, R.P., Goncalves, A.G., Figueiredo, J.L., Orfao, J.J.M., Pereira, M.F.R., Easy method to prepare N-doped carbon nanotubes by ball milling., Carbon, 2015, vol. 91, p. 114.
Богдановская, В.А., Красильникова, О.К., Кузов, А.В., Радина, М.В., Тарасевич, М.Р., Аваков, В.Б., Капустин, А.В., Ландграф, И.К. Электрохимические и структурные характеристики PtCoCr/C катализатора с содержанием платины 50 мас. % и катод на его основе для топливного элемента. Электрохимия. 2015. Т. 51. С. 685. [Bogdanovskaya, V.A., Krasilnikova, O.K., Kuzov, A.V., Radina, M.V., Tarasevich, M.R., Avakov, V.B., Kapustin, A.V., and Landgraf, I.K., Electrochemical and structure characteristics of PtCoCr/C – catalyst with platinum content 50 wt % and cathode on its basis for fuel cell with proton-conducting polymer electrolyte, Russ. J. Electrochem., 2015, vol. 51, p. 602.]
Shirley, D.A., High-Resolution X-Ray Photoemission Spectrum of the Valence Bands of Gold, Phys. Rev., 1972, B 5, p. 4709.
Scofield, H., Hartree-Slater subshell photoionization cross-sections at 1254 and 1487 eV, J. Electron Spectrosc. Relat. Phenom., 1976, vol. 8, p. 129.
Oschatz, M. and Walczak, R., Crucial Factors for the Application of Functional Nanoporous Carbon-Based Materials in Energy and Environmental Applications, J. Carbon Research, 2018, vol. 4, p. 56.
Datsyuk, V., Kalyva, M., Papagelis, K., Parthenios, J., Tasis, D., Siokou, A., Kallitsis, I., and Galiotis, C., Chemical oxidation of multiwalled carbon nanotubes, Carbon, 2008, vol. 46, p. 833.
Cheng-Meng Chen, Qiang Zhang, Xiao-Chen Zhao, Bingsen Zhang, Qing-Qiang Kong, Mang-Guo Yang, Quan-Hong Yang, Mao-Zhang Wang, Yong-Gang Yang, Robert Schlogl, and Dang Sheng Su., Hierarchically aminated graphene honeycombs for electrochemical capacitive energy storage, J. Mater. Chem., 2012, vol. 22, p. 14076.
Heejin Kim, Kirak Lee, Seong Ihl Woo, and Yousung Jung, On the mechanism of enhanced oxygen reduction reaction in nitrogen-doped graphene nanoribbons, Phys. Chem.Chem.Phys. 2011, vol. 39, no. 13, p. 17505.
Unni, S.M., Bhange, S.N., Illathvalappil, R., Mutneja, N., Patil, K.R., and Kurungot, S. Nitrogen induced surface area and conductivity modulation of carbon nanohorn and its function as an efficient metal-free oxygen reduction electrocatalyst for anion-exchange membrane fuel cells, “Small”, 2015, vol. 11, no. 3, p. 352.
Yuyan Shao, Sheng Zhang, Mark H. Engelhard, Guosheng Li, Guocheng Shao, Yong Wang, Jun Liu, and Ilhan A. Aksay and Yuehe Lin. Nitrogen-doped graphene and its electrochemical applications. J. Mater. Chem., 2010, vol. 20, p. 7491.
Esrafili, M.D. and Saeid, N., A catalyst-free achieving of N-doped carbon nanotubes: The healing of single-vacancy defects by NO molecule, Chem. Phys. Lett., 2018, vol. 691, p. 172.
Gui-Li Tian, Qiang Zhang, Bingsen Zhang, Yu-Guang Jin, Jia-Qi Huang, Dang Sheng Su, and Fei Wei, Toward Full Exposure of “Active Sites”: Nanocarbon Electrocatalyst with Surface Enriched Nitrogen for Superior Oxygen Reduction and Evolution Reactivity, Adv.Funct.Mater., 2014, vol. 24, p. 5956.
Gongxiu Guo, Xili Tong, and Xiangyun Guo, Nitrogen-doped mesoporous network-like carbon as an efficient metal-free electrocatalyst for oxygen reduction reaction, Intern. J. Hydrogen Energy, 2016, vol. 41, p. 48.
Ratso, S., Kruusenberg, I., Joost, U., Saar, R., and Tammeveski, K., Enhanced oxygen reduction reaction activity of nitrogen-doped graphene/multi-walled carbon nanotube catalysts in alkaline media, Int. J. Hydrog. Energy, 2016, p. 1.
Тарасевич, М.Р., Корчагин, О.В., Электрокатализ и pH. Электрохимия. 2013. Т. 49. С. 676. [Tarasevich, M.R., Korchagin, O.V., Electrocatalysis and pH, Russ. J. Electrochem., 2013, vol. 49, p. 608.
Chi-Yeong Ahn, Wonchan Hwang, Hyunjoon Lee, Sungjun Kim, Ji Eun Park, Ok-Hee Kim, Min Her, Yong-Hun Cho, and Yung-Eun Sung, Effect of N-doped carbon coatings on the durability of highly loaded platinum and alloy catalysts with different carbon supports for polymer electrolyte membrane fuel cells, Intern. J. Hydrogen Energy, 2018, vol. 43, p. 1007.
Stamatin, S.N, Borghei, M., Dhiman, R., Andersena, S.M., Ruiz, V., Kauppinen, E., and Skou, E.M., Activity and stability studies of platinized multi-walled carbon nanotubes as fuel cell electrocatalysts, Appl. Catal. B: Environmental, 2015, vol. 162, p. 289.
Дополнительные материалы отсутствуют.


