Электрохимия, 2020, T. 56, № 10, стр. 909-920
Катализаторы реакции электрохимического выделения водорода на основе электролитических и химико-каталитических сплавов рения и никеля
В. В. Кузнецов a, c, Ю. Д. Гамбург b, *, В. М. Крутских b, В. В. Жуликов b, Е. А. Филатова a, А. Л. Тригуб d, О. А. Белякова e
a Российский химико-технологический университет им. Д.И. Менделеева
125047 Москва, А-47, Миусская пл., 9, Россия
b Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Ленинский просп., 31/4, Россия
c Национальный исследовательский ядерный университет “МИФИ”
115409 Москва, Каширское шоссе, 31, Россия
d Национальный исследовательский центр “Курчатовский университет”
123098 Москва, пл. академика Курчатова, 1, Россия
e Институт катализа им. Г.К. Борескова СО РАН
630090 Новосибирская обл., Новосибирск, пл. академика Лаврентьева, 5, Россия
* E-mail: gamb@list.ru
Поступила в редакцию 24.09.2019
После доработки 07.02.2020
Принята к публикации 20.02.2020
Аннотация
Сопоставлены состав, структура и электрокаталитические свойства в РВВ для электролитических покрытий Re–Ni и сплавов Ni–Re–P, полученных химико-каталитическим осаждением с использованием гипофосфита натрия в качестве восстановителя. Методами EXAFS и XANES определены координационные числа никеля и рения и межатомные расстояния для полученных материалов. Установлено, что в структуре наиболее каталитически активных Re–Ni-катализаторов отсутствует дальний порядок в расположении атомов рения и никеля, что позволяет сделать вывод об аморфном состоянии полученных электролизом материалов. Для химико-каталитических покрытий Ni‒Re–P показано, что введение рения в состав покрытий приводит к уменьшению содержания фосфора в образующемся сплаве. Химико-каталитические покрытия Ni–Re–P перспективны для катализа РВВ в растворах кислот.
ВВЕДЕНИЕ
Интенсивное развитие водородной энергетики требует создания новых электрокаталитических материалов для водородной реакции. С практической точки зрения, представляют интерес как катодные катализаторы реакции электрохимического выделения водорода (РВВ), так и анодные катализаторы окисления молекулярного H2. Внедрение эффективных катализаторов РВВ, не содержащих платиновых металлов, в перспективе позволит снизить себестоимость электролитического водорода. Неплатиновые катализаторы окисления водорода, толерантные к окислению СО, перспективны для использования в низкотемпературных топливных элементах.
Несмотря на то, что водородная реакция исследовалась в течение десятилетий [1–4], до сих пор нет однозначных критериев выбора эффективных электрокаталитических материалов для нее. В большинстве случаев для выбора потенциально перспективных систем исследователи используют “вулканообразную” зависимость скорости РВВ от энтальпии связи металл–водород [5, 6], хотя она и не имеет достаточно строгого обоснования [7, 8]. Для получения систем с оптимальным значением энтальпии связи M–H целесообразно получение сплавов, один из компонентов которых расположен на восходящей ветви “вулкана”, а другой – на нисходящей. В [9] было обнаружено синергетическое каталитическое действие никеля и рения в отношении РВВ, наибольший каталитический эффект был обнаружен для электролитических покрытий Re–Ni, содержащих 76–80 ат. % рения. В цитируемой работе было обнаружено заметное количество оксидов рения (главным образом, ReO2) в осадках Re–Ni, обладающих наиболее высокой каталитической активностью. После проведения термообработки количество кислорода в поверхностных слоях осадков снижалось, что приводило к снижению каталитической активности. Однако однозначно причины, приводящие к высокой каталитической активности электролитических покрытий Re–Ni в отношении водородной реакции, в [9] установлены не были, что стимулирует проведение новых исследований в этой области.
Кроме сплавов металлов, в качестве катализаторов водородной реакции целесообразно использовать системы, содержащие различные соединения никеля с неметаллами: фосфиды [10, 11], сульфиды [12, 13], селениды [14], карбиды [15], гидратированные оксиды [16]. Во многих случаях введение неметалла в состав покрытий позволяет существенно увеличить коррозионную стойкость осадков, что важно для электрокаталитических приложений. С этой точки зрения, нам представлялось целесообразным протестировать систему Ni–Re–P в качестве возможного электрокатализатора водородной реакции. Для получения указанного сплава целесообразно применять процессы химической металлизации в условиях отсутствия внешней поляризации, используя гипофосфит натрия в качестве восстановителя.
Целями данного исследования были: 1) получение уточненных сведений о природе каталитического эффекта для наиболее каталитически активных электролитических сплавов Ni–Re, 2) осаждение сплава Ni–Re–P в условиях разомкнутой цепи и определение каталитических свойств этого материала в водородной реакции.
МЕТОДИКИ ИССЛЕДОВАНИЯ
Электроосаждение покрытий Re–Ni и химическое осаждение покрытий Ni–Re–P проводили на поверхность предварительно подготовленных [17] медных образцов прямоугольной формы с геометрической площадью поверхности 2 см2.
Электролитические осадки Re–Ni были получены в гальваностатическом режиме из цитратных электролитов, в которых варьировались концентрации сульфата никеля и перрената калия. Состав растворов, применявшихся для электроосаждения, был следующим, М: NiSO4 ⋅ 7H2O – 0.2–0.5; KReO4 – 0.035–0.050; лимонная кислота – 0.35–0.5. Реактивы, использовавшиеся для приготовления электролитов, соответствовали квалификации х. ч. и дополнительной очистке не подвергались. Электроосаждение проводили при рН приготовления (1.5–1.9), температуре 55°С и катодной плотности тока 0.05–0.30 А/см2. Полученные электролизом покрытия содержали 56–80 ат. % рения (табл. 1).
Таблица 1.
Характеристики Re–Ni-сплавов, полученных электроосаждением
| № | c(Ni2+), мМ | c(ReO4–), мМ | Ток осаждения покрытия, jdep, мA/см2 | Выход по току сплава Re–Ni, % | Состав сплава, ат. % (сумма атомных процентов рения и никеля принята равной 1) | |
|---|---|---|---|---|---|---|
| Re | Ni | |||||
| 1 | 500 | 50 | 100 | 8.1 | 80 | 20 |
| 2 | 500 | 50 | 150 | 12.0 | 76 | 24 |
| 3 | 500 | 50 | 250 | 20.0 | 56 | 44 |
| 4 | 120 | 35 | 50 | 6.5 | 79 | 21 |
| 5 | 120 | 35 | 200 | 13.0 | 58 | 42 |
| 6 | 200 | 35 | 100 | 9.2 | 68 | 32 |
| 7 | 200 | 35 | 150 | 14.0 | 67 | 33 |
| 8 | 300 | 35 | 50 | 10.4 | 74 | 26 |
| 9 | 300 | 35 | 200 | 23.0 | 52 | 48 |
Каталитически активные покрытия Ni–Re–P наносили в условиях разомкнутой цепи из цитратных растворов, используя в качестве восстановителя гипофосфит натрия [18]. Растворы содержали, М: NiSO4 ⋅ 7H2O – 0.01–0.05; цитрат натрия – 0.17; KReO4 – 0.01–0.05; NaH2PO2⋅H2O – 0.19. Осаждение проводили при температуре 90°С и рН 10. Отношение площади покрываемой поверхности к объему раствора S/V составляло 0.42 дм2/л.
Морфологию и локальный химический состав полученных покрытий определяли с помощью сканирующего электронного микроскопа Hitachi TM-3000 (Япония), оснащенного микрорентгеноспектральным анализатором. Информацию о химическом составе образцов собирали по крайней мере в 10 точках на поверхности образца. Полученные при этом результаты подвергали статистической обработке.
Валентное состояние элементов в поверхностных слоях Re–Ni- и Ni–Re–P-покрытий определяли методом рентгеновской фотоэлектронной спектроскопии (РФЭС) на спектрометре HB100 (Великобритания). Для возбуждения атомов использовали AlKα-излучение (hν = 1486.6 eV, 200 Вт). Вторичные электроны регистрировали с участка поверхности диаметром ∼600 мкм и толщиной 2–3 нм. Интерпретация спектров была проведена согласно [19].
Фазовый состав синтезированных материалов исследовали методом рентгенофазового анализа (РФА) на дифрактометре Philips PW1820/00, используя CuKα-излучение (λ = 0.15406 нм). Для получения информации о локальном химическом окружении атомов в рентгеноаморфных электродных осадках Re–Ni использовали рентгеновскую спектроскопию поглощения (EXAFS и XANES, Ni K-Edge и Re K-Edge). Исследования были проведены в Национальном Исследовательском Центре “Курчатовский институт” в режиме “на пропускание”, с использованием кремниевого детектора Amptek [20]. Спектры были обработаны с помощью программ Athena и Artemis, входящих в пакет IFEFFIT [21] с использованием фазовых и амплитудных функций ab initio из FEFF8 [22].
Каталитическая активность в РВВ для Re–Ni-покрытий была исследована в 1.0 М растворе гидроксида натрия (t = 20–75°C), который был предварительно декарбонизирован [23]. Ni–Re–P-покрытия были протестированы в 0.5 М растворе серной кислоты (ос. ч.) при температуре 22 ± 2°С. Для приготовления указанных растворов использовали бидистиллированную воду, обработанную далее с помощью системы подготовки воды Milli-Q, Millipore (удельное сопротивление ∼18 МОм см, содержание органических примесей не более 5 ppb). Поляризационные измерения были проведены с использованием цифрового потенциостата IPC Pro; потенциал электрода задавали относительно обратимого водородного электрода (о. в. э.) в том же растворе. Поляризационные кривые РВВ были сняты в потенциодинамических условиях, развертку потенциала проводили от потенциала разомкнутой цепи в катодном направлении со скоростью 2 мВ/с.
Принципиально важное значение для электрокатализа имеет вопрос о стабильности электродных материалов в условиях электролиза. Для ее предварительной оценки проводили длительную поляризацию образцов с нанесенным покрытием при E = –0.1 В в течение 5 ч. Полученные после этого растворы были проанализированы методом атомно-эмиссионной спектроскопии с индуктивно связанной плазмой (AES–ICP).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Электролитические осадки Re–Ni как электрокатализаторы РВВ в щелочных средах
При катодной поляризации медного катода в цитратных растворах, содержащих сульфат никеля и перренат калия, на нем было зафиксировано образование металлического покрытия. Согласно данным рентгеноспектрального анализа (рис. 1а) и РФЭС (рис. 1б), электролитические осадки Re‒Ni содержат рений, никель и заметное количество кислорода. Кислород в составе электродного осадка соответствует O–2 и уверенно фиксируется после проведения ионного травления на глубину 5 и 15 нм. Eго количество постепенно снижается при увеличении глубины ионного травления (рис. 2). Отношение атомных долей рения и никеля при этом остается неизменным (табл. 2). Следовательно, электролитические осадки рений–никель содержат некоторое количество оксидов, которые сконцентрированы в поверхностных слоях электролитически осажденных сплавов.
Рис. 1.
Энергодисперсионный (а) и обзорный РФЭС (б), на глубине 10 нм, спектры Re–Ni-осадка (80 ат. % Re), полученного электроосаждением.
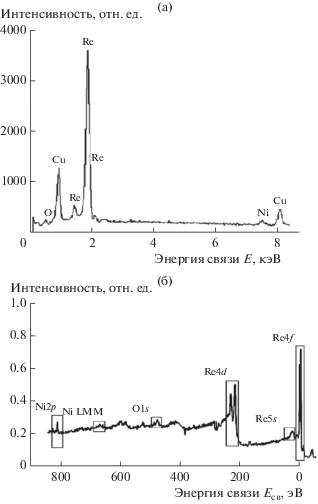
Рис. 2.
Обзорные РФЭС-спектры электролитического Re–Ni-покрытия на различных аналитических глубинах (а) и спектр РФЭС высокого разрешения (б) O1s (5 нм).
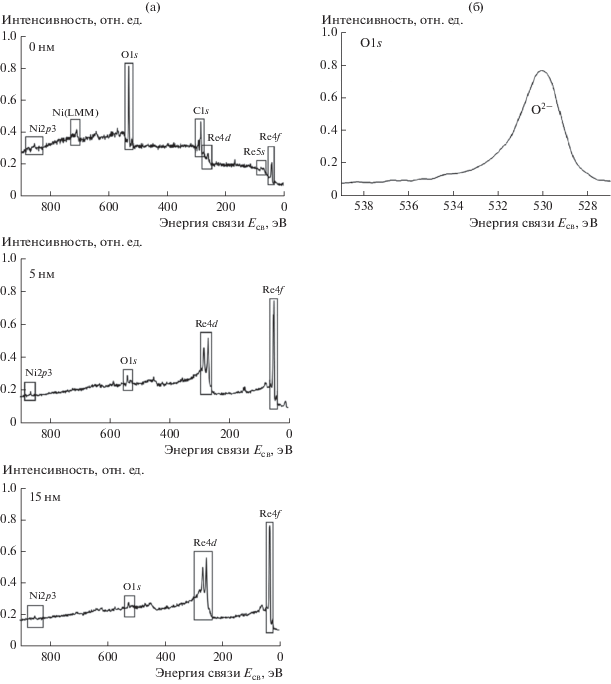
Таблица 2.
Отношение атомных долей рения и никеля x(Re)/x(Ni) на разной глубине катодных осадков Re–Ni (80 ат. Re). Результаты РФЭС
| Аналитическая глубина, нм | x(Re)/x(Ni) |
|---|---|
| 0–2 | 4.6 |
| 5 | 4.9 |
| 15 | 4.3 |
| 30 | 4.0 |
Согласно спектрам РФЭС высокого разрешения, на поверхности электродов фиксируется некоторое количество Ni(OH)2. Однако уже на глубине 5 нм весь никель находится только в металлическом состоянии (рис. 3а). Следовательно, при электроосаждении происходит полное восстановление соединений никеля, а гидроксид никеля, обнаруженный на поверхности, образовался в результате взаимодействия никеля с атмосферным воздухом уже после нанесения покрытия.
Рис. 3.
Спектры РФЭС высокого разрешения электролитических Re–Ni-покрытий: Ni2p (a) и Re4f (б). Аналитическая глубина 10 нм.
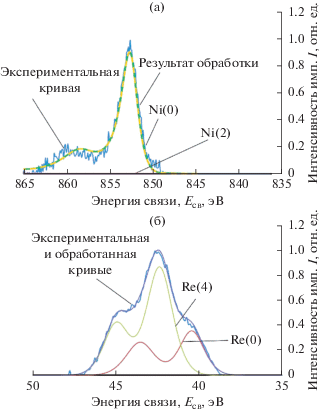
Валентное состояние рения сложнее: как на поверхности, так и после проведения ионного травления на глубину 5, 10 и 20 нм рений зафиксирован как в нулевой степени окисления, так и в степени окисления +4 (рис. 3б). Окисленные формы рения, по-видимому, являются его оксидами. В [9] на основе анализа литературных данных [24, 25] нами было сделано предположение, что высокая каталитическая активность сплавов рений–никель, полученных электроосаждением, связана с наличием оксидов рения в промежуточных степенях окисления в их составе. Известно [26, 27], что модификация катализаторов оксидами и гидроксидами переходных металлов способствует облегчению диссоциации молекул воды и образованию Hадс на поверхности металла, что снижает энергетический барьер РВВ в щелочных растворах.
Для решения задачи электрокатализа РВВ в щелочных растворах принципиальное значение имеет энергия связи адсорбированного атома водорода с поверхностью электрода. По этой причине данные о структуре катализаторов РВВ являются необходимыми для оптимизации состава и методов синтеза катализаторов.
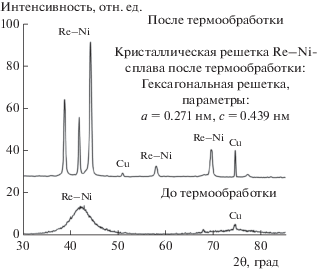
После электроосаждения все осадки Re–Ni (x(Re) = 56–80 ат. %) были рентгеноаморфными. Сплавы оставались рентгеноаморфными после прогрева при 450°С в атмосфере аргона. Лишь термообработка в вакууме (остаточное давление 10–6 Па, 450°С) приводила к появлению кристаллической структуры Re–Ni-сплавов: они представляли собой твердые растворы рения в никеле (рис. 4). Термообработка рений-никелевых сплавов приводит к существенному снижению их каталитической активности в РВВ [9].
Рис. 4.
Дифрактограммы Re–Ni-покрытий, нанесенных на медную подложку, до и после термообработки. CuKα-излучение.
Возможно, что рентгеноаморфность сплавов Re–Ni вызвана их значительным наводороживанием. Содержание водорода в электролитических покрытиях рений–никель зависит от их состава и условий получения и составляет 2–8 см3/г. Атомы водорода, внедряющиеся в кристаллическую решетку, вызывают ее микроискажения, что и приводит к размыванию рефлексов на дифрактограммах. При термообработке в вакууме происходит десорбция Hат. Кроме того, согласно спектрам РФЭС, термообработка приводит к восстановлению оксидов рения в поверхностных слоях осадков рений–никель атомарным водородом [9].
Рентгеновская спектроскопия поглощения (XANES и EXAFS) показала, что осадки Re–Ni после осаждения находятся в аморфном состоянии. Сопоставляя результаты вблизи края поглощения Ni K-edge и Re K-edge для полученных сплавов с данными для никелевой и рениевой фольги (рис. 5) можно сделать вывод, что в структуре полученных материалов отсутствует дальний порядок в расположении атомов. Координационное число атомов никеля близко к 8 (табл. 3), а атомов рения – к 7. Межатомные расстояния Re–Ni составляют 0.282 нм, а Re–Re – 0.271 нм для образца, содержащего 80 ат. % рения. Очевидно, что после термообработки структура сплава меняется: он кристаллизуется в гексагональной решетке с параметрами a = 0.271 нм и c = 0.439 нм. Координационное число атомов рения в этом случае возрастает до 12. Однако следует отметить, что величина параметра a кристаллической структуры Re–Ni-сплавов после термообработки близка к межатомному расстоянию рений–рений в структуре исходного материала. После термообработки структура электролитических сплавов Re–Ni изменяется: происходит кристаллизация с образованием твердых растворов никеля в рениевой матрице [9].
Рис. 5.
Спектры XANES Re–Ni-покрытий (1) и эталонные спектры никелевой и рениевой фольги (2). Пояснения в тексте.
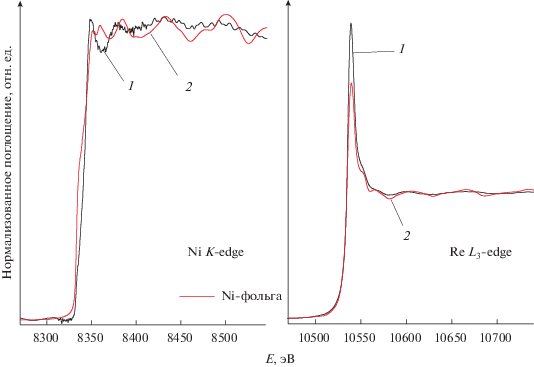
Таблица 3.
Результаты обработки EXAFS и XANES спектров
| Край поглощения | Путь рассеяния фотоэлектронов | Количество атомов в ближайшем окружении, N | Расстояние, нм | σ2 × 102, нм2 |
|---|---|---|---|---|
| Ni K | Ni–Ni | 1.9 | 0.237 | 0.0131 |
| Ni–Re | 6.3 | 0.282 | 0.0128 | |
| Re L3 | Re–Re | 6.4 | 0.271 | 0.0114 |
| Re–Ni | 0.8 | 0.282 | 0.0095 |
Кинетика РВВ в щелочных растворах описывается следующей последовательностью стадий [7, 28]. Сначала происходит разряд молекул воды с образованием на поверхности электрода адсорбированного атома водорода – основного интермедиата РВВ [28] (реакция Фольмера):
Затем следует электрохимическая десорбция Hадс (реакция Гейровского) или рекомбинация двух атомов Hадс с образованием молекулы водорода (реакция Тафеля). Стадией, определяющей скорость РВВ, часто является реакция Фольмера [29, 30]. В [30] показано, что на Pt/C-катализаторах кинетика выделения/ионизации водорода может быть описана уравнением Батлера–Фольмера с α = 0.5. В случае замедленности реакции Фольмера это приводит к значению тафелевского наклона для РВВ ∼118 мВ/декаду. Однако в цитируемой работе со ссылкой на результаты квантовохимических расчетов, проведенных методом функционала плотности [31], отмечается, что энергетические барьеры реакций Фольмера (∼0.15 эВ) и Гейровского (∼0.6 эВ) сопоставимы, и, следовательно, реакция Гейровского также может быть скоростьопределяющей стадией и влиять на скорость РВВ. Для маршрута РВВ с быстрой стадией Фольмера и замедленной стадией Гейровского (α = 0.5) значение кажущегося коэффициента переноса αкаж составляет 1.5, что соответствует тафелевскому наклону ∼40 мВ/декаду.
В случаях, когда скорости реакций Фольмера и Гейровского являются сопоставимыми и, таким образом, одновременно влияют на ток РВВ, уравнение Тафеля, строго говоря, перестает быть корректным. Однако, как показывают результаты модельных расчетов (рис. 6а), в этом случае на вольт-амперных кривых в широкой области потенциалов появляется “псевдотафелевская” область, удовлетворительно описывающаяся в E,lg j-координатах линейной зависимостью с высоким коэффициентом корреляции (0.9935) и сниженным, по сравнению со 120 мВ/декаду, значением тафелевского наклона. Сказанное справедливо в том случае, когда зависимостью степени заполнения поверхности электрода адсорбированными атомами водорода θH от его потенциала можно пренебречь. В [30] отмечается, что такое предположение справедливо в относительно узком интервале потенциалов катода. Как показывают результаты наших вычислений [32] на Re–Ni-катодах в рассматриваемой области потенциалов θH мало зависит от потенциала катода. По указанным причинам экспериментальные значения тафелевских наклонов, определенные в этой работе, следует рассматривать как ориентировочные.
Рис. 6.
Рассчитанные тафелевские кривые (а) для маршрута Фольмера–Гейровского при замедленной стадии Фольмера (1, jo = 10–4 A/см2, α = 0.5), Гейроского (2, jo = 2 × 10–5 A/см2, α = 0.5) и сопоставимых скоростях стадий Фольмера и Гейровского (3, joФ = = 10–4 A/см2, joГ = 2 × 10–5 A/см2). Экспериментальные поляризационные кривые РВВ (б) в 1.0 М растворе NaOH на Re–Ni-катодах в тафелевских координатах.
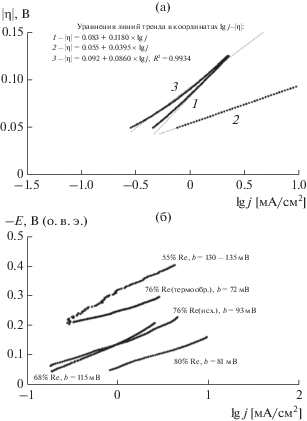
При увеличении содержания рения в электролитических осадках Re–Ni происходило снижение тафелевского угла наклона на E,lg j-зависимостях от 130 мВ для сплава, содержащего 55 ат. % Re (рис. 6б), до 76 мВ для рения, электроосажденного в тех же условиях [9]. Максимум электрокаталитической активности наблюдается для сплавов содержащих 80 ат. % рения. Обсуждаемые закономерности изменения скорости РВВ и тафелевского наклона могут быть объяснены следующим образом. Увеличение содержания рения в Re–Ni-катализаторах приводит к росту энтальпии связи M–Hадс и возрастанию скорости реакции Фольмера, что приводит к увеличению токов РВВ. Скорости стадий Гейровского и Фольмера становятся сопоставимыми, что приводит к уменьшению экспериментального значения bтаф.
Изменение структуры Re–Ni-катализатора (76 ат. % Re) после термообработки также приводит к изменению кинетических параметров РВВ. Во-первых, ток обмена, определенный из тафелевских зависимостей и рассчитанный на геометрическую площадь катода, уменьшается в ∼5 раз. Это снижение не может быть объяснено лишь уменьшением истинной площади поверхности электрода, поскольку двойнослойная емкость рений-никелевых электродов в растворах гидроксида натрия практически не изменяется и составляет ∼3–3.5 мФ/см2 [9]. Кроме того, термообработка приводит к снижению тафелевского угла наклона вольт-амперных зависимостей от 93 до 72 мВ [9], а следовательно, изменяет механизм РВВ.
Осадки Re–Ni, полученные электроосаждением, нестойки в растворах кислот. После электролиза в 0.5 М растворе серной кислоты при t = 22°C и E = –0.1 В в растворе были обнаружены соединения никеля (∼0.2 мг/л). Следовательно, для разработки катализаторов, устойчивых в растворах кислот, необходимо создание новых электродных материалов. В этом отношении целесообразно введение в состав катализаторов фосфора. Аморфные сплавы металлов, содержащие фосфор, обладают повышенной коррозионной стойкостью в кислых средах [31, 32] и часто обладают высокой каталитической активностью в РВВ. Для получения сплава Ni–Re–P целесообразно использовать химическое осаждение, при проведении которого происходит восстановление соединений никеля, рения и фосфора гипофосфитом натрия в условиях разомкнутой цепи.
Сплавы Ni–Re–P, полученные химическим восстановлением, – катализаторы РВВ в растворах кислот
Стандартный электродный потенциал полуреакции
Строго говоря, процесс химической металлизации с использованием гипофосфита натрия в качестве восстановителя проводится при повышенных температурах, в связи с чем указанные величины потенциалов являются ориентировочными. Однако это не изменяет выводов о термодинамической возможности осаждения никель-рениевых сплавов с использованием NaH2PO2 в качестве восстановителя, поскольку движущая сила этого процесса весьма велика.
Бестоковое осаждение металлов с использованием гипофосфита натрия в качестве восстановителя включает стадию каталитического разложения (гетерогенного гидролиза) гипофосфит-ионов [36]:
Электроны, поступающие во внешнюю цепь, выступают в качестве восстановителя для ионов металла и гипофосфит-ионов. При восстановлении ${{{\text{H}}}_{{\text{2}}}}{\text{PO}}_{{\text{2}}}^{--}$-ионов образуются атомы фосфора, что приводит к формированию твердого раствора фосфора в никеле в образующемся покрытии. Итоговое уравнение восстановления ионов никеля может быть представлено следующим образом:
В результате протекания этой реакции приповерхностный слой подкисляется. Восстановление перренат-ионов, наоборот, сопровождается подщелачиванием приповерхностного слоя, приводящим к депротонированию гидрофосфит-ионов:
В результате одновременного протекания этих двух реакций изменения рН приповерхностного слоя не слишком значительны, и процесс химического нанесения сплава Ni–Re–P можно проводить в широком интервале pH (6–10).
Металлический никель является катализатором гетерогенного гидролиза гипофосфит-ионов, что определяет химико-каталитический характер протекания процесса получения Ni–P-покрытий. Ни рений, ни оксиды рения каталитическими свойствами в отношении гетерогенного гидролиза ${{{\text{H}}}_{{\text{2}}}}{\text{PO}}_{{\text{2}}}^{--}$-ионов не обладают. Следовательно, увеличение содержания рения в образующемся при химическом восстановлении сплаве неизбежно должно приводить к торможению реакции восстановления металлов. По этой причине нецелесообразно использовать растворы с высокой концентрацией перренат-ионов (>50 мМ): в этих условиях резко уменьшается скорость химико-каталитического осаждения, а получаемые при этом покрытия содержат лишь незначительное количество фосфора.
Для контроля процесса бестокового осаждения сплава Ni–Re–P важен контроль отношения концентраций соединений никеля и перренат-ионов (c(Ni(II))/c(${\text{ReO}}_{{\text{4}}}^{--}$)) в растворе. В данной работе эксперименты в основном были проведены при постоянном значении этого соотношения; исследовалось влияние концентрации металлов на скорость металлизации, химический состав сплавов Ni–Re–P и их каталитические свойства.
При увеличении концентрации соединений никеля и рения в растворе (c(${\text{ReO}}_{{\text{4}}}^{--}$)/c(Ni(II)) = 1) скорость химико-каталитического осаждения сплава ожидаемо возрастает (рис. 7, кривая 1)), однако полученная зависимость скорости осаждения от концентрации далека от линейной: сказывается тормозящее воздействие перренат-ионов на процесс химического осаждения никеля. Еще более заметно ингибирование процесса химического осаждения сплава соединениями рения в растворах с высоким значением отношения концентраций перренат-ионов и соединений никеля c(${\text{ReO}}_{{\text{4}}}^{--}$)/c(Ni(II)) = 10 (рис. 7, кривая 2).
Рис. 7.
Зависимости скорости химического осаждения Ni–Re–P-покрытий от концентрации перренат-ионов в растворе. Отношение концентраций перренат-ионов и соединений никеля c(${\text{ReO}}_{{\text{4}}}^{--}$)/c(Ni(II) равно: 1 – 1, 2 – 10.
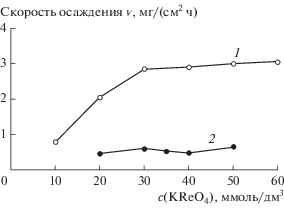
Обращает на себя внимание то, что при увеличении концентрации перренат-ионов в растворе уменьшается содержание фосфора в получаемых покрытиях (табл. 4). По-видимому, наблюдаемое снижение содержания фосфора связано с торможением восстановления гипофосфит-ионов в присутствии соединений рения. Возрастание концентрации ${\text{ReO}}_{{\text{4}}}^{--}$-ионов в растворе приводит также к увеличению содержания кислорода в получаемых Ni–Re–P-покрытиях. По аналогии с электроосаждением Re–Ni-сплавов, можно было бы предположить, что это связано с протеканием неполного восстановления перренат-ионов, которое приводит к образованию оксидов.
Таблица 4.
Составы сплавов Ni–Re–P, полученных химическим восстановлением (данные EDX)
| c (KReO4), мМ | c(${\text{ReO}}_{{\text{4}}}^{--}$)/ c(Ni2+) | Состав покрытий, ат. % | |||
|---|---|---|---|---|---|
| Ni | Re | P | O | ||
| 10 | 1 | 57.0 | 31.9 | 7.2 | 3.9 |
| 20 | 1 | 54.8 | 33.6 | 4.4 | 7.2 |
| 30 | 1 | 55.7 | 37.2 | 3.6 | 3.5 |
| 40 | 1 | 55.4 | 38.6 | 2.2 | 3.8 |
| 50 | 1 | 52.4 | 40.2 | 2.0 | 5.4 |
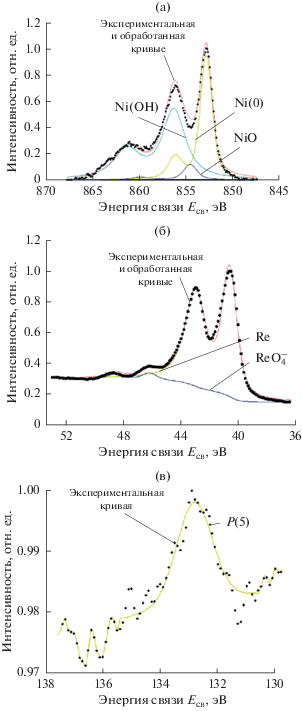
Для проверки этого предположения, были получены спектры РФЭС Ni–Re–P-осадков, полученных химическим осаждением из цитратных растворов с использованием гипофосфита натрия как восстановителя. Как видно из приведенных спектров (рис. 8а), в отличие от осадков Re–Ni, полученных электролизом, химические покрытия Ni–Re–P содержат некоторое количество никеля в виде оксидов и гидроксидов. Полнота восстановления соединений рения, наоборот, достаточно велика: его оксиды в промежуточных степенях окисления не обнаружены (рис. 8б). Наблюдается лишь небольшой “наплыв” в области больших энергий связи, отвечающий невосстановленным перренат-ионам и, по-видимому, вызванный их механическим включением в состав образующегося покрытия. На основании этого можно сделать вывод, что бóльшая часть кислорода в полученном материале связана с никелем, а не с рением. Фосфор в осадках представлен соединениями P+5 (рис. 8в), очевидно, что достаточно толстый фосфатный слой образовался в результате контакта образцов с нанесенным покрытием с атмосферным кислородом [32]. Ni–Re–P-покрытия, так же как и электролитические осадки Re–Ni, являются рентгеноаморфными, однако вопрос об их структуре требует проведения дальнейших исследований [37, 38].
Рис. 8.
Спектры РФЭС высокого разрешения покрытий Ni–Re–P, полученных химическим восстановлением гипофосфитом натрия: а – Ni2p, б – Re4f, в – P2p. Аналитическая глубина 10 нм.
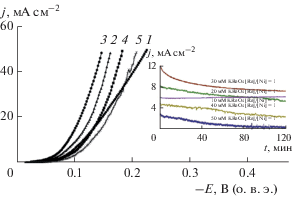
Каталитическая активность рений-никелевых систем, содержащих 30–40 ат. % рения, в РВВ в щелочных растворах мала. По этой причине представляло интерес исследовать кинетику РВВ на Ni–Re–P-катодах в кислых растворах. Полученные результаты (рис. 9) показали, что в 0.5 М растворе серной кислоты РВВ протекает с небольшим перенапряжением, не превышающим 100–150 мВ, что можно считать удовлетворительным результатом. Токи, соответствующие РВВ, для осадка, полученного из раствора с концентрациями соединений никеля и рения 30 мМ, уменьшаются за 2 ч катодной поляризации в растворе серной кислоты при E = –0.1 В (о. в. э.) приблизительно в 1.8 раза (рис. 9, вставка). На покрытиях, осажденных из растворов с меньшей концентрацией соединений металлов (10 мМ), стабильность процесса электрохимического выделения водорода выше. Причины обнаруженного отличия пока до конца не понятны. Возможно, что это связано с увеличением содержания фосфора в полученных покрытиях (табл. 4).
Рис. 9.
Поляризационные кривые РВВ в 0.5 М H2SO4 на Ni–Re–P-катодах, полученных восстановлением гипофосфитом натрия из растворов с c(${\text{ReO}}_{{\text{4}}}^{--}$)/c(Ni(II) = 1 и концентрацией солей металлов, мМ: 1 – 10, 2 – 20, 3 – 30, 4 – 40, 5 – 50. На врезке – потенциостатические транзиенты тока на этих катодах при E = –0.1 В (о. в. э.).
ВЫВОДЫ
1. Наиболее каталитически активные Re–Ni-сплавы, полученные электроосаждением, обладают аморфной структурой: для них характерно отсутствие дальнего порядка в расположении атомов рения и никеля. Термообработка в вакууме приводит к кристаллизации Re-содержащей фазы, что приводит к снижению каталитической активности Re–Ni-катодов в РВВ.
2. Электрохимическое выделение водорода на Ni–Re–P-покрытиях, полученных химическим осаждением с использованием гипофосфита натрия в качестве восстановителя, перспективно для катализа РВВ в кислых растворах. Содержание рения в осадках, полученных химико-каталитическим осаждением, меньше по сравнению с электролитическими сплавами Re–Ni.
Список литературы
Фрумкин, А.Н. Избранные труды. Перенапряжение водорода, / Отв. ред. акад. Б.П. Никольский. М. Наука. 1988. С. 240–254.
Brooman, A.W. and Kuhn, A.T., Correlation between the rate of the hydrogen electrode reaction and the properties of alloys, J. Electroanal. Chem. Interfacial Electrochem, 1974. vol. 49, p. 325. https://doi.org/10.1016/S0022-0728(74)80165-8
McCrory, Ch.C.L., Jung, S., Ferrer, I.M., Chatman, Sh.M., Peters, J.C., and Jaramillo, T.F., Benchmarking HER and OER Electrocatalysts for Solar Water Splitting Devices, J. Am. Chem. Soc., 2015. vol. 137, p. 4347. https://doi.org/10.1021/ja510442p
Petrii, O.A. and Tsirlina, G.A., Electrocatalytic Activity Prediction for Hydrogen Electrode Reaction: Intuition, Art, Science, Electrochim. Acta, 1994, vol. 39, p. 1739. https://doi.org/10.1016/0013-4686(94)85159-X
Trasatti, S., Work function, electronegativity, and electrochemical behaviour of metals: III. Electrolytic hydrogen evolution in acid solutions, J. Electroanal. Chem. Interfacial Electrochem, 1972, vol. 39, p. 163. https://doi.org/10.1016/S0022-0728(72)80485-6
Jakšic, M.M., Electrocatalysis of hydrogen evolution in the light of the Brenner-Engel theory for bonding in metals and intermetallic phases, Electrochim. Acta, 1984, vol. 29, p. 1539. https://doi.org/10.1016/0013-4686(84)85007-0
Schmickler, W. and Santos, E, Interfacial Electrochem. Sec. Ed. Berlin; Heidelberg Springer-Verlag, 2010, p. 163
Nørskov, J.K., Bligaard T., Logadottir A., Kitchin J.R. Chen J.G. Pandelov S., and Stimming U., Trends in the Exchange Current for Hydrogen Evoltion., J. Electrochem. Soc., 2005, vol. 152, p. J23. https://doi.org/10.1149/1.1856988
Kuznetsov, V.V., Gamburg, Yu.D., Zhulikov, V.V., Batalov, R.S., and Filatova, E.A., Re–Ni cathodes obtained by electrodeposition as a promising electrode material for hydrogen evolution reaction in alkaline solutions, Electrochim. Acta, 2019, vol. 317, p. 358. https://doi.org/10.1016/j.electacta.2019.05.156
Popczun, E.J., McKone, J.R., Read, K.G., Biacchi, A.J., Wiltrout, A.M., Lewis, N.S., and Schaak, R.E., Nanostructured Nickel Phosphide as an Electrocatalyst for the Hydrogen Evolution Reaction, J. Am. Chem. Soc. 2013, vol. 135, p. 9267. https://doi.org/10.1021/ja403440e
Feng, L., Vrubel, H., Bensimon, M., and Hu, X., Easily prepared dinickel phosphide (Ni2P) nanoparticles as an efficient and robust electrocatalyst for hydrogen evolution, Phys. Chem. Chem. Phys., 2014, vol. 16, p. 5917. https://doi.org/10.1039/C4CP00482E
Luo, P., Zhang, H., Liu, L., Zhang, Y., Deng, J., Xu, Ch., Hu, N., and Wang, Y., Targeted synthesis of unique nickel sulfides (NiS, NiS2) microarchitectures and the applications for the enhanced water splitting system, ACS Appl. Mater. Interfaces, 2017, vol. 9, p. 2500. https://doi.org/10.1021/acsami.6b13984
Shang, X., Yan, K.-L., Rao, Y., Dong, B., Chi, J.-Q., Liu, Y.-R., Li, X., Chai, Y.-M., and Liu, Ch.-G. In situ cathodic activation of V-incorporated NixSy nanowires for enhanced hydrogen evolution, Nanoscale, 2017, vol. 9, p. 12353, https://doi.org/10.1039/C7NR02867A
Bhat, K.S. and Nagaraja, H.S., Nickel selenide nanostructures as an electrocatalyst for hydrogen evolution reaction, Int. J. Hydrogen Energy, 2018, vol. 43, p. 19851. https://doi.org/10.1016/j.ijhydene.2018.09.018
Xiong, W., Guo, Q., Guo, Z., Li, H., Zhao, R., Chen, Q., Liu, Zh., and Wang, X. Atomic Layer Deposition of Nickel Carbide for Supercapacitors and Electrocatalytic Hydrogen Evolution, J. Mater. Chem. A., 2018, vol. 6, p. 4297. https://doi.org/10.1039/C7TA10202J
Bai, J., Sun, Q., Wang, Z., and Zhao, Ch., Electrodeposition of Cobalt-Nickel Hydroxide Composite as a High-Efficiency Catalyst for Hydrogen Evolution Reactions, J. Electrochem. Soc., 2017, vol. 164, p. H587, https://doi.org/10.1149/2.0761709jes
Кузнецов, В.В., Гамбург, Ю.Д., Жуликов, В.В., Баталов, Р.С., Филатова, Е.А. Электрохимический синтез сплава никель–рений и его электрокаталитические свойства. Гальванотехника и обработка поверхности. 2018. Т. XXVI. № 4. P. 4.
Duhin, A., Inberg, A., Eliaz, N., and Gileadi, E., Electroless plating of nickel-rheniun alloys, Electrochimica Acta, 2011, vol. 56, p. 9637. https://doi.org/10.1016/j.electacta.2011.05.030
Moulder, J.F., Stickle, W.F., Sobol, P.E., and Bomben K.D. / Ed. J Chastain. Handbook of X-ray Photoelectron Spectroscopy, Eden Prairie MN, Perkin-Elmer Corporation, 1992.
Chernyshov, A.A., Veligzhanin A.A., and Zubavichus, Y.V., Structural Materials Science end-station at the Kurchatov Synchrotron Radiation Source: Recent instrumentation upgrades and experimental results, Nucl. Instr. Meth. Phys. Res., 2009, vol. 603, p. 95. https://doi.org/10.1016/j.nima.2008.12.167
Ravel, B. and Newville M. ATHENA, ARTEMIS, HEPHAESTUS: data analysis for X-ray absorption spectroscopy using IFEFFIT, J. Synchrotron Rad., 2005, vol. 12, p. 537. https://doi.org/10.1107/S0909049505012719
Ankudinov, A.L., Ravel, B., Rehr, J.J., and Conradson, S.D., Real-space multiple-scattering calculation and interpretation of x-ray-absorption near-edge structure, Phys. Rev. B, 1998, vol. 58, p. 7565. https://doi.org/10.1103/PhysRevB.58.7565
Кузнецов, В.В., Гамбург, Ю.Д., Жалнеров, М.В., Жуликов, В.В., Баталов, Р.С. Реакция выделения водорода на электролитических сплавах Co–Mo (W) и Ni–Re в щелочных средах. Электрохимия. 2016. Т. 52. С. 1011. https://doi.org/10.7858/S0424857016090061
Vargas-Uscategui, A., Mosquera, E., Chornik, B., and Cufaentes, L. Electrocatalysis of the hydrogen evolution reaction by rhenium oxides electrodeposited by pulse-current, Electrochim. Acta, 2015, vol. 178, p. 739, https://doi.org/10.1016/j.electacta.2015.08.065
Garcia-Garcia, A., Ortega-Zarzosa, G., Rincon, M.E., and Orozco, G., The Hydrogen evolution reaction on rhenium metallic electrodes: a selected review and new experimental evidence, Electrocatalysis, 2015, vol. 6, p. 263. https://doi.org/10.1007/s12678-014-0240-z
Danilovich, N., Subbaraman, R., Strmcnik, D., Chang, K.-Ch., Paulikas, A.P., Stamenkovic, V.R., and Markovic, N.M., Enhancing the Alkaline Hydrogen Evolution Reaction Activity through the Bifunctionality of Ni(OH)2/Metal Catalysts, Angew. Chem. Int. Ed. Engl., 2012, vol. 51, p. 12495. https://doi.org/10.1002/anie.201204842
Subbaraman, R., Tripkovic, D., Chang, K.-Ch., Strmcnik, D., Paulikas, A.P., Hirunsit, P., Chan, M., Greeley, J., Stamenkovic, V., and Markovic, N.M., Trends in activity for the water electrolyser reactions on 3d M (Ni,Co,Fe,Mn) hydr(oxy)oxide catalysts, Nat. Mater., 2012, vol. 11, p. 550. https://doi.org/10.1038/nmat3313
Gennero de Chialvo, M.R. and Chialvo, A.C., Hydrogen evolution reaction: analysis of the Volmer–Heyrovsky–Tafel mechanism with a generalized adsorption model, J. Electroanal. Chem., 1994, vol. 372, p. 209. https://doi.org/10.1016/0022-0728(93)03043-O
Бендерский, В.А., Овчинников, А.А. Механизм реакций электрохимического выделения водорода. Физическая химия. Современные проблемы. Гл. ред. Я.М. Колотыркин Т. 1. М.: Химия, 1980. С. 202.
Sheng W., Gasteiger H.A., and Shao-Horn Y., Hydrogen Oxidation and Evolution Reaction Kinetics on Platinum: Acid and Alkaline Electrolytes, J. Electrochem. Soc., 2010, vol. 157, p. B1529. https://doi.org/10.1149/1.3483106
Skúlason, E., Karlberg, G.S., Rossmeisl, J., Bligaard, T., Greeley, J., Jonsson, H., and Norskov, J.K., Density functional theory calculations for the hydrogen evolution reaction in an electrochemical double layer on the Pt(111) electrode, Phys. Chem. Chem. Phys., 2007, vol. 9, p. 3241. https://doi.org/10.1039/B700099E
Кузнецов, В.В., Гамбург, Ю.Д., Баталов, Р.С., Жуликов, В.В., Зайцев, В.А. Реакция выделения водорода на каталитически активном сплаве Ni–Re, полученном электроосаждением. Исследование методом электрохимического импеданса. Электрохимия. 2018. Т. 54. С. 686. https://doi.org/10.1134/S1023193518070054
Diegle, R.B., Sorensen, N.R., and Nelson, G.C. Dissolution of Glassy Ni–P Alloys in H2SO4 and HCl Electrolytes, J. Electrochem. Soc., 1986, vol. 133, p. 1769. https://doi.org/10.1149/1.2109016
Kuznetsov, V.V., Vinokurov, E.G., Telezhkina, A.V., and Filatova, E.A., Electrodeposition of corrosion-resistant Cr–P and Cr–P–W coatings from solutions based on compounds of trivalent chromium, J. Solid State Electrochem., 2019, vol. 23, p. 2367. https://doi.org/10.1007/s10008-019-04347-w
Bard, A.J., Parsons, R., Jordan, J. Standard Potentials in Aqueous Solutions, N.Y., Marcel Dekker, 1985.
Лурье, Ю.Ю. Справочник по аналитической химии. М.: Химия. 1971. С. 268.
Vajo, J.J., Aikens, D.A., Ashley L., and Poelty, D.E., Facile electroreduction of perrhenate in weakly acidic citrate and oxalate media, Inorg. Chem., 1981, vol. 20, p. 3328. https://doi.org/10.1021/ic5022a037
Ahmad, Z., Principles of Corrosion Engineering and Corrosion Control, Amsterdam, Elsevier, 2006.
Дополнительные материалы отсутствуют.


