Электрохимия, 2020, T. 56, № 10, стр. 921-940
Интенсификация окисления муравьиной кислоты с применением матрицы из оксида циркония для иммобилизации каталитических наночастиц благородных металлов
И. А. Рутковска a, *, П. Краковка a, М. Яжебска a, К. Чарниески a, М. Крех a, К. Собковиц a, К. Здунек a, З. Галюс a, П. Ю. Кулеша a, **
a Варшавский Университет
Варшава, Польша
* E-mail: ilinek@chem.uw.edu.pl
** E-mail: pkulesza@chem.uw.edu.pl
Поступила в редакцию 31.10.2019
После доработки 19.01.2020
Принята к публикации 20.02.2020
Аннотация
Электрокаталитическую активность обычных благородных металлов (платина, биметалл платина–рутений и палладий) в форме наночастиц (как без носителя, так и на носителях Vulcan) по отношению к электроокислению муравьиной кислоты в кислой среде (0.5 М H2SO4) можно существенно интенсифицировать, диспергируя их на тонкой пленке оксида циркония (ZrO2). Эта интенсификация проявляется в увеличении плотности электрокаталитического тока (нормированной на массу благородных металлов-катализаторов), регистрируемой в условиях как циклической вольтамперометрии, так и хроноамперометрии. Эти наблюдения можно рационально объяснить в представлениях о способности наноструктур оксида циркония поставлять активные гидроксильные группы, способствующие удалению ингибирующих адсорбатов типа COOH или CO с их поверхности. Роль носителей Vulcan заключается в улучшении электронной проводимости, в дополнение к их способствованию в распределении центров металла-катализатора по электрокаталитической поверхности. Если говорить о несхожих механизмах окисления HCOOH на наночастицах Pt, PtRu и Pd, то способность оксида циркония к активации меняется в зависимости от приложенного потенциала, отражая таким образом конкретную природу электронных или химических взаимодействий. Возможны также специфические взаимодействия между подложкой из оксида циркония и наночастицами благородных металлов, в частности, в случае катализаторов на основе Pd, когда этот эффект интенсификации наиболее хорошо выражен. Наконец, следует подчеркнуть, что исторически представители Русской электрохимической школы, включая В.С. Багоцкого, одни из первых в мире исследовали окисление муравьиной кислоты и подчеркнули важность взаимодействий металл–подложка в электроокислении небольших органических молекул на наночастицах благородных металлов.
ВВЕДЕНИЕ
Применение муравьиной кислоты (HCOOH) в низкотемпературных топливных элементах подверглось интенсивному исследованию благодаря нескольким привлекательным свойствам этих топливных элементов, включая невоспламеняемость, способность к биодеградации, достаточно быструю кинетику электроокисления, более низкий (по сравнению с метанолом) кроссовер топлива через нафионовую мембрану, способность создавать высокое заполнение протонами в анодном пространстве топливного элемента [1–4].
Динамика и механизм электроокисления муравьиной кислоты сильно зависят от используемого электрокаталитического материала. На Pt-катализаторах эта реакция протекает по механизму с двумя параллельными путями [5–7], включающему как простую дегидрогенизацию, ведущую непосредственно к образованию CO2, так и второй параллельный путь реакции, включающий стадию дегидратации, аналогичную той, что имеет место в окислении метанола и приводит к образованию адсорбированного моноксида углерода в качестве промежуточного продукта этой реакции. Для того чтобы удалить пассивирующие промежуточные частицы CO путем их окисления до CO2, на поверхность Pt необходимо ввести группы OH. При таких условиях в электроокислении муравьиной кислоты также возможен параллельный первый путь (прямое окисление до CO2) [8–10].
По сравнению с Pt с чистой поверхностью, добавление Ru с образованием биметаллического PtRu-катализатора позволяет работать при более низких перенапряжениях и лучше противостоять отравлению катализатора промежуточными продуктами типа CO, в особенности, при окислении метанола в кислых средах [11–14]. Поскольку муравьиная кислота возникает как промежуточный продукт при разложении метанола на платине [15–17], неудивительно, что при окислении муравьиной кислоты PtRu демонстрирует гораздо более высокую электрокаталитическую активность по сравнению с простой Pt сравнимой нанопористости [8].
Было установлено, что на катализаторах на основе Pd электроокисление муравьиной кислоты может протекать по наиболее желательному пути реакции, а именно через простую дегидрогенизацию и индуцированное группами OH разложение промежуточного продукта HCOOad до CO2 в качестве скоростьопределяющей стадии [18–22]. Соответственно, в центре существенного интереса оказалась разработка высокоактивных катализаторов на основе Pd путем сплавления с другими металлами [5, 23, 24], оптимизация изготовления катализаторов, наноструктурирование [25–31] или даже нанесение их на подложки из ряда оксидов [32–39]. К сожалению, наблюдалась медленная деактивация катализаторов на основе Pd, связанная с трудностями массопереноса и появлением на Pd-поверхностях отравляющих их CO-адсорбатов, которые часто соадсорбируются с формиатом и (би)сульфатом [40–44].
С практической точки зрения, наночастицы металлов необходимо диспергировать на надежных в эксплуатации проводящих подложках с большой площадью поверхности и подходящей пористостью, облегчающих подачу реагента в условиях топливного элемента [45–47]. Углеродные носители, включая сажи Vulcan XC-72, – это хорошие кандидаты для иммобилизации каталитических наночастиц [48–52]. Наноструктуры из некоторых оксидов металлов тоже могут индуцировать электрокаталитические реакции, благодаря их уникальным адсорбционным свойствам, большой электрохимически активной площади и специфической химической реакционной способности. При контакте оксидов металлов с водными электролитами их поверхности сразу покрываются гидроксильными группами, благоприятно влияющими на подвижность протонов и таким образом – на общую реакционную способность. Более того, оксиды некоторых переходных металлов могут существовать одновременно в нескольких состояниях окисления, сообщая системе четкие химические черты, включая смешанную электронную и ионную проводимость [53–57].
Среди представителей наноструктурированных подложек из оксидов металлов следует назвать оксиды вольфрама [58–62], титана [57, 62–66], циркония [67–72], церия [73–75], ванадия [76] и смешанные оксиды металлов, такие как WO3/ZrO2 [77, 78]. Важное место оксида циркония(IV) (ZrO2) является общепринятым в катализе (в приложении к высокотемпературному сенсорному определению кислорода [79], с учетом высокой межфазной кислотности этой системы [57, 80, 81]) и во многих промышленных процессах, включая гидратацию–дегидратацию, изомеризацию, окисление, конденсацию и конверсию метанола в диметиловый эфир [82]. В условиях электрохимического эксперимента, благодаря высокому заполнению мест на поверхности ZrO2 гидроксильными группами, постулируют десорбцию CO-адсорбатов с каталитических центров Pt [57, 83]. Также большое значение имеет существование многочисленных мостиковых и внешних гидроксильных групп на многоядерных ионных кластерах типа цирконила (ZrO2+ или Zr(OH)3+), существующих в кислых средах [84]. Установлено, что введение наноструктурированного углерода (например, сажи Vulcan, углеродных нанотрубок) улучшает распределение электронов и использование металлических (например, Pt) центров, рассредоточенных по полупроводниковой ZrO2-матрице на электрокаталитической границе раздела [57, 71].
В настоящей работе мы рассматриваем гибридные электрокаталитические системы (для электроокисления муравьиной кислоты), использующие наноструктурированные матрицы из оксида циркония (ZrO2) для диспергирования на них трех типов наночастиц из хорошо выраженных каталитических металлов (Pt, PtRu и Pd) как в первозданном виде (без носителя), так и на углеродной подложке (Vulcan). Хотя дисперсность и электрохимически активная площадь поверхности наночастиц благородных металлов на подложке Vulcan, несомненно, больше, но все же исследование катализаторов в их первозданном виде (без носителя) ставит целью выявление непосредственного взаимодействия между оксидом циркония и благородными металлами в отсутствие третьих компонентов (Vulcan). Наши электрохимические “диагностические” эксперименты проводились методами вольтамперометрии и хроноамперометрии в растворах H2SO4 и муравьиной кислоты. Полученные результаты, в общем и целом, согласуются с той точкой зрения, что плотность электрокаталитического тока окисления муравьиной кислоты возрастают после диспергирования платиновых, платино-рутениевых и палладиевых катализаторов (как без носителя, так и на носителе Vulcan) на наноструктурированные матрицы из оксида циркония. Поскольку механизм окисления HCOOH на наночастицах Pt, PtRu и Pd носит четко выраженный характер, способность оксида циркония к активации в каждом отдельном случае различна; возможно, она отражает различия в электронных или химических взаимодействиях оксида с каталитическими местами на Pt, PtRu или Pd. Следует отметить, что наиболее хорошо выраженный эффект активирования со стороны ZrO2-матрицы наблюдался при окислении муравьиной кислоты на наночастицах палладия (как без носителя, так и на носителе Vulcan). В этом случае, похоже в дополнение к сильным кислотным свойствам оксида циркония, увеличивающим подвижность протонов, действуют как специфическое электронное взаимодействие между ZrO2 и наночастицами металла, так и химическая активность гидроксильных (OH) групп по отношению к окислительному удалению отравляющих электрод промежуточных продуктов (например, типа CO). Использование углеродных (Vulcan) носителей облегчает дисперсность наночастиц каталитического металла и распределение заряда (проводимости) внутри каталитического слоя.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Химические реактивы имели квалификацию “чистые для анализа”. Наночастицы оксида циркония(IV), в виде дисперсии в воде (5 вес. %), палладиевая чернь и 5%-ный раствор нафиона (Nafion-110) были приобретены у компании Aldrich. Платиновая чернь (Pt) и наночастицы платина–рутений (PtRu; Pt : Ru = 50 : 50) были приобретены у компании Alfa Aesar. Наночастицы 20% платиновой черни на Vulcan XC72 (Pt/C) и 20% платино-рутениевой черни (50 : 50% по атомному весу) на Vulcan XC72 (PtRu/C) были приобретены у компании E-TEK. Образцы 20% палладия на Vulcan XC72 (Pd/V) были приобретены у компании Premetek. Серная кислота и муравьиная кислота были приобретены у компании POCH (Польша).
Все растворы были приготовлены на дважды перегнанной и далее деионизированной (Millipore Milli-Q) воде. Их освобождали от кислорода, пробулькивая высокочистый азот. Измерения проводили при комнатной температуре (22 ± 2°C).
Электрохимические измерения проводили, используя электрохимический комплекс CH Instruments (Остин, США), модель 760D, в трехэлектродной конфигурации. Стеклоуглеродный рабочий электрод имел форму диска с геометрической площадью поверхности 0.071 cм2. Электродом сравнения являлся Hg2SO4/K2SO4(насыщ.) – электрод, а противоэлектродом – углеродный стержень. Все потенциалы в настоящей работе пересчитаны на обратимый водородный электрод (ОВЭ).
Осаждение пленок ZrO2 [39, 66, 70–72, 77, 78] проводили на поверхность стеклоуглеродного электрода методом агрегирования золь–гель, индуцированного вольтамперометрическим циклированием путем приложения 25 полных циклов потенциала (при скорости развертки потенциала 10 мВ с–1) в области потенциалов от 0.04 до 1.04 В (ОВЭ) в растворе для модифицирования, полученном диспергированием 0.3 мл водной суспензии наночастиц ZrO2 (5 вес. %) в 30 мл раствора H2SO4 (0.5 М). Рентгеновские дифрактограммы пленок ZrO2 демонстрируют пики, характерные для моноклинной фазы. Профилометрическая толщина пленок ZrO2 близка к 200–300 нм, как было показано ранее [70–73]. Отсюда следует, что массовая нагрузка ZrO2 находится на уровне порядка 1 мкг cм–2.
Суспензии (чернила) наночастиц металлов с сажей Vulcan и без нее были приготовлены путем диспергирования 7.1 мг коммерческих образцов под действием ультразвука в течение 120 мин в 2.0 cм3 дистиллированной воды до получения однородной смеси. Затем 2 мкдм3 этих чернил помещали на поверхность пленки для получения следующих нагрузок благородными металлами: 100 мкг cм–2 в случае наночастиц Pt, PtRu и Pd без носителя, 20 мкг cм–2 наночастиц Pt/C, PtRu/C и Pd/C на носителе Vulcan.
В приготовлении каталитических слоев, использующих наночастицы металлов на ZrO2-подложке, содержащие и не содержащие Vulcan, первая стадия – это осаждение матрицы из оксида циркония. После стадии сушки в условиях окружающей среды в течение 1.5 ч, 2.0 мкдм3 нужной суспензии наночастиц каталитического металла (на носителе Vulcan или без него) наносили на поверхность пленки.
Как правило, пленки были покрыты ультратонким слоем полиэлектролита Нафион путем осаждения на них 1 мкдм3 раствора Нафиона (приготовленного добавлением 5 мас. % коммерческого раствора Нафиона в этанол в объемном отношении 1–10) и стабилизированы.
Эти каталитические материалы (пленки) вначале были предобработаны в деаэрированном растворе электролита (0.5 М H2SO4) путем повторяющегося циклирования потенциала в диапазоне от 0.04 до 1.04 В (ОВЭ) при скорости развертки потенциала 10 мВ с–1 в течение 30 мин. Перед началом собственно электрокаталитического эксперимента электрод доводился до кондиционного состояния путем циклирования потенциала (10 полных циклов при скорости развертки потенциала 10 мВ с–1) в интервале потенциалов от 0.04 до 1.04 В (ОВЭ) в растворе 0.5 М HCOOH + + 0.5 М H2SO4. Перед записью каждой типичной вольтамперограммы рабочий электрод выдерживали в течение 20 с (“мертвый час”) при начальном потенциале.
Вычисление реальной площади поверхности, характерной для наночастиц Pt, выполнялось в предположении, что один атом водорода может адсорбироваться на одном активном центре на поверхности платины, где и происходит переход заряда [85]. Таким образом, интегрируя площадь под адсорбционным пиком водорода (рис. 6а и 7а), после поправки на ток фона и используя коэффициент пересчета 210 мкКл cм–2 для Pt без носителя и на носителе Vulcan (Pt/V), мы получили значения, соответственно, 20 и 115 м2 г–1; площади активной поверхности (полученные, как описано выше) составляют ~39 м2 г–1 как в присутствии, так и в отсутствие ZrO2.
Площади электрохимической поверхности PtRu-каталитических центров оценивали с помощью диагностических экспериментов (для простоты эти данные не приводятся) с использованием субпотенциального осаждения (UPD) меди с ее последующим растворением (по методике, описанной в работах [86, 87]). Медь охотно вступает в процесс субпотенциального осаждения как на платине, так и на рутении из-за близости атомных радиусов, соответственно, Cu (128 пм), Pt (138 пм) и Ru (134 пм). Интегрируя площадь под пиком стравливания меди, после поправки на ток фона (измеренный в отсутствие осажденной меди), и используя коэффициент пересчета 420 мкКл cм–2, мы получили (по вышеописанной методике) реальную активную площадь поверхности биметаллического сплава PtRu (как в отсутствие носителя, так и осажденного на ZrO2) на уровне 19 м2 г–1. В случае PtRu без носителя и на носителе Vulcan (PtRu/V), активная площадь поверхности (полученная по вышеописанной методике) равняется приблизительно 39 м2 г–1 как в присутствии, так и в отсутствие ZrO2.
В случае наночастиц палладия, без носителя (Pd) и на носителе Vulcan (Pd/C), мы оценили заряд под пиком восстановления PdO (рис. 10а и 11а) и, соответственно, вычислили площадь электрохимически активной поверхности, используя коэффициент пересчета 424 мкКл cм–2 (относящийся к монослойному покрытию PdO) [88, 89]. Она составила 20 и 115 м2 г–1, соответственно, для Pd и Pd/C, независимо от того, осажден ли металл на ZrO2 или нет.
Микрофотографии наночастиц оксида циркония ZrO2 были получены методом просвечивающей электронной микроскопии (ТЕМ) на приборе JEM 1400 (JEOL Co., Япония, 2008), снабженном цифровой камерой высокого разрешения (CCD MORADA, SiS-Olympus, Германия).
Морфологию пленок исследовали методом сканирующей электронной микроскопии (SEM) на анализаторе Roentec, модель M1, EDX (Германия), совмещенном с LEO, модель 435 VP, при ускоряющем напряжении 15 кВ.
Измерения методом атомно-силовой микроскопии (AFM) проводили на приборе 5500AFM (Agilent Technologies, Санта Клара, США). Изображения записывали на воздухе в моде прерывистого контакта с кантилевером PPP-NCSTR (Nanosensors).
ИК-спектры снимали на спектрометре Shimadzu 8400 FTIR, укомплектованном модулем для измерения спектров ИК-отражения Specular Reflectance Accessory, модель 500 (Spectra Tech). Угол падения пучка равнялся 80° по отношению к нормали к поверхности. В типичном случае усредняли 1000 сканов для получения одного спектра отражения.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Физико-химические характеристики матрицы из оксида циркония и наночастиц каталитических металлов
Рисунок 1 иллюстрирует (а) микрофотографии наночастиц оксида циркония, полученные методом трансмиссионной электронной микроскопии, а также (б) сканирующей электронной микроскопии и (в) атомно-силовой микроскопии пленок ZrO2 на стеклоуглероде. Микрофотографии рис. 1а и 1б согласуются между собой в том, что касается высокой пористости пленок, а также гранулярной морфологии осадков оксида циркония, что согласуется с более или менее выраженным агломеративным характером наночастиц оксида циркония, размер которых варьируется от 10 до 20 нм (рис. 1а и 1в).
Рис. 1.
(а) TEM-, (б) SEM- и (в) AFM-микрофотографии исходных (неиммобилизованных на носителе) наночастиц ZrO2.

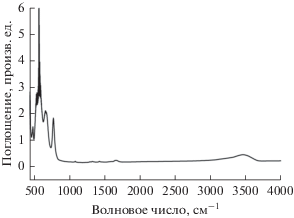
На рис. 2 показан традиционный ИК-спектр с преобразованием Фурье наночастиц ZrO2 в KBr. Полосы, наблюдаемые приблизительно при 3456 и 1637 cм–1, следует приписать изгибным и валентным колебаниям связей O–H в адсорбированных молекулах воды. Здесь хорошо видно существование колебаний O–H, в частности, вблизи 3500 cм–1. Резкая полоса при 744 cм–1 характерна для моноклинного ZrO2. Пик при 535 cм–1 и плечо при 634 cм–1 следует приписать колебаниям связи Zr–O в тетрагональном ZrO2 [90–92]. Основываясь на прежних исследованиях [91, 93, 94], пик ИК-колебаний при ~500 cм–1 обычно приписывают характеристическим колебаниям в кубическом оксиде циркония. Явление расщепления колебательного пика, характерное для кубического оксида циркония, может отражать зависящее от размера частиц ZrO2 образование тетрагональной и моноклинной фаз оксида циркония, в дополнение к моноклинной фазе.
На рис. 3а показаны циклические вольтамперограммы, записанные при осаждении пленок оксида циркония в коллоидной смеси для модифицирования, содержащей наночастицы оксида циркония, взвешенные в серной кислоте. При таких условиях поверхность наноструктур ZrO2 покрыта оксокатионами ZrO2+, ZrOH3+ или [Zr3(OH)4]3+ [84]. Хотя оксид циркония не электроактивен, разумно ожидать, что сканирование потенциала к отрицательным значениям индуцирует агломерирование положительно заряженных наноструктур оксида циркония в результате уменьшения отталкивательных сил. Тот факт, что при циклировании потенциала токи систематически растут, скорее всего отражает явления емкостного заряжения/разряда, сопровождающие рост пленок ZrO2 [95]. Для сравнения, на рис. 3б приведена циклическая вольтамперограмма стеклоуглеродной подложки, подвергнутой повторяющемуся циклированию потенциала при условиях рис. 3а. Само появление тока, растущего в исследованном интервале потенциалов, может отражать существование окислительно-восстановительных процессов, относящихся к межфазному окислению углеродной подложки, включая образование поверхностных соединений типа карбоксилата или альдегида вблизи потенциалов 0.5–0.7 В. В любом случае токи, источником которых является электрохимия стеклоуглеродной подложки, относительно невелики (рис. 3в) по сравнению с токами, связанными со слоем на поверхности оксида циркония (рис. 3а).
Рис. 3.
Циклические вольтамперограммы, записанные при (а) электроосаждении пленок ZrO2 на стеклоуглерод и (б) циклировании стеклоуглеродного электрода в той же области потенциалов. Электролит 0.5 М H2SO4. Скорость развертки потенциала 10 мВ с–1.
Вышеописанные пленки оксида циркония служили матрицей для наночастиц каталитических металлов. На рис. 4 показаны микрофотографии, полученные методом ТЕМ, следующих наночастиц: (a) Pt на подложке из сажи Vulcan, (б) PtRu на подложке из сажи Vulcan, и (В) Pd на подложке из сажи Vulcan. Здесь Pt-, PtRu- и Pd-наночастицы имеют диаметр около 2–4 нм; их размер меньше, чем размер частиц носителя Vulcan (30–40 нм). На рис. 5 показаны микрофотографии, полученные методом ТЕМ, наночастиц без носителя. Эти наночастицы Pt, PtRu и Pd имеют несколько больший размер: соответственно, приблизительно 7–8 (рис. 5а), 3–4 (рис. 5б) и 8–10 (рис. 5в) нм. Все эти наночастицы проявляют склонность к образованию агломератов.
Характеристики наночастиц Pt на носителе Vulcan, диспергированных на пленке ZrO2
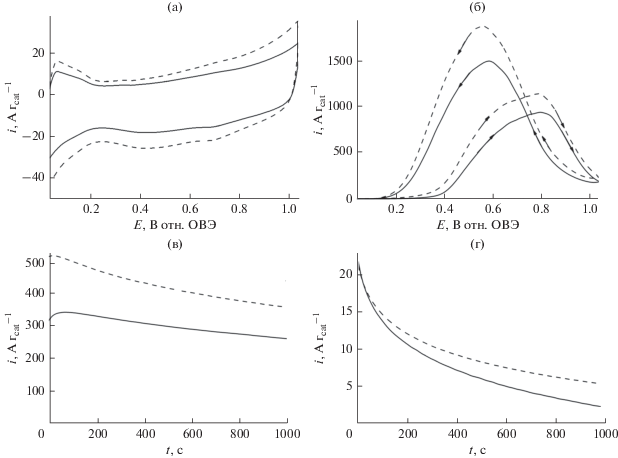
На рис. 6а даны циклические вольтамперограммы, записанные в кислой среде (0.5 М H2SO4) на наночастицах Pt на носителе Vulcan без ZrO2 (Pt/C) (сплошная линия) и наночастиц Pt/C, осажденных на слой наноструктурированного оксида циркония. Доминантой этих вольтамперограмм являются пики тока, характерные для платины: пики адсорбции/десорбции водорода и образования оксида наблюдаются, соответственно, при более низких и более высоких потенциалах [3, 8, 11, 16, 39]. Хотя ZrO2 не электроактивен в исследуемой области потенциалов, наблюдаемое некоторое увеличение тока, по-видимому, отражает емкостные свойства пленок ZrO2 (их заряжение/разряд) [95]. Вклад емкостных токов, очевидно, сильнее выражен в присутствии углеродных наноструктур, способных облегчать распространение заряда в пленке (сравн. пунктирные линии на рис. 6а и 7а). Рост тока вблизи потенциалов 0.5–0.6 В, по-видимому, отражает наличие окислительно-восстановительных процессов межфазного окисления углеродных компонентов (здесь – Vulcan) до поверхностных соединений типа карбоксилатов или альдегидов. Подобные вольтамперометрические особенности ранее наблюдались для наноструктур TiO2 на углеродных подложках [64]. Наконец, тот факт, что пики адсорбции водорода (на Pt) не подавлены в присутствии ZrO2, согласуется с той точкой зрения, что гидроксильные группы, возникающие на поверхности оксида циркония, облегчают процессы с участием протонов, одновременно исключая возможность сильных адсорбционных взаимодействий с наноструктурами платины.
Рис. 6.
(а) Циклические вольтамперограммы электрокатализаторов Pt/C (сплошная кривая) и Pt/C, осажденного на ZrO2 (пунктирная кривая). (б) Окисление муравьиной кислоты (0.5 М) в условиях вольтамперометрии на наночастицах Pt/C (сплошная кривая) и Pt/C, осажденных на оксид циркония. Электролит: 0.5 М H2SO4. Скорость развертки потенциала: 10 мВ с–1. Хроноамперограммы, записанные при (в) 0.34 и (г) 0.24 В в ходе окисления муравьиной кислоты (0.5 М) на наночастицах Pt/C (сплошная кривая) и Pt/C, осажденных на ZrO2 (пунктирная кривая). Электролит: 0.5 М H2SO4.
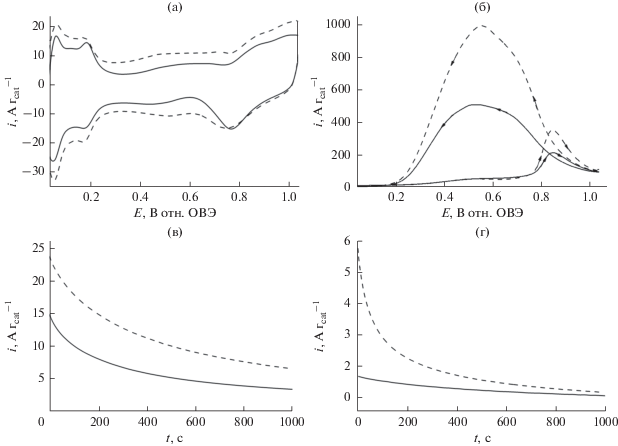
Рисунок 6б отсылает нас к окислению муравьиной кислоты (0.5 М) в условиях вольтамперометрии (рис. 6а) на следующих электродных материалах: наночастицы Pt/C без носителя (сплошная линия) и наночастицы Pt/C, диспергированные на слое наноструктурированного оксида циркония (пунктирная линия). Видно, что в области потенциалов от 0.20 до 1.04 В плотность тока окисления муравьиной кислоты выше на наночастицах Pt/C, диспергированных на оксиде циркония (по сравнению с системой ZrO2). В частности, мы наблюдаем развитие пиков тока окисления при 0.80–0.85 В. Причина этих пиков – каталитическая активность оксидов Pt, а они появляются при потенциалах, чересчур положительных для того, чтобы быть совместимыми с технологией низкотемпературных топливных элементов. На обратных сканах можно наблюдать даже более высокие токи окисления при потенциалах ниже 0.75 В, где генерируются чистые (т.е., свободные от ингибирующих адсорбатов) высокоактивные центры Pt0. Вышеописанное электрохимическое поведение системы согласуется с той точкой зрения, что электроокисление муравьиной кислоты на наночастицах Pt протекает по механизму двух путей: простая дегидрогенизация, ведущая непосредственно к образованию CO2, и непрямой путь, включающий адсорбцию промежуточных частиц CO, существенно отравляющих активность Pt-катализаторов. Наблюдаемое возрастание тока (рис. 6б) следует объяснить присутствием соединений ZrO2, а именно межфазных гидроксильных групп поблизости от каталитических центров Pt. При таких условиях улучшается общая устойчивость по отношению к ингибирующим CO-адсорбатам, предположительно, благодаря стимулированию их окислительного удаления [57].
Для того чтобы получить больше информации о электрокаталитическом поведении вышеописанных систем в течение продолжительных электрохимических измерений, мы провели дополнительные хроноамперометрические измерения ток–время при приложении постоянного потенциала 0.34 и 0.24 В (рис. 6в и 6г). По сравнению с циклической вольтамперометрией, чувствительной к поверхностным состояниям металлических катализаторов при различных потенциалах, хроноамперометрия, вероятно, дает более воспроизводимые стационарные электрокаталитические токи. Хроноамперометрические результаты ясно показывают, что токи окисления муравьиной кислоты были выше в случае систем, использующих наночастицы Pt/C, диспергированные по поверхности ZrO2. Эти результаты подтверждают точку зрения о долговременной “активирующей” роли ZrO2 при электроокислении муравьиной кислоты. Этот эффект роста тока предположительно объясняется присутствием на поверхности наночастиц оксида циркония большого количества гидроксильных групп. Эти группы –OH предположительно взаимодействуют с каталитическими центрами Pt и индуцируют окисление пассивирующих промежуточных групп типа CO на платине. Более того, эти межфазные гидроксильные группы облегчают подвижность и перемещение протонов, возникающих в результате окисления муравьиной кислоты.
Для сравнения мы измеряли аналогичный отклик фона (только в сернокислом электролите) на Pt-наночастицах без носителя (без сажи Vulcan) в отсутствие и в присутствии матрицы оксида циркония (рис. 7а). Как и ранее (рис. 6), в присутствии матрицы ZrO2 плотности электрокаталитического тока выше как при вольтамперометрических (рис. 7б), так и хроноамперометрических и хронокулонометрических условиях (рис. 7в и 7г). В отличие от поведения Pt/C на ZrO2 с носителем – сажей Vulcan (рис. 6г), “активирующая” роль гидроксильных групп, присутствующих на поверхности наноструктур оксида циркония (в кислых средах) и взаимодействующих с Pt-центрами, кажется особенно хорошо выраженной при хроноамперометрическом окислении муравьиной кислоты даже при таком низком потенциале, как 0.24 В (рис. 7г), т.е. там, где существует металлическая Pt, сразу за пиками десорбции водорода. С другой стороны, в отсутствие наноструктурированных углеродных носителей Vulcan, способных промотировать распределение и диспергирование каталитических Pt-центров, использование матрицы из ZrO2 не дает сколько-нибудь заметного прироста вольтамперометрических пиковых токов (рис. 7г). Для объяснения роли как углеродных, так и циркониевооксидных носителей при вышеописанных условиях необходимы дальнейшие исследования.
Рис. 7.
(а) Циклические вольтамперограммы электрокатализаторов Pt (сплошная кривая) и Pt, осажденной на ZrO2 (пунктирная кривая). (б) Окисление муравьиной кислоты (0.5 М) в условиях вольтамперометрии на наночастицах Pt (сплошная кривая) и Pt, осажденных на оксид циркония. Электролит: 0.5 М H2SO4. Скорость развертки потенциала: 10 мВ с–1. Хроноамперограммы, записанные при (в) 0.34 и (г) 0.24 В в ходе окисления муравьиной кислоты (0.5 М) на наночастицах Pt (сплошная кривая) и Pt, осажденных на ZrO2 (пунктирная кривая). Электролит: 0.5 М H2SO4.
Характеристики наночастиц PtRu на носителе Vulcan, диспергированных на пленке ZrO2
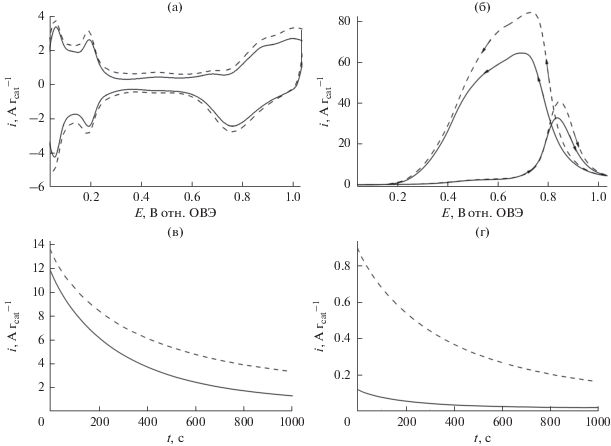
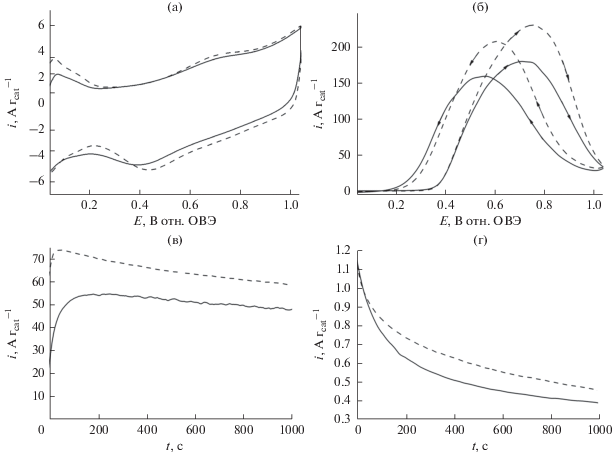
На рис. 8а показаны циклические вольтамперограммы, записанные в кислой среде (0.5 М H2SO4) на исходных наночастицах PtRu (PtRu/C) (сплошная линия) и на наночастицах PtRu/C, диспергированных на матрицу из наноструктурированного оксида циркония, на саже Vulcan. Как и ожидалось, система PtRu/C дает отклик характерный для адсорбции водорода, при относительно низких потенциалах (<0.25 В), а также для образования смешанных соединений – оксидов Pt и Ru, при более высоких потенциалах (>0.5 В). Матрица ZrO2, как упоминалось выше, не электроактивна в исследованном интервале потенциалов, но демонстрирует емкостные свойства (вследствие чего возрастает фоновый ток), в частности, когда она сосуществует с углеродными носителями (сравн. с пунктирными линиями на рис. 8а и 9а). Рост тока может также отражать возможные взаимодействия оксида циркония (его межфазных гидроксильных групп) с рутениевым компонентом, облегчающим образование оксо-соединений Ru. Действительно, фоновые токи (измеренные в деаэрированной H2SO4), характерные для PtRu/C на носителе из оксида циркония, выше, чем токи на PtRu/C без носителя при одинаковой нагрузке. Когда дело идет об окислении 0.5 М муравьиной кислоты в 0.5 М H2SO4 на наночастицах PtRu/C (сплошная линия) в сравнении с наночастицами PtRu/C на носителе (оксид циркония), видно, что введение ZrO2 на электрокаталитическую границу раздела приводит к существенному увеличению токов окисления муравьиной кислоты.
Рис. 8.
(а) Циклические вольтамперограммы электрокатализаторов PtRu/C (сплошная кривая) и PtRu/C, осажденного на ZrO2 (пунктирная кривая). (б) Окисление муравьиной кислоты (0.5 М) в условиях вольтамперометрии на наночастицах PtRu/C (сплошная кривая) и PtRu/C, осажденных на оксид циркония. Электролит: 0.5 М H2SO4. Скорость развертки потенциала: 10 мВ с–1. Хроноамперограммы, записанные при (в) 0.34 (г) 0.24 В в ходе окисления муравьиной кислоты (0.5 М) на наночастицах PtRu/C (сплошная кривая) и Pt/C, осажденных на ZrO2 (пунктирная кривая). Электролит: 0.5 М H2SO4.
Дальнейшие диагностические эксперименты (ориентированные на применения в низкотемпературных топливных элементах с топливом – спиртом) основаны на мониторинге и анализе долговременного (хроноамперометрического) отклика ток–время (рис. 8в и 8г), записанного, как и раньше, при двух выбранных низких потенциалах: (а) 0.34 и (б) 0.24 В. Еще раз, измеренные токи окисления муравьиной кислоты относительно выше на наночастицах PtRu/C, диспергированных по поверхности ZrO2. В общем и целом, стационарное хроноамперометрическое поведение систем на основе PtRu/C (рис. 8в и 8г) согласуется с вольтамперометрическими данными (рис. 8б).
Для сравнения мы приводим основные вольтамперометрические характеристики, записанные в обескислороженном электролите 0.5 М H2SO4 на наночастицах PtRu без сажи Vulcan (рис. 9): в отсутствие оксида циркония (сплошная линия) и с модифицирующим оксидом циркония (пунктирная линия). Результаты, представленные на рис. 9а, отражают типичное электрохимическое поведение наночастиц PtRu [72, 77]. После введения ZrO2 в систему емкостный вклад не так хорошо выражен, как до того (рис. 8а), благодаря отсутствию наноструктурированных углеродных носителей. В общем и целом, гибридная система (без сажи Vulcan), содержащая оксид циркония, демонстрирует более высокие плотности тока (чем немодифицированные наночастицы PtRu) как в вольтамперометрии, так и в хроноамперометрии. Принимая в расчет различия в морфологии (больший размер наночастиц PtRu и меньшая площадь электрохимически активной поверхности по сравнению с наночастицами PtRu/C), можно заключить, что эффекты увеличения тока (рис. 9) в общем выражены слабее, чем в поведении наночастиц PtRu на носителе Vulcan (рис. 8). Тем не менее, в обоих случаях (PtRu и PtRu/C) OH-группы, возникающие на оксиде циркония, похоже усиливают электрокаталитическую активность металлических компонентов (Pt, Ru). Следует отметить, что об активирующих взаимодействиях между оксидом циркония и оксидом рутения в ходе окисления уже сообщалось ранее [54]. Наконец, важное наблюдение заключается в том, что, в отличие от поведения исходного PtRu, в электроокислении муравьиной кислоты на осадках PtRu/C есть тенденция сдвига к более низким потенциалам после нанесения PtRu/C на носитель ZrO2. Среди возможных объяснений этого обстоятельства назовем возможность лучшего использования полупроводниковых свойств наноструктур оксида циркония и гидроксильных групп на его поверхности в присутствии более электропроводных углеродных носителей (Vulcan).
Рис. 9.
(а) Циклические вольтамперограммы электрокатализаторов PtRu (сплошная кривая) и PtRu, осажденного на ZrO2 (пунктирная кривая). (б) Окисление муравьиной кислоты (0.5 М) в условиях вольтамперометрии на наночастицах PtRu (сплошная кривая) и PtRu, осажденного на оксид циркония. Электролит: 0.5 М H2SO4. Скорость развертки потенциала: 10 мВ с–1. Хроноамперограммы, записанные при (в) 0.34 и (г) 0.24 В в ходе окисления муравьиной кислоты (0.5 М) на наночастицах PtRu (сплошная кривая) и PtRu, осажденных на ZrO2 (пунктирная кривая). Электролит: 0.5 М H2SO4.
Характеристики наночастиц Pd на носителе Vulcan, диспергированных на пленке ZrO2
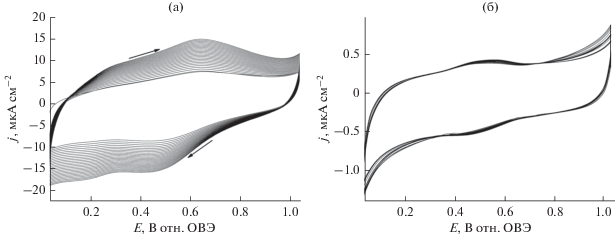
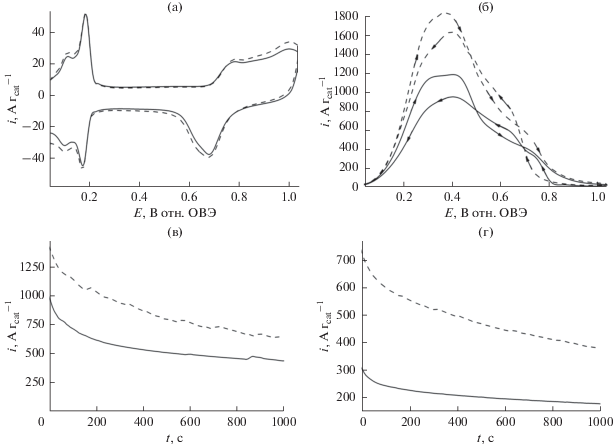
На рис. 10а приведены циклические вольтамперограммы, записанные в обескислороженном (насыщенном азотом) растворе 0.5 М H2SO4 на исходных наночастицах Pd (сплошная линия) и на наночастицах Pd, модифицированных ZrO2 (пунктирная линия), осажденных на носитель Vulcan на стеклоуглеродном электроде. Следует отметить, что и та, и другая вольтамперограммы очень похожи друг на друга, причем они демонстрируют характерные пики адсорбции/десорбции водорода (при потенциалах ниже 0.25 В), так же как и образование оксида Pd или его восстановление (при потенциалах ниже 0.55 В) [38, 39, 96]. На рис. 10в приведены результаты исследования методом циклической вольтамперометрии окисления 0.5 М муравьиной кислоты в 0.5 М H2SO4 на наночастицах Pd/C (сплошная линия) и наночастицах Pd/C на оксиде циркония в качестве носителя (пунктирная линия). Две почти перекрывающиеся волны или пика, согласующиеся с окислительными процессами (положительные токи), ясно видны как на положительном, так и на отрицательном сканах потенциала. Сообщалось, что окисление муравьиной кислоты на Pd-катализаторе может протекать по механизму, включающему два пути реакции [5, 6, 38, 39, 97]: (1) прямое окисление до CO2 (простая дегидрогенизация) и (2) непрямое окисление через адсорбцию промежуточных частиц CO. Таким образом, вольтамперометрические пиковые токи, появляющиеся при потенциалах 0.4 и 0.6 В, должны быть отнесены к механизмам, соответственно, (1) и (2). При сравнении сплошной и пунктирной линий на рис. 10б становится ясно, что простое использование носителя из оксида циркония для Pd/C приводит к почти 50%-ному увеличению электрокаталитических токов (по сравнению с Pd/C без носителя). В присутствии оксида циркония эта реакция все еще преимущественно протекает по механизму прямого окисления (до CO2). Эффект повышения тока может быть связан с присутствием большого числа гидроксильных групп или высокой подвижностью протонов на поверхности ZrO2, способствующей реакции простой дегидрогенизации. Для объяснения электрокаталитического поведения систем, описанных выше, за более продолжительные периоды времени мы провели дополнительные эксперименты методом хроноамперометрии, прикладывая два относительно низких потенциала: 0.34 В (рис. 10в) и 0.24 В (рис. 10г), при которых имеет место (наиболее желательный) механизм прямого окисления (простая дегидрогенизация). Характерные хроноамперограммы (рис. 10в и 10г) похожи на стационарные токовые кривые. В целом, как и в случае Pt и PtRu, добавление ZrO2 в систему привело росту электрокаталитических токов.
Рис. 10.
(а) Циклические вольтамперограммы электрокатализаторов Pd/C (сплошная кривая) и Pd/C, осажденного на ZrO2 (пунктирная кривая). (б) Окисление муравьиной кислоты (0.5 М) в условиях вольтамперометрии на наночастицах Pd/C (сплошная кривая) и Pd/C, осажденных на оксид циркония. Электролит: 0.5 М H2SO4. Скорость развертки потенциала: 10 мВ с–1. Хроноамперограммы, записанные при (в) 0.34 и (г) 0.24 В в ходе окисления муравьиной кислоты (0.5 М) на наночастицах Pd/C (сплошная кривая) и Pt/C, осажденных на ZrO2 (пунктирная кривая). Электролит: 0.5 М H2SO4.
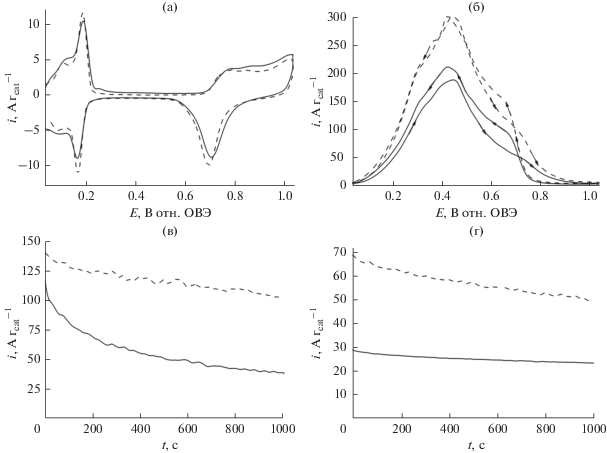
Для сравнения на рис. 11 показано электрохимическое поведение, включая электрохимические характеристики, наночастиц Pd без сажи Vulcan (сплошные линии) и тех же наночастиц Pd, осажденных на ZrO2 (пунктирные линии). И здесь использование оксида циркония дает ощутимый эффект увеличения тока. Единственное отличие, говорящее в пользу носителя Vulcan – в дополнение к обыкновенно бóльшим каталитическим токам, возникающим на катализаторах с большей дисперсностью – это то, что этот эффект увеличения тока наблюдался при таких низких потенциалах, как 0.2–0.3 В (рис. 10б). Поскольку электрокаталитические токи относительно выше в случае Pd-катализатора (по сравнению с Pt и PtRu), то вполне вероятно, что, в дополнение к обеспечению большого числа гидроксильных групп и влиянию на подвижность протонов на электрокаталитической границе раздела, в действие вступают и другие специфические взаимодействия металл–оксид металла.
Рис. 11.
(а) Циклические вольтамперограммы электрокатализаторов Pd (сплошная кривая) и Pd, осажденного на ZrO2 (пунктирная кривая). (б) Окисление муравьиной кислоты (0.5 М) в условиях вольтамперометрии на наночастицах Pd (сплошная кривая) и Pd, осажденных на оксид циркония. Электролит: 0.5 М H2SO4. Скорость развертки потенциала: 10 мВ с–1. Хроноамперограммы, записанные при (в) 0.34 и (г) 0.24 В в ходе окисления муравьиной кислоты (0.5 М) на наночастицах Pd (сплошная кривая) и Pt, осажденных на ZrO2 (пунктирная кривая). Электролит: 0.5 М H2SO4.
Следует подчеркнуть, что исторически Российская электрохимическая школа внесла существенный вклад в рассматриваемую область науки. В своих пионерских публикациях Багоцкий с сотр. обратились к механистическим аспектам адсорбции муравьиной кислоты (через COOH) на наночастицах благородных металлов (Pt, Pd), а также динамике окислительного разложения с образованием CO2 и H2 [18, 98–101]; памяти В.С. Багоцкого посвящена и настоящая публикация. В то время возможность осуществления специфических взаимодействий упоминалась по отношению к разложению муравьиной кислоты, как результат ее межфазного взаимодействия с благородными металлами или с атомами водорода, генерируемыми при менее отрицательных потенциалах. Позднее важность химической природы носителя (вместе с размером частиц и кристаллографической ориентацией) и связанных с ней взаимодействий между каталитически-активным металлом и носителем была подчеркнута и охарактеризована с помощью измерений фотоэмиссии электронов из платинированного оксида титана [18, 97–105]. С учетом недавнего исследования применения катализаторов Pd–ZrO2 в топливных элементах с прямым окислением муравьиной кислоты [106], в котором данные рентгеновской фотоэлектронной спектроскопии указывают на образование связей Pd–O–Zr и существование нестехиометрического ZrO2 – x с недостатком кислорода, добавление оксида циркония на электрокаталитическую границу раздела может облегчить десорбцию COOH или других адсорбатов типа CO (с поверхности палладия) и усилить общий электрокаталитический эффект. Подобные же электрокаталитические взаимодействия [107] можно ожидать от Pt и PtRu, хотя величина такого эффекта несколько меньше.
ЗАКЛЮЧЕНИЕ
Применение наноструктурированного оксида циркония (ZrO2) в качестве матрицы для диспергирования наночастиц благородных металлов (Pt, PtRu, Pd) повышает каталитические токи электроокисления муравьиной кислоты в кислой среде. Несмотря на относительные различия в таком повышении тока и отвлекаясь от конкретных механизмов окисления, в общем и целом разумно объяснять этот усиливающий эффект способностью гидроксильных групп (существующих на оксиде циркония вблизи каталитических центров благородного металла) благоприятствовать окислительному удалению отравляющих катализатор адсорбатов типа COOH или CO. Действительный механизм окисления муравьиной кислоты может быть весьма сложным и сильно зависеть от структуры и состава поверхности катализатора, включая определенные пути реакции и даже более активные промежуточные соединения, как это было недавно заявлено [108]. Результаты, полученные в настоящей работе, согласуются с обусловленным ZrO2-матрицей хорошо выраженным активирующим действием при окислении муравьиной кислоты на наночастицах палладия (как на носителе Vulcan, так и в его отсутствие). В последнем случае следует также принимать во внимание возможность специфических взаимодействий между оксидом циркония и Pd или даже образование нестехиометрического ZrO2– x с недостатком кислорода, обладающего электронной проводимостью (как было заявлено в работе [106]), в дополнение к способности этого оксида давать реакционноспособные группы –OH, проявлять кислотные свойства и повышать подвижность протонов на электрокаталитической границе раздела. Применение углеродных носителей (Vulcan) для наночастиц благородных металлов (Pt, PtRu и Pd) явно оказывает положительное влияние на общую проводимость и распределение заряда внутри каталитической пленки. Такой подход согласуется с необходимым условием на так называемой трехфазной границе раздела, подчеркивающим важность быстрого электронного и ионного смещения в дополнение к доступности и наличию реагента на каталитически-активных местах.
Прямое сравнение результатов, полученных в настоящей работе, с имеющимися литературными данными не такое уж простое и ясное из-за различия в экспериментальных условиях (например, несовпадающие нагрузки катализаторами и морфологии катализаторов, скорости развертки потенциала в вольтамперометрии или потенциалы окисления в хроноамперометрии), использованных в каждом отдельном случае. Простое обращение к нескольким репрезентативным сообщениям [37, 52, 109–111] ясно указывает на то, что наши результаты с Pt, PtRu и Pd (как на носителе Vulcan, так и в его отсутствие) находятся в основном на том же уровне, и во всяком случае, не ниже, если не выше.
Сама возможность матриц и модификаторов из оксидов некоторых металлов, главным образом оксидов переходных металлов и соответствующих наноструктур, усиливать электрокаталитические токи окисления простых органических молекул и потенциальных топлив была установлена ранее, ей посвящены обзоры [53, 57]. Очевидно, что не все сконструированные электрокаталитические нанограницы раздела, сочетающие оксиды металлов с благородными металлами, обладают таким многообещающим усиливающим действием [112]. Среди важных обстоятельств есть такие, как текстура, морфология, проводимость, наличие примесей и степень наноструктурирования, нестехиометрии или смешанной валентности [53–57]. Предложенные в настоящей работе содержащие оксид циркония гибридные системы с наночастицами Pt, PtRu и Pd (как с носителем Vulcan, так и в его отсутствие) – явно не ингибирующие, так как они демонстрируют улучшение поведения в ходе электроокисления муравьиной кислоты по сравнению с поведением аналогичных каталитических металлов без носителя. Описанные выше результаты основаны на многочисленных (по крайней мере, 15) независимых измерениях, так что возможная ошибка в токах (в частности, хроноамперометрических), составляющая приблизительно 5–10%, в зависимости от системы, намного ниже систематически наблюдаемых эффектов усиления.
Список литературы
Rice, C., Ha, S., Masel, R.I., Waszczuk, P., Wieckowski, A., and Barnard, T., Direct formic acid fuel cells, J. Power Sources, 2002, vol. 111, p. 83.
Zhang, Z.H., Huang, Y.J., Ge, J.J., Liu, C.P., Lu, T.H., and Xing, W., WO3/C hybrid material as a highly active catalyst support for formic acid electrooxidation, Electrochem. Commun., 2008, vol. 10, p. 1113.
Rice, C., Ha, S., Masel, R.I., and Wieckowski, A., Catalysts for direct formic acid fuel cells, J. Power Sources, 2003, vol. 115, p. 229.
Demirci, U.B., Direct liquid-feed fuel cells: Thermodynamic and environmental concerns, J. Power Sources, 2007, vol. 169, p. 239.
Yu, X. and Pickup, P.G., Recent advances in direct formic acid fuel cells (DFAFC), J. Power Sources, 2008, vol. 182, p. 124.
Capon, A. and Parsons, R., The oxidation of formic acid at noble metal electrodes Part III. Intermediates and mechanism on platinum electrodes, J. Electroanal. Chem., 1973, vol. 45, p. 205.
Podlovchenko, B.I., Petry, O.A., Frumkin, A.N., and Hira Lal, The behaviour of a platinized-platinum electrode in solutions of alcohols containing more than one carbon atom, aldehydes and formic acid, J. Electroanal. Chem., 1966, vol. 11, 12.
Jiang, J. and Kucernak, A., Nanostructured platinum as an electrocatalyst for the electrooxidation of formic acid, J. Electroanal. Chem., 2002, vol. 520, p. 64.
Park, S., Xie Y., and Weaver, M.J., Electrocatalytic Pathways on Carbon-Supported Platinum Nanoparticles: Comparison of Particle-Size-Dependent Rates of Methanol, Formic Acid, and Formaldehyde Electrooxidation, Langmuir, 2002, vol. 18, p. 5792.
Lovic, J.D., Tripkovic, A.V., Gojkovic, S.Lj., Popovic, K.Dj., Tripkovic, D.V., Olszewski, P., and Kowal, A., Kinetic study of formic acid oxidation on carbon-supported platinum electrocatalyst, J. Electroanal. Chem., 2005, vol. 581, 294.
Gasteiger, H.A., Markovic, N.M., Ross, P.N., and Cairns, E.J., Methanol electrooxidation on well-characterized platinum-ruthenium bulk alloys, J. Phys. Chem., 1993, vol. 97, p. 12020.
Chu, D. and Gilman, S., Methanol Electro-oxidation on Unsupported Pt-Ru Alloys at Different Temperatures, J. Electrochem. Soc., 1996, vol. 143, p. 1685.
Frelink, T., Visscher, W., and Ween, J.A.R.V., Measurement of the Ru Surface Content of Electrocodeposited PtRu Electrodes with the Electrochemical Quartz Crystal Microbalance: Implications for Methanol and CO Electrooxidation, Langmuir, vol. 12, p. 3702.
Hable, C.T. and Wrighton, M.S., Electrocatalytic oxidation of methanol and ethanol: a comparison of platinum-tin and platinum-ruthenium catalyst particles in a conducting polyaniline matrix, Langmuir, 1993, vol. 9, p. 3284.
Iwasita, T. and Vielstich, W., On-line mass spectroscopy of volatile products during methanol oxidation at platinum in acid solutions, J. Electroanal. Chem., 1986, vol. 201, p. 403.
Beden, B., Hahn, F., Juanto, S., Lamy, C., and Leger, J.-M., Infrared spectroscopic study of the methanol adsorbates at a platinum electrode: Part I. Influence of the bulk concentration of methanol upon the nature of the adsorbates, J. Electroanal. Chem., 1987, vol. 225, p. 215.
Capon, A. and Parsons, R., The oxidation of formic acid on noble metal electrodes: II. A comparison of the behaviour of pure electrodes, J. Electroanal. Chem., 1973, vol. 44, p. 239.
Поляк, А.Г., Васильев, Ю.Б., Багоцкий, В.С., Смирнова, Р.М. Электрохимическое окисление муравьиной кислоты на палладии. Сообщение I. Электрохимия. 1967. Т. 3. С. 942. [Polyak, A.G., Vasil’ev, Yu.B., Bagotskii, V.S., and Smirnova, R.M., Electrochemical Oxidation of Formic Acid on Palladium. Communication I, Soviet Electrochem., 1967, vol. 3, p. 958.]
Zhou, Y., Liu, J., Ye, J., Zou, Z., Ye, J., Gu, J., Yu, T., and Yang, A., Poisoning and regeneration of Pd catalyst in direct formic acid fuel cell, Electrochim. Acta, 2010, vol. 55, p. 5024.
Grozovski, V., Solla-Gullón, J., Climent, V.C., Herrero, E., and Feliu, J.M., Formic Acid Oxidation on Shape-Controlled Pt Nanoparticles Studied by Pulsed Voltammetry, J. Phys. Chem. C, 2010, vol. 114, p. 13802.
Larsen, R., Zakzeski, J., and Masel, R.I., Unexpected Activity of Palladium on Vanadia Catalysts for Formic Acid Electro-oxidation, Electrochem. Solid-State Lett., 2005, vol. 8, p. A291.
Brandt, K., Steinhausen, M., and Wandelt, K., Catalytic and electro-catalytic oxidation of formic acid on the pure and Cu-modified Pd(1 1 1)-surface, J. Electroanal. Chem., 2008, vol. 616, p. 27.
Zhang, Z.H., Ge, J.J., Ma, L.A., Liao, J.H., Lu, T.H., and Xing, W., Highly Active Carbon-supported PdSn Catalysts for Formic Acid Electrooxidation, Fuel Cells, 2009, vol. 9, p. 114.
Suo, Y. and Hsing, I.M., Synthesis of bimetallic PdAu nanoparticles for formic acid oxidation, Electrochim. Acta, 2011, vol. 56, p. 2174.
Bai, Z., Yang, L., Guo, Y., Zheng, Z., Hu, C., and Xu, P., High-efficiency palladium catalysts supported on ppy-modified C60 for formic acid oxidation, Chem. Commun., 2011, vol. 47, p. 1752.
Huang, Y.J., Zhou, X.C., Liao, J.H., Liu, C.P., Lu, T.H., and Xing, W., Preparation of Pd/C catalyst for formic acid oxidation using a novel colloid method, Electrochem. Commun., 2008, vol. 10, p. 621.
Jena, B.K., Sahu, S.C., Satpati, B., Sahu, R.K., Behera, D., and Mohanty, S., A facile approach for morphosynthesis of Pd nanoelectrocatalysts, Chem. Commun., 2011, vol. 47, p. 3796.
Li, H.Q., Sun, G.Q., Jiang, Q., Zhu, M.Y., Sun, S.G., and Xin, Q., Preparation and characterization of Pd/C catalyst obtained in NH3-mediated polyol process, J. Power Sources, 2007, vol. 172, p. 641.
Zhang, S., Shao, Y., Yin, G., and Lin, Y., Facile synthesis of PtAu alloy nanoparticles with high activity for formic acid oxidation, J. Power Sources, 2010, vol. 195, p. 1103.
Cheng, N., Webster, R.A., Pan, M., Mu, S., Rassaei, L., Tsang, S.C., and Marken, F., One-step growth of 3–5 nm diameter palladium electrocatalyst in a carbon nanoparticle–chitosan host and characterization for formic acid oxidation, Electrochim. Acta, 2010, vol. 55, p. 6601.
Lu, G., Crown, A., and Wieckowski, A., Formic Acid Decomposition on Polycrystalline Platinum and Palladized Platinum Electrodes, J. Phys. Chem. B, 1999, vol. 103, p. 9700.
Wang, X., Wang, J., Zou, Q., and Xia, Y., Pd nanoparticles supported on carbon-modified rutile TiO2 as a highly efficient catalyst for formic acid electrooxidation, Electrochim. Acta, 2011, vol. 56, p. 1646.
Feng, L., Cui, Z., Yan, L., Xing, W., and Liu, C., The enhancement effect of MoOx on Pd/C catalyst for the electrooxidation of formic acid, Electrochim. Acta, 2011, vol. 56, p. 2051.
Yi, Q., Huang, W., Liu, X., Xu, G., Zhou, Z., and Chen, A., Electroactivity of titanium-supported nanoporous Pd–Pt catalysts towards formic acid oxidation, J. Electroanal. Chem., 2008, vols. 619–620, p. 197.
Feng, L., Yang, J., Hu, Y., Zhu, J., Liu, C., and Xing, W., Electrocatalytic properties of PdCeOx/C anodic catalyst for formic acid electrooxidation, Int. J. Hydrogen Energy, 2012, vol. 37, p. 4812.
Matos, J., Borodzinski, A., Mikolajczuk-Zychora, A., Kedzierzawski, P., Mierzwa, B., Juchniewicz, K., Mazurkiewicz, M., and Hernadez-Garrido, J.C., Direct formic acid fuel cells on Pd catalysts supported on hybrid TiO2-C materials, App. Catal. B, 2015, vol. 163, p. 167.
Qu, W.-L., Wang, Z.-B., Sui, X.-L., Gu, D.-M., and Yin, G.-P., ZrC–C and ZrO2–C as Novel Supports of Pd Catalysts for Formic Acid Electrooxidation, Fuel Cells, 2013, vol. 13, p. 149.
Rutkowska, I.A., Marks, D., Perruchot, C., Jouini, M., and Kulesza, P.J., Admixing palladium nanoparticles with tungsten oxide nanorods toward more efficient electrocatalytic oxidation of formic acid, Colloids Surfaces A: Physicochem. Eng. Aspects, 2013, vol. 439, p. 200.
Rutkowska, I.A., Enhancement of Oxidation of Formic Acid in Acid Medium on Zirconia-Supported Phosphotungstate-Decorated Noble Metal (Pd, Pt) Nanoparticles, Aust. J. Chem., 2016, vol. 69, p. 394.
Osawa, M., Komatsu, K.-I., Samjeské, G., Uchida, T., Ikeshoji, T., Cuesta, A., and Gutiérrez, C., The role of bridge-bonded adsorbed formate in the electrocatalytic oxidation of formic acid on platinum, Angew. Chem. Int. Ed., 2011, vol. 50, p. 1159.
Jeon, H., Uhm, S., Jeong, B., and Lee, J., On the origin of reactive Pd catalysts for an electrooxidation of formic acid, Phys. Chem. Chem. Phys., 2011, vol. 13, p. 6192.
Chen, Y.X., Heinen, M., Jusys, Z., and Behm, R.J., Bridge-Bonded Formate: Active Intermediate or Spectator Species in Formic Acid Oxidation on a Pt Film Electrode?, Langmuir, 2006, vol. 22, p. 103998.
Chenitz, R. and Dodelet, J.-P., A simple approach to improve the electrocatalytic properties of commercial Pt/C, J. Electrochem. Soc., 2010, vol. 157, p. B1658.
Du, C., Chen, M., Wang, W., Yin, G., and Shi, P., Electrodeposited PdNi2 alloy with novelly enhanced catalytic activity for electrooxidation of formic acid, Electrochem. Commun., 2010, vol. 12, p. 843.
Antolini, E. and Gonzalez, E.R., Ceramic materials as supports for low-temperature fuel cell catalysts, Solid State Ionics, 2009, vol. 180, p. 746.
Shao, Y.Y., Liu, J., Wang, Y., and Lin, Y.H., Novel catalyst support materials for PEM fuel cells: current status and future prospects, J. Mater. Chem., 2009, vol. 19, p. 46.
Lai, L., Huang, G., Wang, X., and Weng, J., Preparation of Pt nanoparticle-loaded three-dimensional Fe3O4/carbon with high electro-oxidation activity, Carbon, 2011, vol. 49, p. 1581.
Chen, Y., Zhou, Y., Tang, Y., and Lu, T., Electrocatalytic properties of carbon-supported PtRu catalyst with the high alloying degree for formic acid electrooxidation, Electrocatalytic properties of carbon-supported Pt–Ru catalysts with the high alloying degree for formic acid electrooxidation, J. Power Sources, 2010, vol. 195, p. 4129.
Mazurkiewicz-Pawlica, M., Malolepszy, A., Mikolajczuk-Zychora, A., Mierzwa, B., Borodzinski, A., and Stobinski, L., A simple method for enhancing the catalytic activity of Pd deposition on carbon nanotubes used in direct formic acid fuel cells, Appl. Surf. Sci., 2019, vol. 476, p. 806.
Mikolajczuk-Zychora, A., Borodzinski, A., Kedzierzawski, P., Mierzwa, B., Mazurkiewicz–Pawlicka, M., Stobinski, L., Ciecierska, E., Zimoch, A., and Opallo, M., High active carbon supported Pd cathode catalysts for direct formic acid fuel cells, App. Surf. Sci., 2016, vol. 388, p. 645.
Antolini, E., Carbon supports for low-temperature fuel cell catalysts, Appl. Catal. B Environ., 2009, vol. 88, p. 1.
Liu, Z. and Hong, L., Electrochemical characterization of the electrooxidation of methanol, ethanol and formic acid on Pt/C and PtRu/C electrodes, J. Appl. Electrochem., 2007, vol. 37, p. 505.
Rutkowska, I.A. and Kulesza, P.J., Metal Oxide Cluster and Polyoxometallate Supports for Noble Metal Nanoparticles in Efficient Electrocatalysis, in: Wandelt, K., (Ed.), Encyclopedia of Interfacial Chemistry: Surface Science and Electrochemistry, Elsevier, 2018, vol. 5, p. 207.
Trasatti, S., in: Wieckowski, A. (Ed.), Interfacial Electrochemistry / Theory, Experiment and Applications, N.Y.: Marcel Dekker, 1999, p. 769.
Trasatti, S., Oxide/aqueous solution interfaces, interplay of surface chemistry and electrocatalysis, Mat. Chem. Phys., 1987, vol. 16, p. 157.
Trasatti, S., Electrolysis by oxides-attempt at unifying approach, J. Electroanal. Chem., Interf. Electrochem., 1980, vol. 111, p. 125.
Kulesza, P.J., Pieta, I.S., Rutkowska, I.A., Wadas, A., Marks, D., Klak, K., Stobinski, L., and Cox, J.A., Electrocatalytic oxidation of small organic molecules in acid medium: Enhancement of activity of noble metal nanoparticles and their alloys by supporting or modifying them with metal oxides, Electrochim. Acta, 2013, vol. 110, p. 474.
Jayaraman, S., Jaramillo, T.F., Baeck, S.-H., and McFarland, E.W., Synthesis and Characterization of Pt-WO3 as Methanol Oxidation Catalysts for Fuel Cells, J. Phys. Chem. B, 2005, vol. 109, p. 22958.
Barczuk, P.J., Tsuchiya, H., Macak, J.M., Schmuki, P., Szymanska, D., Makowski, O., Miecznikowski, K., and Kulesza, P.J., Enhancement of the Electrocatalytic Oxidation of Methanol at Pt/Ru Nanoparticles Immobilized in Different WO3 Matrices, Electrochem. Solid-State Lett., 2006, vol. 9, E13.
Micoud, F., Maillard, F., Bonnefont, A., Job, N., and Chatenet, M., The role of the support in COads monolayer electrooxidation on Pt nanoparticles: Pt/WOx vs. Pt/C, PhysChemChemPhys., 2010, vol. 12, p. 1182.
Salmaoui, S., Sediri, F., Gharbi, N., Perruchot, C., Aeiyach, S., Rutkowska, I.A., Kulesza, P.J., and Jouini, M., Hexagonal nanorods of tungsten trioxide: synthesis, structure, electrochemical properties and activity as supporting material in electrocatalysis, Appl. Surf. Sci., 2011, vol. 257, p. 8223.
Rutkowska, I.A., Koster, M.D., Blanchard, G.J., and Kulesza, P.J., Nanoporous Platinum Electrodes as Substrates for Metal Oxide-Supported Noble Metal Electrocatalytic Nanoparticles: Synergistic Effects During Electrooxidation of Ethanol, Aust. J. Chem., 2014, vol. 67, p. 1414.
Hasa, B., Kalamaras, E., Papaioannou, E.I., Sygellou, L., and Katsaounis, A., Electrochemical oxidation of alcohols on Pt–TiO2 binary electrodes, Int. J. Hydrogen Energy, 2013, vol. 38, p. 15395.
Rutkowska, I.A. and Kulesza, P.J., Electroanalysis of Ethanol Oxidation and Reactivity of Platinum-Ruthenium Catalysts Supported onto Nanostructured Titanium Dioxide Matrices, J. Electrochem. Soc., 2016, vol. 163, p. H3052.
Hepel, M., Kumarihamy, I., and Zhong, C.J., Nanoporous TiO2-supported bimetallic catalysts for methanol oxidation in acidic media, Electrochem. Commun., 2006, vol. 8, p. 1439.
Zoladek, S., Rutkowska, I.A., and Kulesza, P.J., Enhancement of activity of platinum towards oxidation of ethanol by supporting on titanium dioxide containing phosphomolybdate-modified gold nanoparticles, Appl. Surf. Sci., 2011, vol. 257, p. 8205.
Bai, Y., Wu, J., Xi, J., Wang, J., Zhu, W., Chen, L., and Qiu, X., Electrochemical oxidation of ethanol on Pt–ZrO2/C catalyst, Electrochem. Commun., 2005, vol. 7, p. 1087.
Deshmane, V.G. and Adewuyi, Y.G., Synthesis of thermally stable, high surface area, nanocrystalline mesoporous tetragonal zirconium dioxide (ZrO2): Effects of different process parameters, Micropor. Mesopor. Mater., 2012, vol. 148, p. 88.
Song, H., Qiu, X., and Li, F., Promotion of carbon nanotube-supported Pt catalyst for methanol and ethanol electro-oxidation by ZrO2 in acidic media, Appl. Catal. A, 2009, vol. 364, p. 1.
Rutkowska, I.A., Koster, M.D., Blanchard, G.J., and Kulesza, P.J., Enhancement of ethanol oxidation at Pt and PtRu nanoparticles dispersed over hybrid zirconia–rhodium supports, J. Power Sources, 2014, vol. 272, p. 681.
Rutkowska, I.A. and Kulesza, P.J., Electrocatalytic oxidation of ethanol in acid medium: enhancement of activity of vulcan-supported Platinum-based nanoparticles upon immobilization within nanostructured zirconia matrices, Funct. Mater. Let., 2014, vol. 7, p. 1440005.
Rutkowska, I.A., Zoladek, S., and Kulesza, P.J., Polyoxometallate-assisted integration of nanostructures of Au and ZrO2 to form supports for electrocatalytic PtRu nanoparticles: enhancement of their activity toward oxidation of ethanol, Electrochim. Acta, 2015, vol. 162, p. 215.
Xu, C. and Shen, P.K., Novel Pt/CeO2/C catalysts for electrooxidation of alcohols in alkaline media, Chem. Commun., 2004, p. 2238.
Ou, D.R., Mori, T., Fugane, K., Togasaki, H., and Ye, F., Drennan, J., Promoting Effect of CeO2 in Combustion Synthesized Pt/CeO2 Catalyst for CO Oxidation, J. Phys. Chem. C, 2011, vol. 115, p. 19239.
Yuana, W., Zhang, J., Shen, P.K., Lia, C.M., and Jiang, S.P., Self-assembled CeO2 on carbon nanotubes supported Au nanoclusters as superior electrocatalysts for glycerol oxidation reaction of fuel cells, Electrochim. Acta, 2016, vol. 190, p. 817.
Maiyalagan, T. and Khan, F.N., Electrochemical oxidation of methanol on Pt/V2O5–C composite catalysts, Catal. Commun., 2009, vol. 10, p. 433.
Rutkowska, I.A., Wadas, A., and Kulesza, P.J., Enhancement of Oxidative Electrocatalytic Properties of Platinum Nanoparticles by Supporting onto Mixed WO3/ZrO2 Matrix, Appl. Surf. Sci., 2016, vol. 388, p. 616.
Rutkowska, I.A., Wadas, A. and Kulesza, P.J., Mixed layered WO3/ZrO2 films (with and without rhodium) as active supports for PtRu nanoparticles: enhancement of oxidation of ethanol, Electrochim. Acta, 2016, vol. 210, p. 575.
Amberg, M. and Günter, J.R., Metastable cubic and tetragonal zirconium dioxide, prepared by thermal oxidation of the dichalcogenides, Solid State Ionics, 1996, vol. 84, p. 313.
Lee, S.M., Oh, S.H., Cho, W.I., and Jang, H., The effect of zirconium oxide coating on the lithium nickel cobalt oxide for lithium secondary batteries, Electrochim. Acta, 2006, vol. 52, p. 1507.
Lu, J., Zang, J.B., Shan, S.X., Huang, H., and Wang, Y.H., Synthesis and Characterization of Core-Shell Structural MWNT-Zirconia Nanocomposites, Nano Lett., 2008, vol. 8, p. 4070.
Yadav, G.D. and Nair, J.J., Sulfated zirconia and its modified versions as promising catalysts for industrial processes, Micropor. Mesopor. Mat., 1999, vol. 33, p. 1-48.
Johnson, G.E., Mitric, R., Tyo, E.C., Bonacic-Koutecky, V., and Castleman, A.W., Jr., Stoichiometric Zirconium Oxide Cations as Potential Building Blocks for Cluster Assembled Catalysts, J. Am. Chem. Soc., 2008, vol. 130, p. 13912.
Cotton, F.A. and Wilkinson, G., Advanced Inorganic Chemistry, 4th ed., N.Y.: Wiley, 1980, p. 827.
Trasatti, S. and Petrii, O.A., Real surface area measurements in electrochemistry, Pure Appl. Chem., 1991, vol. 63, p. 711.
Petrii, O.A., Pt–Ru electrocatalysts for fuel cells: a representative review, J. Solid State Electrochem., 2008, vol. 12, p. 609.
Green, C.L. and Kucernak, A., Determination of the Platinum and Ruthenium Surface Areas in Platinum–Ruthenium Alloy Electrocatalysts by Underpotential Deposition of Copper. I. Unsupported Catalysts, J. Phys Chem. B, 2002, vol. 106, p. 1036.
Rand, A. J. and Woods, R. J., The nature of adsorbed oxygen on rhodium, palladium and gold electrodes, J. Electroanal. Chem., 1071, vol. 31, p. 29.
Breiter, M.W., Dissolution and adsorption of hydrogen at smooth Pd wires at potentials of the alpha phase in sulfuric acid solution, J. Electroanal. Chem., 1977, vol. 81, p. 275.
Hao, Y., Li, J., Yang, X., Wang, X., and Lu, L., Preparation of ZrO2–Al2O3 composite membranes by sol–gel process and their characterization, Mater. Sci. Eng. A, 2004, vol. 367, p. 243.
Chen, S., Yin, Y., Wang, D., Liu, Y., and Wang, X., Structures, growth modes and spectroscopic properties of small zirconia clusters, J. Cryst. Growth, 2005, vol. 282, p. 498.
Jayakumar, S., Ananthapadmanabhan, P.V., Perumal, K., Thiyagarajan, T.K., Mishra, S.C., Su, L.T., Tok, A.I.Y., and Guo, J., Characterization of nano-crystalline ZrO2 synthesized via reactive plasma processing, Mat. Sci. Eng. B, 2011, vol. 176, p. 894.
Phillippe, C.M., Mazdiyasni, K.S., Infrared and Raman Spectra of Zirconia Polymorphs, J. Am. Ceram. Soc., 1971, vol. 54, p. 254.
Feinberg, A. and Perry, C.H., Structural disorder and phase transitions in ZrO2–Y2O3 system, J. Phys. Chem. Solids, 1981, vol. 42, p. 513.
Elmouwahidi, A., Bail on-Garcia, E., Perez-Cadenas, A.F., Maldonado-Hodar, F.J., Castelo-Quiben, J., and Carrasco-Marin, F., Electrochemical performances of supercapacitors from carbon–ZrO2 composites, Electrochim. Acta, 2018, vol. 259, p. 803.
Cui, Z., Kulesza, P.J., Li, C.M., Xing, W., Jiang, S.P., Pd nanoparticles supported on HPMo-PDDA-MWCNT and their activity for formic acid oxidation reaction of fuel cells, Int. J. Hydrogen Energy, 2011, vol. 36, p. 8508.
Wang, D., Lu, S., Kulesza, P.J., Li, C.M., De Marco, R., and Jiang, S.P., Enhanced oxygen reduction at Pd catalytic nanoparticles dispersed onto heteropolytungstate-assembled poly(diallyldimethylammonium)-functionalized carbon nanotubes, PhysChemChemPhys., 2011, vol. 13, p. 4400.
Минакшисундарам, Н., Васильев, Ю.Б., Багоцкий, В.С. Адсорбция муравьиной кислоты на платиновом электроде. Природа адсорбированных частиц. Электрохимия. 1967. Т. 3. С. 150. [Minakshisundaram, N., Vasil’ev, Yu.B., and Bagotskii, V.S., Adsorption of Formic Acid on a Platinum Electrode. The Nature of the Adsorbed Particles, Soviet Electrochem., 1967, vol. 3, p. 161.]
Минакшисундарам, Н., Васильев, Ю.Б., Багоцкий, В.С. Кинетика адсорбции муравьиной кислоты на платиновом электроде. Электрохимия. 1967. Т. 3. С. 231. [Minakshisundaram, N., Vasil’ev, Yu.B., and Bagotskii, V.S., Kinetics of Formic Acid Adsorption on a Platinum Electrode, Soviet Electrochem., 1967, vol. 3, p. 245.]
Поляк, А.Г., Васильев, Ю.Б., Багоцкий, В.С. Кинетика анодного окисления муравьиной кислоты на палладиевом электроде. Электрохимия. 1968. Т. 4. С.456. [Polyak, A.G., Vasil’ev, Yu.B., and Bagotskii, V.S., Kinetics of formic acid anodic oxidation at palladium electrode, Soviet Electrochem., 1968, vol. 4, p. 474.]
Skundin, A.M. and Tsirlina, G.A., V.S. Bagotsky’s contribution to modern electrochemistry, J. Solid State Electrochem., 2014, vol. 18, p. 1147.
Napolskii, K.S., Barczuk, P.J., Vassiliev, S.Yu., Veresov, A.G., Tsirlina, G.A., and Kulesza, P.J., Templating of electrodeposited platinum group metals as a tool to control catalytic activity, Electrochim. Acta, 2007, vol. 52, p. 7910.
Багоцкий, В.С., Скундин, А.М., Якушев, В.В. Фотоэмиссия электронов из микроосадков платины на титане. Докл. АН СССР. 1982. Т. 265. С. 617. [Bagotskii, V.S., Skundin, A.M., Yakushev, V.V., Photoemission from platinum microdeposits on titanium, Doklady Akad. Nauk SSSR, 1982, vol. 265, p. 628.]
Якушев, В.В., Скундин, А.М., Багоцкий, В.С. Фотоэмиссия электронов из микроосадков платины и палладия на стеклоуглероде в раствор. Электрохимия. 1984. Т. 20. С. 234. [Yakushev, V.V., Skundin, A.M., and Bagotskii, V.S., Electron Photoemission from Platinum and Palladium Microdeposits on Glassy Carbon into the Solution, Soviet Electrochem., 1984, vol. 20, p. 246.]
Bagotzky, V.S. and Skundin, A.M., Electrocatalysts on supports – IV. Investigation of electron interaction of microdeposits with the support by the method of electron photoemission into solution, Electrochim. Acta, 1985, vol. 30, p. 899.
Malolepszy, M., Mazurkiewicz, M., Stobinski, L., Lesiak, B., Kover, L., Toyh, J., Mierzwa, B., Borodzinski, A., Nitze, F., and Wagberg, T., Deactivation resistant Pd-ZrO2 supported on carbon nanotubes catalyst for direct formic acid fuel cells, Int. J. Hydrogen. Energy, 2015, vol. 40, p. 16724.
Gavrilov, A.N., Savinova, E.R., Simonov, P.A., Zaikovskii, V.I., Cherepanova, S.V., Tsirlina, G.A., and Parmon, V.N., On the influence of the metal loading on the structure of carbon-supported PtRu catalysts and their electrocatalytic activities in CO and methanol electrooxidation, PhysChemChemPhys., 2007, vol. 9, p. 5476.
Петрий, О.А., Прогресс в понимании механизмов электроокисления метанола и муравьиной кислоты на платиновых металлах (обзор), Электрохимия. 2019. Т. 55. С. 3. [Petrii, O.A., The Progress in Understanding the Mechanisms of Methanol and Formic Acid Electrooxidation on Platinum Group Metals (a Review), Russ. J. Electrochem., 2019, vol. 55, p. 1.]
Yang, L., Wang, X.,Liu, D., Cui, G., Dou, B., and Wang, J., Efficient anchoring of nanoscale Pd on three-dimensional carbon hybrid as highly active and stable for electro-oxidation of formic acid, App. Catal. B-Environ. 2020, vol. 263, p. 118304.
Jiang, Z. and Jiang, Z.-J., Improvements of electrocatalytic activity of PtRu nanoparticles on multi-walled carbon nanotubes by H2 plasma treatment in methanol and formic acid, Electrochim. Acta, 2011, vol. 56, p. 8662.
Liu, Z., Hong, L., Tham, M.P., Lim, T.H., and Jiang, H., Nanostructured Pt/C and Pd/C catalysts for direct formic acid fuel cells, J. Power Sources, 2006, vol. 161, p. 831.
Кузнецов, В.В., Кавыршина, K.В., Подловченко, Б.И., Особенности формирования и электрокаталитические свойства осадков Pd на Mo, полученных гальваническим вытеснением, Электрохимия. 2012, vol. 48, p. 513. [Kuznetsov, V.V., Kavyrshina, K.V., and Podlovchenko, B.I., Formation and electrocatalytic properties of Pd deposits on Mo obtained by galvanic displacement, Russ. J. Electrochem., 2012, vol. 48, p. 467.
Дополнительные материалы отсутствуют.