Электрохимия, 2020, T. 56, № 11, стр. 994-1001
Особенности работы электродов литий-ионного аккумулятора при пониженных температурах
А. А. Кузьмина a, Т. Л. Кулова a, *, Е. К. Тусеева a, Е. В. Чиркова a, b
a Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Ленинский просп., 31, корп. 4, Россия
b Национальный исследовательский университет “МЭИ”
111250 Москва, ул. Красноказарменная, 14, Россия
* E-mail: tkulova@mail.ru
Поступила в редакцию 14.12.2019
После доработки 16.02.2020
Принята к публикации 20.02.2020
Аннотация
Исследованы зарядные и разрядные характеристики электродов основе LiNi0.8Co0.15Al0.05O2 (NCA) и Li4Ti5O12 (LTO) в растворе LiClO4 в смеси пропиленкарбоната с диметоксиэтаном при температурах от –45 до +60°С. В обоих случаях разрядная емкость уменьшается при снижении температуры, и эта зависимость не описывается уравнением Пейкерта. При снижении температуры увеличивается также поляризация, причем эффективная энергия активации на электроде из NCA составляет 52 кДж/моль, а на электроде из LTO – только 23 кДж/моль. Подтверждена возможность эксплуатации аккумуляторов системы NCA–LTO при температурах до –40°С.
ВВЕДЕНИЕ
Большинство современных литий-ионных аккумуляторов не рассчитано на эксплуатацию при пониженных температурах. Разрядная емкость типичного аккумулятора при температуре –20°С не превышает половины емкости при комнатной температуре. Изменение температуры влияет как на скорость транспортных процессов в электролите и твердой фазе электродов, так и на скорость электродных процессов. Чаще всего в литий-ионных аккумуляторах используются положительные электроды на основе LiCoO2 или смешанных слоистых оксидов (например, LiNi1/3Mn1/3Co1/3O2, NMC), отрицательные электроды на основе углеродных материалов и раствор LiPF6 в смеси этиленкарбоната с алкилкарбонатами в качестве электролита. В настоящей работе оценено влияние температуры на работу другой электрохимической системы. Здесь исследовались положительные электроды на основе LiNi0.8Co0.15Al0.05O2 (NCA) и отрицательные электроды на основе Li4Ti5O12 (LTO), а в качестве электролита – раствор LiClO4 в смеси пропиленкарбоната с диметоксиэтаном (7 : 3). Такой электролит широко используется, в частности в первичных литиевых элементах; его температура замерзания составляет около –70°С.
Низкие температуры затрудняют все ключевые моменты работы литий-ионного аккумулятора, такие как перенос заряда на границе раздела электрод/электролит [1] и транспорт ионов лития в SEI, электролите и электродах [1–3], приводя к потере мощности. Коммерческий электролит состава 1 М LiPF6 в смеси ЭК–ДМК–ДЭК замерзает при температуре около –30°С. Следовательно, медленная ионная проводимость в таком электролите является основной проблемой для эффективной работы низкотемпературных литий-ионных аккумуляторов [3, 4]. Дополнительной причиной плохой работы литий-ионного аккумулятора с углеродным анодом является медленная диффузия ионов лития в углероде при низкой температуре [2, 5], т.е. снижение емкости аккумуляторов с углеродными анодами обусловлено кинетическими причинами. Высокое сопротивление переноса заряда при низких температурах приводит к высокой электрохимической поляризации [5–8].
Кроме того, при низких температурах возникают затруднения массопереноса на границе раздела электрод/электролит, вызывающие концентрационную поляризацию [9–11].
Увеличение поляризации при низких температурах может приводить к образованию дендритов на отрицательном электроде и нарушению целостности SEI на отрицательном электроде [12].
Таким образом, при низких температурах уменьшается литий-ионная проводимость на границе раздела электрод/электролит, в электролите, в SEI, в положительном и отрицательном электродах. Во всех этих процессах низкая скорость переноса ионов лития на границе раздела электрод/электролит, обусловленная низкой кинетикой электрохимической реакции, является моментом, определяющим скорость при низкотемпературном заряде и разряде.
NCA как материал положительного электрода литий-ионных аккумуляторов был предложен в 2006 г. [13] и в последнее время начал набирать популярность. Он является представителем семейства материалов с общей формулой LiNi1 –x–yCoxAlyO2 [14, 15]. В литературе нет информации о характеристиках электродов на основе NCA при пониженных температурах, напротив, указывается на ускорение деградации таких электродов при температурах, значительно выше комнатной [16, 17]. Во всех упомянутых работах использовались электролиты на основе 1 М LiPF6 в смеси этиленкарбонат (ЭК)–диэтилкарбонат (ДЭК)–диметилкарбонат (ДМК) (1 : 1 : 1).
Электрохимические характеристики Li4Ti5O12 исследованы достаточно подробно. В работе [18] разрядные характеристики электродов на основе титаната лития были получены в интервале температур от –15 до +60°С. В работе [15] также был использован электролит с 1 М LiPF6 в смеси этиленкарбонат–диэтилкарбонат–диметилкарбонат (1 : 1 : 1).
Настоящая работа является продолжением серии работ по исследованию электрохимического поведения функциональных материалов литий-ионного аккумулятора при пониженных температурах [18, 19] с целью изучения электрохимического поведения NCA и LTO при пониженных температурах.
МЕТОДИКА ЭКСПЕРИМЕНТА
Электроды изготавливали из коммерческих материалов NCA и LTO (Gelon LIB Co., Ltd., КНР) по стандартной намазной технологии. В качестве токоотвода использовали сетку из нержавеющей стали. Активную массу готовили смешением порошка NCA или LTO (80 мас. %), сажи (15 мас. %, Timcal, Бельгия) и поливинилиденфторида (5 мас. %, Aldrich), предварительно растворенного в N-метилпирролидоне (Aldrich). Количество активного вещества на электроде составляло 5–7 мг/см2. Электроды прессовали давлением 1000 кг/см2 с последующей сушкой под вакуумом при температуре 120°С в течение 8 ч.
Электрохимические измерения проводили в трехэлектродных герметичных ячейках с литиевым вспомогательным электродом и литиевым электродом сравнения. Ячейки собирали и заполняли электролитом в перчаточном боксе с атмосферой сухого аргона (“Спектроскопические системы”, Россия). В качестве электролита использовали 1 М LiClO4 в смеси пропиленкарбонат–диметоксиэтан (7 : 3) (все компоненты электролита имели квалификацию “extra dry” и были приобретены в Aldrich). Содержание воды в электролите, измеренное методом титрования по Фишеру (Ti-Touch (Metrohm, Switzerland), не превышало 15 ppm. В качестве сепаратора использовали нетканый полипропилен толщиной 25 мкм (НПО “Уфим”, Россия). На каждой собранной ячейке проводили измерения при всех температурах без промежуточного демонтажа ячеек.
Гальваностатическое тестирование электрохимических ячеек проводили с помощью компьютеризированного стенда (ЗАО “Бустер”, Россия). Во всех случаях ток заряда был равен току разряда. Ячейка размещалась в камере тепла–холода КТХ-74-65/165 (ОАО “Смоленское СКТБ СПУ”, Россия), обеспечивающей поддержание рабочей температуры с погрешностью не более 0.5°С. Перед началом гальваностатических измерений ячейку выдерживали при рабочей температуре не менее 1 ч.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Тестирование электродов из NCA
На рис. 1 приведены зарядные и разрядные кривые для электрода из NCA, полученные при комнатной температуре и токах от 20 до 3200 мА/г, что соответствовало режимам от С/10 до 16 С. Качественно эти кривые не отличаются от кривых, приведенных в литературе [13, 19–21], несмотря на различие в природе электролита.
Рис. 1.
Гальваностатические зарядные и разрядные кривые на электроде из NCA при плотностях тока, мА/г: 20 (1), 100 (2), 200 (3), 400 (4), 800 (5), 1600 (6) и 3200 (7), что соответствует режимам С/10, С/2, С, 2 С, 4 С, 8 С и 16 С.
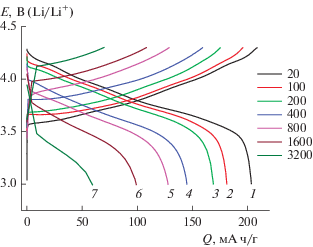
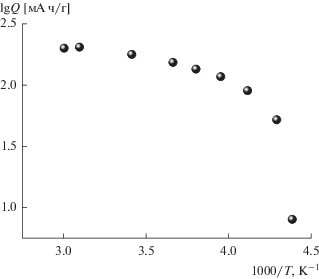
С ростом токовой нагрузки разрядная емкость электрода на основе NCA уменьшается, и зависимость емкости (Q) от плотности тока (i) не подчиняется обычному уравнению Пейкерта
т.е. не линеаризуется в координатах lg Q,lg i (рис. 2). Невыполнимость уравнения Пейкерта может свидетельствовать о том, что в данном случае лимитирующей стадией электродного процесса не является единственная транспортная стадия в системе с распределенными параметрами.На рис. 2 приведены также литературные данные, удовлетворительно согласующиеся с результатами настоящей работы, что подтверждает неслучайность сделанного выше вывода.
Рисунок 3 демонстрирует гальваностатические зарядные и разрядные кривые электрода из NCA, полученные в режиме С/2 (т.е. при плотности тока 100 мА/г) при температурах от +60 до ‒45°С. При регистрации гальваностатических кривых при всех температурах выше –40°С анодным пределом был выбран потенциал 4.3 В, а катодным пределом – 3.0 В. При температурах –40 и –45°С пределы были произвольно расширены с учетом сильного роста поляризации, в том числе омической составляющей. Это несколько осложняет количественный анализ результатов, но не изменяет качественной картины. Как и следовало ожидать, снижение температуры приводит качественно к такому же эффекту, как и повышение тока: возрастает поляризация, снижается разрядная емкость.
Рис. 3.
Гальваностатические зарядные и разрядные кривые электрода из NCA, полученные при плотности тока 100 мА/г и температурах, °С: 60 (1), 50 (2), 20 (3), 0 (4), –10 (5), –20 (6), –30 (7), –40 (8) и –45 (9).
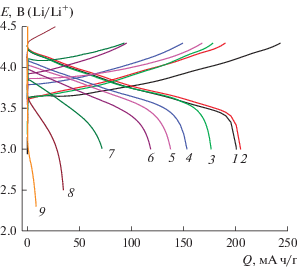
Природа температурной зависимости емкости интрекаляционных электродов неоднократно обсуждалась в литературе (напр., [18, 22, 23]). Предполагалось, что если лимитирующей стадией электродного процесса является твердофазная диффузия лития, то в гальваностатических условиях при относительно малых плотностях тока литий внедряется во всю глубину частиц активного материала; при увеличении плотности тока толщина диффузионного слоя к моменту достижения нулевой поверхностной концентрации и резкого изменения потенциала (т.е., когда время опыта равно переходному времени гальваностатического процесса) становится меньше размера частиц материала, и емкость оказывается меньше предельной. Поскольку переходное время, а следовательно, и разрядная емкость пропорциональны коэффициенту диффузии лития, температурная зависимость емкости должна совпадать с температурной зависимостью коэффициента диффузии лития. Именно такая ситуация реализуется при внедрении лития в графит [22]. Здесь температурная зависимость емкости хорошо описывалась уравнением Аррениуса (так же, как и температурная зависимость коэффициента диффузии).
Температурная зависимость емкости электрода на основе NCA показана на рис. 4.
Видно, что эта зависимость не описывается простым уравнением Аррениуса. Примерно такой же результат был получен при исследовании температурной зависимости емкости электродов из феррофосфата лития. При температуре выше 45°С разрядная емкость не зависит от температуры и приближается к своему предельному теоретическому значению. При пониженных температурах, снижение температуры сопровождается увеличением энергии активации (увеличение наклон кривой, представленной в координатах Аррениуса) [23]. В этой же статье обсуждены возможные причины отклонений характера температурной зависимости разрядной емкости от простой аррениусовской.
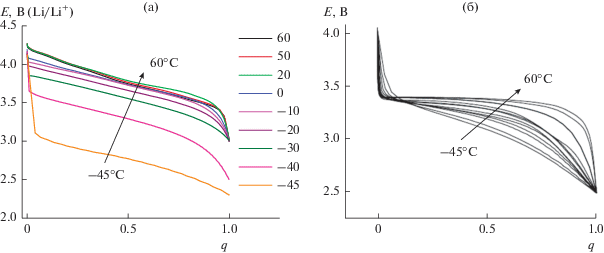
Заметное отличие влияния температуры на внедрение лития в NCA от влияния температуры на внедрение лития в LiFePO4 сказывается также на характере изменения формы гальваностатических кривых с изменением температуры. Это отличие наглядно видно при представлении гальваностатических кривых в нормализованных координатах (когда по оси абсцисс отложено отношение текущей емкости к конечной емкости). Такое сравнение приведено на рис. 5, где на рис. 5а показаны кривые рис. 3 в нормализованных координатах, а на рис. 5б – соответствующие данные для электрода из LiFePO4, заимствованные из [23].
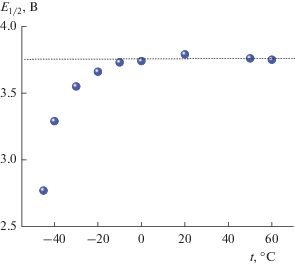
Как видно, снижение температуры приводит к практически параллельному смещению разрядных кривых электрода из NCA без заметного изменения формы кривых, причем при изменении температуры от +60 до –10°С смещение кривых сопоставимо с экспериментальной погрешностью. Наглядное представление о влиянии температуры на поляризацию электрода из NCA дает зависимость потенциала при степени разряженности, равной 50%, от температуры. Эта зависимость показана на рис. 6.
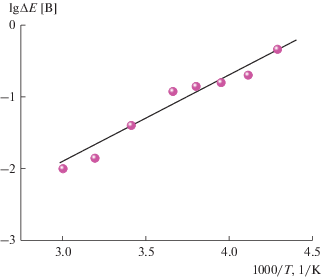
Можно было бы предположить, что поляризация при пониженных температурах связана с ростом сопротивления электролита. Для проверки этого предположения полезно проанализировать температурную зависимость поляризации в аррениусовских координатах. Такая зависимость приведена на рис. 7. Здесь в качестве поляризации (ΔE) использована разность потенциала Е1/2 при низких температурах и потенциала при температурах от 0 до +60°С (пунктирная прямая на рис. 6).
Рис. 7.
Температурная зависимость поляризации при катодном процессе на электроде из NCA. Прямая проведена по методу наименьших квадратов.

Как видно, температурная зависимость поляризации при отрицательных температурах хорошо описывается уравнением Аррениуса. Наклон прямой на рис. 7 соответствует энергии активации 52 кДж/моль. Это значение слишком велико для энергии активации проводимости электролита, что свидетельствует о значительном вкладе затруднений не транспортных процессов в кинетику электродного процесса при отрицательных температурах и согласуется с сформулированным выше выводом о природе нелинейной зависимости на рис. 4.
Электроды из Li4Ti5O12
В работе [18] гальваностатические кривые на электроде из Li4Ti5O12 были получены в режимах С/8, С/1.6 и 1.2 С в электролите состава 1 М LiPF6 в смеси этиленкарбонат–диэтилкарбонат–диметилкарбонат (1 : 1 : 1). В настоящей работе с использованием электролита состава 1 М LiClO4 в смеси пропиленкарбонат–диметоксиэтан (7 : 3) диапазон токов заряда и разряда составлял от С/8 до 12.5 С. На рис. 8 приведены гальваностатические кривые, полученные при комнатной температуре. Вид этих кривых качественно не отличается от вида кривых в работе [18].
Рис. 8.
Гальваностатические зарядные и разрядные кривые на электроде из Li4Ti5O12 при токах (мА/г) 20 (1), 100 (2), 200 (3), 400 (4), 800 (5) и 2000 (6), что соответствует режимам С/8, С/1.6, 1.25 С, 2.5 С, 5 С и 12.5 С.

Зависимость разрядной емкости от плотности тока, здесь так же как и в случае с электродами на основе NCA, не описывается уравнением Пейкерта (рис. 9).
Рис. 9.
Зависимость емкости (Q) электродов из Li4Ti5O12 от плотности тока (i) в билогарифмических координатах.

С изменением температуры характер гальваностатических кривых, полученных на электроде из Li4Ti5O12 в электролите на основе LiClO4, качественно изменяется так же, как и при измерениях в стандартном электролите с LiPF6 [21], но температурный диапазон в данном случае был расширен до –40°С. Гальваностатические зарядные и разрядные кривые на электроде из Li4Ti5O12, полученные в режиме С/1.6 (т. е., при токе 100 мА/г) при температурах от +60 до –40°С, показаны на рис. 10.
Рис. 10.
Гальваностатические зарядные и разрядные кривые на электроде из Li4Ti5O12, полученные при плотности тока 100 мА/г и температурах, °С: 60 (1), 40 (2), 20 (3), 0 (4), –10 (5), –20 (6), –30 (7) и –40 (8).

Зависимость разрядной емкости электрода из Li4Ti5O12 от температуры показана на рис. 11 в аррениусовских координатах. Здесь же для сравнения приведены данные из работы [18], в которой проводили измерения на электродах из того же материала в электролите состава 1 М LiPF6 в смеси этиленкарбонат–диэтилкарбонат–диметилкарбонат (1 : 1 : 1).
Рис. 11.
Температурная зависимость емкости электродов из Li4Ti5O12 по данным настоящей работы (кружки, измерения в растворе 1 М LiClO4 в смеси пропиленкарбоната с диметоксиэтаном (7 : 3)) и по данным работы [18] (квадраты, измерения в растворе 1 М LiPF6 в смеси этиленкарбонат–диэтилкарбонат–диметилкарбонат (1 : 1 : 1))
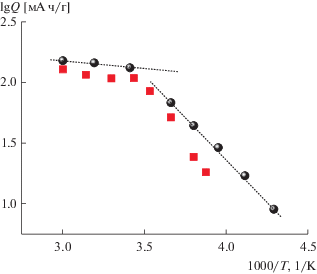
Видно, что качественный характер температурной зависимости емкости, измеренной в разных электролитах одинаков. При температурах выше 0°С емкость почти не зависит от температуры (наклон этой зависимости соответствует формальному значению энергии активации около 2 кДж/моль), а при более низких температурах хорошо выполняется уравнение Аррениуса. Однако наклон низкотемпературного участка этой зависимости несколько различается при измерениях в разных электролитах. При измерении в растворе 1 М LiClO4 в смеси пропиленкарбоната с диметоксиэтаном (7 : 3) (настоящая работа) этот наклон соответствует энергии активации около 26 кДж/моль, а при измерениях в растворе 1 М LiPF6 в смеси этиленкарбонат–диэтилкарбонат–диметилкарбонат (1 : 1 : 1) [18] этот наклон соответствует энергии активации около 34 кДж/моль. Это различие в эффективной энергии активации явно выходит за рамки экспериментальной погрешности, и именно оно позволило в настоящей работе проводить измерения при более низких температурах, чем в работе [18].
На рис. 12 кривые для рис. 10 приведены в нормализованных координатах. В целом характер этих кривых качественно такой же, как в работе [18], несмотря на различие в природе электролита. В то же время, изменение формы анодных кривых (при экстракции ионов лития), полученных в настоящей работе, с изменением температуры заметно больше, чем для кривых, полученных в стандартном этиленкарбонатном электролите [18]. Заметное изменение формы разрядных кривых на электроде из Li4Ti5O12 с температурой качественно отличает их от поведения электродов из NCA (рис. 5а).
На рис. 13 приведена температурная зависимость поляризации анодного процесса (экстракции ионов лития) на электроде из Li4Ti5O12 (отклонение потенциала при данной температуре от бестокового потенциала при температуре 60°С). Несмотря на значительный разброс данных эту зависимость можно описать уравнением Аррениуса с энергией активации 23 кДж/моль. Такое значение сопоставимо с энергией активации проводимости жидкого электролита, но утверждать, что именно сопротивление электролита определяет кинетику экстракции ионов лития из Li4Ti5O12, нельзя.
ЗАКЛЮЧЕНИЕ
Настоящее исследование показало, что замена традиционного электролита литий-ионного аккумулятора состава 1 М LiPF6 в смеси этиленкарбонат–диэтилкарбонат–диметилкарбонат (1 : 1 : 1) на электролит состава 1 М LiClO4 в смеси пропиленкарбоната с диметоксиэтаном (7 : 3) позволяет циклировать электроды из титаната лития и литированного оксида кобальта, никеля, алюминия в диапазоне температур от 60 до –45°С. Такая возможность обеспечена низкой температурой замерзания электролита на основе пропиленкарбоната, отсутствием большой необратимой емкости на отрицательном электроде, поскольку разряд на титанате лития ограничивается потенциалом 1 В, т.е. выше потенциала восстановления пропиленкарбоната и диметоксиэтана, а также относительно низкой энергией активации процессов на положительном и отрицательном электродах. Температурная зависимость поляризации литированного оксида кобальта, никеля, алюминия соответствует энергии активации 52 кДж/моль. Температурная зависимость поляризации титаната лития соответствует энергии активации 23 кДж/моль, что сопоставимо с энергией активации проводимости жидкого электролита. Результаты настоящей работы свидетельствуют о возможности изготовления литий-ионного аккумулятора, работоспособного при температурах до ‒45°С в токовом режиме 1 С.
Список литературы
Liao, X.-Z., Ma, Z.-F., Gong, Q., He, Y.-S., Pei, L., and Zeng, L.-J., Low-temperature performance of LiFePO4/C cathode in a quaternary carbonate-based electrolyte, Electrochem. Commun., 2008, vol. 10, p. 691. https://doi.org/10.1016/j.elecom.2008.02.017
Huang, C.K., Sakamoto, J.S., Wolfenstine, J., and Surampudi, S., The Limits of Low-Temperature Performance of Li-Ion Cells, J. Electrochem. Soc., 2000, vol. 147, p. 2893. https://doi.org/10.1149/1.1393622
Smart, M., Ratnakumar, B., and Surampudi, S., Electrolytes for Low-Temperature Lithium Batteries Based on Ternary Mixtures of Aliphatic Carbonates, J. Electrochem. Soc., 1999, vol. 146, p. 486. https://doi.org/10.1149/1.1391633
Plichta, E.J. and Behl, W.K., A low-temperature electrolyte for lithium and lithium-ion batteries, J. Power Sources, 2000, vol. 88, p. 192. https://doi.org/10.1016/S0378-7753(00)00367-0
Zhang, S.S., Xu, K., and Jow, T.R., Electrochemical impedance study on the low temperature of Li-ion batteries, Electrochem. Acta, 2004, vol. 49, p. 1057. https://doi.org/10.1016/j.electacta.2003.10.016
Nagasubramanian, G., Electrical characteristics of 18650 Li-ion cells at low temperatures, J. Appl. Electrochem., 2001, vol. 31, p. 99. https://doi.org/10.1023/A:1004113825283
Chunsheng, W., Appleby, A.J., and Little, F.E., Low-Temperature Characterization of Lithium-Ion Carbon Anodes via Microperturbation Measurement, J. Electrochem. Soc., 2002, vol. 149, p. A754. https://doi.org/10.1149/1.1474427
Zhang, S.S., Xu, K., and Jow, T.R., Enhanced performance of Li-ion cell with LiClO4-PC based electrolyte by addition of small amount of LiBOB, J. Power Sources, 2006, vol. 156, p. 629. https://doi.org/10.1016/j.jpowsour.2005.04.023
Lin, H., Chua, D., Salomon, M., Shiao, H.C., Hendrickson, M., Plichta E., and Slane, S., Low-Temperature Behavior of Li-Ion Cells, Electrochem. Solid State Lett., 2001, vol. 4, p. A71. https://doi.org/10.1149/1.1368736
Ma, M., Tu, J., Yuan, Y., Wang, X., Li, K., Mao F., and Zeng, Z., Electrochemical performance of ZnO nanoplates as anode materials for Ni/Zn secondary batteries, J. Power Sources, 2008, vol. 179, p. 395. https://doi.org/10.1016/j.jpowsour.2008.01.026
Xu, K., Nonaqueous Liquid Electrolytes for Lithium-Based Rechargeable Batteries, Chem. Rev., 2004, vol. 104, p. 4303. https://doi.org/10.1021/cr030203g
Yamaki, J.-I., Tobishima, S.-I., Hayashi, K., Saito, K., Nemoto, Y., and Arakawa, M., A consideration of the morphology of electrochemically deposited lithium in an organic electrolyte, J. Power Sources, 1998, vol. 74, p. 219. https://doi.org/10.1016/S0378-7753(98)00067-6
Majumder, S.B., Nieto, S., and Katiyar, R.S., Synthesis and electrochemical properties of LiNi0.80(Co0.20 –xAlx)O2 (x = 0.0 and 0.05) cathodes for Li ion rechargeable batteries, J. Power Sources, 2006, vol. 154, p. 262. https://doi.org/10.1016/j.jpowsour.2005.03.186
Weaving, J., Coowar, F., Teagle, D., Cullen, J., Dass, V., Bindin, P., Green, R., and Macklin, W., Development of high energy density Li-ion batteries based on LiNi1 –x – yCoxAlyO2, J. Power Sources, 2001, vol. 97–98, p. 733. https://doi.org/10.1016/S0378-7753(01)00700-5
Lee, K.K., Yoon, W.S., Kim, K.B., Lee, K.Y., and Hong, S.T., Characterization of LiNi0.85Co0.10M0.05O2 (M = Al, Fe) as a cathode material for lithium secondary batteries, J. Power Sources, 2001, vols. 97–98, p. 308. https://doi.org/10.1016/S0378-7753(01)00516-X
Kostecki, R. and McLarnon, F., Local-Probe Studies of Degradation of Composite LiNi0.8Co0.15Al0.05O2 Cathodes in High-Power Lithium-Ion Cells, Electrochem. Solid-State Let., 2004, vol. 7, p. A380. https://doi.org/10.1149/1.1793771
Bang, H. J., Joachin, H., Yang, H., Amine, K., and Prakasha, J., Contribution of the Structural Changes of LiNi0.8Co0.15Al0.05O2 Cathodes on the Exothermic Reactions in Li-Ion Cells, J. Electrochem. Soc., 2006, vol. 153, p. A731. https://doi.org/10.1149/1.2171828
Тусеева, Е.К., Кулова, Т.Л., Скундин, А.М. Влияние температуры на поведение электродов из титаната лития. Электрохимия. 2018. Т. 54. С. 1135. [Tuseeva, E.K., Kulova, T.L., and Skundin, A.M., Temperature Effect on the Behavior of a Lithium Titanate Electrode, Russ. J. Electrochem., 2018, vol. 54, p. 1186.]https://doi.org/10.1134/S0424857018140098https://doi.org/10.1134/S1023193518140082
Loghavi, M.M., Mohammadi-Manesh, H., and Eqra, R., LiNi0.8Co0.15Al0.05O2 coated by chromium oxide as a cathode material for lithium-ion batteries, J. Solid State Electrochem., 2019, vol. 23, p. 2569. https://doi.org/10.1007/s10008-019-04342-1
Luo, W., Liu L., Li, X., Yu, J., and Fang, C., Templated assembly of LiNi0.8Co0.15Al0.05O2/graphene nano composite with high rate capability and long-term cyclability for lithium ion battery, J. Alloys Comp., 2019, vol. 810, article No. 151786. https://doi.org/10.1016/j.jallcom.2019.151786
Liang, M., Sun, Y., Song, D., Shi, X., Han, Y., Zhang, H., and Zhang, L., Superior electrochemical performance of quasi-concentration-gradient LiNi0.8Co0.15Al0.05O2 cathode material synthesized with multi-shell precursor and new aluminum source, Electrochim. Acta, 2019, vol. 300, p. 426. https://doi.org/10.1016/j.electacta.2019.01.125
Кулова, Т.Л. Влияние температуры на обратимые и необратимые процессы при интеркаляции лития в графит. Электрохимия. 2004. Т. 40. С. 1221. [Kulova, T.L., Effect of Temperature on Reversible and Irreversible Processes during Lithium Intercalation in Graphite, Russ. J. Electrochem., 2004, vol. 40, p. 1052.] https://doi.org/10.1023/B:RUEL.0000046490.73990.c3
Тусеева, Е.К., Кулова, Т.Л., Скундин, А.М., Галеева, А.К., Курбатов, А.П. Влияние температуры на поведение электродов из феррофосфата лития. Электрохимия. 2019. Т. 55. С. 329. [Tusseeva, E.K., Kulova, T.L., Skundin, A.M., Galeeva, A.K., and Kurbatov, A.P., Temperature Effects on the Behavior of Lithium Iron Phosphate Electrodes, Russ. J. Electrochem., 2019, vol. 55, p. 194.] https://doi.org/10.1134/S0424857019020154https://doi.org/10.1134/S1023193519020149
Дополнительные материалы отсутствуют.