Электрохимия, 2020, T. 56, № 3, стр. 261-272
ЩЕЛОЧНОСТЬ ЭЛЕКТРОАКТИВИРОВАННЫХ ВОДНЫХ РАСТВОРОВ
Алина Гержова a, b, *, Мохаммед Айдер a, b, c, **
a Кафедра пищевых наук, Университет Лаваля
G1V 0A6 провинция Квебек, Квебек, Канада
b Институт питания и функциональных продуктов питания (INAF), Университет Лаваля
G1V 0A6 провинция Квебек, Квебек, Канада
c Кафедра почвоведения и агро-пищевой инженерии, Университет Лаваля
G1V 0A6 провинция Квебек, Квебек, Канада
* E-mail: alina.gerzhova.1@ulaval.ca
** E-mail: mohammed.aider@fsaa.ulaval.ca
Поступила в редакцию 27.07.2018
После доработки 22.03.2019
Принята к публикации 28.05.2019
Аннотация
Сообщалось, что электроактивированный щелочной (основной) раствор, известный как католит, обладает рядом уникальных свойств. В настоящем исследовании регулировали изменения pH и щелочности католита. Полнофакторный дизайн был применен для того, чтобы изучить влияние силы тока, времени обработки и концентрации соли на электроактивированные растворы, обработанные в конфигурациях четырех типов. Две конфигурации были сконструированы как трехкамерные ячейки с камерами, разделенными анионообменной мембраной (AEM) и катионообменной мембраной (CEM) с различным расположением в ячейке. Две другие конфигурации представляли собой двухкамерные ячейки с камерами, разделенными либо AEM, либо CEM. Для повышения pH время было наиболее значимым фактором, в то время как для щелочности конфигурация ячеек оказала значительное влияние. Таким образом, когда CEM использовали для разделения центрального и катодного отделений в трехэлементном реакторе или анодного и катодного отделений в двухэлементном реакторе, было обнаружено, что только сила тока и время были очень значительными. С другой стороны, когда использовали AEM, концентрация соли также оказалась важным фактором. Максимальные значения pH (12) и щелочности (25.46 ± 0.31 ммоль/л) были получены через 60 мин обработки при силе ока 0.2 A, независимо от концентрации NaCl при использовании CEM, тогда как максимальные значения для AEM были достигнуты только с максимальной концентрацией NaCl 1 М. Несмотря на сильнощелочную среду (рН ~ 12), прочность раствора была сопоставима с разбавленным раствором NaOH (~0.03 М).
ВВЕДЕНИЕ
Долгое время воду считали биохимически пассивным веществом. Ее главную роль рассматривали как роль растворителя, в котором происходили превращения активных компонентов, и изучали только взаимодействия органических и неорганических веществ с водой. Однако в последние десятилетия исследования в области электрохимии рассматривали воду как весьма привлекательную молекулу для генерирования кислотных и щелочных условий на основе окислительно-восстановительных реакций, которые происходят на границе раздела электрод–раствор. Кроме того, электрохимия прояснила определяющую роль различных условий, таких как плотность тока и электрический двойной слой, в образовании новых соединений после электролиза воды. Это явление затем использовалось для самогенерации кислот и оснований в различных электрохимических ячейках и реакторах. Кроме того, были разработаны различные теории взаимодействия воды с электрическим током для объяснения изменений, происходящих в свойствах водных растворов, подверженных воздействию внешнего электрического тока [1]. Действительно, после магнитной, ультразвуковой, световой или термической обработки существенно изменяются свойства воды, и воздействие электрического поля также меняет ее свойства. Кроме того, было показано, что такие обработки оказывают существенное влияние на кинетику химических реакций, происходящих в водных средах, на их биологическую, солюбилизирующую, дезинфицирующую и очищающую активность [1, 6].
Водный раствор, подверженный влиянию внешнего электрического поля, становится электроактивированным раствором (EAS), и его свойства и поведение значительно изменяются. Кроме того, приложенный электрический ток подает внешнюю энергию в воду и растворяет в ней молекулы и, таким образом, делает возможными различные химические реакции, аналогичные тем, которые возникают при добавлении химических веществ, таких как кислоты, основания и катализаторы. Все эти реакции стали возможными благодаря высокой реакционной способности электрохимически обработанных (модифицированных) растворов [6]. Кроме того, влияние электроактивации на водные растворы связано со свойствами молекулы воды и главным образом с ее дипольным моментом и поляризацией электрического заряда, которые имеют место во время и после электрохимической обработки. С практической точки зрения электроактивация (ЭА) водных растворов нашла многочисленные применения в химической, экологической и пищевой промышленности [7] и в настоящее время рассматривается как потенциальное дезинфицирующее средство, которое можно использовать для обеззараживания рабочих поверхностей и оборудования. Действительно, ее бактерицидное действие на многие патогенные бактерии было описано в научной литературе [8, 9]. Кроме того, были отмечены улучшенные экстрактивные и каталитические функции [6, 10].
Электроактивация как технология получения активированных водных растворов с особыми свойствами основана главным образом на процессе электролиза молекул воды на границах раздела электрод/раствор [6]. Простейшая схема электроактивирующего реактора состоит из двух электродов; анод и катод, погруженные в водный раствор и подключенные к источнику электрического тока. Разность потенциалов между этими двумя электродами позволяет проводить реакции окисления и восстановления на границе раздела раствор/электрод, которые частично ответственны за изменения реакционной способности раствора [11]. Основные реакции, которые происходят в типичном электролизере, представляют собой окисление на аноде с выделением молекулярного (газообразного) кислорода (O2) (уравнение 1) и восстановление на поверхности катода с выделением молекулярного (газообразного) водорода (H2) (уравнение 2), образование газообразных веществ, таких как хлор на аноде (уравнение 3), образование очень активных окислителей в анодном отделении, таких как Cl2O, ClO2, ClO−, HClO, ${\text{C}}{{{\text{l}}}^{\centerdot }}$, ${\text{O}}_{{\text{2}}}^{\centerdot },$ O3, H+, и образование сверхактивных восстановителей, таких как ОН−, Н−, Н2, ${\text{НО}}_{{\text{2}}}^{\centerdot },$ ${\text{НО}}_{{\text{2}}}^{ - },$ ${\text{О}}_{{\text{2}}}^{ - }$ в катодном отделении [2, 12].
(1)
$\begin{gathered} Анодное окисление{\text{:}}\,\, \\ 2{{Н}_{2}}О \rightleftharpoons 4{{Н}^{ + }} + 4е\, + {{О}_{2}} \uparrow . \\ \end{gathered} $(2)
$\begin{gathered} {\text{Катодное восстановление: }} \\ 2{{{\text{Н}}}_{{\text{2}}}}{\text{О}} + 2{\text{е}} \rightleftharpoons {{{\text{Н}}}_{2}} \uparrow + {\text{ 2О}}{{{\text{Н}}}^{ - }}. \\ \end{gathered} $(3)
$\begin{gathered} {\text{Образование хлора на аноде: }} \\ 2{\text{C}}{{{\text{l}}}^{ - }} \rightleftharpoons {\text{С}}{{{\text{l}}}_{2}} \uparrow + {\text{ }}2{\text{е}}. \\ \end{gathered} $Таким образом, под воздействием внешнего электрического поля одновременно генерируются два типа электроактивированных растворов. Электрохимически щелочной раствор производится на катодной стороне. Этот раствор обладает сильным восстановительным потенциалом, насыщен молекулярным водородом и содержит высокую концентрацию активных гидроксильных ионов (ОН–). На другой стороне реактора электроактивации на границе раздела анод/раствор генерируется электрохимически подкисленный раствор, обладающий сильным окислительным потенциалом [13]. Этот раствор насыщен молекулами кислорода и характеризуется высокой концентрацией активных протонированных ионов водорода (Н+).
Основным недостатком классического процесса электролиза является тот факт, что продукты реакций окисления/восстановления смешиваются и, таким образом, могут взаимно нейтрализовать друг друга. Для их разделения используются различные типы диафрагм, такие как пористые полупроницаемые мембраны или ионопроницаемые мембраны, анион- и катионообменные мембраны или обе из них [14]. Эти мембраны действуют как модуляторы массопереноса электрически заряженных частиц [15]. Таким образом, применяя внешнее электрическое поле с адекватной конфигурацией электроактивирующего реактора, можно создать уникальные предпосылки для реакций, которые в обычных условиях не могут быть выполнены. Например, простая реакция гидролиза NaCl при нормальных условиях будет протекать в противоположном направлении, но применение внешней энергии позволяет получать хлор и NaOH. Для такой реакции можно использовать двухэлементный реактор в сочетании с катионообменной мембраной (CEM). В результате ионы хлора разряжаются с выделением газа на аноде, а ионы Na+ мигрируют в соседнее отделение, где ионы H+ образуют газообразный H2, а ионы Na+ вместе с OH– образуют сильную щелочь, известную как гидроксид натрия [16].
Явление миграции ионов через заряженные мембраны также используется в процессе, известном как электродиализ, который, однако, не следует путать с электроактивацией. Основной целью электродиализа является разделение заряженных частиц, тогда как для электроактивации это приобретение новых физико-химических свойств, таких как целевой pH и окислительно-восстановительный потенциал, которые не могут быть получены обычными химическими реакциями [12, 17]. Вкратце, когда прикладывают электрическое поле, состав водного раствора в ближнем анодном и ближнем катодном слое модифицируется и сопровождается измененной (высокой) реакционной способностью. Кроме того, самая высокая (максимальная) сила тока достигается в приэлектродном слое, называемом двойным диффузионным слоем, где фактически происходит процесс активации. В результате после возбуждения внешним электрическим полем водный раствор переходит в метастабильное состояние, характеризующееся различными физико-химическими характеристиками по сравнению с невозбужденным раствором. Кроме того, электроны на орбитали приобретают более высокую активность [6, 12]. Такая гипотеза была подтверждена изучением колебательных спектров электроактивированных растворов (ЭПР) с помощью спектроскопии комбинационного рассеяния [18]. Результаты показали значительное различие в спектрах комбинационного рассеяния между 700 и 2700 см–1 растворов ЭА, взятых в ближней анодной (анолитной) и катодной (католитной) областях и в химически подкисленном и подщелачиваемом водном растворе путем добавления HCl и NaOH. Было отмечено присутствие ионов H+ или OH– в анолите и католите соответственно, которые, как известно, ответственны за кислотные и щелочные свойства. Кроме того, анолит и католит показали полосы, аналогичные полосам концентрированных кислотных и щелочных растворов. Поэтому предполагалось, что растворы ЭА могут иметь свойства, аналогичные свойствам концентрированных кислот и щелочей, но с более высокой реакционной способностью [6].
Зная основные параметры, которые влияют на процесс электроактивации, и используя конкретную конфигурацию электроактивирующего реактора, можно достичь желаемой степени ЭА. Однако исследования по взаимосвязи между конструкционными характеристиками реактора ЭА и технологическими параметрами процесса, с одной стороны, и свойствами растворов ЭА, с другой стороны, в научной литературе практически не освещаются. Кроме того, эмпирическая настройка параметров используется в большинстве источников [6]. Поэтому основной целью данного исследования было изучение параметров, которые влияют на изменения рН и щелочности в водном растворе, подверженные воздействию внешнего электрического поля в катодном отделении электроактивирующего реактора, модулированного анионообменными и катионообменными мембранами. Для этого были изучены эффекты конфигурации ячеек, концентрации соли, силы тока и времени обработки.
МАТЕРИАЛЫ И МЕТОДЫ
Химические вещества
Хлорид натрия (NaCl) был приобретен у Caledon Laboratories LTD (Джорджтаун, провинция Онтарио, Канада). Гидроксид натрия (NaOH) был приобретен у VWR International LLC (Вест-Честер, штат Пенсильвания, США). Концентрированная соляная кислота (HCl) и сульфат натрия (Na2SO4) были приобретены у Fisher Scientific (Монреаль, Канада).
Ионообменные мембраны
Анионные (AM-40) и катионные (CM-40) обменные мембраны были приобретены у Открытого акционерного общества “Щекиноазот” (Щекино, Российская Федерация). Перед использованием обе мембраны были промыты 96% этанолом для удаления воска и подготовлены в соответствии с инструкциями производителя перед их использованием в электроактивирующем реакторе.
Конструкция реактора и конфигурации электроактивирующих ячеек
Электроактивирующий реактор был изготовлен из прозрачных плексигласовых колонок с размерами L50 × W50 × H120 мм. Были использованы электроактивирующие реакторы с тремя и двумя отделениями, в результате чего были показаны четыре различные конфигурации, показанные на рис. 1. Первый реактор состоял из анодного, центрального и катодного отделений, разделенных AEM и CEM, тогда как последний имел только два отделения, разделенных либо AEM, либо CEM.
Рис. 1.
Конфигурации электроактивирующего реактора, используемого для генерации электроактивированных растворов, соответствующих: (а) конфигурации 1; (б) конфигурации 2; (в) конфигурации 3; (г) конфигурации 4.

В первой конфигурации AEM отделяла анод и центральные части, тогда как CEM находилась на катодной стороне, отделяя ее от центральной секции. Вторая конфигурация имела те же три отделения, но на этот раз мембраны помеются своими местами. Третья и четвертая конфигурации имели два отделения, разделенные CEM и AEM, соответственно.
Электроды RuO2–IrO2–TiO2 120 × 34 × 1 мм с рабочей активной площадью 40 см2 размещались на концах ячеек и были подключены к положительной стороне источника постоянного электрического тока для анодного отделения и к отрицательной стороне для катодного отделения. Значения приложенного напряжения и силы электрического тока измеряли с использованием источника тока (CSI12001X, Circuit Specialists, Inc, США).
Методика электроактивации
Это исследование в первую очередь сосредоточено на анализе католита и его свойств. Трехпараметрический полный факторный план эксперимента был использован для проверки влияния конфигурации ячейки, концентрации соли и силы тока на pH и щелочность электроактивированных растворов. ЭА проводили при трех постоянных значениях силы электрического тока 0.05, 0.1 и 0.2 А, обеспечивающих гальваностатическое состояние. Образцы анализировали через 10, 30 и 60 мин обработки.
Для обеспечения тока протекающие солевые растворы смешивали во всех отделениях с помощью магнитных мешалок. Катодное отделение было заполнено раствором NaCl следующих концентраций 0.01, 0.1 и 1 М. Анодное и центральное (где это применимо) отделения всегда были заполнены раствором Na2SO4 постоянной концентрации, соответствующей 0.25 М, чтобы избежать выделения токсичного хлора (Cl2) на аноде.
Методы анализа
Во время каждой обработки пробы по 5 мл отбирали каждые 2 мин в течение первых 10 мин, а затем каждые 10 мин. Значения pH образцов измеряли с использованием pH-метра (модель SR 601 C SympHony, VWR Scientific Products, США), после чего образцы возвращали обратно в ячейку, чтобы минимизировать влияние отбора проб.
Для определения щелочности использовали простой метод титрования с некоторыми модификациями. Электроактивированный раствор титровали 0.1 М HCl до достижения нейтрального рН. Объем кислоты, используемой для нейтрализации щелочи, был отмечен и использован для расчета щелочности:
Здесь A представляет собой щелочность, c(HCl) представляет собой молярную концентрацию кислоты, используемой для титрования, V1 представляет собой объем исследуемого раствора, взятый для анализа, и V2 представляет собой объем HCl, используемой для нейтрализации щелочи.ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Конфигурация 1
Конфигурация 1 показана на рис. 1а вместе с основными реакциями, которые происходят во время электроактивации. Эта конфигурация характеризуется двумя основными процессами: опреснение в центральном отделении и концентрация в отделениях, обнаруженных в крайних местах. Катодное отделение отделено от центрального с помощью CEM. Эта конфигурация позволяет переносить катионы из центрального отделения и в то же время предотвращает выход анионов из катодного отделения. Электролиз воды происходит на катоде с выделением H2, поэтому в течение некоторого периода времени накапливаются ионы OH–, что приводит к увеличению pH.
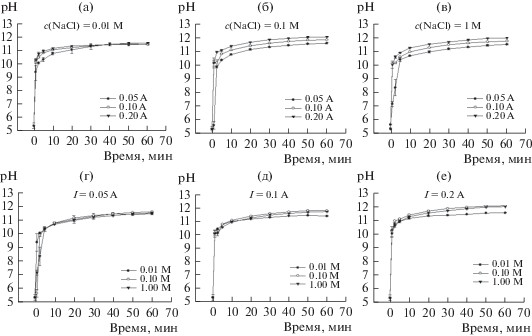
Изменение рН. Начальные значения рН варьировались от 5.6 до 5.9 в зависимости от дистиллированной воды, использованной в лаборатории. Это изменение было вызвано растворенным CO2 и не превышало 5% во всех экспериментах. Кроме того, некоторые карбонат-ионы также могут образовываться после электрохимической обработки. Действительно, щелочная среда в катодном сечении является благоприятным фактором для такого образования. При подаче постоянного тока pH раствора резко возрастал в течение первых нескольких минут, и через 10 минут после электроактивации он достигал плато. Влияние концентрации соли и силы тока на рН катодного раствора во времени показано на рис. 2. Все рисунки показывают одинаковую тенденцию. Как видно из рис. 2a–2в, что для всех трех концентраций, чем выше сила тока, тем выше pH, полученный после 60 минут работы. Кроме того, щелочное значение pH (pH 10) для I = 0.2 A достигается в течение одной минуты ЭА, в течение 2.5 мин для I = = 0.1 A и в течение 5 мин для I = 0.05 A. Это означает, что при более высокой силе токе значение pH повышалось быстрее по сравнению с более низкой силой тока. Как видно из рис. 2г–2е, между кривыми отсутствует существенное различие, показывающее, что концентрация соли не влияет на pH.
Рис. 2.
Влияние силы тока и концентрации соли с течением времени на мониторинг pH электроактивированных растворов в конфигурации 1.

Щелочность раствора. Щелочность представляет собой меру способности нейтрализовать кислоты, также называемая кислотной способностью нейтрализации. Основными веществами, которые влияют на щелочность воды, являются гидроксид, карбонат и бикарбонат. Щелочность часто путают с рН, предполагая, что щелочные растворы имеют рН выше 7. Однако раствор с высокой щелочностью не всегда имеет высокие значения рН. Например, раствор, содержащий карбонатную щелочность, будет иметь рН около 8.3. В настоящем исследовании проверяется только щелочность гидроксида, поскольку другие вышеупомянутые компоненты не присутствуют в растворах. Поскольку гидроксид-ион ОН– является сильным основанием, высокая щелочность приведет к высокому значению рН (выше 10). Общая щелочность раствора представляет собой его способность связывать протоны, что также означает способность противостоять изменениям рН путем нейтрализации кислот. Другими словами, измерения щелочности можно использовать для оценки буферной емкости растворов. Это даст полезную информацию о силе растворов ЭА и сделает возможным их сравнение с традиционными основаниями. При анализе щелочности полученных растворов существенных изменений не обнаружено. На рис. 3 показано влияние тестируемых параметров на щелочность католита. График представлен в закодированных значениях, которые объяснены в табл. 1. Вначале титруемый раствор малочувствителен к изменениям концентраций ионов H+ (т.е. к добавлению кислоты), и его pH изменяется медленно, но близко к эквивалентной точке даже незначительные количества кислоты приводят к резким и быстрым изменениям pH. Только время и сила тока оказали существенное влияние на щелочность (р < 0.05) (рис. 3а–3в). Щелочность увеличивается с увеличением времени и силы тока. Максимальные значения были достигнуты при максимальной силе тока (I = 0.2 А) и в течение максимального времени (t = 60 мин), независимо от концентрации NaCl, и были в два раза больше, чем те, которые были получены при 0.1 А, и в 4 раза больше, чем те, которые были при 0.05 А (табл. 2). Влияние времени и концентрации подтверждается первым законом Фарадея, согласно которому масса вещества, выделяющегося на электроде, прямо пропорциональна количеству электричества, протекающего через электролит, и времени [19]. С увеличением силы тока электролиз воды на катоде становится более интенсивным, поэтому генерируется больше ионов H+ и OH–, а также других активных восстановителей. Ионы H+, в свою очередь, восстанавливаются на поверхности электрода в виде газа, а ионы OH– накапливаются, что приводит к увеличению pH. Точно так же больше ионов OH– накапливается с течением времени. Поскольку CEM разделяет два отделения, гидроксильные ионы, которые имеют тенденцию достигать анода, не могут выходить из отделения, отклоняются мембраной в соответствии с исключением Доннана и, таким образом, повышают щелочную прочность раствора. Ионы Na+ легко проникают через катионообменную мембрану из центрального отделения и вместе с гидроксильными ионами образуют сильное основание NaOH.
Рис. 3.
Влияние концентрации соли, силы тока и времени на щелочность: а) время остается постоянным при максимальном значении (60 мин); б) сила тока остается постоянной при максимальном значении (0.2 А); в) концентрация остается постоянной при максимальном значении (1 М).

Таблица 1.
Переменные и их кодированные значения
| Переменная | Кодированные значения | ||
|---|---|---|---|
| –1 | 0 | 1 | |
| Концентрация NaCl, М | 0.01 | 0.1 | 1 |
| Сила тока, А | 0.05 | 0.1 | 0.2 |
| Время, мин | 10 | 30 | 60 |
Таблица 2.
Сравнение pH и щелочности между двумя конфигурациями для различных значений силы тока при концентрации 0.01M NaCl
| c(NaCl) = 0.01 M, I = 0.05 A | ||||||||
|---|---|---|---|---|---|---|---|---|
| t, мин | Конфигурация 1 | Конфигурация 2 | ||||||
| pH | ±СО | Щелочность | ±СО | pH | ±СО | Щелочность | ±СО | |
| 10 | 10.56 | 0.02 | 0.92 | 0.11 | 10.75 | 0.07 | 1.00 | 0.06 |
| 30 | 11.02 | 0.13 | 3.20 | 0.06 | 11.00 | 0.02 | 2.73 | 0.10 |
| 60 | 11.34 | 0.05 | 6.90 | 0.14 | 11.42 | 0.06 | 5.12 | 0.25 |
| c(NaCl) = 0.01 M, I = 0.1 A | ||||||||
| t, мин | Конфигурация 1 | Конфигурация 2 | ||||||
| pH | ±СО | Щелочность | ±СО | pH | ±СО | Щелочность | ±СО | |
| 10 | 10.88 | 0.03 | 2.34 | 0.05 | 10.91 | 0.01 | 2.15 | 0.13 |
| 30 | 11.24 | 0.06 | 6.50 | 0.57 | 11.23 | 0.02 | 4.75 | 0.21 |
| 60 | 11.54 | 0.02 | 12.85 | 0.78 | 11.39 | 0.04 | 8.47 | 0.04 |
| c(NaCl) = 0.01 M, I = 0.2 A | ||||||||
| t, мин | Конфигурация 1 | Конфигурация 2 | ||||||
| pH | ±СО | Щелочность | ± СО | pH | ±СО | Щелочность | ±СО | |
| 10 | 11.05 | 0.01 | 4.85 | 0.78 | 11.20 | 0.06 | 3.50 | 0.28 |
| 30 | 11.60 | 0.02 | 14.07 | 0.04 | 11.33 | 0.02 | 7.30 | 0.28 |
| 60 | 11.81 | 0.07 | 25.46 | 0.31 | 11.49 | 0.04 | 11.55 | 0.07 |
Конфигурация 2
Вторая конфигурация показана на рис. 1б. Это похоже на предыдущий, но мембраны поменялись местами. Эта модификация приводит к изменениям в поведении заряженных видов. В отличие от конфигурации 1, среднее отделение представляет собой зону концентрирования, тогда как два крайних отделения представляют собой зоны обеднения. Анионы теперь могут проникать через AEM, в то время как катионы из среднего отделения остаются.
Изменение рН. Изменение pH в катодном отделении для конфигурации 2 показано на рис. 4. Как и в предыдущей конфигурации, pH увеличивается как функция времени. Однако в отношении концентрации соли не все кривые имеют одинаковую тенденцию. Разница заметна при самой низкой концентрации соли. Таким образом, при низкой концентрации NaCl сила тока оказывает влияние только при 10 и 30 мин обработки, а после этого изменения незначительны. При более высоких концентрациях кривые хорошо разделены, увеличение pH наблюдается при увеличении силы тока, как это было для конфигурации 1. Аналогично, при постоянной низкой силе тока отсутствует различие между значениями pH растворов для различных концентраций. Однако можно заметить, что для I = 0.1 A и 0.2 A значения pH несколько ниже при концентрации NaCl 0.01 М.
Рис. 4.
Влияние силы тока и концентрации соли с течением времени на мониторинг pH электроактивированных растворов в конфигурации 2.
Щелочность раствора. Эволюция щелочности показана на рис. 5. Разница в конфигурации выявила новый параметр, влияющий на щелочность растворов. Хотя время и сила тока имеют тот же эффект, что и в предыдущей конфигурации (рис. 5в), наблюдается значительное отклонение в отношении влияния концентрации NaCl (рис. 5а, 5б). Так, при 0.05 А щелочность увеличилась в 1.35 и 1.46 раза для растворов 0.1 М и 1 М соответственно. При силе тока 0.1 А она увеличилась в 1.55 и 1.68 раза. Наконец, при 0.2 А щелочность увеличилась в 2.09 и 2.44 раза для растворов 0.1 и 1 М по сравнению с 0.01 М раствором (рис. 5а, табл. 2–4).
Рис. 5.
Влияние концентрации соли, силы тока и времени на щелочность: (а) время остается постоянным при максимальном значении (60 мин); (б) сила тока остается постоянной при максимальном значении (0.2 А); (в) концентрация остается постоянной при максимальном значении (1 М).

Таблица 3.
Сравнение pH и щелочности между двумя конфигурациями для различных значений силы тока при концентрации 0.1 М NaCl
| c(NaCl) = 0.1 M, I = 0.05 A | ||||||||
|---|---|---|---|---|---|---|---|---|
| t, мин | Конфигурация 1 | Конфигурация 2 | ||||||
| pH | ± | Щелочность | ± | pH | ± | Щелочность | ± | |
| 10 | 10.68 | 0.01 | 0.93 | 0.04 | 10.83 | 0.04 | 1.27 | 0.01 |
| 30 | 11.22 | 0.00 | 3.28 | 0.03 | 11.29 | 0.05 | 3.25 | 0.07 |
| 60 | 11.56 | 0.04 | 6.62 | 0.17 | 11.56 | 0.04 | 6.90 | 0.37 |
| c(NaCl) = 0.1 M, I = 0.1 A | ||||||||
| t, мин | Конфигурация 1 | Конфигурация 2 | ||||||
| pH | ± | Щелочность | ± | pH | ± | Щелочность | ± | |
| 10 | 11.03 | 0.08 | 2.03 | 0.10 | 11.08 | 0.01 | 2.16 | 0.20 |
| 30 | 11.48 | 0.01 | 7.08 | 0.03 | 11.55 | 0.02 | 6.77 | 0.24 |
| 60 | 11.76 | 0.01 | 13.80 | 0.08 | 11.81 | 0.01 | 13.14 | 0.06 |
| c(NaCl) = 0.1 M, I = 0.2 A | ||||||||
| t, мин | Конфигурация 1 | Конфигурация 2 | ||||||
| pH | ± | Щелочность | ± | pH | ± | Щелочность | ± | |
| 10 | 11.38 | 0.01 | 4.35 | 0.21 | 11.39 | 0.01 | 4.45 | 0.07 |
| 30 | 11.81 | 0.02 | 14.77 | 0.10 | 11.82 | 0.01 | 13.05 | 0.21 |
| 60 | 12.03 | 0.02 | 27.90 | 0.14 | 12.03 | 0.01 | 24.15 | 0.49 |
Таблица 4.
Сравнение pH и щелочности между двумя конфигурациями для различных значений силы тока при концентрации 1 М NaCl
| c(NaCl) = 1 M, I = 0.05 A | ||||||||
|---|---|---|---|---|---|---|---|---|
| t, мин | Конфигурация 1 | Конфигурация 2 | ||||||
| pH | ± | Щелочность | ± | pH | ± | Щелочность | ± | |
| 10 | 10.62 | 0.03 | 0.96 | 0.06 | 10.66 | 0.08 | 1.07 | 0.04 |
| 30 | 11.12 | 0.01 | 3.03 | 0.04 | 11.11 | 0.08 | 3.35 | 0.13 |
| 60 | 11.40 | 0.01 | 6.42 | 0.40 | 11.49 | 0.04 | 7.45 | 0.78 |
| c(NaCl) = 1 M, I = 0.1 A | ||||||||
| t, мин | Конфигурация 1 | Конфигурация 2 | ||||||
| pH | ± | Щелочность | ± | pH | ± | Щелочность | ± | |
| 10.00 | 10.92 | 0.04 | 2.02 | 0.03 | 11.01 | 0.02 | 2.31 | 0.07 |
| 30.00 | 11.36 | 0.00 | 6.77 | 0.04 | 27.99 | 23.37 | 7.20 | 0.00 |
| 60.00 | 11.74 | 0.03 | 13.20 | 0.14 | 11.72 | 0.01 | 14.25 | 0.35 |
| c(NaCl) = 1 M, I = 0.2 A | ||||||||
| t, мин | Конфигурация 1 | Конфигурация 2 | ||||||
| pH | ± | Щелочность | ± | pH | ± | Щелочность | ± | |
| 10 | 11.24 | 0.01 | 4.39 | 0.01 | 11.28 | 0.03 | 4.77 | 0.18 |
| 30 | 11.74 | 0.02 | 13.32 | 0.11 | 11.80 | 0.02 | 14.40 | 0.03 |
| 60 | 12.00 | 0.01 | 27.15 | 0.35 | 11.96 | 0.00 | 28.15 | 0.64 |
Влияние типа конфигурации является более важным с минимальной концентрацией соли и максимальной силой тока в этом отделении. Из-за различного расположения мембран катодное отделение превращается в зону обеднения. При использовании концентрации 0.01 М наблюдается недостаток носителей тока, что можно заметить по более высокому напряжению (данные не показаны). Кроме того, ионы хлора и гидроксида покидают катодное отделение под действием внешнего электрического поля. Чтобы компенсировать недостаток ионов в отделении, происходит диссоциация воды на мембране, как сообщалось в [20]. Поэтому вновь генерируемые ионы H+ и OH– становятся носителями тока. В этом случае, чем больше диссоциирует вода, тем меньше увеличивается щелочность. Диссоциация воды приводит к образованию ионов H+ и OH–, последние, в свою очередь, покидают отделение, а первые нейтрализуют ионы OH–, образующиеся при электролизе воды. Со временем в камере накапливается больше ионов, и напряжение начинает медленно уменьшаться, так как в результате увеличения электропроводности раствора уменьшается диссоциация воды и увеличивается щелочность.
Когда в катодном отделении используются более высокие концентрации NaCl, наблюдается более высокая щелочность, поскольку имеется достаточно носителей тока. Поэтому концентрация так же важна, как время и сила тока для этой конфигурации.
Конфигурации 3 и 4
Третья конфигурация представляет собой двухкамерную ячейку, состоящую из анодной и катодной камер, разделенных CEM (рис. 1в). Из-за более близкого расположения электродов, чем для первых двух конфигураций, напряжение ниже (данные не показаны). При транспортировке электрических зарядов между электродами расстояние меньше. Для катодного отделения эта конфигурация аналогична конфигурации 1. В основном происходят те же реакции, что и для первой конфигурации. Различие представляет собой лишь отсутствие среднего отделения. Однако, в отличие от первой конфигурации, происходит перенос ионов H+ из анодного отделения вместе с ионами Na+ в катодное отделение. Это менее благоприятно, так как ионы водорода нейтрализуют ОН–, тем самым уменьшая щелочность. В целом, с точки зрения pH и щелочности результаты были аналогичны (данные не показаны) для первой конфигурации. Никакого снижения pH или щелочности не наблюдалось, несмотря на дополнительную миграцию ионов H+ для этой конфигурации, предположительно из-за диапазона выбранных условий. Однако возможно, что различие будет иметь место, если время обработки и сила тока увеличатся. С другой стороны, эффектом миграции H+, по-видимому, можно пренебречь, так как изменения щелочности в основном регулируются электродными реакциями, образующимися при ЭА.
Четвертая конфигурация (рис. 1г) также представляет собой двухкамерную ячейку с AEM, разделяющим оба электродных отделения. Исследование pH и щелочности показало ту же тенденцию, что и в конфигурации 2. Однако отсутствие среднего отделения привело к дополнительному выделению хлора (Cl2) на аноде из-за миграции Cl– из катодного отделения. Помимо этого факта и меньшего расстояния между электродами, никакой разницы не было замечено. Подобно второй конфигурации, все три параметра были значимыми для изменений щелочности (не показаны).
Влияние типа конфигурации реактора
Учитывая сходство между конфигурациями 1, 3 и 2, 4, будут обсуждаться только конфигурации 1 и 2. Основное различие между ними заключается в мембране, используемой для отграничения катодного отделения. В результате влияние концентрации соли на щелочность не является значительным в первом случае, но оказывает выраженное влияние во втором случае. Табл. 2 показывает увеличение щелочности и pH с увеличением времени для двух конфигураций. Как можно заметить, pH изменяется постепенно с увеличением времени и силы тока. Что касается pH, то не было обнаружено существенного различия между двумя конфигурациями. Что касается щелочности, ситуация была совсем другой. Максимальная щелочность 25.46 ± 0.31 в первой конфигурации и 0.01 М концентрации NaCl достигается в течение 60 мин. Он постепенно увеличивается с увеличением времени и силы тока. Для конфигурации 2 также наблюдается увеличение, но оно не такое резкое. Для того же времени и силы тока она составляла только 11.55 ± 0.07, что более чем вдвое меньше, чем в конфигурации 1. Поэтому при минимальной концентрации NaCl щелочность в конфигурации 1 достигла своего максимума, а в конфигурации 2 – нет. Увеличение концентрации NaCl в первой конфигурации не влияло на щелочность, тогда как во второй конфигурации была обнаружена значительная разница (табл. 3). Наконец, при концентрации 1 М NaCl щелочность, достигнутая в конфигурации 2, была статистически аналогичной той, которая была получена в конфигурации 1, независимо от концентрации соли (табл. 4).
Следовательно, кажется, что вторая конфигурация менее эффективна по сравнению с конфигурацией 1, главным образом, из-за того, что целевые ионы ОН– покидают отделение через AEM. Конфигурация 1 предотвращает выход гидроксильных ионов из отделения и, кроме того, позволяет переносить ионы Na+ из центрального отделения, образуя NaOH. Сила растворов, полученных с помощью конфигурации 1, не зависит от концентрации соли и, следовательно, не требует высокого содержания соли. Для конфигурации 2 подобная щелочность может быть достигнута при использовании концентрации 1 М NaCl.
Исследование щелочности растворов ЭА несет ценную информацию о силе полученных растворов. Несмотря на то, что не наблюдалось значительных изменений в отношении pH, были отмечены значительные различия в отношении титруемой щелочности. Это можно объяснить накопленной щелочью при электроактивации [21]. По сравнению с обычной щелочью, такой как NaOH, максимальная щелочность, полученная в тестируемых условиях в настоящем исследовании, эквивалентна 0.03 М концентрации NaOH. Чтобы увеличить эту концентрацию, необходимы более высокие значения силы тока, а также более длительные процедуры. С другой стороны, продукт ЭА представляет собой не концентрированный, а активированный раствор. Такие растворы требуют дальнейших исследований с точки зрения их реакционной способности. Их поведение в различных физико-химических и биологических реакциях является предметом дальнейшего анализа.
ВЫВОДЫ
Исследовано влияние силы тока, времени и концентрации соли на рН и щелочность водных растворов, полученных в реакторе 4-х различных конфигураций. Среди четырех протестированных конфигураций наблюдается парное сходство. Таким образом, конфигурации 1 и 3 были аналогичны конфигурациям 2 и 4. Время обработки было наиболее важным параметром для изменения pH всех растворов ЭА. Высокое щелочное значение pH было достигнут в течение первых 10 мин, но дальнейшая обработка не привела к заметному различию. Что касается силы тока, концентрации соли и типа конфигурации, различия были незначительными. Ситуация была совсем другой для щелочности. Хотя значение pH растворов во всех случаях указывало на сильно щелочную среду, исследования щелочности показали значительную разницу для разного времени и силы тока (для всех протестированных конфигураций) и концентрации соли (для конфигураций 2 и 4). Щелочность была выше при более высокой силе тока и более длительном времени обработки. Для конфигураций 2 и 4 щелочность возрастала с увеличением концентрации соли, что объяснялось расположением мембран. В общем, конфигурации 1 и 3 представляются более эффективными в тестируемых условиях, поскольку они удерживают требуемые ионы в ячейке, тогда как две другие конфигурации позволяют их переносить в соседнее отделение. Несмотря на сильно щелочной pH, который указывает на присутствие групп OH–, полученные растворы были слабее, чем обычные основания, такие как NaOH. Раствор с самой высокой щелочностью соответствовал 0.03 М раствору NaOH. В испытанных условиях растворы, сравнимые с сильным NaOH, не были получены. Поэтому для увеличения щелочности требуется существенное увеличение силы тока и времени обработки. Особый интерес проявляет корреляция между pH и щелочностью. Растворы, полученные в конфигурациях 1 и 2, не показали существенного различия с точки зрения рН, тогда как с точки зрения щелочности наблюдалось значительное увеличение. Разница между pH и щелочностью может быть показателем воздействия других веществ (продуктов электродных реакций) и неравновесных процессов, которые происходят в приэлектродном слое. Энергия активации вызывает неравновесные процессы, которые изменяют свойства растворов. Необходим дальнейший анализ использования ЭАР. Щелочные свойства католита могут быть использованы в технологических процессах, где обычно используются обычные основания. Потенциально технология ЭА может стать лучшей альтернативой использованию традиционных основ во многих технологических процессах, поскольку позволяет отказаться от использования химических реагентов. В странах, где электроэнергия производится из возобновляемых источников энергии, ЭА можно рассматривать как экологически чистую и благоприятную для окружающей среды технологию.
Список литературы
Bogatova, O.V. and Bogatov, A.I., Study of electro-activated aqueous solutions and their use in the poultery industry, Vestnik OSU, 2003, vol. 3, p. 151. [Богатова, О.В., Богатова, А.И. Исследование электроактивированных водных растворов и их использование в птицеводстве. Вестник ОГУ, 2003. Т. 1. № 3. С. 3, С. 151.]
Chaplin, M., Water structure and science, http://www1.lsbu.ac.uk/water/electrolysis.html, Accessed on 10,12,2016.
Pang, X. and Deng, B., Investigation of changes in properties of water under the action of a magnetic field, Science China Physics, Mechanics and Astronomy, 2008, vol. 51, p. 1621.
Cai, R., Yang, H., He, J., and Zhu, W., The effects of magnetic fields on water molecular hydrogen bonds, J. Molecular Structure, 2009, vol. 938, p. 15.
Cardella, C., De Magistris, L., Florio, E., and Smith, C.W., Permanent changes in the physico-chemical properties of water following exposure to resonant circuits, Scientific Exploration, 2001, vol. 15, p. 501.
Aider, M., Gnatko, E., and Benali, M., Electro-activated aqueous solutions: Theory and application in the food industry and biotechnology, Innovative Food Sci. Emerg. Technol., 2012, vol. 15, p. 38.
Huang, Y.-R., Hung, Y.-C., and Hsu, S.-Y., Application of electrolyzed water in the food industry, Food Control, 2008, vol. 19, p. 329.
Rahman, S.M.E., Ding, T., and Oh, D.-H., Effectiveness of low concentration electrolyzed water to inactivate foodborne pathogens under different environmental conditions, Int. J. Food Microbiol., 2010, vol. 139, p. 147.
Kiura, H., Sano, K., and Morimatsu, S., Bactericidal activity of electrolyzed acid water from solution containing sodium chloride at low concentration, in comparison with that at high concentration, J. Microbiol. Methods, 2002, vol. 49, p. 285.
Aït Aissa, A. and Aïder, M., Ion exchange membranes controlled electro-catalytic synthesis of lactulose from lactose under refrigerated conditions, Innovative Food Sci. Emerg. Technol., 2013, vol. 20, p. 299.
Bazinet, L., Electrodialytic Phenomena and Their Applications in the Dairy Industry: A Review, Crit. Rev. Food Sci. Nutr., 2005, vol. 44, p. 525.
Tomilov, A.P., Electrochemical activation: a new trend in applied electrochemistry, Life and Safety, 2002, vol. 3, p. 302. [Томилов, А.П. Электрохимическая активация: новое направление в прикладной электрохимии. Жизнь и безопасность. 2002. Вып. 3. С. 302.]
Hsu, S.-Y., Effects of flow rate, temperature and salt concentration on chemical and physical properties of electrolyzed oxidizing water, J. Food Eng., 2005, vol. 66, p. 171.
Mani, K.N., Electrodialysis water splitting technology, J. Membr. Sci., 1991, vol. 58, p. 117.
Baker, R.W., Membrane Technology and Applications, John Wiley & Sons, Ltd, 2012, p. 417.
Shaposhnik, V.A., Evolution of the Membrane Electrochemistry, Russ. J. Electrochem., 2002, vol. 38, p. 800. [Шапошник, В.А. Эволюция мембранной электрохимии. Электрохимия. 2002. Т. 38. С. 800.]
Maevskaya, T.N. and Babkov, N.I., Study of electro-activated solutions and use in the fish protein production industry, Food Science and Technology (Odessa, Ukraine), 2012, vol. 1(18), p. 99. [Маевская, Т.Н., Бабков, Н.И. Исследование электроактивированных растворов и их использование в производстве рыбных белков. Пищевая наука и технология (Одесса, Украина). 2012. Т. 1(18). С. 99.]
Pastukhov, V.I. and Morozov, V.P., Raman scattering of light by the electroactivated water, Optics and Spectroscopy, 2000, vol. 88, p. 35. [Пастухов, В.И., Морозов, В.П. Комбинационное рассеяние света на электроактивированной воде. Оптика и спектроскопия. 2000. Т. 88. С. 35.]
Damaskin, B.B., Petrii, O.A., and Tsirlina, G.A., Elektrokhimiya (Electrochemistry), Khimiya, M., 2008. [Дамаскин, Б.Б., Петрий, О.А., Цирлина, Г.А. Электрохимия. М.: Химия. 2008.]
Tanaka, Y., Water dissociation reaction generated in an ion exchange membrane, J. Membr. Sci., 2010, vol. 350, p. 347.
Belovolova, L.V., Glushkov, M.V., and Vinogradova, G.I., Osobennosti fluorescentsii vody, aktivirovannoi electrolizom. Rol aktivnyh form vodoroda. Fluorent characteristics of water activated by electrolysis. The role of active forms of the hydrogen, 2006. [Беловолова, Л.В., Глушков, М.В., Виноградова, Г.И. Особенности флуоресценции воды, активированной электролизом. Роль активных форм водорода. 2006.]
Дополнительные материалы отсутствуют.


