Электрохимия, 2020, T. 56, № 3, стр. 256-260
ИССЛЕДОВАНИЕ АНОДНОГО РАСТВОРЕНИЯ НЕРЖАВЕЮЩЕЙ СТАЛИ В HCl МЕТОДОМ ИЗМЕРЕНИЯ ОМИЧЕСКОГО СОПРОТИВЛЕНИЯ
К. В. Рыбалка a°, *, Л. А. Бекетаева a, А. Д. Давыдов a, **
a Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Ленинский просп., 31, корп. 4, Россия
* E-mail: mamaison2000@yandex.ru
** E-mail: alexdavydov@yandex.ru
Поступила в редакцию 30.04.2019
После доработки 21.06.2019
Принята к публикации 29.07.2019
Аннотация
Цель настоящей работы – показать возможности метода измерения омического сопротивления при исследовании анодного растворения металлов. Показано, что одновременное измерение скорости растворения металла этим методом (по изменению массы образца, рассчитанного по изменению его сопротивления) и по затраченному количеству электричества при его поляризации, позволяет определить электрохимический эквивалент нержавеющей стали. Получена зависимость катодной компоненты тока от анодного потенциала и определена область потенциалов вблизи потенциала разомкнутой цепи, где следует учитывать одновременное протекание анодной и катодной реакции.
ВВЕДЕНИЕ
Электрохимические процессы, в частности анодное растворение, катодное осаждение и коррозию металлов часто изучают, используя различные виды вольтаметрии. Например, метод тафелевской экстраполяции часто используют для определения скорости коррозии или скорости химического травления металлов [1–6]. Однако на поляризационных кривых в полулогарифмических координатах не всегда удается обнаружить прямолинейные участки. Кроме того, эти линейные участки отстоят на десятки милливольт от потенциала разомкнутой цепи (ПРЦ). Поэтому свойства поверхности образца в этом случае могут существенно отличаться от свойств поверхности при ПРЦ.
Метод тафелевской экстраполяции, как и многие другие электрохимические экспресс-методы, выражает скорость коррозии в А/см2. Преобразование полученных таким образом данных в величины более пригодные для практического использования требует знания электрохимического эквивалента материалов, что особенно проблематично для сплавов, имеющих сложный состав. Расчеты основываются на данных о процентном содержании компонентов сплава и выборе валентности каждого из компонентов. При этом предполагается, что растворение каждого из компонентов сплава происходит независимо от растворения других компонентов. Это предположение достаточно спорно. Известно, что компоненты сплава могут анодно растворяться при потенциалах, отличных от потенциалов растворения индивидуальных металлов [7, 8]. Если механизм растворения в условиях свободного растворения неизвестен, может быть выбрана неправильная величина валентности. Это имеет место в случае хрома, железа, титана, алюминия и ряда других металлов. Кроме того, некоторые металлы могут обнаруживать при окислении аномальные величины валентности [9, 10].
Метод измерения омического сопротивления исследуемого образца известен в течение длительного времени и находит практическое применение, например, для мониторинга процессов коррозии различных устройств, находящихся в агрессивной среде [11–15]. Сенсоры коррозии, основанные на использовании тонких металлических плёнок, позволяют определять изменение толщины образца, составляющие миллионные доли сантиметра [16].
В настоящей работе исследование влияния анодной поляризации металла на скорость его растворения основано на регистрации изменения омического сопротивления образца за время его поляризации и определении затраченного при этом количества электричества. Сочетание метода измерения омического сопротивления образца с его анодной поляризацией позволяет расширить возможности применения этого метода, особенно при изучении коррозионноусточивых материалов. В последнем случае может потребоваться слишком большое время, для того чтобы почувствовать изменение геометрических размеров образца в условиях свободной коррозии. Анодная поляризация существенно ускоряет этот процесс. Одновременное определение количества растворенного металла и затраченного на это количества электричества позволяет получить дополнительную информацию.
В настоящей работе показаны возможности, предоставляемые сочетанием метода омического сопротивления с потенциостатическими измерениями, при исследовании закономерностей анодного растворения стали AISI 304.
МЕТОДИКА ЭКСПЕРИМЕНТОВ
Исследовали проволочные образцы из нержавеющей стали AISI 304 диаметром 0.5 мм.
Химический состав стали AISI 304 приведен выше в табл. 1.
Таблица 1.
Химический состав стали AISI 304
| Элемент | C | Mn | Si | P | S | Cr | Ni | Fe |
|---|---|---|---|---|---|---|---|---|
| мас. % | 0.07 | 2.00 | 1.0 | 0.045 | 0.03 | 18 | 9.00 | >69 |
Все измерения проведены в 0.5 М растворе HCl марки “ос. ч” в дистиллированной воде в трехэлектродной электрохимической ячейке при свободном доступе воздуха при температуре 25°С. Поляризация проволочного образца осуществлялась с помощью потенциостата типа IPC compact. Потенциал образца отсчитывался относительно насыщенного хлорсеребряного электрода. Проволочные образцы перед опытом обезжиривали этиловым спиртом, промывали дистиллированной водой и выдерживали до начала измерений в 0.5 М растворе HCl в течение 24 ч для стабилизации состояния поверхности. Затем выдерживали образец при каждом заданном потенциале в течение шести часов и регистрировали протекающий ток. На основании этих измерений рассчитывали количество прошедшего электричества в каждом шестичасовом опыте.
До начала поляризации и после ее завершения измеряли сопротивление образца и рассчитывали изменение радиуса проволоки под влиянием анодной поляризации. На основе этих данных с учетом удельной плотности образца рассчитывали количество растворенного металла. Для проверки достоверности результатов, полученных методом определения омического сопротивления, исследуемый образец стали AISI 304 взвешивали на аналитических весах ACCULAB ALC-210d4 до и после опыта. Различие результатов не превышало 1%.
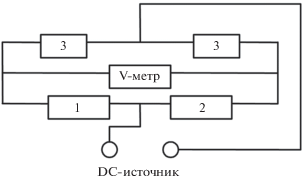
При измерениях сопротивления исследуемого образца ток заданной величины от генератора постоянного тока БП-49 делится на две равные части, проходя через одинаковые резисторы (3), сопротивление которых на 3 порядка превышает сопротивление исследуемого образца. Обе составляющие тока, как следует из схемы (рис. 1), проходят через исследуемый образец (1), помещенный в электролит, и через вспомогательный резистор (2), аналогичный исследуемому образцу, и расположенный на внешней стороне сосуда.
Токи, проходящие через элементы 1 и 2, протекают в противоположных направлениях, благодаря чему разности потенциалов на исследуемом образце и вспомогательном резисторе компенсируют друг друга. Это позволяет измерять небольшие изменения в сопротивлении исследуемого образца, обусловленные уменьшением его диаметра в процессе коррозии. Разность потенциалов измерялась с помощью универсального вольтметра В7-21А. Зная изменение разности потенциалов Δu(t) и ток i, легко определить изменение во времени сопротивления образца ΔR(t) = = Δu(t)/i, находящегося в электролите. Зависимость радиуса проволоки r(t) от времени его пребывания в электролите определяется следующим соотношением:
(1)
$r\left( t \right) = {{\left[ {\frac{1}{{r_{0}^{2}}} + \frac{{\pi \Delta R\left( t \right)}}{{\rho L}}} \right]}^{{ - \frac{1}{2}}}},$РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
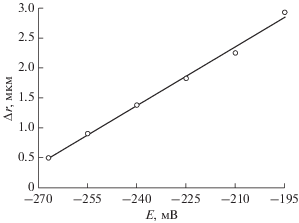
На рис. 2 приведена зависимость изменения радиуса проволоки из стали AISI 304 за 6 ч выдержки в растворе от величины навязанного потенциала E.
Рис. 2.
Зависимость уменьшения радиуса Δr проволоки из стали AISI 304 в 0.5 М растворе HCl от величины анодного потенциала.
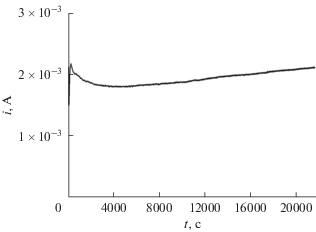
На рис. 3 в качестве примера приведена зависимость тока, протекающего через исследуемый образец, от времени в шестичасовом эксперименте при потенциале –230 мВ. Аналогичные зависимости были получены при других потенциалах.
Интегрированием приведенной на рис. 3 зависимости тока от времени рассчитывали количество электричества ΔQ, затраченное на растворение металла при заданном потенциале. Отношение ΔМ (уравнение (2)) к ΔQ позволяет определить электрохимический эквивалент стали K = ΔМ/ΔQ.
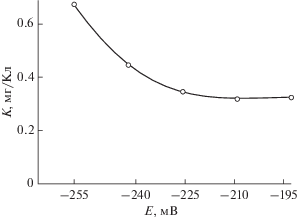
Как следует из зависимости определенного таким образом электрохимического эквивалента от потенциала (рис. 4), при достаточно большом удалении от потенциала разомкнутой цепи, равного –264 мВ, рассчитанная величина электрохимического эквивалента не зависит от потенциала. При приближении к коррозионному потенциалу его величина возрастает. Такое поведение электрохимического эквивалента объясняется тем, что вблизи коррозионного потенциала измеряемый ток включает как анодную, так и катодную (восстановление растворенного в растворе кислорода и ионов водорода) составляющие. Корректная величина электрохимического эквивалента (0.32 мг/Кл) может быть получена в той области потенциалов, где величина K не зависит от потенциала.
Рис. 4.
Зависимость экспериментально определенного электрохимического эквивалента стали AISI 304 от потенциала.
Прямое экспериментальное определение K, основанное на использовании результатов уменьшения массы образца и затраченного на это количества электричества, учитывает условия растворения сплава и не требует данных о механизме его растворения и о валентности компонентов сплава.
На рис. 5 приведена зависимость скорости растворения U стали AISI 304 от потенциала, рассчитанная с учетом соотношения (2) и времени поляризации образца, и отнесенная к единице его поверхности. Метод измерения омического сопротивления позволяет определять скорость коррозии в единицах массы также и в отсутствие поляризации. При потенциале коррозии скорость растворения стали оказалась равной 2.1 × 10–5 мг с–1 см–2.
Рис. 5.
Зависимость скорости растворения стали AISI 304 в 0.5 М HCl от потенциала. Пунктирная прямая соответствует положению коррозионного потенциала.

Определенная выше величина электрохимического эквивалента позволяет выразить скорость растворения стали (рис. 5) в электрических единицах, рис. 6, кривая 1.
Рис. 6.
Зависимость плотности тока анодного растворения стали AISI 304 от потенциала: 1 – получена из данных по изменению массы образца при его анодной поляризации (рис. 5), 2 – получена при учете средней величины тока в каждом шестичасовом опыте при разных потенциалах, 3 – кривая зависимости катодной составляющей тока от анодного потенциала.
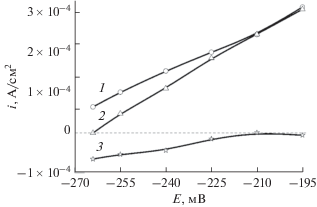
Кривые 1 и 2 совпадают при некотором удалении от коррозионного потенциала. Расхождение кривых при приближении к коррозионному потенциалу обусловлено влиянием протекающих одновременно с анодным растворением процессов катодного восстановления кислорода и ионов водорода на исследуемом образце.
Метод измерения омического сопротивления позволяет определять непосредственно скорость растворения металла, на измерение которой катодные процессы не оказывают никакого влияния. На рис. 6 представлена зависимость скорости анодного растворения металла от потенциала в электрических единицах (кривая 1). Ток поляризации (кривая 2) включает как анодную, так и катодную составляющие тока. Вычитанием кривой 1 из кривой 2 удается получить катодную составляющую тока в анодной области потенциалов. Как следует из рис. 6, катодная составляющая исчезает при удалении на 50 мВ в анодную сторону от потенциала разомкнутой цепи. В этой же области потенциалов наблюдается установившаяся величина электрохимического эквивалента (рис. 4).
ЗАКЛЮЧЕНИЕ
Методом измерения омического сопротивления образца стали AISI 304 в сочетании с потенциостатическим методом определена скорость ее анодного растворения при различных потенциалах, вплоть до коррозионного.
Изменение массы образца в процессе поляризации, определенное методом измерения омического сопротивления, и затраченное при этом количество электричества, рассчитанное интегрированием хроноамперограмм, позволили определить электрохимический эквивалент стали, без привлечения данных о степени окисления ее основных компонентов.
Рассчитана зависимость катодной компоненты измеряемого тока от анодного потенциала.
Определена область анодных потенциалов, примыкающая к потенциалу коррозии, в которой проявляется влияние катодных реакций на величину тока.
Список литературы
Analytical Methods in Corrosion Science and Engineering, Marcus, P. and Mansfeld, F., Eds Boca Raton, FL: CRC Press, Taylor & Francis Group, 2006.
Mansfeld, F., The polarization resistance technique for measuring corrosion currents, in Advances in corrosion science and technology, Fontana, G. and Staehle, R.W., Eds., N.Y.: Plenum Press, 1976, vol. 6, ch. 2, p.163.
Kelly, R.G., Scully, J.R., Shoesmith, D.W., and Buchheit, R.G., Electrochemical Techniques. In Corrosion science and engineering, N.Y.: Marcel Dekker, 2003.
Stansbury, E.E. and Buchanan, R.A., Fundamentals of the Electrochemical Corrosion, Ohio: ASM International, Materials Park, 2000. ch. 6.
McCafferty, E., Introduction to Corrosion Science, N.Y.: Springer, 2010.
Corrosion: fundamentals, testing, and protection, Cramer, S.D. and Covino, B.S., Eds., ASM International, ASM Handbook, vol. 13A, 2003.
Давыдов, А.Д., Кирияк, Е.Н., Кащеев, В.Д. Основные закономерности электрохимического растворения сплавов при высоких плотностях тока. Сплавы никеля с хромом. Электрохимия. 1978. Т. 14. С. 420. [Davydov, A.D., Kiriyak, E.N., and Kashcheev, V.D., Basic features of electrochemical alloy dissolution at high current densities. Nickel-chromium alloys, Soviet Electrochem., 1978, vol. 14, p. 352.]
Davydov, A.D. and Volgin, V.M., Electrochemical Machining, in Encyclopedia of Electrochemistry, Macdo-nald, D.D., Schmuki, P., Eds, Wiley. 2007, vol. 5, p. 809.
James, W.J., Anodic Dissolution of Metals – Anomalous Valence, in Advances in Corrosion Science and Technology, Fontana, M.G. and Staehle, R.W., Eds, N.Y.: Plenum Press, 1974, p. 85.
Dražić, D.M. and Popić, J.P., Anomalous dissolution of metals and chemical corrosion, J. Serb. Chem. Soc., 2005, vol. 70, p. 489.
Suganya, S., Jeyalakshmim, R., and Rajamane, N.P., Corrosion rate monitoring of mild steel in underground soil at different depths using electrical resistance (ER) probe technique, Orient J. Chem., 2017, vol. 3, p. 937.
Jankowski, J., Sokólski, W., and Hoffmann, A., Application of the electrical resistance technique to monitoring of cathodic protection effectiveness, Ochrona Przed Korozja, 2012, vol. 55, p. 347.
Cessna, J.C., Electrical resistance method for studying corrosion inhibitors in automotive anti-freezes, Corrosion, 1959, vol. 15, p. 67.
Azumi, K., Nakajima, M., Okamoto, K., and Seo, M., Dissolution of Ti wires in sulphuric acid and hydrochloric acid solutions, Corros Sci., 2007, vol. 49, p. 469.
Hunt, G.J., Gahagan, M.P., and Peplow, M.A., Wire resistance method for measuring the corrosion of copper by lubricating fluids, Lubr Sci., 2017, vol. 29, p. 279.
Roller, D. and Scott, W.R., Detecting and measuring corrosion using electrical resistance techniques, Corrosion Technology, 1961, vol. 8, p. 71.
Corrosion Tests and Standards: Application and Interpretation, 2nd edn., Baboian, R., Ed., Baltimore, MD: ASTM International, 2005, p. 25.
Дополнительные материалы отсутствуют.