Электрохимия, 2020, T. 56, № 3, стр. 273-281
ОПТИМИЗАЦИЯ ПАРАМЕТРОВ СИНТЕЗА КАТАЛИЗАТОРА Co–Pi/α-Fe2O3 С ИСПОЛЬЗОВАНИЕМ МЕТОДА ТАГУЧИ ДЛЯ РАЗЛОЖЕНИЯ ВОДЫ
Масуд Тогрей a, *, Хоссейн Сиадати a
a Отдел материаловедения и инженерии, Технологический университет им. К.Н. Тооси
Тегеран, № 7,улица Молла-Садра, площадь Ванак, Иран
* E-mail: siadati@kntu.ac.ir
Поступила в редакцию 30.11.2018
После доработки 04.04.2019
Принята к публикации 14.06.2019
Аннотация
Использование гематита в качестве фотоанода было ограничено из-за его оптоэлектронных свойств и большого перенапряжения для фоторазложения воды. В этом исследовании слой фосфата кобальта (Co–Pi) был нанесен на гематитовые фотоаноды (α-Fe2O3), чтобы увеличить время жизни фотогенерированных дырок и снизить приложенное смещение. Влияние толщины катализатора Co–Pi, pH осаждения и скорости сканирования фотоэлектрохимических (PEC) измерений было оптимизировано с использованием статистического метода Тагучи. Ортогональная решетка L9 с тремя факторами контроля на трех уровнях использовалась для определения оптимальных условий для разложения воды в случае нейтральной воды с минимальным приложенным смещением. После нанесения слоя Co–Pi на α-Fe2O3 в различных условиях PEC измеряли с помощью линейной развертки, вольтамперометрии (LSV) и хроноамперометрии. Анализ дисперсии среднего перенапряжения по сравнению с чистым гематитом и отношением сигнал/шум показал большое влияние толщины катализатора на уменьшение перенапряжения для фоторазложения воды по сравнению с чистым α‑Fe2O3. Характеристика катализатора и морфология α-Fe2O3 были выполнены с помощью SEM, XRD и EDS. Оптимизированный фотоанод показал увеличение примерно в два раза для фототока и в 1.5 раза эффективность преобразования падающего фотона в ток (IPCE) по сравнению с чистым α-Fe2O3. Эти результаты приводят к пониманию роли катализатора Co–Pi в улучшении гематитового фотоанода.
ВВЕДЕНИЕ
Фотоэлектрохимическое (PEC) разложение воды – использование солнечного света для расщепления молекул воды на составляющие водород и кислород газы – остается одной из новаторских технологий получения чистого и возобновляемого водорода [1]. Ячейка PEC объединяет функции солнечного элемента и электролизера в одном устройстве [2]. Со времени первого сообщения об использовании полупроводника в ультрафиолетовом свете [3] существенные исследования были направлены на синтетическое электрокаталитическое окисление воды, работающее при низком перенапряжении [4]. Тем не менее, большинство из этих исследований включают дорогие металлы или тяжелые условия рН. В качестве недорогого полупроводника, гематит (α‑Fe2O3) появился в качестве перспективного фотоэлектродного материала благодаря значительному поглощению света, химической стабильности в водных средах и достаточному содержанию [5, 6]. Он также имеет ширину запрещенной зоны 2.1 эВ, что позволяет ему поглощать значительную видимую часть солнечного спектра. Кроме того, он имеет положение валентной зоны с достаточным перенапряжением для окисления воды до O2 [7–11]. Поэтому гематит (α-Fe2O3) продолжает привлекать внимание в качестве модельного фотоанода для окисления воды PEC [6]. Фотоанод α-Fe2O3 придает низкую скорость реакции выделения кислорода (OER) во время фотоэлектрохимического разложения воды. В результате на поверхности электрода накапливаются фотогенерированные отверстия, и значительная рекомбинация заряда происходит до переноса заряда через поверхность раздела α-Fe2O3/электролит. Следовательно, большое перенапряжение должно быть применено для достижения значительных фототоков расщепления воды [11]. Тем не менее, эффективность α-Fe2O3 в качестве водоокисляющего фотоанода была критически ограничена из-за его плохих оптоэлектронных свойств, которые приводят как к низкой эффективности сбора света, так и к значительному перенапряжению для фотоокисления воды [12]. Несмотря на этот интерес, из-за плохой подвижности заряда (от 10–2 до 10–1 см2 с–1 В–1), короткой диффузионной длины (2–20 нм) и кинетики медленного переноса заряда (от 10–3 до 1 с) α-Fe2O3 солнечно-водородная эффективность падает из-за электронно-дырочной рекомбинации [6]. Несколько исследований показали, что это требование к электрохимическому смещению может быть уменьшено при использовании таких катализаторов, как кобальт-фосфат (Co–Pi) [4, 13]. До настоящего времени мало исследований было посвящено улучшению интерфейса Co–Pi/α-Fe2O3 [4, 8, 14]. Однако основным недостатком освещения на передней стороне являются потери на поглощение при увеличении толщины Co–Pi [6, 15]. Измерения переходного поглощения композитных фотоанодов Co–Pi/α-Fe2O3 показали наличие фотогенерированных дырок с увеличенным временем жизни, по-видимому, внутри самого α-Fe2O3, что позволяет предположить, что Co–Pi не участвует непосредственно в катализе окисления воды, вместо этого он играет косвенную роль, вызывая дополнительный изгиб зоны α-Fe2O3, который уменьшает рекомбинацию электронов и дырок [6, 13, 14].
Целью данного исследования является выявление оптимальной конструкции путем объединения критических факторов, определяющих поведение PEC фотоанодов Co–Pi/α-Fe2O3. Статистически управляемые эксперименты с использованием метода Тагучи использовались как способ оптимизации наилучшего состояния из переменных факторов, влияющих на поведение PEC этих фотоанодов. Поэтому дисперсионный анализ (ANOVA) и отношение сигнал/шум (отношение S/N) [16] использовались для исследования влияния факторов для определения оптимальных условий слоев Co–Pi, которые электроосаждали нанокристаллический α-Fe2O3 для разложения воды в случае нейтральной воды с минимальным перенапряжением.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Тонкие пленки α-Fe2O3
Подложку из проводящего легированного фтором оксида олова (FTO) (8 Ом Solaronix, Швейцария) очищали ультразвуковым методом в ацетоновой бане в течение 10 мин. Затем пленку оксида железа выращивали на подложке FTO с типичной трехэлектродной конфигурацией в электролите, состоящем из водного раствора 10 мМ FeCl3, 10 мМ KF, 0.1 М KCl и 1 М H2O2 (30%). В качестве рабочего электрода использовали FTO, а в качестве противоэлектрода и электрода сравнения использовали проволоку Pt и Ag/AgCl соответственно. Анодное осаждение проводили с помощью циклической вольтамперометрии (потенциостат/гальваностат EG & G Model 273A, 50 циклов со скоростью сканирования 0.1 В/с) от –0.47 до 0.93 В [относительно Ag/AgCl]). Эта процедура была аналогична той, которой следовали Schrebler и др. [17]. Электроосаждение проводили при 50°С. После осаждения все образцы были тщательно промыты деионизованной водой и высушены небольшим потоком газообразного азота. Тонкие пленки оксида железа отжигали в течение 20 мин при 550°С в печи в атмосферных условиях.
Электроосаждение слоев Co–Pi
Ортогональная матрица Тагучи L9 была принята трехуровневой и трехфакторной комбинацией L9, чтобы найти оптимальные факторы, способствующие PEC-поведению слоев Co–Pi, электроосажденных на подложке α-Fe2O3. Эти факторы и их уровни показаны в табл. 1. В качестве рабочего электрода электрод α-Fe2O3 погружали в водный раствор, содержащий 0.5 мМ Co(NO3)2 и 0.1 M NaH2PO4. Чтобы избежать локальных флуктуаций рН в этом растворе, которые могли бы повлиять на потенциал плоской полосы, в раствор был добавлен буфер рН [11]. Одним из вариантов был хорошо известный фосфатный буфер, содержащий 0.1 М KH2PO4 и 0.1 М Na2HPO4. Эти два химических вещества были смешаны в разных количествах, чтобы получить желаемый уровень pH для электроосаждения и обеспечить успешное измерение PEC при нейтральном pH [11, 18]. Насыщенный Ag/AgCl и Pt-проволоку использовали в качестве электрода сравнения и противоэлектрода соответственно. Электроосаждение слоев Co–Pi проводили потенциостатически при 1.1 В (относительно Ag/AgCl) для условий, описанных в табл. 2. Электрохимические измерения и последующее электроосаждение проводили с использованием потенциостата/гальваностата EG & G Model 273A. После процесса осаждения каждый слой Co–Pi тщательно промывали и помещали в емкость с дистиллированной водой.
Таблица 1.
Факторы и уровни для электроосаждения и измерения PEC фотоанодов Co–Pi/α-Fe2O3
| Обозначение | Факторы | Уровень 1 | Уровень 2 | Уровень 3 |
|---|---|---|---|---|
| A | Время электроосаждения | 10 | 20 | 40 |
| B | pH электроосаждения | 6 | 7 | 8 |
| C | Скорость сканирования PEC | 10 | 30 | 50 |
Таблица 2.
Экспериментально измеренные значения перенапряжения по сравнению с начальным потенциалом фотоанода α-Fe2O3 и отношением сигнал/шум (ортогональная матрица L9)
| Номер | Контрольные переменные | A | B | C | Перенапряжение по отношению к гематиту, В | S/N | ||
|---|---|---|---|---|---|---|---|---|
| Среднее значение образцов 1 и 2 | ||||||||
| TL1 | 10 | 6 | 10 | 1 | 1 | 1 | 0.231 | –20.9151 |
| TL2 | 10 | 7 | 30 | 1 | 2 | 2 | 0.211 | –23.098 |
| TL3 | 10 | 8 | 50 | 1 | 3 | 3 | 0.161 | –33.9794 |
| TL4 | 20 | 6 | 30 | 2 | 1 | 2 | 0.241 | –20.0000 |
| TL5 | 20 | 7 | 10 | 2 | 2 | 1 | 0.231 | –20.9151 |
| TL6 | 20 | 8 | 50 | 2 | 3 | 3 | 0.361 | –13.1515 |
| TL7 | 40 | 6 | 50 | 3 | 1 | 3 | 0.211 | –23.098 |
| TL8 | 40 | 7 | 10 | 3 | 2 | 1 | 0.221 | –21.9382 |
| TL9 | 40 | 8 | 30 | 3 | 3 | 2 | 0.171 | –30.4576 |
| Соотношение сигнал/шум: чем больше, тем лучше. | ||||||||
Согласно предыдущим исследованиям [4, 6, 13, 19–21] толщина катализатора, рН осаждения и скорость сканирования измерений PEC оказали большее влияние на поведение PEC по сравнению с голыми гематитовыми фотоанодами. Потенциал начала работы фотоанодов α-Fe2O3, Co–Pi/α-Fe2O3 посредством вольтамперометрии с линейной разверткой потенциала (LSV) использовали для исследования результатов эксперимента. Каждый эксперимент повторяли дважды, чтобы получить достоверные данные. Для анализа отношения S/N была выбрана соответствующая функция отношения S/N на предпосылке “чем больше, тем лучше”. Отношение сигнал/шум является логарифмической функцией, используемой для оптимизации дизайна изделия, минимизируя изменчивость [16]. Чтобы свести к минимуму изменчивость, необходимо выбрать уровень факторов, который дает наибольшее значение отношения сигнал/шум. Чтобы получить наибольший экспериментальный способствующий фактор и относительные оптимизированные условия, полученные отношения сигнал/шум были интегрированы и обсуждены с использованием ANOVA с программным обеспечением для статистического анализа MinitabTM. Результаты эксперимента приведены в табл. 2.
Исследование
PEC выполняли при моделируемом освещении AM 1.5G (100 мВт/см2), обеспечиваемом солнечным имитатором (300 Вт Xe с оптическим фильтром) в 0.1 М NaCl, забуференном 0.1 М раствором KPi (pH 8). Характеристики фототока в зависимости от напряжения (I–V) регистрировали путем сканирования потенциала от –0.8 до 1.3 В (относительно Ag/AgCl) с заданными скоростями сканирования в табл. 2, используя потенциостат/гальваностат EG & G Model 270A, имеющий трехэлектродную конфигурацию с фотоанодом Co–Pi в качестве рабочего электрода, Ag/AgCl в качестве электрода сравнения и платиновой проволокой в качестве противоэлектрода. Для крепления верхней части FTO использовали зажим из нержавеющей стали, а нижнюю часть погружали в электролит. Все образцы освещали с лицевой стороны (со стороны катализатора) фотоанода при комнатной температуре в воздушной атмосфере. Потенциалы, измеренные по отношению к Ag/AgCl, преобразовывали по отношению к водородному электроду сравнения (RHE) по следующему уравнению:
(1)
${{E}_{{{\text{RHE}}}}} = {{E}_{{{{{\text{Ag}}} \mathord{\left/ {\vphantom {{{\text{Ag}}} {{\text{AgCl}}}}} \right. \kern-0em} {{\text{AgCl}}}}}}} + 0.059{\text{pH}} + E_{{{{{\text{Ag}}} \mathord{\left/ {\vphantom {{{\text{Ag}}} {{\text{AgCl}}}}} \right. \kern-0em} {{\text{AgCl}}}}}}^{0}.$Чтобы получить чистоту и кристалличность α-Fe2O3, после процесса отжига рентгеновские дифракционные (XRD) спектры были получены с использованием дифрактометра PANalytical-X’Pert PRO MPD (CuKα = 1.5418 Å). Изображения FE-SEM получали, используя сканирующий электронный микроскоп с полевой эмиссией HITACHI S-4160, работающий при 30 кВ. Все пленки покрывали золотом, используя термический испаритель перед формированием изображения, чтобы уменьшить проблемы с зарядкой. Химический анализ образцов осуществляли с помощью энергодисперсионной рентгеновской спектроскопии (ЭДС).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Подход Тагучи к планированию эксперимента
План эксперимента Тагучи был использован для анализа влияния параметров на поведение PEC фотоанодов Co–Pi/α-Fe2O3. Результаты измерений двух образцов были использованы для проверки повторяемости экспериментов. Поскольку целью эксперимента было уменьшить потенциал появления фототока, анализ “чем больше, тем лучше” был использован для получения более высокого перенапряжения по сравнению с гематитом. Чтобы получить оптимальные измерения PEC, использовали максимальный соответствующий уровень отношения сигнал/шум для каждого фактора.
Рисунок 1а – график основных воздействий для средних значений и рисунок 1б – график основных воздействий для соотношений сигнал/шум показывают, что оптимальной комбинацией уровней для каждого фактора был фактор A3 (время электроосаждения: 40 мин), B1 (рН электроосаждения: 6) и C2 (скорость сканирования PEC: 50 мВ/с), т.е. седьмой прогон предыдущего эксперимента. Основной целью ANOVA является использование статистического метода для понимания уровней влияния параметров поведения PEC катализатора Co–Pi. Среднеквадратичное значение (MS) определяется как MS = SS/df, где SS и df – сумма квадратов и степень свободы соответственно. Что касается статистического тестового коэффициента, отношение F представляет собой распределение степени свободы v1 = 2 и v2 = 2 (каждая строка, состоящая из трех уровней, где степень свободы для каждого ряда составляла 2, а общая степень свободы для L9 составляла 8). Когда значимый уровень α составлял 0.05, указанный уровень вероятности F в таблице F0.05 (2, 6) составлял 5.314. Значения F трех параметров для факторов A, B и C составили 6.15, 0.92 и 0.01 соответственно. Это показало, что фактор времени оказал значительное влияние на поведение PEC. Поэтому для оптимизации прогнозируемых значений отношения S/N при измерениях PEC с комбинацией уровней A3B1C3 были учтены только влияющие значимые факторы. Среднее отношение сигнал/шум для 95% доверительного интервала для измерений PEC составило 4.99 ± 0.65 [16]. Поскольку среднее значение эксперимента по проверке составило 5.314, что находится в пределах доверительного интервала, это указывает на то, что факторы A, B и C должным образом соответствуют соответствующим уровням.
Исследование структуры
Рентгенограммы пленок чистого гематита, выращенных на подложке FTO, показанные на рис. 2, подтверждают присутствие фазы α-Fe2O3, которая была получена после отжига осажденных пленок оксида железа при 550°C в течение 20 мин. Это полностью согласуется с идеей, что при синтезе циклической вольтамперометрии получают оксигидроксидное соединение Fe(III), аморфное или нанокристаллическое, которое превращается в α-Fe2O3 [17].
На графике приведены зарегистрированные пики субстрата и пики α-Fe2O3. Все осажденные гематитовые пленки имели поликристаллическую природу с основным пиком при 10.54 град. Определение размера кристаллического гематита с использованием уравнения Шеррера (с полной шириной на половине максимума) показывает размер около 18 нм, что согласуется с другими сообщениями [22, 23].
На рис. 3 показан EDS-анализ Co–Pi/α-Fe2O3. На этом графике можно найти возрастающие пики при 2.05 и 7.1 кэВ, что соответствует соединениям кобальта и фосфора соответственно [24]. Соотношение кобальта и фосфора (Co/P) составляет 1 : 6.5. Как и при фотоосаждении электроосаждения катализатора, рост Co и P не просто основан на специальной молекулярной формуле, а больше похож на аморфную структуру, в которой, как ожидается, содержится более одного атома фосфата в каждом атоме кобальта [20]. Стоит отметить, что присутствие фосфата на границе раздела электролитов, способствующее выделению кислорода, необходимо, но точная величина этого не очень важна [25–27]. Важно отметить, что точное отношение Co/P не является необходимым для демонстрации каталитической активности, хотя добавление большего количества фосфата способствует переносу протонно-связанного электрона для выделения O2 [20, 28].
Методом FE-SEM исследовали морфологию покрытия α-Fe2O3, сформированного на подложке FTO после отжига. На рис. 4 показано, что пленка гематита полностью покрывала FTO при двух разных увеличениях. Очевидно, что пленка α-Fe2O3 содержит крошечные взаимосвязанные сферы с диаметром около 250 нм по всей поверхности. Этот диаметр больше размера, определенного уравнением Шеррера, но достаточно близок для разрешения FE-SEM. Эти результаты предполагают, что шаровидные сферы состоят из более мелких кристаллов, которые образовали пористую структуру после агломерации. Эта морфология подтверждает предшествующее анодное осаждение структур гематита, которые были отожжены при температуре 550–650°C [29, 30].
Рисунок 5 показывает осаждение фотоэлектродов Co–Pi/α-Fe2O3, которые были электроосаждены в наилучших условиях, полученных с помощью анализа Тагучи. Результаты еще более укрепили предыдущие работы [4, 6, 8], в которых было установлено, что правильные условия электроосаждения могут привести к осаждению тонких пленок Co–Pi на фотоанодах α-Fe2O3. Было обнаружено, что пленки являются компактными и имеют хорошую адгезию к гематитовой подложке с размером частиц в диапазоне 90–100 нм. Слегка размытые изображения позволяют предположить, что изолирующее воздействие катализаторов на поверхности и, следовательно, более восприимчиво к эффектам зарядки от электронного пучка [8]. Как было предложено ранее, адсорбция Co2+ привела бы только к покрытию нанослоем, что подразумевало бы также близость к одному монослою кластера Co–Pi [9]. Как и ожидалось, оптимальное время для электроосаждения привело к полному покрытию гематита катализатором, что было доказано EDS (рис. 3), в отличие от других работ, в которых было обнаружено, что на гематите образуются просто некоторые пятна катализатора [6, 8]. Что еще более важно, слой катализатора Co–Pi не растрескивался, хотя это довольно распространено при сушке [4, 21, 24].
Сферические конкреции, агрегированные во время электроосаждения и слитые в более крупные агрегаты, сходны по морфологическим характеристикам с таковыми у катализатора Co–Pi, электроосажденного на подложках FTO и ITO [21, 27]. Узелки показывают тонкую микроструктуру, но долины кажутся плоскими, подтверждая гипотезу [6], что Co–Pi откладывается преимущественно в долинах. Эти результаты означают, что при использовании освещения на передней стороне узелки с большой площадью поверхности могут участвовать в других местах, кроме долин, и демонстрируют продолжающийся переход к более отрицательным значениям начального потенциала (рис. 6).
Фотоэлектрохимические измерения
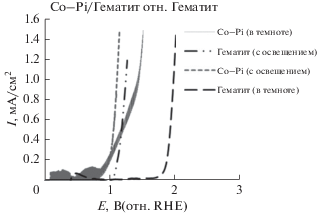
На рис. 6 показаны кривые IV фотоанодов Co‒Pi/α-Fe2O3 и α-Fe2O3, измеренные при скорости сканирования 50 мВ/с в темноте и при освещении с лицевой стороны в электролите 0.1 М NaOH (рН 8). Как сообщалось ранее, α-Fe2O3, осажденный на Co–Pi, уменьшил напряжение смещения, необходимое для окисления воды солнечной PEC [4, 6, 31]. При 1.23 В (RHE) фототок оптимального фотоанода Co–Pi/α-Fe2O3 составляет 2.6 мА/см2 вблизи фототоков в основном растворе (pH 13.6). Следует отметить, что толстый слой Co–Pi может препятствовать быстрому заряду или переносу протона из электролита через катализатор, тем самым ограничивая протекание тока и позволяя другим непродуктивным путям рекомбинации стать конкурентоспособными [4]. Как видно на рис. 6, темновой фототок непрерывно возрастает при потенциалах, превышающих 1.7 В (RHE), что указывает на окисление воды на поверхности α‑Fe2O3. Это связано с увеличением концентрации свободных дырок в валентной зоне, когда уровень Ферми понижается (более положительный потенциал) и начинает приближаться к валентной зоне в области вблизи поверхности [11], как и ожидалось для n фотоанода. При освещении фототок можно было наблюдать при потенциалах выше 1.035 В (RHE), что больше, чем заявленный потенциал плоской полосы α-Fe2O3, который необходим для инициирования реакции расщепления воды, направляя фотогенерированные отверстия на поверхность для реакции [5, 12, 32]. Как и результаты, полученные при рН 8 и 13.6 [4, 31], катализатор Co–Pi дает катодное смещение >150 мВ в потенциале начала фототока относительно α-Fe2O3, что дополнительно подтверждается увеличением IPCE, показанным на рис. 8. α-Fe2O3, осажденный на фотоаноде Co‒Pi, приводит к фототокам, приближающимся к 1.75 мА/см2 при 1.23 В относительно RHE. Аналогичные результаты были описаны ранее для электроосаждения Co–Pi на фотоанодах α‑Fe2O3 [4, 6].
Рис. 7.
Текущие временные диаграммы для α-Fe2O3 и Co–Pi/α-Fe2O3 (оптимизированный с помощью Taguchi) при 1.23 В относительно RHE в электролите 0.1 М NaCl.
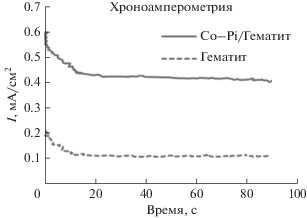
Рис. 8.
Диаграммы IPCE для α-Fe2O3 и Co–Pi/α-Fe2O3 (оптимизированы с помощью Тагучи) при 1.23 В относительно RHE в электролите 0.1 М NaCl.

Усиление фототока может быть результатом окисления воды (E0 = 1.23 В относительно RHE при pH 8) с катализатором Co–Pi или окислением Co(II) до Co(III) (E0 = 0.82 В относительно Ag/AgCl). Очевидно, что увеличение тока связано с разложением воды, а не с окислением Со в отношении более положительного потенциала, необходимого для более поздней реакции [33]. Поэтому катализатор Co–Pi требует перенапряжения ~0.2 В для окисления воды. Для освещенного Co–Pi/α-Fe2O3 фототок быстро возрастает с увеличением потенциала. Как указано, добавление катализатора Co–Pi к α-Fe2O3 оказывает существенное влияние на фотоэлектрохимическое поведение этого фотоанода. В электроде Co–Pi/α-Fe2O3 необходимое перенапряжение значительно уменьшилось, а начало фототока сместилось примерно на 150 мВ. Полученный фототок с оптимальной толщиной катализатора Co–Pi в нейтральном растворе (pH 8) был четко признан соответствующей толщиной Co–Pi на α-Fe2O3 для увеличения вероятности рекомбинации электронов и дырок [20]. Фототок фотоанодов Co–Pi/α-Fe2O3 при 1.23 В (RHE) увеличился в два раза по сравнению с чистым α‑Fe2O3, что объясняется оптимальным временем осаждения слоя Co–Pi.
Кривые зависимости тока от времени при 1.23 В относительно RHE для α-Fe2O3 и Co–Pi/α-Fe2O3 показаны на рис. 7. После воздействия света фототок α-Fe2O3 достигает максимума (0.23 мА/см2), эта тенденция быстро уменьшается после пикового тока, и ток остается постоянным. Как описано ранее, фотоанод Co–Pi/α-Fe2O3 демонстрирует большой начальный пик в течение первой секунды облучения при низких потенциалах, что связано с окислением катализатора, необходимого для разложения воды [21, 25]. Наблюдаемый ток после активации может быть обусловлен рекомбинацией фотогенерированных носителей заряда и указывает на миграцию дырок к границе раздела полупроводник/электролит при освещении анода [21]. После увеличения времени освещения происходил распад фототока, что указывало на то, что дырки достигают поверхности полупроводника и рекомбинируют с электронами из зоны проводимости, а не захватывают электроны из электролита [34]. Очевидно, что при постоянном потенциале начальные токи неизолированного гематитового анодного электрода и модифицированного Co–Pi электрода подобны при постоянном потенциале, тогда как их конечные токи различаются, и распад модифицированного Co–Pi электрода значительно ниже. Эти различия в фотораспаде также указывают на эффективность Co–Pi для уменьшения рекомбинации электрон-дырочных пар [26]. Эти результаты согласуются с данными вольтамперометрии с линейной разверткой потенциала и подтверждают переходное состояние полученных фототоков. Возможное объяснение роли слоя Co–Pi для затруднения рекомбинации электронных дырок может быть связано с истощением электронов в зоне проводимости Fe2O3, что приводит к увеличению изгиба зон в α-Fe2O3, что приводит к разделению электронов дырки в пленке α-Fe2O3 и уменьшению плотности электронов в окрестности границы раздела Co–Pi/α-Fe2O3 [13].
IPCE как функция длины волны для α-Fe2O3 и Co–Pi/α-Fe2O3 представлена на рис. 8. Как показано, фотоанод α-Fe2O3 имеет максимальный IPCE около 13% при 460 нм и 1.23 В относительно RHE в 0.1 М NaCl. Как и подсветка на задней стороне, IPCE уменьшается при еще более коротких длинах волн, что отражает объемные рекомбинационные потери фотогенерированных носителей заряда, созданных вблизи границы раздела α‑Fe2O3/FTO [6]. Это может быть связано с уменьшением глубины проникновения света на длине волны менее 400 нм [31]. Такое поведение между 400 и 600 нм согласуется с шириной запрещенной зоны гематита (2.1 эВ) [34]. Для фотоанода Co–Pi/α-Fe2O3 IPCE на всех длинах волн увеличивается до 18% при длине волны 460 нм. На всех длинах волн значения IPCE для Co–Pi/α-Fe2O3 примерно в 1.5 раза выше, чем для чистого α-Fe2O3, что соответствует падению IPCE для толстого катализатора Co–Pi, а значения IPCE больше чем 7% для 25 нм катализатора, обсуждаемого Carroll и др. [6]. Следует учитывать, что большая площадь поверхности наноструктур α-Fe2O3 позволяет собирать дырки даже после возбуждения такого локализованного перехода. Это также подчеркивает роль Co–Pi в облегчении продуктивного использования этих отверстий для окисления воды [8].
ВЫВОДЫ
Осаждение тонких пленок Co–Pi на гематитовый фотоанод (α-Fe2O3) было сделано для увеличения времени жизни фотогенерированных дырок и уменьшения приложенного смещения. Влияние толщины Co–Pi, pH осаждения и скорости сканирования измерений PEC было оптимизировано с использованием статистического метода Тагучи. Анализ дисперсии среднего перенапряжения по сравнению с чистым гематитом и отношением сигнал/шум показал большое влияние толщины катализатора на уменьшение приложенного смещения для разложения воды с фотоусилением. Лучший фотоанод со слоем Co–Pi показал увеличение примерно в два раза для фототока и увеличение IPCE по сравнению с чистым α-Fe2O3. Эти результаты приводят к заключению, что катализатор Co–Pi увеличивает время жизни фотогенерированных дырок в гематите и препятствует рекомбинации электронов и дырок, что вызывает увеличение фототока по меньшей мере в два раза по сравнению с гематитными фотоэлектродами. Поэтому полученный фотокатализатор считается отличным кандидатом для применений солнечного расщепления воды, но усилия по расширению этой стратегии для нейтральной воды с более низким смещением могут иметь большое значение для будущих экспериментов.
Список литературы
Vayssieres, L., On solar hydrogen and nanotechnology: John Wiley & Sons, 2010.
Kim, J.Y., et al., Single-crystalline, wormlike hematite photoanodes for efficient solar water splitting, Scientific reports, 2013, vol. 3, p. 2681.
Fujishima, A., Electrochemical photolysis of water at a semiconductor electrode, Nature, 1972, vol. 238, p. 37.
Zhong, D.K. and Gamelin, D.R., Photoelectrochemical water oxidation by cobalt catalyst (“Co–Pi”)/α-Fe2O3 composite photoanodes: Oxygen evolution and resolution of a kinetic bottleneck, J. Amer. Chem. Soc., 2010, vol. 132, p. 4202.
Sivula, K., Le Formal, F., and Grätzel, M., Solar Water Splitting: Progress Using Hematite (α-Fe2O3) Photoelectrodes, ChemSusChem, 2011, vol. 4, p. 432.
Carroll, G.M., Zhong, D.K., and Gamelin, D.R., Mechanistic insights into solar water oxidation by cobalt-phosphate-modified α-Fe2O3 photoanodes, Energy & Environmental Sci., 2015, vol. 8, 577 p.
Shinar, R. and Kennedy, J.H., Photoactivity of doped α-Fe2O3 electrodes, Solar Energy Materials, 1982, vol. 6(3), p. 323.
Zhong, D.K., et al., Photo-assisted electrodeposition of cobalt–phosphate (Co–Pi) catalyst on hematite photoanodes for solar water oxidation, Energy & Environmental Sci., 2011, vol. 4(5), p. 1759.
Kay, A., Cesar, I., and Grätzel, M., New benchmark for water photooxidation by nanostructured α-Fe2O3 films, J. Amer. Chem. Soc., 2006, vol. 128(49), p. 15714.
McDonald, K.J. and Choi, K.S., Photodeposition of co-based oxygen evolution catalysts on α-Fe2O3 photoanodes, Chem. Materials, 2011, vol. 23(7), p. 1686.
Van de Krol, R. and Grätzel M., Photoelectrochemical hydrogen production, Springer, 2011.
Hamann, T.W., Splitting water with rust: hematite photoelectrochemistry, Dalton Transactions, 2012, vol. 41(26), p. 7830.
Barroso, M., et al., The role of cobalt phosphate in enhancing the photocatalytic activity of α-Fe2O3 toward water oxidation, J. Amer. Chem. Soc., 2011, vol. 133(38), p. 14868.
Barroso, M., et al., Dynamics of photogenerated holes in surface modified α-Fe2O3 photoanodes for solar water splitting, Proceedings of the National Academy of Sciences, 2012, vol. 109(39), p. 15640.
Lin, F. and Boettcher,S.W., Adaptive semiconductor/electrocatalyst junctions in water-splitting photoanodes, Nature Materials, 2014, vol. 13(1), p. 81.
Roy, R.K., A Primer on the Taguchi Method: Society of Manufacturing Engineers,1990.
Schrebler, R., et al., An electrochemical deposition route for obtaining α-Fe2O3 thin films, Electrochemical and solid-state letters, 2006, vol. 9(7), p. C110.
Hamann, C.H, Hamnett, A., and Vielstich, W., Electrochemistry, John Wiley & Sons, 1998.
Gerken, J.B., et al., Electrochemical Water Oxidation with Cobalt-Based Electrocatalysts from pH 0–14: The Thermodynamic Basis for Catalyst Structure, Stability, and Activity., J. Amer. Chem. Soc., 2011, vol. 133(36), p. 14431.
Shi, X., Zhang, K., and Park, J.H., Understanding the positive effects of (Co–Pi) co-catalyst modification in inverse-opal structured α-Fe2O3-based photoelectrochemical cells, International J. Hydrogen Energy, 2013, vol. 38(29), p. 12725.
Kanan, M.W., Surendranath, Y., and Nocera, D.G., Cobalt–phosphate oxygen-evolving compound, Chem. Soc. Rev., 2009, vol. 38(1), p. 109.
Enache, C., Liang, Y., and Van de Krol, R., Characterization of structured α-Fe2O3 photoanodes prepared via electrodeposition and thermal oxidation of iron, Thin Solid Films, 2011, vol. 520(3), p. 1034.
Bak, A., Choi, W., and Park, H., Enhancing the photoelectrochemical performance of hematite (α-Fe2O3) electrodes by cadmium incorporation, Appl.Catal. B: Environmental, 2011, vol. 110, p. 207.
Kanan, M.W. and Nocera, D.G., In situ formation of an oxygen-evolving catalyst in neutral water containing phosphate and Co2+, Science, 2008, vol. 321(5892), p. 1072.
Surendranath, Y., Kanan, M.W., and Nocera, D.G., Mechanistic studies of the oxygen evolution reaction by a cobalt-phosphate catalyst at neutral pH, J. Amer. Chem. Soc., 2010, vol. 132(46), p. 16501.
Lutterman, D.A., Surendranath, Y., and Nocera, D.G., A self-healing oxygen-evolving catalyst, J. Amer. Chem. Soc., 2009, vol. 131(11), p. 3838.
Surendranath, Y., Dinca, M., and Nocera, D.G., Electrolyte-dependent electrosynthesis and activity of cobalt-based water oxidation catalysts, J. Amer. Chem. Soc., 2009, vol. 131(7), p. 2615.
Steinmiller, E.M. and Choi, K.-S., Photochemical deposition of cobalt-based oxygen evolving catalyst on a semiconductor photoanode for solar oxygen production, Proc. National Acad. Sci., 2009, vol. 106(49), p. 20633.
Wang, L., Lee, C.-Y., and Schmuki, P., Influence of annealing temperature on photoelectrochemical разложение воды of α-Fe2O3 films prepared by anodic deposition, Electrochim. Acta, 2013, vol. 91, p. 307.
Spray, R.L. and Choi, K.-S., Photoactivity of transparent nanocrystalline α-Fe2O3 electrodes prepared via anodic electrodeposition, Chem. Materials, 2009, vol. 21(15), p. 3701.
Zhong, D.K., et al., Solar water oxidation by composite catalyst/α-Fe2O3 photoanodes, J. Amer. Chem. Soc., 2009, vol. 131(17), p. 6086.
Tilley, S.D., et al., Light-Induced Water Splitting with Hematite: Improved Nanostructure and Iridium Oxide Catalysis, Angewandte Chemie, 2010, vol. 122(36), p. 6549.
Smith, R.D., et al., Photochemical route for accessing amorphous metal oxide materials for water oxidation catalysis, Science, 2013, vol. 340(6128), p. 60.
Bak, T., et al., Photo-electrochemical hydrogen generation from water using solar energy, Materials-related aspects, Internat. J. Hydrogen Energy, 2002, vol. 27(10), p. 991.
Дополнительные материалы отсутствуют.