Электрохимия, 2020, T. 56, № 3, стр. 229-237
ИССЛЕДОВАНИЕ ПРОЦЕССА ЭЛЕКТРООСАЖДЕНИЯ ТОНКИХ ПЛЕНОК РУТЕНИЯ ИЗ ХЛОРИДНЫХ РАСТВОРОВ В ГАЛЬВАНОСТАТИЧЕСКИХ УСЛОВИЯХ
Д. Кутила a, *, К. Кольчук a, П. Жабински a, Р. Ковалик a, А. Квиечинска a, К. Скибинска a
a Научно-технологический Университет – Горно-металлургическая Академия
Краков, Польша
* E-mail: kutyla@agh.edu.pl
Поступила в редакцию 27.12.2018
После доработки 12.04.2019
Принята к публикации 05.07.2019
Аннотация
Рутениевое покрытие получено гальваностатическим осаждением на медную подложку. Количество осажденного металла возрастает с ростом тока осаждения. С помощью рентгенофазового анализа идентифицирован фазовый состав; показано, что изменение плотности тока может значительно изменить ориентацию зерен в осадке. Влияние условий осаждения на электрокаталитическое поведение рутениевых пленок изучено на примере реакции выделения водорода из 1 M раствора NaOH. Наивысшая каталитическая активность получена для образца, осажденного при –60 мA/cм2, что может быть связано с хорошей кристаллической структурой и хорошо развитой электроактивной поверхностью.
ВВЕДЕНИЕ
Рутений входит в группу платиновых металлов. Все металлы этой группы известны как хорошие катализаторы химических и электрохимических реакций и обладают прекрасной коррозионной стойкостью, что делает их очень важными материалами для многих промышленных технологий [1]. По сравнению с другими металлами платиновой группы, рутений относительно недорог. Этот элемент вызывает всё больший интерес, как более дешевый заменитель других металлов платиновой группы, потенциально имеющий много применений. В настоящее время металлический рутений и его неорганические соединения и сплавы изучаются, как материал для различных новых технологических целей, таких как суперконденсаторы [2], промышленный катализ [3–5], электронные устройства, и как подслой при электроосаждении [6–8]. Рутениевые покрытия можно приготовить различными способами, в зависимости от желаемых свойств. Самые обычные и лучше всего проработанные методы изготовления тонких пленок – это газотранспортная реакция (chemical vapor deposition, CVD) [9] и осаждение из паров органических соединений металлов (MOCVD) [10]. Другие методы – это химическое осаждение из растворов [11, 12] или электрохимическое осаждение из ионных жидкостей [13, 14] или водных растворов [15–17].
В работе [15] был описан электролит для такого осаждения на основе комплекса хлористого нитрозила рутения(IV). В общем и целом, получаются блестящие покрытия, не имеющие трещин, но повышение pH электролита для увеличения эффективности электроосаждения интенсифицирует выделение водорода. Предлагалось модифицировать электролит, используя различные агенты в качестве добавок. В работе [16] описано электроосаждение рутения на титановой подложке из кислого электролита при повышенной температуре; с ростом приложенного напряжения регулярность распределения рутения в осадке нарушалась. Оптимальная величина напряжения была определена как 2.0 В. В работе [18] проследили стабильность комплекса аквапентахлоррутената(III) с помощью метода спектроскопии в УФ- и видимой областях. Рутений осаждали на Si-подложках. Из-за выделения водорода процесс роста зародышей Ru ингибирован одновременным восстановлением и образованием пузырьков водорода. В статье [19] описано электроосаждение рутения методом динамического шаблона. Приложенный катодный потенциал лежал в пределах от –4 до –5 (Ag/AgCl). Полученные покрытия были дендритообразными (фактор шероховатости свыше 400) и имели удельную площадь до 18.8 м2/г, что может быть использовано в производстве суперконденсаторов.
Основная цель настоящей работы – это оптимизация процесса гальваностатического осаждения компактных и гладких рутениевых покрытий на медной подложке из кислых растворов комплексов рутения и исследование их структуры, морфологии и каталитических свойств.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Ванну для осаждения приготовили, растворяя нужное количество соли в соляной кислоте. Все реактивы смешивали, нагревали до 70°C и перемешивали. Через 5 ч полученный раствор смешивали с 1.5 M/дм3 раствором NaCl для того, чтобы получить концентрацию Ru3+, равную 10 мM/дм3. Значение pH устанавливали, добавляя NaOH. Полная концентрация хлорид-ионов в растворе была постоянной: 3 M/дм3. Полученный раствор нагревали до 40°C и выдерживали при этой температуре 24 ч, давая возможность хлоридным комплексам прийти в равновесие. Циклические вольтамперограммы снимали в электрохимической ячейке с вращающимся дисковым золотым электродом (площадь поверхности 0.196 cм2) и платиновой проволочкой в качестве анода. Потенциал измеряли против насыщенного каломельного электрода (НКЭ). Растворы освобождали от кислорода, пропуская аргон перед каждым опытом. Поверхность золотого электрода полировали с помощью эмульсии Al2O3 (зерно 0.05 мкм). Все эксперименты по электроосаждению проводили в разработанной нами измерительной ячейке. Расстояние между медным электродом (площадь поверхности 2.82 cм2) и платиновым анодом (6 cм2) составляло 6 cм. Медный катод полировали химически в смеси концентрированных кислот H3PO4, HNO3, и CH3COOH (в отношении 1 : 1 : 1 по объему) при температуре 65°C в течение 45 с. Каждый эксперимент проводили со свежим раствором для того, чтобы избежать трудностей, связанных с истощением раствора по иону Ru3+ и изменением pH раствора. Все исследования вели при комнатной температуре (25°C).
В ходе электролиза на поверхности платиновой пластинки выделялся газообразный хлор, поэтому все эксперименты проводили в лабораторном вытяжном шкафу для удаления токсичных паров. Процесс электроосаждения вели в неперемешиваемом растворе в течение 3 ч для каждого образца; по его окончании покрытия промывали деионизованной водой и этанолом и сушили на воздухе. Измеряли изменение массы; свежеприготовленные образцы исследовали методом рентгенофазового анализа. Фазовую характеристику осадков выполняли на рентгеновском дифрактометре Rigaku Miniflex 600 с источником CuKλ-излучения (λ = 1.5418 Å). Микротвердость измеряли прибором Vickers HV0.01 (Zwick-ZHVµ). Морфологию образцов характеризовали методом сканирующей электронной микроскопии (SEM) на приборе Hitachi Su-50. На основе заряда, потребленного в ходе гальваностатического осаждения и измеренной массы осадка мы оценивали выход по току, используя закон Фарадея.
(1)
$\varphi = \left( {{{\Delta m} \mathord{\left/ {\vphantom {{\Delta m} m}} \right. \kern-0em} m}} \right) \times 100\% ,$(2)
$m = {{\left( {Jt{{M}_{{{\text{Ru}}}}}} \right)} \mathord{\left/ {\vphantom {{\left( {Jt{{M}_{{{\text{Ru}}}}}} \right)} {\left( {Fn} \right)}}} \right. \kern-0em} {\left( {Fn} \right)}}.$Средняя толщина покрытия находится из следующего выражения:
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На циклических вольтамперограммах (рис. 1) видно, что катодный пик тока (C1 – Ru) связан с изменением состояния окисления хлоридного комплекса рутения(III) до Ru(0). Токовый отклик этой реакции ярче проявляется при повышении скорости развертки потенциала; он является результатом процесса объемного осаждения (уравнение (4)) рутения на золотом электроде [20]:
(4)
$\begin{gathered} {{\left[ {{\text{RuC}}{{{\text{l}}}_{y}}{{{\left( {{{{\text{H}}}_{{\text{2}}}}{\text{O}}} \right)}}^{{6{\text{ }}--y}}}} \right]}^{{3{\text{ }}--y}}} + 3{\text{e}} \to {\text{R}}{{{\text{u}}}^{0}} + \\ + \,\,y{\text{C}}{{{\text{l}}}^{--}} + \left( {6{\text{ }}--y} \right){{{\text{H}}}_{{\text{2}}}}{\text{O}}. \\ \end{gathered} $Рис. 1.
Циклические вольтамперограммы, полученные на Au-подложке при различных скоростях развертки потенциала от потенциала разомкнутой цепи до –1.2 В и обратно до 0.8 В (НКЭ) в ванне для электроосаждения: 0.01 M RuCl3, 3 M [Cl–], pH 1.

С появлением на электроде фазы металлического рутения начинается реакция выделения водорода. Между корнем квадратным из скорости развертки потенциала и плотностью тока в пике C1 – Ru наблюдается линейное соотношение, что характерно для электрохимической реакции, находящейся под диффузионным контролем. На рис. 2 даны кривые гальваностатического осаждения при различных плотностях тока.
Рис 2.
Кривые гальваностатического осаждения Ru на медную подложку при различных скоростях развертки потенциала в ванне для электроосаждения: 0.01 M RuCl3, 3 M [Cl–], pH 1. Время осаждения 3 ч.
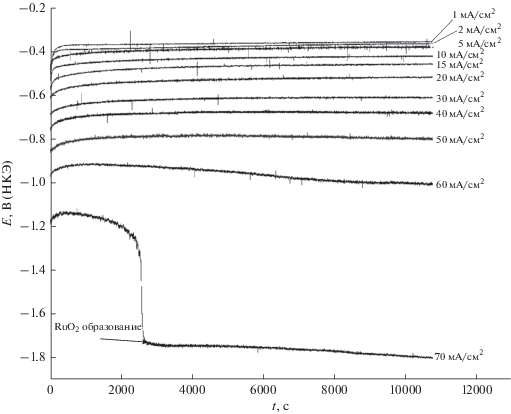
Процессс осаждения металла занимает 3 ч; значения измеряемого потенциала практически устойчивы во времени. Кривая электроосаждения при плотности тока 70 мA/cм2 отличается по форме, потому что после 3000 с начинается процесс образования оксида. Из-за сильного обеднения раствора вблизи поверхности покрытия по ионам водорода и очень медленной доставки рутениевых комплексов диффузией на катоде образуется темно-серый осадок.
На рис. 3 показано изменение толщины покрытий и выход по току процесса осаждения металла при различных плотностях тока. Эти параметры оценивали по массе осажденного металла и закону Фарадея [уравнения (1–3)]. В ходе процесса электроосаждения часть тока расходуется на реакцию выделения водорода, что ведёт к значительному снижению величины выхода по току. При самой большой плотности тока (70 мA/cм2) создаются благоприятные условия для образования оксидов и гидроксидов рутения, которые проявляются, как тонкая черная пленка на блестящей поверхности металла, и это увеличивает изменение массы образца.
Рис. 3.
Оценка толщины покрытий и выхода по току при различных приложенных плотностях тока электроосаждения Ru в ванне для электроосаждения: 0.01 M RuCl3, 3 M [Cl–], pH 1.
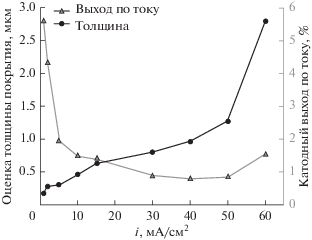
В табл. 1 показано, что толщина покрытия систематически растет с ростом приложенной плотности тока. Плотность тока оказывает влияние и на микротвердость: от 61 HV (твердость по Виккерсу) до ~100 HV. Низкие значения твердости относятся к малым толщинам полученных покрытий и к медной подложке, которая относительно мягкая и потому может уменьшить измеренное значение. Полученные при плотностях тока 1–50 мA/cм2 покрытия гладкие и блестящие, на них не видно явных микротрещин. В табл. 2 представлены SEM-микрофотографии покрытий.
Таблица 1.
Влияние условий электроосаждения на толщину, микротвердость и природу осадков, полученных на медной подложке из раствора: 0.01 M RuCl3, 3 M [Cl–], pH 1
| Условия электроосаждения | Рассчитанная толщина, мкм | Микротвердость HV0.01 | Природа осадка |
|---|---|---|---|
| 1 мA/cм2 | 0.20 | 61 ± 1 | Блестящий |
| 10 мA/cм2 | 0.50 | 73 ± 2 | Блестящий |
| 20 мA/cм2 | 0.70 | 84 ± 2 | Блестящий |
| 40 мA/cм2 | 1.00 | 85 ± 2 | Блестящий |
| 50 мA/cм2 | 1.30 | 100 ± 1 | Полублестящий |
Таблица 2.
SEM-микрофотографии осадков, полученных при плотности тока 10, 20 и 50 мA/cм2, после измерения микротвердости
 |
 |
 |
| 10 мA/cм2 | 20 мA/cм2 | 50 мA/cм2 |
Рентгенофазовые диаграммы содержат очень сильные рефлексы от металлической подложки, которые представляют собой смесь различных кристаллографических ориентаций Cu (рис. 4). С ростом тока электроосаждения эта текстура сильно ослабляется, и становятся видимыми новые пики от рутениевого осадка. При низких токах (1–10 мA/cм2) идентифицируются слабые и смазанные сигналы от граней Ru (100), (101), (002), и их можно видеть даже в случае очень тонких (меньше 1 мкм) покрытий. В условиях более интенсивного осаждения доминируют более интенсивные пики от граней (002) и (101). Медная текстура полностью исчезает при плотности тока 60 и 70 мA/cм2, что объясняется большей толщиной осадков. Более того, только при 70 мA/cм2 поверхность рутения покрывается черным, неплотным осадком, что очень характерно для процесса образования оксидов. При рентгенофазовом анализе идентифицируется небольшой пик, который присутствует только в этих покрытиях, как принадлежащий оксиду рутения RuO2. Изменение морфологии осадков мы исследовали методом сканирующей электронной микроскопии (табл. 3). Следует отметить, что рутениевые покрытия, полученные при различных плотностях тока (1–30 мA/cм2), не содержат трещин, а осадок состоит из маленьких зерен. К тому же, оказалось, что при электроосаждении большими токами усиливается выделение водорода на поверхности рутения. Присутствие пузырьков не слишком сильно сказывается на качестве поверхности, потому что скорость роста зёрен намного меньше, чем время образования, роста и отрыва пузырька от осадка. У покрытия, выращенного при плотности тока 70 мA/cм2, существенно иная морфология, более развитая и нерегулярная.
Рис. 4.
Рентгеновские дифрактограммы рутениевых покрытий, осажденных при различных приложенных плотностях тока, показывающие различные дифракционные пики Ru наряду с Cu-подложкой.

Таблица 3.
SEM-микрофотографии, иллюстрирующие изменения морфологии осадков рутения при различной плотности тока
 |
 |
 |
| 1 мA/cм2 | 10 мA/cм2 | 40 мA/cм2 |
 |
 |
 |
| 2 мA/cм2 | 15 мA/cм2 | 60 мA/cм2 |
 |
 |
 |
| 5 мA/cм2 | 30 мA/cм2 | 70 мA/cм2 |
Результаты “картирования” поверхности осадка (рис. 5) и точечного энергорассеивающего рентгеновского анализа образцов (табл. 4) подтверждают присутствие оксидов в покрытии. В особенности, количество кислорода выше в маленьких нерегулярных кластерах, и это подтверждает, что процесс образования оксидов рутения имеет место.
Рис. 5.
Картирование и точечный энергорассеивающий рентгеновский анализ поверхности образца, полученного при плотности тока 70 мA/cм2.

Таблица 4.
Точечный энергорассеивающий рентгеновский анализ для различных зерен (по SEM-микрофотографиям) для образца, осажденного при плотности тока 70 мA/cм2
| Точки | O–K, мас. % | Ru–L, мас. % |
|---|---|---|
| 1 | 45.47 | 54.53 |
| 2 | 36.52 | 63.48 |
| 3 | 4.79 | 95.04 |
| 4 | 33.58 | 66.42 |
| 5 | 25.41 | 74.59 |
| 6 | 4.71 | 95.29 |
| 7 | 19.59 | 80.41 |
Устойчивость приготовленных электродов и их реакционная способность по отношению к реакции выделения водорода исследовали путем хронопотенциометрического анализа, пропуская постоянный ток –10 мA/cм2 в 1 M растворе NaOH. Потенциал изменялся в течение первых 60 с поляризации, а потом принимал постоянное значение. На рис. 6 приведены хронопотенциограммы для каждого электрода.
Рис. 6.
Поляризационные кривые, снятые при линейной развертке потенциала при осаждении рутениевых покрытий при различных приложенных плотностях тока в насыщенном аргоном 1 M растворе NaOH при скорости развертки потенциала 2 мВ/с, и хронопотенциограммы, полученные в поляризационных измерениях различных рутениевых покрытий при плотности тока 10 мA/cм2.
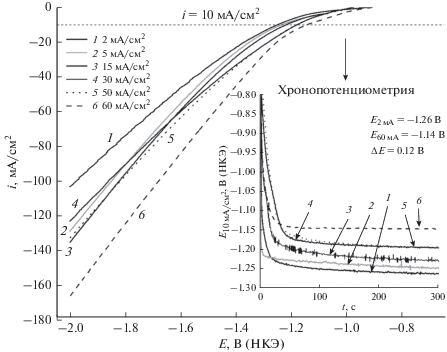
Полученные результаты показывают, что покрытия, электроосажденные при высокой плотности тока (60 мA/cм2), – это эффективный электродный материал для производства водорода в щелочной среде по сравнению с другими синтезированными материалами в настоящей работе. Разность измеренных потенциалов для рутениевых покрытий, осажденных при 2 мA/cм2 и при 60 мA/cм2, составляет 0.12 В. Дополнительно, мы снимали кривые при линейной развертке потенциала от значения потенциала разомкнутой цепи (t = 240 с) до –2 В (НКЭ) при скорости развертки потенциала 1 мВ/с. Значения потенциала на кривых, полученных с линейной разверткой потенциала, при плотности катодного тока –10 мA/cм2 очень близки к потенциалам, измеренным при хронопотенциометрическом анализе.
Для сравнения, измеренное значение потенциала в хронопотенциометрическом эксперименте в шкале стандартного водородного электрода (СВЭ) вычисляли по следующему уравнению:
На рутении, осажденном при более высоких плотностях тока, потенциал начала реакции сдвинут к более низким перенапряжениям; это свидетельствует о существенном повышении каталитической активности. Эти значения перечислены в табл. 5.
Таблица 5.
Измеренные значения потенциала в хронопотенциометрических опытах и величины перенапряжения, после пересчета на стандартный водородный потенциал (СВЭ) для плотности тока –10 мA/cм2
| Плотность тока, мA/cм2 | E (НКЭ) для –10 мA/cм2 в 1 M NaOH | Перенапряжение, мВ |
|---|---|---|
| 2 | –1.260 | 193 |
| 5 | –1.246 | 179 |
| 15 | –1.224 | 157 |
| 30 | –1.193 | 125 |
| 50 | –1.190 | 123 |
| 60 | –1.144 | 77 |
Как показано в работе [21], добавка рутения к никелю может снизить перенапряжение реакции водородного электрода в щелочной среде (‒10 мA/cм2 = 40 мВ). Каталитические свойства сильно зависят от морфологии поверхности и кристаллической структуры, которые гораздо сильнее развиты у покрытий, осажденных при более высокой плотности тока. Усиление выделения водорода может быть вызвано постепенным увеличением площади электрохимически активной поверхности электрода.
ЗАКЛЮЧЕНИЕ:
Исследовано электроосаждение рутения на медную подложку из кислого раствора хлоридов. Цель исследования – оптимизировать условия эксперимента для того, чтобы получить плотный, гладкий осадок без трещин, скручивания и охрупчивания. На выход электроосаждения по току сильно влияет приложенная плотность тока, что связано с восстановлением ионов H+ в процессе электроосаждения Ru. Гладкие, плотные и блестящие покрытия осаждаются при плотности тока 1–50 мA/cм2. Их толщина и твердость сильно зависят от параметров процесса и времени осаждения. Электрохимические свойства тонких пленок Ru можно легко регулировать, подбирая оптимальную плотность тока.
ОБОЗНАЧЕНИЯ
A – площадь электрода, cм2;
F – константа Фарадея, Кл/моль;
G – плотность металлического рутения, г/cм3;
J – приложенный ток, A;
m – теоретическая масса, согласно закону Фарадея, г;
Δm – масса осажденного покрытия, г ;
MRu – молярная масса рутения, г;
n – число электронов, перенесенных в реакции восстановления/окисления;
t – время электроосаждения, с;
φ – катодный выход по току, % ;
σ – средняя толщина покрытия, мкм.
Список литературы
Fernandez, V., Some facts on the platinum-group elements, Int. Rev. Financ. Anal., 2017, vol. 52, p. 333.
Li, Q., Zheng, S., Xu, Y., Xue, H., and Pang, P., Ruthenium based materials as electrode materials for supercapacitors, 2018, Chem. Eng. J., vol. 333, p. 505.
Liu, H., Song, C., and Zhang, L., A review of anode catalysis in the direct methanol fuel cell, J. Power Sources, 2006, vol. 155, p. 95.
Rao, C.R.K. and Trivedi, D.C., Chemical and electrochemical depositions of platinum group metals and their applications, Coord. Chem. Rev., 2005, vol. 249, p. 613.
García-Álvarez, R. Francos, J., Tomás-Mendivil, E., Crochet, P., and Cadierno, V., Metal-catalyzed nitrile hydration reactions: The specific contribution of ruthenium, J. Organomet. Chem., 2014, vol. 771, p. 93.
Chen, Q., Lin, X., and Valvede, C., Electroless copper deposition on ruthenium for damascene interconnects, ECS Transactions, 2007, vol. 6, p. 179.
Moffat, T.P., Walker, M., and Chen, P., Electrodeposition of Cu on Ru barrier layers for damascene processing, J. Electrochem. Soc., 2006, vol. 153, p. C37.
Josell, D., Wheeler, D., Witt, C., and Moffat, T., Seedless superfill: Copper electrodepositon in trenches with ruthenium barriers, Electrochem. Solid-State Lett., 2003, vol. 6, p. C143.
Parnian, J.M., Khodadadi, A., Najafabadi, A., and Mortazavi, Y., Preferential chemical vapor deposition of ruthenium on cobalt with highly enhanced activity and selectivity for Fischer-Tropsch synthesis, Appl. Catal. A Gen., 2014, vol. 470, p. 221.
Chiba, H., Hirano, M., Kawano, K., Oshima, N., and Funakubo, H., Effect of substrate type and temperature on the growth of thin Ru films by metal organic chemical vapor deposition, Mater. Sci. Semicond. Process., 2017, vol. 70, p. 73.
Chen, J.Y., Huang, S.L., Wu, P.W., and Lin, P., Electroless deposition of Ru films on Si substrates with surface pretreatments, Thin Solid Films, 2013, vol. 529, p. 42612.
Chen, J.Y.,Wang, L.Y., and Wu, P.W., Preparation and characterization of ruthenium films via an electroless deposition route, Thin Solid Films, 2010, vol. 518, p. 724513.
Raz, O., Cohn, G., Freyland, W., Mann, O., and Ein-Eli, Y., Ruthenium electrodeposition on silicon from a room-temperature ionic liquid, Electrochim. Acta, 2009, vol. 54, p. 6042.
Jayakumar, M., Venkatesan, K.A., Sudha, R., Srinivasan, T.G., and Vasudeva Rao, P.R., Electrodeposition of ruthenium, rhodium and palladium from nitric acid and ionic liquid media: Recovery and surface morphology of the deposits, Mater. Chem. Phys., 2011, vol. 128, p. 141.
Reddy, G.S. and Taimsalu, P., Electrodeposition of Ruthenium, Trans. Insitute Met. Finish., 1969, vol. 47, p. 187.
Kim, Y.S., Kim, H., and Cho, J., Electrochemical deposition of copper and ruthenium on titanium, Electrochim. Acta, 2006. vol. 51, p. 5445.
Chou, Y.S., Yen, S.C., and Jeng, K.T., Fabrication of ruthenium thin film and characterization of its chemical mechanical polishing process, Mater. Chem. Phys., 2015, vol. 162, p. 477.
Philipsen, H. and Monnens, W., Immersion and electrochemical deposition of Ru on Si, Electrochim. Acta, 2018, vol. 274, p. 306.
Oppedisano, D.K., Jones, L.A., Junk, T., and Bhargava, S.K., Ruthenium Electrodeposition from Aqueous Solution at High Cathodic Overpotential, J. Electrochem. Soc., 2014 vol. 161, p. D489.
Mech, K., Mech, J., Zabinski, P.,Kowalik, R., and Wojnicki, M., Electrochemical deposition of alloys in Ru3+–Co2+–Cl−–H2O system, J. Electroanal. Chem. 2015, vol. 748, p.76.
Ding, J., Shao, Q., Feng, Y., and Huang, X., Ruthenium–nickel sandwiched nanoplates for efficient water splitting electrocatalysis, Nano Energy, 2018, vol. 47, p. 1.
Дополнительные материалы отсутствуют.


