Электрохимия, 2020, T. 56, № 3, стр. 238-245
ЭЛЕКТРОХИМИЧЕСКОЕ ОПРЕДЕЛЕНИЕ СЕРТРАЛИНА НА ЭЛЕКТРОДЕ С ТРАФАРЕТНОЙ ПЕЧАТЬЮ, МОДИФИЦИРОВАННОМ ПЕРООБРАЗНЫМИ НАНОЦВЕТАМИ La3+/ZnO, И ЕГО ОПРЕДЕЛЕНИЕ В ФАРМАЦЕВТИЧЕСКИХ И БИОЛОГИЧЕСКИХ ОБРАЗЦАХ
Сомых Таджик a, b, *, Хади Бейтоллахи c
a Научно-исследовательский центр нейронауки, Керманский университет медицинских наук
Керман, Иран
b Научно-исследовательский центр тропических и инфекционных заболеваний,
Керманский университет медицинских наук
Керман, Иран
c Отдел окружающей среды, Институт науки и высоких технологий и наук об окружающей среде,
Высший университет передовых технологий
Керман, Иран
* E-mail: s1365@yahoo.com
Поступила в редакцию 30.10.2018
После доработки 27.02.2019
Принята к публикации 17.07.2019
Аннотация
В этой статье было описано использование электрода с трафаретной печатью, модифицированного перообразными наноцветами La3+/ZnO, для определения сертралина. Эти наноцветы показали удовлетворительную каталитическую активность для определения сертралина методами циклической вольтамперометрии (CV) и дифференциальной импульсной вольтамперометрии (DPV). При оптимальном pH 7.0 окисление сертралина происходило при потенциале примерно на 280 мВ менее положительном, чем у немодифицированного электрода с трафаретной печатью. На основании DPV окисление сертралина демонстрировало динамический диапазон от 0.5 до 150.0 мкМ и предел обнаружения (3ϭ) 0.15 ± 0.01 мкМ. Модифицированный электрод имел хорошие характеристики для обнаружения сертралина в реальных образцах стандартным методом добавления.
ВВЕДЕНИЕ
Разработка надежных аналитических методов, которые могут легко обнаружить фармацевтические загрязнители, является сложной задачей. Электроаналитические методы являются привлекательными методами из-за их применимости в различных областях, включая обнаружение лекарственных средств [1], загрязнителей окружающей среды [2–5], безопасность пищевых продуктов [6] и биомедицину [7]. Электрохимические методы имеют ряд преимуществ перед другими аналитическими методами из-за их простоты и низкой стоимости. Электрохимические датчики имеют короткое время отклика, отличную селективность и чувствительность и способны измерять непосредственно анализируемые вещества в сложных матрицах [8–15].
Сертралин (цис-1S,4S-N-метил-4-(3,4-дихлорфенил)-1,2,3,4-тетрагидро-1-нафталинамингидрохлорид) широко используется в качестве антидепрессанта и относится к классу селективных ингибиторов обратного захвата серотонина. Он используется для лечения глубокой депрессии, обсессивно-компульсивных и панических расстройств, предменструальных дисфорических и посттравматических стрессовых расстройств. Сертралин стал одним из наиболее широко используемых препаратов для лечения депрессии из-за его минимальных побочных эффектов [16, 17]. Более того, недавние исследования показали, что селективные ингибиторы обратного захвата серотонина, такие как сертралин, проникают через клеточную мембрану и связаны с высоким риском развития рака [18]. Следовательно, необходимо точное определение количества сертралина в биологических образцах, таких как кровь, плазма и моча. Сообщалось о нескольких типах аналитических и электрохимических методов, включая ВЭЖХ, газовую хроматографию, капиллярный электрофорез, вольтамперометрию, потенциометрию и спектроскопию для измерения уровня сертралина в биологических и фармацевтических образцах [19–28].
Наноструктурные оксиды металлов демонстрируют уникальные свойства, такие как полупроводниковые, изолирующие свойства и т.д., по сравнению с соответствующими объемными материалами [29–31]. В последние годы наноматериалы на основе оксида цинка (ZnO) привлекли большое внимание научных исследователей благодаря их низкой стоимости, простоте изготовления, фотокаталитической активности, широкозонному полупроводнику [32–37], уникальным оптическим, магнитным и электронным свойствам и т.д. [38–40]. Материалы ZnO представляют собой полупрозрачные пьезоэлектрические и электропроводящие материалы. Легированные лантаном (La) материалы на основе ZnO, проявляют превосходную электрохимическую активность.
В настоящей работе сообщается о синтезе и характеристике перообразных наноцветов La+3/ZnO с последующей иммобилизацией на поверхности электрода с трафаретной печатью для разработки вольтамперометрического датчика, предназначенного для электрокаталитического определения сертралина. Насколько нам известно, в отношении этого датчика ранее не проводилось никаких исследований. В конечном итоге мы оцениваем аналитические характеристики предлагаемого датчика для определения сертралина в реальных образцах.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Приборы и реагенты
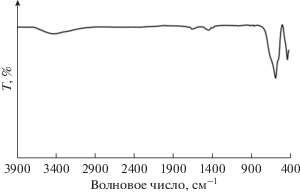
Инфракрасные спектры с преобразованием Фурье (FT-IR) регистрировали в режиме пропускания с помощью инфракрасного спектрометра Perkin Elmer BX FT-IR. ИК-фурье-спектры в диапазоне 4000–400 см–1 регистрировали, чтобы исследовать природу образующихся химических связей. Рентгеноструктурный анализ (XRD) проводили на аналитическом рентгеновском дифрактометре Philips PC-APD с монохроматизированным графито CuKα-излучением (α1, λ1 = = 1.54056 Å, α2, λ2 = 1.54439 Å) для проверки образования продуктов. Рентгенограмму индексировали с использованием карты Объединенного комитета по стандартам порошковой дифракции (JCPDS). СЭМ-изображения образцов были собраны на JSM, 6380 LV, снабженном микроанализом EDX.
Электрохимические измерения проводили с помощью потенциостата/гальваностата Autolab (PGSTAT 302N, Eco Chemie, Нидерланды). Условия эксперимента контролировали с помощью программного обеспечения для электрохимической системы общего назначения (GPES). Полученный трафаретной печатью электрод (DropSens, DRP-110, Испания) состоит из трех основных частей, которые представляют собой графитовый противоэлектрод, серебряный псевдоэлектрод сравнения и рабочий графитовый электрод. Для измерения использовали pH-метр Metrohm 710.
Сертралин и все другие реагенты категории “ч. д. а.” были получены от Merck (Дармштадт, Германия). Буферные растворы готовили из ортофосфорной кислоты и ее солей в диапазоне рН 2.0–9.0.
Синтез перообразных наноцветов La3+/ZnO
Для получения нанопорошков были использованы химические вещества категории “ч. д. а.”, а именно ацетат цинка (Zn(CH3COO)2 · 2H2O), нитрат лантана (La(NO3)3 · 6H2O), тиомочевина ((NH2)2CS) и аммиак (25% NH3). Деионизованная вода была использована для растворения всех исходных веществ. Аммиак был внедрен в качестве комплексообразующего агента при приготовлении нанопорошков. Для приготовления наноструктур ZnO использовали раствор 0.46 моль ацетата цинка в 80 мл деионизованной воды, 0.0046 моль нитрата лантана в 80 мл деионизованной воды, 0.18 моль тиомочевины в 80 мл деионизованной воды. Наконец, добавляли 19.76 мл аммиака в 80 мл деионизованной воды. Постоянные количества ацетата цинка, аммиака и тиомочевины поддерживали в соотношении 1 : 1 : 1. Следующим этапом было добавление раствора ацетата цинка в химический стакан в реакционной бане. Затем в ту же реакционную баню добавляли тиомочевину и нитрат лантана. Полученную смесь затем перемешивали в течение короткого периода времени. Наконец, в смесь постепенно добавляли аммиак и перемешивание продолжали в течение 5 мин. Температура ванны повышалась до 80°С. После обнаружения образовавшихся осадков их выдерживали в течение ночи, а затем фильтровали. Этанол затем использовали для промывки осадков. В условиях окружающей среды полученный порошок сушили в течение нескольких дней.
Изготовление электрода
Непокрытый электрод с трафаретной печатью был покрыт перообразными наноцветами La3+/ZnO, как показано ниже. Исходный раствор наноцветов La3+/ZnO в 1 мл водного раствора готовили диспергированием 1 мг наноцветов La3+/ZnO с помощью ультразвука в течение 1 ч, в то время как 2 мкл аликвоты суспензионного раствора La3+/ZnO/H2O наносили методом литья на угольные рабочие электроды с последующим ожиданием, пока растворитель не испарится при комнатной температуре.
Получение реальных образцов
Образцы мочи хранили в холодильнике сразу после сбора. Десять миллилитров образцов центрифугировали в течение 15 мин при 2000 об/мин. Супернатант отфильтровывали с использованием фильтра 0.45 мкм. Затем различные объемы раствора переносили в мерную колбу объемом 25 мл и разбавляли до метки, используя фосфатно-солевой буферный раствор (PBS) при pH 7.0. Разбавленные образцы мочи были добавлены с различным количеством сертралина. Содержание сертралина анализировали предлагаемым способом с использованием стандартного метода добавления.
Раствор готовили путем полного измельчения и гомогенизации десяти таблеток сертралина, содержащих по 50 мг вещества. Затем 50 мг каждого порошка из таблеток точно взвешивали и растворяли в 100 мл воды ультразвуком. После полного перемешивания смесь фильтровали на обычной фильтровальной бумаге, 10 мл фильтрата затем переносили в мерную колбу на 100 мл и разбавляли до метки водой. Содержание сертралина анализировали предлагаемым способом с использованием стандартного метода добавления.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Морфология и структура перообразных наноцветов La3+/ZnO
На рис. 1 приведены ИК-фурье-спектры образца перообразных наноцветов La3+/ZnO в диапазоне частот 400–4000 см–1. ИК-фурье-спектр перообразных наноцветов La3+/ZnO показал сильные полосы колебаний в областях более низких частот (около 582 и 439 см–1), приписываемые колебаниям металл–кислород. Считается, что поглощение, наблюдаемое при ~3438 см–1, связано с симметричной вибрацией групп –ОН поглощенных молекул H2O. Пик при ~1621 см–1 соответствует группам O–H, также связанным с адсорбированными молекулами H2O [41].
Основные характеристические дифракционные пики перообразных наноцветов La3+/ZnO соответствуют стандартным дифрактограммам ZnO (карта JCPDS № 36-1451) с гексагональной фазой вюрцита, что позволяет предположить, что легирование La не изменит основной цепи природного ZnO (рис. 2). По мере увеличения La в ZnO характерный пик при 2θ = 36.2° ослабевает и слегка смещается к малоугловым отражениям с увеличением La в ZnO. Введение ионов La с большим электронным и атомным радиусом в поверхность зерна ZnO приводит к потере степени упорядоченности атомов ZnO, что способствует ограниченному росту зерна, измельчению зерна и уменьшению кристалличности [42].
Ширина дифракционных пиков свидетельствует о наноразмерной природе продукта, и средний размер кристаллитов (t) его был рассчитан по формуле Дебая–Шеррера как 35.0 нм. t = = 0.9λ/β cos(θ), где λ – длина волны рентгеновского излучения (1.54056 Å для медного катода), θ – угол дифракции, и β – полная ширина на половине максимума (FWHM).
Морфология продукта была исследована с помощью СЭМ. Изображение ZnO на рис. 3 показывает, что десятки нанопроволок ZnO образуют перообразный кластер.
Электрохимическое поведение сертралина на поверхности различных электродов
Электрохимическое поведение сертралина зависит от значения рН водного раствора. Следовательно, оптимизация рН раствора, по-видимому, необходима для получения наилучших результатов при электроокислении сертралина. Таким образом, электрохимическое поведение сертралина было изучено в 0.1 М фосфатно-солевом буферном растворе (PBS) при различных значениях pH (2.0–9.0) на поверхности La3+/ZnO/SPE методом вольтамперометрии. Было обнаружено, что электроокисление сертралина на поверхности La3+/ZnO/SPE более благоприятно в нейтральных условиях, чем в кислой или щелочной среде. Здесь значение pH 7.0 было выбрано в качестве оптимального pH для электроокисления сертралина на поверхности La3+/ZnO/SPE. На рис. 4 изображены отклики CV для электроокисления 100,0 мкМ сертралина при неизмененном SPE (кривая a) и La3+/ZnO/SPE (кривая б). Пиковый потенциал возникает при 900 мВ из-за окисления сертралина, который примерно на 280 мВ более отрицательный, чем немодифицированный SPE. Кроме того, La3+/ZnO/SPE показывает намного более высокий анодный пиковый ток для окисления сертралина по сравнению с немодифицированным SPE, что указывает на то, что модификация немодифицированного SPE с наноцветами La3+/ZnO значительно улучшила работу электрода в отношении окисления сертралина.
Влияние скорости развертки потенциала
Изучено влияние скорости развертки потенциала на ток окисления сертралина (рис. 5). Результаты показали, что увеличение скорости развертки потенциала вызывает увеличение пикового тока. Кроме того, процессы окисления контролируются диффузией, как выводится из линейной зависимости тока анодного пика (Ip) от квадратного корня из скорости развертки потенциала (v1/2) для анализируемого вещества (рис. 5а).
Рис. 5.
LSV перообразного La3+/ZnO/SPE в 0.1 М PBS (pH 7.0), содержащем 100.0 мкМ сертралина при различных скоростях развертки потенциала; числа 1‒10 соответствуют 5, 10, 30, 50, 75, 100, 200, 300, 400 и 500 мВ с–1, соответственно. Вставки: а – изменение тока анодного пика в зависимости от квадратного корня скорости развертки и б – график Тафеля, полученный из LSV при скорости развертки 10 мВ с–1.
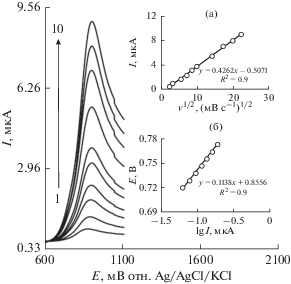
График Тафеля был построен на основе данных возрастающей части вольт-амперной кривой, записанной при скорости сканирования 5 мВ с–1 для сертралина (рис. 5б). Эти части вольтамперограммы, известной как область Тафеля, подвержены влиянию кинетики переноса электронов между субстратом (сертралином) и перообразными наноцветами La3+/ZnO/SPE. Получены наклоны Тафеля 0.1138 В, что хорошо согласуется с участием одного электрона на определяющем скорость этапе электродного процесса [43], принимая коэффициенты переноса заряда α = 0.48 для сертралина.
Хроноамперометрические измерения
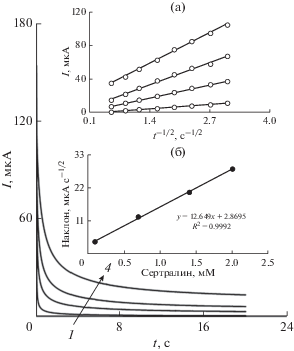
Хроноамперометрические измерения сертралина на перообразном La3+/ZnO/SPE проводили, устанавливая потенциал рабочего электрода на 950 мВ относительно Ag/AgCl/KCl (3.0 М) для различных концентраций сертралина (рис. 6) в PBS (pH 7.0) соответственно. Для электроактивных материалов (в данном случае сертралина) с коэффициентом диффузии D ток, наблюдаемый для электрохимической реакции в условиях ограниченного массопереноса, описывается уравнением Коттрелла [43]:
Рис. 6.
Хроноамперограммы, полученные на перообразном La3+/ZnO/SPE в 0.1 М PBS (pH 7.0) для различных концентраций сертралина. Числа 1–4 соответствуют 0.1, 0.7, 1.4 и 2.0 мМ сертралина. Вставки: а – графики зависимости I от t–1/2, полученные из хроноамперограмм 1–4; б – график наклона прямых линий зависимости от концентрации сертралина.
Калибровочные графики и пределы обнаружения
Пиковые токи электроокисления сертралина на поверхности перообразного La3+/ZnO/SPE могут быть использованы для определения сертралина в растворе. Поскольку DPV имеет преимущество, заключающееся в увеличении чувствительности и улучшении характеристик для аналитических применений, эксперименты с DPV проводились с использованием La3+/ZnO/SPE в 0.1 М PBS, содержащем различные индивидуальные концентрации сертралина (рис. 7). Результаты показывают, что пиковые токи электрокаталитического окисления сертралина на поверхности пера, подобного La3+/ZnO/SPE, были линейно зависимы от концентраций сертралина в диапазоне 0.5–150.0 мкМ (с коэффициентом корреляции 0.9995) и чувствительности 0.015 мкА мкМ–1 см–2, в то время как полученный предел обнаружения (3σ) составлял 0.15 ± 0.01 мкМ. Эти значения сопоставимы со значениями, сообщенными другими исследовательскими группами для определения сертралина на поверхности модифицированных электродов (см. табл. 1).
Рис. 7.
DPV перообразного La3+/ZnO/SPE в 0.1 М PBS (pH 7.0), содержащем различные концентрации сертралина. Числа 1–8 соответствуют 0.5, 15.0, 40.0, 60.0, 80.0, 100.0, 125.0 и 150.0 мкМ сертралина. На вставке показан график зависимости пикового тока от концентрации сертралина в диапазоне 0.5–150.0 мкМ.

Таблица 1.
Сравнение эффективности некоторых методов, используемых при обнаружении сертралина
| Электрод | Модификатор | Предел обнаружения | LDR | Литература |
|---|---|---|---|---|
| Стеклоуглерод | Рутин | 1.0 мкМ | 3.0–90.0 мкМ | [16] |
| Висящая ртутная капля | – | 0.5 мкМ | 0.2–1.2 мкМ | [25] |
| Угольная паста | Поливинилхлорид | 2.80 мкМ | 0.01–10.0 мкМ | [28] |
| Карандашный грифель | 3,4-этилендиокситиофен и поливинилхлорид | 25 нМ | 100.0–1000.0 нМ | [44] |
| Золото | Цитохром P450-2D6 и нанотрубки поли-8-анилино-1-нафталинсульфоновой кислоты | 0.13 мкМ | 0.2–1.4 мкМ | [45] |
| Стеклоуглерод | Наночастицы золота и многостенные углеродные нанотрубки | 95 нМ | 0.05–5.5 мкМ | [46] |
| Трафаретная печать | Перообразные наноцветы La3+/ZnO | 0.15 мкМ | 0.5–150.0 мкМ | Настоящая работа |
Кроме того, найденный предел обнаружения составлял 0.5 мкМ. Для оценки точности датчика было измерено количество сертралина в серии из шести повторяющихся образцов, содержащих 70.0 мкМ сертралина, и получено относительное стандартное отклонение (RSD) 2.4%, что демонстрирует приемлемую точность изготовленного датчика. Также время отклика датчика составляло около 20 с.
Воспроизводимость и устойчивость La3+/ZnO/SPE
Долгосрочная устойчивость La3+/ZnO/SPE была исследована в течение трехнедельного периода. Когда CV регистрировали после того, как модифицированный электрод хранился в атмосфере при комнатной температуре, пиковый потенциал окисления сертралина не изменялся, и сигналы тока демонстрировали снижение первоначального отклика только на 2.3%. Противообрастающие свойства модифицированного электрода в отношении окисления сертралина и продуктов его окисления были исследованы путем регистрации циклических вольтамперограмм модифицированного электрода до и после использования в присутствии сертралина. Циклические вольтамперограммы регистрировали в присутствии сертралина после циклического повторения потенциала в течение 10 циклов при скорости развертки 50 мВ с–1. Пиковые потенциалы не изменились до положительных значений, а токи снизились менее чем на 2.4%. Следовательно, на поверхности La3+/ZnO/SPE не только увеличивается чувствительность, но также уменьшается загрязняющий эффект анализируемого вещества и его продукта окисления. Однако перед каждым экспериментом мы восстанавливали поверхность La3+/ZnO/SPE.
Анализ реальных образцов
Для оценки аналитической применимости предложенного метода его применяли для определения сертралина в реальных образцах с использованием стандартного метода добавления. Результаты определения сертралина в реальных образцах приведены в табл. 2.
Таблица 2.
Определение сертралина в реальных образцах. Все концентрации указаны в мкМ (n = 5)
| Образец | Добавлено | Найдено | Обнаружение, % | RSD, % |
|---|---|---|---|---|
| Моча | 0 | – | – | – |
| 5.0 | 4.9 | 98.0 | 2.2 | |
| 7.5 | 7.7 | 102.7 | 1.8 | |
| 12.5 | 12.4 | 99.2 | 3.2 | |
| 17.5 | 18.1 | 103.4 | 2.4 | |
| Таблетка | – | 7.5 | – | 2.2 |
| 2.5 | 10.3 | 103.0 | 3.1 | |
| 5.0 | 12.3 | 98.4 | 2.5 | |
| 7.5 | 14.9 | 99.3 | 2.7 | |
| 10.0 | 17.8 | 101.7 | 1.9 |
ВЫВОДЫ
В настоящем исследовании для определения сертралина использовали трафаретный электрод, модифицированный перообразными наноцветами La3+/ZnO. Исследования CV и DPV показали эффективную электрокаталитическую активность модифицированного электрода в снижении анодного перенапряжения для окисления сертралина. Высокая чувствительность, воспроизводимость вольтамперометрических откликов и предел обнаружения 0.15 ± 0.01 мкМ, а также простота приготовления делают предложенный модифицированный электрод очень полезным для точного определения сертралина в реальных образцах.
Список литературы
Mahmoudi Moghaddam, H.M., Tajik, S., and Beitollahi, H., Highly sensitive electrochemical sensor based on La3+– doped Co3O4 nanocubes for determination of Sudan I content in food samples, Food Chem., 2019, vol. 286, p. 191.
Promphet, N., Rattanarat, P., Rangkupan, R., Chailapakul, O., and Rodthongkum, N., An electrochemical sensor based on graphene/polyaniline/polystyrene nanoporous fibers modified electrode for simultaneous determination of lead and cadmium, Sens. Actuators B: Chem., 2015, vol. 207, p. 526.
Santos, V.B., Luiz Fava, E., Miranda Curi, N.S., Censi Faria, R., Guerreiro, T.B., and Fatibello-Filho, O., An electrochemical analyzer for in situ flow determination of Pb(II) and Cd(II) in lake water with on-line data transmission and a global positioning system, Anal. Methods, 2015, vol. 7, p. 3105.
Liua, H., Wana, X., Liub, T., Lib, Y., and Yaob, Y., Cascade sensitive and selective fluorescence OFF-ON-OFF sensor for Cr3+ cation and F– anion, Sens. Actuators B: Chem., 2014, vol. 200, p. 191.
Abdel Aziza, A.A., and Sedab, S.H., Detection of trace amounts of Hg2+ in different real samples based on immobilization of novel unsymmetrical tetradentate schiff base within PVC membrane, Sens. Actuators B: Chem., 2014, vol. 197, p. 155.
Цзя, Д.Х., Ванг, Х.Х., Ванг, K., Фу, К.В., Ванг, Дж.Х. Новый электрохимический датчик шума, применяемый для обнаружения безопасности пищевых продуктов. Электрохимия. 2014. Т. 50. С. 599. [Xia, D.H., Wang, H.H., Wang, K., Fu, C.W., and Wang, J.H., A novel electrochemical noise sensor applied to detect food safety, Russ. J. Electrochem., 2014, vol. 50, p. 599.]
Zhu, X., Feng, C., Ye, Z., Chen, Y., and Li, G., Fabrication of magneto-controlled moveable architecture to develop reusable electrochemical biosensors, Sci Rep., 2014, vol. 4, p. 4169.
Beitollahi, H., Karimi-Maleh, H., and Khabazzadeh, H., Nanomolar and selective determination of epinephrine in the presence of norepinephrine using carbon paste electrode modified with carbon nanotubes and novel 2‑(4-oxo-3-phenyl-3, 4-dihydro-quinazolinyl)-N′-phenyl-hydrazinecarbothioamide, Anal. Chem., 2008, vol. 80, p. 9848.
Beitollahi, H., Ghofrani Ivari, S., and Torkzadeh-Mahani, M., Application of antibody nanogold ionic liquid carbon paste electrode for sensitive electrochemical immunoassay of thyroid stimulating hormone, Biosens. Bioelectron., 2018, vol. 110, p. 97.
Beitollahi, H., Nekooei, S., and Torkzadeh-Mahani, M., Amperometric immunosensor for prolactin hormone measurement using antibodies loaded on a nano-Au monolayer modified ionic liquid carbon paste electrode, Talanta, 2018, vol. 188, p. 701.
Beitollahi, H., Tajik, S., Aflatoonian, M.R., and Makarem, A., NiFe2O4 Nanoparticles Modified Screen Printed Electrode for Simultaneous Determination of Serotonin and Norepinephrine, Anal. Bioanal. Electrochem., 2018, vol. 10, p. 1399.
Tajik, S. and Beitollahi, H., A Sensitive Chlorpromazine Voltammetric Sensor Based on Graphene Oxide Modified Glassy Carbon Electrode, Anal. Bioanal. Chem. Res., 2019, vol. 6, p. 171.
Ganjali, M.R., Dourandish, Z., Beitollahi, H., Tajik, S., Hajiaghababaei, L., and Larijani, B., Highly sensitive determination of theophylline based on graphene quantum dots modified electrode, Int. J. Electrochem. Sci., 2018, vol. 13, p. 2448 .
Beitollahi, H., Safaei, M., and Tajik, S., Different electrochemical sensors for determination of dopamine as neurotransmitter in mixed and clinical samples: A Review, Analytical and Bioanalytical Chemistry Research, 2019, vol. 6, p. 81.
Tajik, S., Beitollahi, H., and Biparva, P., Methyldopa electrochemical sensor based on a glassy carbon electrode modified with Cu/TiO2 nanocomposite, J. Serb. Chem. Soc., 2018, vol. 83, p. 863.
Cheng, H., Liang, J., Zhang, Q., and Tu, Y., The electrochemical behavior and oxidation mechanism of sertraline on a rutin modified electrode, J. Electroanal. Chem., 2012, vol. 674, p. 7.
Tajik, S., Taher, M.A., and Beitollahi, H., Mangiferin DNA biosensor using double-stranded DNA modified pencil graphite electrode based on guanine and adenine signals, J. Electroanal. Chem., 2014, vol. 720, p.134.
Ganjali, M.R., Beitollahi, H., Zaimbashi, R., Tajik, S., Rezapour, M., and Larijani, B., Voltammetric Determination of Dopamine Using Glassy Carbon Electrode Modified with ZnO/Al2O3 Nanocomposite, Int. J. Electrochem. Sci., 2018, vol. 13, p. 2519.
Eap, C.B., Bouchoux, G., Amey, M., Cochard, N., Savary, L., and Baumann, P., Simultaneous determination of human plasma levels of citalopram, paroxetine, sertraline, and their metabolites by gas chromatography mass spectrometry, J. Chromatogr. Sci., 1998, vol. 36, p. 365.
Ramirez, A.J., Mottaleb, M.A., Brooks, B.W., and Chambliss, C.K., Analysis of pharmaceuticals in fish using liquid chromatography-tandem mass spectrometry, Anal. Chem., 2007, vol. 79, p. 3155.
Lacassie, E., Gaulier, J.M., Marquet, P., Fabatel, J.F., and Lachâtre, G., Methods for the determination of seven selective serotonin reuptake inhibitors and three active metabolites in human serum using high-performance liquid chromatography and gas chromatography, J. Chromatogr. B, 2000, vol. 742, p. 229.
Lajeunesse, A., Gagnon, C., and Sauvé, S., Determination of basic antidepressants and their Ndesmethyl metabolites in raw sewage and wastewater using solid-phase extraction and liquid chromatography-tandem mass spectrometry, Anal. Chem., 2008, vol. 80, p. 5325.
Schultz, M.M., and Furlong, E.T., Trace analysis of antidepressant pharmaceuticals and their select degradates in aquatic matrixes by LC/ESI/MS/MS, Anal. Chem., 2008, vol. 80, p. 1756.
Vela, M.H., Quinaz Garcia, M.B., and Montenegro, M.C., Electrochemical behavior of sertraline at a hanging mercury drop electrode and its determination in pharmaceutical products, Fresen. J. Anal. Chem., 2001, vol. 369, p. 563.
Nouws, H.P.A., Matos, C.D., Barros, A.A., and Rodrigues, J.A., Electroanalytical study of the antidepressant sertraline, J. Pharm. Biomed. Anal., 2005, vol. 39, p. 290.
Arvand, M. and Hashemi, M., Synthesis by Precipitation polymerization of a molecularly imprinted polymer membrane for the potentiometric determination of sertraline in tablets and biological fluids, J. Braz. Chem. Soc., 2012, vol. 23, p. 392.
Das, R.S. and Agrawal, Y.K., Spectrofluorometric analysis of new-generation antidepressant drugs in pharmaceutical formulations, human urine, and plasma samples, Spectrosc-Int. J., 2012, vol. 27, p. 59.
Khater, M.M., Issa, Y.M., Hassib, H.B., and Mohammed, S.H., Dynamic potential and surface morphology study of sertraline membrane sensors, J. Adv. Res., 2015, vol. 6, p. 459.
Meenatchi, B., Sathiya Lakshmi, V., Manikandan, A., Renuga, V., Sharmila, A., Nandhine Deve, K.R., and Kumar Jaganathan, S., Protic ionic liquid assisted synthesis and characterization of ferromagnetic cobalt oxide nanocatalyst, J. Inorg. Organomet. Polym., 2017, vol. 27, p. 446.
Колотыгин, В.А., Ципис, Е.В., Марков, А.А., Патракеев, М.В. Уэренборг, Дж.С., Шаула, А.Л., Хартон, В.В. Транспортные и электрохимические свойства SrFe(Al,Mo)O3. Электрохимия. 2018. Т. 54. С. 514. [Kolotygin, V.A., Tsipis, E.V., Markov, A.A. Patrakeev, M.V. Waerenborgh, J.C. Shaula, A.L., and Kharton, V.V., Transport and Electrochemical Properties of SrFe(Al,Mo)O3, Russ. J. Electrochem., 2018, vol. 54, p. 514.]
Manikandan, A., Durka, M., and Arul Antony, S., A novel synthesis, structural, morphological, and opto-magnetic characterizations of magnetically separable spinel CoxMn1 –xFe2O4 nano-catalysts, J. Supercond. Nov. Magn., 2014, vol. 27, p. 2841.
Beitollahi, H. and Garkani Nejad, F., Graphene oxide/ZnO nano composite for sensitive and selective electrochemical sensing of levodopa and tyrosine using modified graphite screen printed electrode, Electroanalysis, 2016, vol. 28, p. 2237.
Zhu, J.F. and Zhu, Y.J. Microwave-assisted one-step synthesis of polyacrylamide-metal (M = Ag, Pt, Cu) nanocomposites in ethylene glycol, J. Phys. Chem. B, 2006, vol. 110, p. 8593.
Selvam, N.C.S., Manikandan, A., John Kennedy, L., and Judith Vijaya, J., Comparative investigation of zirconium oxide (ZrO2) nano and microstructures for structural, optical and photocatalytic properties, J. Colloid Interf. Sci., 2013, vol. 389, p. 91.
Kennedy, J., Murmu, P.P., Leveneur, J., Markwitz, A., and Futter, J. Controlling preferred orientation and electrical conductivity of zinc oxide thin films by post growth annealing treatment, Appl. Surf. Sci., 2016, vol. 367, p. 52.
Manikandan, E., Kennedy, J., Kavitha, G., Kaviyarasu, K., Maaza, M., Panigrahi, B. K., and Kamachi Mudali, U., Hybrid nanostructured thin-films by PLD for enhanced field emission performance for radiation micro-nano dosimetry applications, J. Alloys Comp., 2015, vol. 647, p. 141.
Kennedy, J., Sundrakannan, B., Katiyar, R.S., Markwitz, A., Li, Z., and Gao, W., Raman scattering investigation of hydrogen and nitrogen ion implanted ZnO thin films, Curr. Appl. Phys., 2008, vol. 8, p. 291.
Murmu, P.P., Kennedy, J., Williams, G.V.M., Ruck, B.J., Granville, S., and Chong, S.V., Observation of magnetism, low resistivity, and magnetoresistance in the near-surface region of Gd implanted ZnO, Appl. Phys. Lett., 2012, vol. 101, p. 082408.
Kennedy, J., Williams, G.V.M., Murmu, P.P., and Ruck, B.J., Intrinsic magnetic order and inhomogeneous transport in Gd-implanted zinc oxide, Phys. Rev. B, 2013, vol. 88, p. 214423
Sathyaseelan, B., Manikandan, E., Sivakumar, K., Kennedy, J., and Maaza, M., Enhanced visible photoluminescent and structural properties of ZnO/KIT-6 nanoporous materials for white light emitting diode (w-LED) application, J. Alloy Comp., 2015, vol. 651, p. 479.
Ansari, A.A., Kaushik, A., Solanki, P.R., and Malhotra, B.D., Nanostructured zinc oxide platform for mycotoxin detection, Bioelectrochem., 2010, vol. 77, p. 75.
Pal, E., Hornok, V., Kun, R., Chernyshev, V., Seemann, T., Dekany, I., and Busse, M., Growth of raspberry-, prism-and flower-like ZnO particles using template-free low-temperature hydrothermal method and their application as humidity sensors, J. Nanopart. Res., 2012, vol. 14, p. 1002.
Bard, A. and Faulkner, L., Electrochemical methods fundamentals and applications, second ed., New York: Wiley. 2001.
Izadyar, A. Arachchige, D.R., Cornwell, H., and Harshberger, J.C., Ion transfer stripping voltammetry for the detection of nanomolar levels of fluoxetine, citalopram, and sertraline in tap and river water samples, Sens. Actuators B, 2016, vol. 223, p. 226.
Iwuoha, E., Ngece, R., Klink, M., and Baker, P., Amperometric responses of CYP2D6 drug metabolism nanobiosensor for sertraline: a selective serotonin reuptake inhibitor, IET Nanobiotechnol., 2007, vol. 1, p. 62.
Shoja, Y., Rafati, A.A., and Ghodsi, J., Electropolymerization of Ni-LD metallopolymers on gold nanoparticles enriched multi-walled carbon nanotubes as nano-structure electrocatalyst for efficient voltammetric sertraline detection in human serum, Electrochim. Acta, 2016, vol. 203, p. 281.
Дополнительные материалы отсутствуют.