Электрохимия, 2020, T. 56, № 4, стр. 317-324
Электрохимические свойства ионов кобальта(II), никеля(II) и железа(II) в присутствии 2,2'-бипиридила
А. Ф. Хуснуриялова a, b, А. В. Сухов a, b, Г. Э. Бекмухамедов a, b, Д. Г. Яхваров a, b, *
a Казанский (Приволжский) федеральный университет
420008 Казань, ул. Кремлевская, 18, Россия
b Институт органической и физической химии им. А.Е. Арбузова ФИЦ “КазНЦ РАН”
420088 Казань, ул. Арбузова, 8, Россия
* E-mail: yakhvar@iopc.ru
Поступила в редакцию 18.03.2019
После доработки 11.04.2019
Принята к публикации 15.08.2019
Аннотация
Методом циклической вольтамперометрии исследованы электрохимические свойства ионов кобальта(II), никеля(II) и железа(II) в присутствии возрастающих количеств 2,2'-бипиридила (bpy). Установлено, что добавление в раствор, содержащий ионы кобальта(II), никеля(II) и железа(II), незначительных количеств bpy (10–50 мол. %) приводит к стабилизации восстановленных форм металла(0) и предотвращает процесс их электрохимического осаждения и образования нерастворимых металлических ассоциатов.
ВВЕДЕНИЕ
Развитие современной химии на настоящий момент протекает в нескольких приоритетных направлениях, одним из которых является разработка и использование технологий на основе наноразмерных частиц переходных металлов [1, 2]. Одна из движущих сил быстрого развития в направлении получения наночастиц металлов заключается в совершенно разных физико-химических свойствах наноразмерных частиц по сравнению с их массивными металлами. Данные производные широко используются в современной промышленности. Это обусловлено, прежде всего, специфическими свойствами как самих наночастиц, так и модифицированных ими материалов [3–7]. Эти системы подчиняются принципам самоорганизации и позволяют формировать наноматериалы, которые используются в различных технологиях, применяются для создания элементов микроэлектронных, сенсорных и оптических устройств, синтеза новых материалов с заданными свойствами [8–10]. Среди огромного массива известных наночастиц металлов особое место занимают наноразмерные частицы 3d-металлов VIII группы, а именно наночастицы кобальта, никеля и железа, которые представляют большой интерес в связи с их относительно высокой химической активностью и специфическими свойствами, такими как каталитические, магнитные, механические, оптические и электрические [11–17]. Это дает возможность использовать наночастицы металлов в различных областях, включая катализ, медицину и физику [18–22].
Получение наноразмерных металлических частиц является сложной задачей. Большинство методов, особенно физические, энергоемки и требуют наличия специального оборудования. Ограничения способов получения связаны с трудностями контроля химического состава конечного продукта, загрязнением наночастиц исходными реагентами [23–27]. Одним из перспективных направлений получения наноразмерных частиц металлов является использование электрохимических методов [28], которые основаны как на прямом электрохимическом генерировании наночастиц металлов, так и на процессах, вовлекающих использование органических медиаторов, способных проводить электрохимическое восстановление металла в гомогенном состоянии непосредственно в реакционной среде после активации медиатора на поверхности рабочего электрода [29].
Ранее нами был разработан новый способ генерирования наноразмерных частиц кобальта, никеля и железа путем электрохимического восстановления координационно-ненасыщенных комплексов металла(II) [30]. Механизм процесса электрохимического генерирования наноразмерных частиц металлов включает стадию электрохимического восстановления комплекса металла(II) и последующую реакцию диспропорционирования координационно-ненасыщенных по 2,2'-бипиридилу (bpy) комплексов [М0(bpy)]. Было найдено, что образование наночастиц в растворе протекает только при использовании координационно-ненасыщенных по bpy комплексов металлов (соотношение M : bpy = 1 : 1), а при использовании избытка лиганда, образования наночастиц не происходит в силу высокой устойчивости бис- и трис-хелатных комплексов металла(0). Однако на настоящий момент остается невыясненным вопрос влияния малых концентраций bpy (соотношение M : bpy > 1 : 1) на стабильность образующихся ассоциатов при восстановлении ионов металла(II) в металл(0).
Целью настоящей работы является исследование электрохимических свойств ионов кобальта(II), никеля(II) и железа(II) в присутствии возрастающих концентраций 2,2'-бипиридила методом циклической вольтамперометрии (ЦВА).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все эксперименты, связанные с проведением электрохимических исследований, были выполнены в инертной атмосфере (азот) с использованием стандартной аппаратуры Шленка. Электрохимические свойства исследовали при использовании циклической вольтамперометрии.
Диметилформамид (ДМФА) очищали трехкратной вакуумной перегонкой с промежуточной сушкой над гидридом кальция (10 г/л) и хранили в атмосфере азота. Комплексы металла с 2,2'-бипиридилом получали из дибромида металла и требуемого количества bpy в ДМФА. Используемые Alfa Aesar 2,2'-бипиридил (99%), CoBr2 (99%), NiBr2 (98%), FeBr2 (98%), (NBu4)BF4 (98%) – коммерчески доступные реактивы использовали без дополнительной очистки. Фоновую соль (NBu4)BF4 расплавляли в вакууме для удаления следов остаточной воды непосредственно перед использованием.
В исследованиях методом ЦВА в качестве рабочего электрода использовали электрод из стеклоуглерода (СУ) с площадью рабочей поверхности 3.14 мм2. Вольтамперограммы (ЦВА-кривые) регистрировали при включении электрохимической ячейки по трехэлектродной схеме. Регистрацию ЦВА-кривых осуществляли в ДМФА на фоне 0.1 M (NBu4)BF4 и скорости линейной развертки потенциала 50 мВ/с при использовании потенциостата BASI EC Epsilon с ячейкой C3. Электродом сравнения служила система Ag/0.01 М AgNO3 в ацетонитриле (Е0(Fc/Fc+) = +0.20 B). Все потенциалы в работе приведены относительно этого электрода сравнения. В качестве вспомогательного электрода использовали Pt-проволоку диаметром 1 мм и длиной 20 мм. Измерения проводили в ячейке в атмосфере азота при комнатной температуре. При проведении экспериментов объем рабочего раствора был равен 5 мл, а концентрация ионов металла(II) составляла 5 × 10–3 М. Растворы для регистрации ЦВА-кривых готовили растворением в 5 мл ДМФА соответствующей соли металла CoBr2, NiBr2, FeBr2 и 2,2'-бипиридила в соотношении M/bpy 1 : 0.1, 1 : 0.3, 1 : 0.5, 1 : 0.8, 1 : 1, 1 : 2.
При проведении in situ ЭПР-спектроэлектрохимических экспериментов была использована плоская стеклянная электрохимическая ЭПР-ячейка, снабженная платиновым катодом [31]. Алюминиевая проволока диаметром 1.0 мм и длиной 20.0 мм была использована в качестве анода. ЭПР-эксперименты были проведены на спектрометре Bruker EMX X-диапазона. Энергия микроволнового излучения была равна 1–4 мВт. Для разрешения спектров амплитуда модуляции составляла от 0.01 до 0.1 мT.
Электрохимическое восстановление ионов кобальта(II) в электрохимической ЭПР-ячейке. Раствор для электролиза был приготовлен при растворении CoBr2 (5.5 мг, 0.025 ммоль) и bpy (0.39 мг, 0.0025 ммоль для соотношения Co/bpy 1 : 0.1; 1.17 мг, 0.0075 ммоль для соотношения Co/bpy 1 : 0.3 и 1.95 мг, 0.0125 ммоль для соотношения Co/bpy 1 : 0.5) в ДМФА (5 мл). Полученный раствор был перенесен в электрохимическую ЭПР-ячейку, снабженную платиновым катодом и алюминиевым анодом. Постоянный ток силой около 5.0 мкА был пропущен через ячейку при потенциале рабочего электрода в пределах ‒1.40–1.50 В (отн. Ag/Ag+) в течение часа. Образование в растворе наночастиц кобальта (g = 2.30, 800–1600 G) для всех исследованных мольных соотношений было обнаружено в течение минуты после включения тока (Q ≈ 300 мкА c).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для исследования электрохимических свойств ионов кобальта(II), никеля(II) и железа(II) в присутствии возрастающих количеств 2,2'-бипиридила были использованы системы, содержащие соответствующие бромиды металлов и bpy в различных мольных соотношения M : bpy.
Электрохимическое восстановление ионов кобальта(II) в отсутствие и в присутствии 2,2'-бипиридила
На рис. 1 представлены данные, полученные для системы CoBr2/bpy методом ЦВА. Потенциалы катодных пиков приведены в табл. 1.
Рис. 1.
ЦВА-кривые для системы, содержащей CoBr2 (5 × 10–3 М) в отсутствие и в присутствии 2,2'-бипиридила в среде ДМФА в присутствии (NBu4)BF4 (0.1 M) (рабочий электрод – СУ, v = 50 мВ/с).
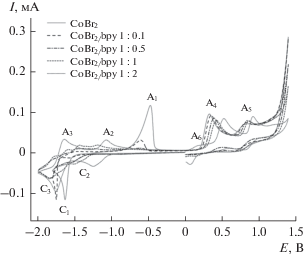
Таблица 1.
Потенциалы пиков* на ЦВА-кривых CoBr2 (5 × 10–3 М) в отсутствие и присутствии 2,2'-бипиридила
| Система | Мольное соотношение CoBr2/bpy | Катодные пики Е, В | Анодные пики (реокисление) Е, В | ||
|---|---|---|---|---|---|
| CoBr2 | – | C1 | –1.63 | A1 | –0.46 |
| CoBr2/bpy | 1 : 0.1 | C1 | –1.74 | A1 | –0.61 |
| CoBr2/bpy | 1 : 0.3 | C1 | – | A1 | – |
| С3 | –1.81 | А3 | –1.62 | ||
| CoBr2/bpy | 1 : 0.5 | C2 | –1.56 | A1 | – |
| С3 | –1.82 | А3 | –1.62 | ||
| CoBr2/bpy | 1 : 0.8 | C2 | –1.50 | A2 | –1.18 |
| С3 | –1.83 | А3 | –1.62 | ||
| CoBr2/bpy | 1 : 1.0 | C2 | –1.49 | A2 | –1.18 |
| С3 | –1.82 | А3 | –1.60 | ||
| CoBr2/bpy | 1 : 2.0 | C2 | –1.25 | A2 | –1.07 |
| С3 | –1.75 | А3 | –1.64 | ||
Из полученных данных следует, что электрохимическое восстановление сольватированных ионов кобальта(II) в отсутствие bpy протекает как необратимый перенос двух электронов при потенциале пика С1 с образованием металлического кобальта, адсорбированного на поверхности рабочего СУ-электрода (cхема 1). Процесс адсорбции подтверждается наличием адсорбционного пика реокисления металлического кобальта А1.
Схема 1 .
Кроме этого, следует отметить, что на ЦВА-кривой в анодной области присутствуют характерные пики окисления присутствующих в растворе бромид-анионов А4 и А5 (схема 2 ) [32, 33].
Схема 2 .
Добавление bpy к рабочему раствору, содержащему ионы кобальта(II), приводит к существенному изменению морфологии ЦВА-кривой. Детальное исследование адсорбционного пика А1 показало, что резкое снижение тока данного пика происходит уже при добавлении 0.1 эквивалента bpy относительно ионов кобальта(II), то есть при мольном соотношении Co : bpy = 1 : 0.1 в растворе, и приводит к полному его исчезновению при соотношении Co : bpy = 1 : 0.5 (рис. 1). Адсорбционный пик А1 полностью пропадает за счет стабилизации ионов кобальта(0) молекулами bpy в гомогенном состоянии. Более того, в катодной области происходит уменьшение тока пика С1, соответствующего восстановлению несвязанных с 2,2'-бипиридилом ионов Co2+, и появляются новые пики восстановления, соответствующие восстановлению образующихся в растворе комплексов кобальта с bpy [30].
Для выяснения природы образующихся продуктов электрохимического процесса был проведен препаративный электролиз в электрохимической ЭПР-ячейке, как и в ранее описанном нами случае [30]. Было установлено, что при проведении электрохимического восстановления растворов, содержащих бромид кобальта и bpy в соотношениях Co : bpy = 1 : 0.1–0.5 в ДМФА, в реакционной смеси происходит образование парамагнитных частиц. В ЭПР-спектре, зарегистрированном с полученного раствора, присутствует широкая линия (800 Гc), с g-фактором равным 2.3 (g = 2.3). Однако в течение электролиза происходит небольшое смещение g-фактора и уширение линии. Через 5 мин эксперимента ширина линии составляет 1600 Гс. Такое поведение является характерным для наноразмерных частиц металлов, в которых наблюдается ферромагнитный резонанс. Это доказывает образование наноразмерных частиц кобальта(0) в растворе в ходе электролиза даже при концентрациях bpy значительно меньших эквивалентного значения. Следует также отметить, что в ходе данного процесса методом in situ ЭПР-спектроскопии нам удалось зафиксировать все возможные интермедиаты процесса электрохимического восстановления ионов кобальта(II) в изучаемых условиях в присутствии bpy. Так в ЭПР-спектре, записанном после проведения электрохимического процесса, присутствуют три линии, соответствующие моноядерному комплексу кобальта (0), наноразмерным частицам кобальта и металлическому кобальту, осажденному на поверхности рабочего электрода (катода) [30].
Электрохимическое восстановление ионов никеля(II) в отсутствие и в присутствии 2,2’-бипиридила
На ЦВА-кривой никелевой соли NiBr2, зарегистрированной в отсутствие и присутствии bpy, наблюдается сходная с ионами кобальта картина (рис. 2). Так, в отсутствие bpy на ЦВА-кривой NiBr2 присутствуют пик восстановления С1 и пик окисления адсорбированного на поверхности рабочего электрода металлического никеля А1, который образуется при потенциалах пика С1. Одновременно c этим в анодной области присутствуют пики окисления бромид-анионов А4 и А5 (рис. 2, схема 3 ).
Схема 3 .
Рис. 2.
ЦВА-кривые для системы, содержащей NiBr2 (5 × 10–3 М) в отсутствие и в присутствии 2,2'-бипиридила в среде ДМФА в присутствии (NBu4)BF4 (0.1 M) (рабочий электрод – СУ, v = 50 мВ/с).
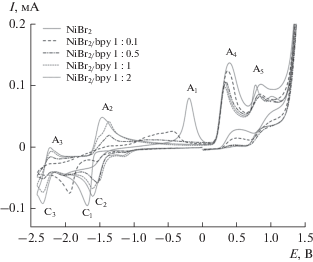
Следует отметить, что ранее нами были исследованы системы, содержащие координационно-насыщенные и координационно-ненасыщенные по bpy комплексы никеля(II) (соотношение Ni(II)/bpy 1 : 1, 1 : 2 и 1 : 3) [34]. Показано, что стабилизация восстановленных форм ионов никеля имеет место при соотношении Ni(II)/bpy 1 : 1. Однако, как следует из полученных в данной работе экспериментальных данных, добавление уже 0.1 эквивалента bpy к раствору, содержащему ионы никеля(II), приводит к резкому снижению тока пика А1, а его полное исчезновение наблюдается в присутствии в растворе 0.3–0.5 эквивалентов bpy (рис. 2). Наблюдаемый эффект, как и в случае системы CoBr2/bpy, обусловлен стабилизацией частиц никеля(0) молекулами бипиридила в растворе. Электрохимические характеристики системы NiBr2/bpy приведены в табл. 2.
Таблица 2.
Потенциалы пиков* на ЦВА-кривых NiBr2 (5 × 10–3 М) в отсутствие и присутствии 2,2'-бипиридила
| Система | Мольное соотношение NiBr2/bpy | Катодные пики Е, В | Анодные пики (реокисление) Е, В | ||
|---|---|---|---|---|---|
| NiBr2 | – | C1 | –1.67 | A1 | –0.20 |
| NiBr2/bpy | 1 : 0.1 | C1 | –1.94 | A1 | –0.41 |
| C2 | –1.54 | A2 | –1.37 | ||
| NiBr2/bpy | 1 : 0.3 | C1 | – | A1 | – |
| C2 | –1.52 | A2 | –1.37 | ||
| NiBr2/bpy | 1 : 0.5 | C2 | –1.52 | A2 | –1.37 |
| С3 | –2.31 | А3 | –2.24 | ||
| NiBr2/bpy | 1 : 0.8 | C2 | –1.57 | A2 | –1.35 |
| С3 | –2.30 | А3 | –2.19 | ||
| NiBr2/bpy | 1 : 1.0 | C2 | –1.59 | A2 | –1.34 |
| С3 | –2.32 | А3 | –2.19 | ||
| NiBr2/bpy | 1 : 2.0 | C2 | –1.60 | A2 | –1.45 |
| С3 | –2.32 | А3 | –2.21 | ||
Электрохимическое восстановление ионов железа(II) в отсутствие и присутствии 2,2’-бипиридила
На ЦВА-кривой бромида железа(II) в катодной области наблюдаются три пика. Пик С1 соответствует процессу восстановления ионов железа(II) до железа(0), которое в отсутствие bpy осаждается на поверхности рабочего электрода, давая пик окисления металлического железа при потенциале А1 (рис. 3, схема 4 ). Присутствие на ЦВА-кривой пиков С0 и С01 обусловлено восстановлением мостиковых производных типа [FeBr2]n в растворе. В анодной области, аналогично бромидам кобальта и никеля, наблюдаются пики А5 и А6, соответствующие окислению бромид и трибромид анионов (схема 2 ), и пик А7, отвечающий за квазиобратимый процесс окисления ионов Fe2+.
Схема 4 .
Рис. 3.
ЦВА-кривые для системы, содержащей FeBr2 (5 × 10–3 М) в отсутствие и в присутствии 2,2'-бипиридила в среде ДМФА в присутствии (NBu4)BF4 (0.1 M) (рабочий электрод – СУ, v = 50 мВ/с).
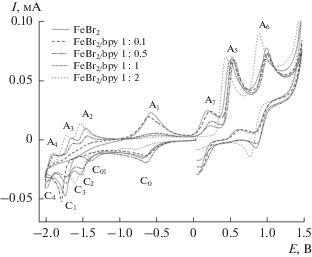
Известно, что, в отличие от никеля и кобальта, в присутствии bpy или 1,10-фенантролина (phen) железо не склонно к образованию комплексов состава ML и ML2, где L = bpy, phen, образуя, даже при недостаточном количестве лиганда, комплексы состава ML3 [35]. Проведенные эксперименты показали, что добавление 0.1 и более эквивалентов bpy приводит к уменьшению и, впоследствии, полному исчезновению пиков С1 и A1, соответствующих исходным ионам и восстановленным формам железа, и появлению новых пиков С2, С3 и С4 с соответствующими пиками реокисления А2, А3 и А4 (рис. 3), что указывает на стадийное восстановление [Fe(bpy)n]2+ до [Fe(bpy)n]– [36, 37] с образованием в растворе промежуточных комплексов железа с bpy. Электрохимические характеристики процессов системы FeBr2/bpy приведены в табл. 3.
Таблица 3.
Потенциалы пиков* на ЦВА-кривых FeBr2 (5 × 10-3 М) в отсутствие и присутствии 2,2'-бипиридила
| Система | Мольное соотношение FeBr2/bpy | Катодные пики Е, В | Анодные пики (реокисление) Е, В | ||
|---|---|---|---|---|---|
| FeBr2 | – | C0 | –0.68 | A1 | –0.60 |
| C01 | –1.39 | A2 | – | ||
| C1 | –1.73 | А3 | – | ||
| FeBr2/bpy | 1 : 0.1 | C0 | –0.66 | A1 | –0.63 |
| C01 | – | A2 | – | ||
| C1 | –1.78 | А3 | – | ||
| FeBr2/bpy | 1 : 0.3 | C0 | –0.65 | A1 | –0.56 |
| C01 | – | A2 | –1.43 | ||
| C1 | –1.79 | А3 | –1.62 | ||
| C2 | –1.50 | А4 | –1.87 | ||
| С3 | –1.67 | ||||
| C4 | –1.96 | ||||
| FeBr2/bpy | 1 : 0.5 | C0 | –0.67 | A1 | –0.54 |
| C01 | – | A2 | –1.43 | ||
| C1 | –1.71 | А3 | –1.61 | ||
| C2 | –1.50 | А4 | –1.89 | ||
| С3 | –1.69 | ||||
| C4 | –1.97 | ||||
| FeBr2/bpy | 1 : 0.8 | C0 | –0.69 | A1 | – |
| C01 | –1.38 | A2 | –1.45 | ||
| C1 | –1.69 | А3 | –1.65 | ||
| C2 | –1.55 | А4 | –1.89 | ||
| С3 | –1.66 | ||||
| C4 | –1.96 | ||||
| FeBr2/bpy | 1 : 1 | C0 | –0.71 | A1 | – |
| C01 | –1.35 | A2 | –1.45 | ||
| C1 | –1.72 | А3 | –1.64 | ||
| C2 | –1.52 | А4 | –1.88 | ||
| С3 | –1.67 | ||||
| C4 | –2.00 | ||||
| FeBr2/bpy | 1 : 2 | C0 | –0.78 | A1 | – |
| C01 | –1.16 | A2 | –1.52 | ||
| C1 | –1.79 | А3 | –1.72 | ||
| C2 | –1.49 | А4 | –1.90 | ||
| С3 | –1.60 | ||||
| C4 | –2.00 | ||||
ЗАКЛЮЧЕНИЕ
Таким образом, можно заключить, что электрохимическое восстановление ионов кобальта(II), никеля(II) и железа(II) в присутствии незначительных количеств 2,2'-бипиридила (10–50 мол. %) приводит к стабилизации восстановленных форм металла(0) в гомогенном состоянии и предотвращает процесс электрохимического осаждения восстановленных форм и образования нерастворимых металлических ассоциатов. Процесс стабилизации электрохимически восстановленных форм ионов кобальта(II), никеля(II) и железа(II) включает не только образование комплексных соединений данных металлов с 2,2'-бипиридилом в растворе, но также и металлических наночастиц [30], что требует значительно меньших концентраций лиганда.
Список литературы
Dur an Pachon, L. and Rothenberg, G., Transition-metal nanoparticles: synthesis, stability and the leaching issue, Appl. Organometal. Chem., 2008, vol. 22, p. 288.
Akbarzadeh, A., Samiei, M., and Davaran, S., Magnetic nanoparticles: preparation, physical properties, and applications in biomedicine, Nanoscale Res. Lett., 2012, vol. 7, p. 144.
Aiken III, J.D. and Finke, R.G., A review of modern transition-metal nanoclusters: their synthesis, characterization, and applications in catalysis, J. Mol. Catal. A: Chem., 1999, vol. 145, p. 1.
Guczi, L., Peto, G., Beck, A., and Paszti, Z., Electronic structure and catalytic properties of transition metal nanoparticles: the effect of size reduction, Top.Catal., 2004, vol. 29, p. 129.
Yoon, M., Kim, Y., Kim, Y.M., Yoon, H., Volkov, V., Avilov, A., Park, Y.J., and Park, I.-W., Superparamagnetism of transition metal nanoparticles in conducting polymer film, J. Magn. Magn. Mater., 2004, vol. 272, p. 1259.
Arda, L., Ozturk, O., Asikuzun, E., and Ataoglu, S., Structural and mechanical properties of transition metals doped ZnMгO nanoparticles, Powder Technol, 2013, vol. 235, p. 479.
Aliofkhazraei, M., Handbook of Nanoparticles, Springer International Publishing, 2015, vol. 2, 1439 p.
Kim, K.-R., Kang, J., and Chae, K.-J., Improvement in methanogenesis by incorporating transition metal nanoparticles and granular activated carbon composites in microbial electrolysis cells, Int. J. Hydrogen Energy, vol. 42, p. 27623.
Lu, A.-H., Salabas, E.L., and Schuth, F., Magnetic nanoparticles: synthesis, protection, functionalization, and application, Angew. Chem. Int. Ed., 2007, vol. 46, p. 1222.
Borchardt, L., Hasche, F., Lohe, M.R., Oschatz, M., Schmidt, F., Kockrick, E., Ziegler, C., Lescouet, T., Bachmatiuk, A., Büchner, B., Farrusseng, D., Strasser, P., and Kaskel, S., Transition metal loaded silicon carbide-derived carbons with enhanced catalytic properties, Carbon, 2012, vol. 50, p. 1861.
Huang, X., Xiao, X., Zhang, W., Fan, X., Zhang, L., Cheng, C., Li, S., Ge, H., Wang, Q., and Chen, L., Transition metal (Co, Ni) nanoparticles wrapped with carbon and their superior catalytic activities for the reversible hydrogen storage of magnesium hydride, Phys. Chem. Chem. Phys., vol. 19, p. 4019.
Kleibert, A., Passig, J., Meiwes-Broer, K.-H., Getzlaff, M., and Bansmann, J., Structure and magnetic moments of mass-filtered deposited nanoparticles, J. Appl. Phys., 2007, vol. 101, p. 114318.
Kumar, S., Kumar, S., Jain, S., and Verma, N.K., Magnetic and structural characterization of transition metal co-doped CdS nanoparticles, Appl Nanosci, 2012, vol. 2, p. 127.
Hu, Y., Ji, C., Wang, X., Huo, J., Liu, Q., and Song, Y., The structural, magnetic and optical properties of TMn@(ZnO)42 (TM = Fe, Co and Ni) heteronanostructure, Sci.Rep., 2017, vol. 7, p. 16485.
Wobbe, M.C.C. and Zwijnenburg, M.A., Chemical trends in the optical properties of rocksalt nanoparticles, Phys. Chem. Chem. Phys., 2015, vol. 17, p. 28892.
Ibrahim, E.M.M., Abu-Dief, A.M., Elshafaie, A., and Ahmed, A.M., Electrical, thermoelectrical and magnetic properties of approximately 20-nm Ni–Co–O nanoparticles and investigation of their conduction phenomena, Mater. Chem. Phys., 2017, vol. 192, p. 41.
Fan, D., Feng, J., Zhang, S., Lv, X., Gao, T., Xie, J., and Liu, J., Synthesis, structure, and magnetic properties of Ni and Co nanoparticles encapsulated by few-layer h-BN, J. Alloys Compd., vol. 689, p. 153.
Gual, A., Godard, C., Castillon, S., and Claver, C., Soluble transition-metal nanoparticles-catalysed hydrogenation of arenes, Dalton Trans., 2010, vol. 39, p. 11499.
Scholten, J.D., Leal, B.C., and Dupont, J., Transition metal nanoparticle catalysis in ionic liquids, ACS Catal., 2012, vol. 2, p. 184.
Willing, S., Lehmann, H., Volkmann, M., and Klinke, C., Metal nanoparticle film–based room temperature Coulomb transistor, Sci. Adv., 2017, vol. 3, p. 1603191.
Rao, C.N.R., Kulkarni, G.U., and Edwards P.P., Metal nanoparticles and their assemblies, Chem. Soc. Rev., 2000, vol. 29, p. 27.
Popova, A.N., Synthesis and characterization of iron-cobalt nanoparticles, J. Phys. Conf. Ser., 2012, p. 345.
Gusev, A.I. and Rempel, A.A., Nanocrystalline Materials: Monograph, Cambridge International Science Publishing, 2004. 357 p.
Гусев, А.И. Нанокристаллические материалы: методы получения и свойства, Екатеринбург: УрО РАН, 1998. 115 с. [Gusev, A.I., Nanocrystalline materials: methods of production and properties (in Russia), Ekaterinburg: Ural RAS, 1998. 115 p.]
Ершов, Б.Г. Наночастицы металлов в водных растворах: электронные, оптические и каталитические свойства. Рос. хим. журн. 2002. Т. 45. № 3. С. 20. [Ershov, B.G., Nanoparticles of metals in aqueous solutions: electronic, optical and catalytic. Russ. Chem. J. (in Russian), 2002, vol. 45, no. 3, p. 20.]
Ying, J. Yi-Ru, Nanostructured Materials: Monograph, Academic Press, 2001. 350 p.
Третьяков, Ю.Д. Процессы самоорганизации в химии материалов. Успехи химии. 2003. Т. 72. № 8. С. 731. [Tretyakov, Y.D., The self-assembly processes in the chemistry of materials, Russ. Chem. Rev., 2003, vol. 72, no 8, p. 651.]
Янилкин, В.В., Насретдинова, Г.Р., Кокорекин, В.А., Медиаторный электрохимический синтез наночастиц металлов. Успехи химии. 2018. Т. 87. № 11. С. 1080 [Yanilkin, V.V., Nasretdinova, G.R., and Kokorekin, V.A., Mediated electrochemical synthesis of metal nanoparticles, Russ. Chem. Rev., 2018, vol. 87, p. 1080.]
Yanilkin, V.V., Nasretdinova, G.R., Osin, Y.N., and Salnikov, V.V., Anthracene mediated electrochemical synthesis of metallic cobaltnanoparticles in solution, Electrochim. Acta, 2015, vol. 168, p. 82.
Khusnuriyalova, A.F., Petr, A., Gubaidullin, A.T., Sukhov, A.V., Morozov, V.I., Büchner, B., Kataev, V., Sinyashin, O.G., and Yakhvarov, D.G., Electrochemical generation and observation by magnetic resonance of superparamagnetic cobalt nanoparticles, Electrochim. Acta, 2018, vol. 260, p. 324.
Dunsch, L. and Petr, A., In situ ESR-Untersuchungen an elektrochemischen Systemen, Ber. Bunsenges, Phys. Chem., 1993, vol. 97, p. 436.
Iwasita, T. and Giordano, M.C., Kinetics of the bromine-tribromide redox processes on platinum electrodes in acetonitrile solutions, Electrochim. Acta, 1969, vol. 14, p. 1045.
Popov, A.I. and Geske, D.H., Studies on the chemistry of halogen and of polyhalides. XVI. Voltammetry of bromine and interhalogen species in acetonitrile, J. Amer. Chem. Soc., 1958, vol. 80, p. 1340.
Будникова, Ю.Г., Яхваров, Д.Г., Морозов, В.И., Каргин, Ю.М., Ильясов, А.В., Вяхирева, Ю.Н., Синяшин, О.Г. Электрохимическое восстановление комплексов никеля с 2,2'-бипиридилом. Журн. общ. химии. 2002. Т. 72. С. 184. [Budnikova, Yu.G., Yakhvarov, D.G., Morozov, V.I., Kargin, Yu.M., Il’yasov, A.V., Vyakhireva, Yu.N., and Sinyashin, O.G., Electrochemical reduction of nickel complexes with 2,2'-bipyridine, Russ. J. Gen. Chem., 2002, vol. 72, p. 168.]
Carter, M.T., Rodriguez, M., and Bard, A.J., Tris-chelated complexes of cobalt(III) and iron(II) with 1,10-phenanthroline and 2,2'-bipyridine, J. Amer. Chem. Soc., 1989, vol. 111, p. 8901.
Mun, J., Lee, M.-J., Park, J.-W., Oh, D.-J., Lee, D.-Y., and Doo, S.-G., Non-aqueous redox flow batteries with nickel and iron tris(2,2-bipyridine) complex electrolyte, Electrochem. Solid-State Lett., 2012, vol. 15, p. A80.
Buriez, O., Durandetti, M., and Perichon, J., Mechanistic investigation of the iron-mediated electrochemical formation of β-hydroxyesters from α-haloesters and carbonyl compounds, J. Electroanal. Chem., 2005, vol. 578, p. 63.
Дополнительные материалы отсутствуют.


