Электрохимия, 2020, T. 56, № 4, стр. 325-335
Влияние различных факторов на адсорбцию комплексов кукурбитурилов на границе электрод/раствор
Е. В. Стенина a, *, Л. Н. Свиридова a, **
a Московский государственный университет им. М.В. Ломоносова, Химический факультет
119992 Москва, Ленинские горы, 1, стр. 3, ГСП-1, Россия
* E-mail: slianan@mail.ru
** E-mail: estenina@yandex.ru
Поступила в редакцию 12.03.2019
После доработки 05.04.2019
Принята к публикации 12.09.2019
Аннотация
Обобщены данные исследований адсорбционных свойств комплексов кукурбитурилов СВ6, СВ7, СВ8 с неорганическими катионами (Na+, K+, Cs+), катионом органического красителя 3,3′-диэтил-тиокарбоцианин иодида и нейтральными органическими соединениями: адамантанолом-1 и ферроценом на границе электрод/раствор. Дан анализ влияния различных факторов на адсорбционное поведение изучаемых супрамолекулярных комплексов.
ВВЕДЕНИЕ
В последние годы наблюдается значительный рост числа исследований в области супрамолекулярной химии, химии соединений, сформированных нековалентными взаимодействиями, начало которым было положено фундаментальными работами нобелевского лауреата Ж.М. Лена [1]. Значительная часть работ этого направления связана с созданием и изучением свойств молекулярных кавитандов, объемных молекул, обладающих жестким каркасом и способных формировать инклюзивные комплексы различного типа. Среди этой группы соединений особое место занимает относительно новая группа молекулярных контейнеров семейства кукурбитурилов, напоминающих по форме тыкву (family cucurbitaceae). Первый представитель этой группы был синтезирован в 1905 г. [2], однако строение этих молекулярных контейнеров было установлено только в 1981 г. [3]. Молекулы этих соединений (СВns) сформированы из n гликольурильных фрагментов. К настоящему времени синтезированы молекулы этой группы с n 5–8, 10. Уникальная особенность строения этих молекул заключается в наличии гидрофобной внутримолекулярной полости и двух ее порталов, обрамленных карбонильными группами. Благодаря этому кукурбитурилы могут одновременно формировать инклюзивные комплексы с органическими соединениями путем их включения в полость молекулярного контейнера и комплексы с неорганическими катионами в результате их взаимодействия с карбонильными группами порталов. Эти уникальные свойства определяют все возрастающий интерес к изучению этой группы супрамолекул и перспективность их использования в области супрамолекулярной химии, фармакологии, биохимии, нанотехнологии. Результаты интенсивного исследования этого гомологического ряда кавитандов в последние годы отражены в нескольких обзорах [4–6].
До недавнего времени практически отсутствовали систематические исследования адсорбционного поведения соединений рассматриваемой группы на межфазных границах, как впрочем и супрамолекулярных соединений иного типа. В цикле выполненных нами исследований были получены данные по адсорбционным свойствам криптатных комплексов катионов на границе электрод/раствор [7]. В последние годы нами проводилось изучение комплексов кукурбитурилов СВ5–СВ8 с катионами и нейтральными органическими соединениями [8–11]. Целью данной публикации является обобщение полученных данных и анализ влияния различных факторов на адсорбционное поведение изучаемых супрамолекулярных комплексов на границе электрод/раствор.
МЕТОДИКА ЭКСПЕРИМЕНТА
Исследования проведены на электроде в виде стационарной Hg-капли путем измерения дифференциальной емкости электрода С в зависимости от потенциала Е с использованием потенциостата-гальваностата Autolab с FRA-программой (Eco Chemie Netherlands) при частоте f = 370 Гц и амплитуде переменного напряжения 1 мВ. Потенциал электрода изменялся с шагом 20 мВ. Ртутная капля с площадью поверхности 0.016 см2 (определенной по весу нескольких капель) формировалась на конце конусовидного капилляра с внутренним диаметром 80 мкм с использованием специальной установки, входящей в полярографический анализатор PA-3 (Czechoslovakia). Потенциалы рабочего электрода измерялись (и приведены в статье) относительно насыщенного каломельного электрода (нас. к. э.). Величины емкости регистрировались при выдержке рабочего электрода в течение t = 0–35 с при каждом значении Е после его установления. Кукурбит [7]урил (Aldrich), адамантанол-1 (Merk), ферроцен (Fluka), 3,3'-диэтилтиокарбоцианин иодид (SIGMA-ALDRICH) использовались без дополнительной очистки, Na2SO4, K2SO4, Cs2SO4 дважды перекристаллизованы и прокалены при 500°С, вода очищалась на установке Millipor, растворы деаэрировали аргоном высокой чистоты.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Исследование адсорбционных явлений на границе электрод/раствор проводили в системах, содержащих комплексы кукурбитурилов с неорганическими катионами (Na+, K+, Cs+), органическими соединениями: адамантанолом-1 (AdOH), ферроценом (Fc) и органическим красителем 3,3'-диэтилтиокарбоцианин иодидом (DECI). Среди множества органических соединений, формирующих инклюзивные комплексы с СВns, производные адамантана и ферроцена выделяются тем, что образуют исключительно прочные комплексы с СВ7. Так, константы комплексообразования (Ks) СВ7 с AdOH и гидроксиметилферроценом составляют 2.8 × 1010 М–1 [12] и 3.0 × 109 М–1 [13] соответственно (точное значение Ks для комплекса СВ7 с Fc неизвестно, но предполагается высоким). Для некоторых других производных адамантана и ферроцена константы комплексообразования с СВ7 достигают значений порядка 1014, 1015 М–1. Очевидно, что в исследуемых системах, где лиганд и формирующее с ним комплекс органическое соединение находятся в эквимолярных количествах, при таких значениях Ks в объеме раствора практически отсутствуют свободные молекулы лиганда. Ранее считалось, что столь высокие значения Ks при комплексообразовании за счет нековалентных взаимодействий достижимы лишь для высокомолекулярных (белковых) систем. Одним из самых ярких примеров такого рода является комплекс авидин–биотин, одна из прочнейших бимолекулярных систем, значение Ks для которой является экстраординарно высоким (≈1015 М–1) [12]. Для комплекса СВ7 с катионом красителя DEC+Ks = 2.8 × 104 М–1 [14]. В настоящее время значения Ks известны для всех кавитандов СВ5–СВ8 только для катиона Na+ [4, 15]. Наиболее прочным из этих комплексов является комплекс с СВ6 (lg Ks = 3.49), наименее прочным – с СВ5 (lg Ks = 1.85), для СВ7 и СВ8 эти величины равны 2.89 и 2.62 соответственно. Очевидно, что концентрация свободного лиганда СВn в исследуемых растворах определяется именно прочностью комплекса, и в случае наименее прочных комплексов присутствие молекул кавитанда при определенных условиях делает возможным их участие в формировании адсорбционного слоя.
В настоящее время неизвестно, происходит ли в случае комплексов СВ7 с AdOH и Fc одновременное комплексообразование с неорганическими катионами. Подобный процесс зафиксирован для комплексов СВ6 с некоторыми органическими красителями и небольшими органическими молекулами [16, 17]. В принципе вывод о протекании одновременного комплексообразования СВ7 с молекулами органических соединений и неорганическими катионами может быть сделан с использованием результатов импедансметрических измерений. Прежде всего этот вывод может базироваться на данных по расположению области потенциалов адсорбции, которая зависит от заряда адсорбирующейся частицы.
С,Е-зависимости были получены в 0.1 М растворах сульфатов натрия, калия и цезия в присутствии СВ6, СВ7, СВ8 в различных концентрациях, а также в 0.1 М Na2SO4 с различными эквимолярными концентрациями СВ7 с AdOH, Fc или DECI. Измерения проводились при противоположных направлениях развертки потенциала и при разных временах выдержки электрода при каждом потенциале после его установления. Типичные для изучаемых систем данные иллюстрируются на рис. 1 результатами, полученными для раствора 0.1 М Na2SO4 + 10–5 М СВ8 при разных временах выдержки электрода при каждом потенциале и противоположных направлениях развертки потенциала. Как и для других представителей этого гомологического ряда, при адсорбции СВ8 наблюдается необычно широкая область потенциалов адсорбции (~2 В), где значения С ниже, чем в растворе индифферентного электролита без добавки. Как известно, область потенциалов адсорбции нейтральных органических соединений на электродах обычно не превышает 1 В. В случае СВ8, как и для катионных комплексов других гомологов, предельные значения заполнения поверхности электрода органическими молекулами достигаются при предельно низких концентрациях добавки. Отличительной особенностью представленных на рис. 1 данных, наблюдавшейся для комплексов с неорганическими катионами и для других кукурбитурилов, является наличие на С,Е-зависимостях двух участков, что может свидетельствовать о формировании адсорбционных слоев различного строения. Область перехода между этими участками находится вблизи потенциала нулевого заряда электрода (ПНЗ) в растворе индифферентного электролита (–0.44 В). Это позволяет предположить, что изменение потенциала в этой области сопровождается определенными изменениями заряда адсорбирующихся частиц. Самая значительная часть области адсорбции (≈–1.85…–0.44 B) отвечает отрицательным зарядам поверхности электрода, что приводит к выводу об адсорбции в этом интервале потенциалов катионных комплексов кукурбитурилов.
Рис. 1.
С,Е-зависимости в растворе 0.1 М Na2SO4 в присутствии 5 × 10–6 M CB8, полученные при сканировании потенциала от отрицательных значений к положительным (а) и в противоположном направлении (б) при выдержке рабочего электрода при каждом значении Е в течение времени t, с: 1 – 0, 2 – 1, 3 – 3, 4 – 10, 5 – 15, 6 – 35 (а) и 1 – 0, 2 – 1, 3 – 3, 4 – 10, 5 – 35, 6 – 50 (б). На врезке: С,Е-зависимости в растворе 0.1 М Na2SO4 в присутствии 10–5 M CB8, полученные при сканировании потенциала в противоположных направлениях, t = 35 с. Пунктир – С,Е-зависимость в 0.1 М Na2SO4.
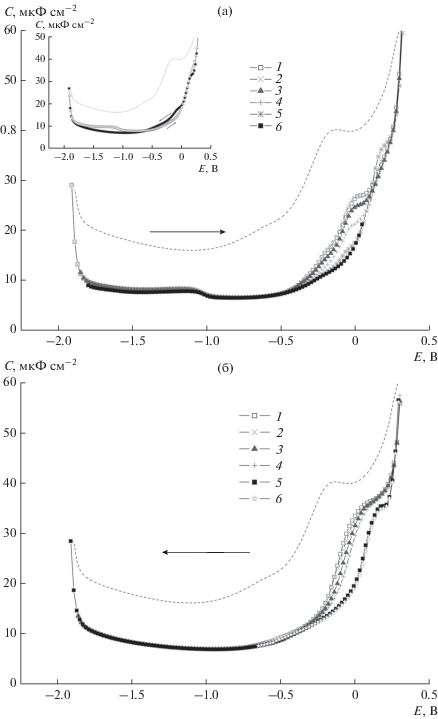
Положительный заряд комплексов должен препятствовать их адсорбции при положительных зарядах поверхности, однако в некоторых случаях положительная граница области адсорбции смещена относительно ПНЗ примерно на 0.7 В к положительным потенциалам. Это может быть объяснено возможным участием молекул кукурбитурила в образовании слоя адсорбата в этой области потенциалов.
Формирование адсорбционных слоев для систем, содержащих катионные комплексы СВns, в областях потенциалов, отвечающих различным участкам С,Е-зависимостей существенно различается. В области потенциалов, отвечающей отрицательным зарядам поверхности электрода, при адсорбции катионных комплексов кукурбитурилов практически не наблюдается зависимости емкости от концентрации комплексов, времени выдержки электрода при каждом потенциале и направления развертки потенциала. В области, отвечающей положительным зарядам поверхности электрода, подобные зависимости наблюдаются, что приводит к появлению гистерезиса (рис. 1а, врезка). В этой области наблюдается замедленное формирование адсорбционного слоя, что проявляется в постепенном снижении С при увеличении времени t, постоянные значения С достигаются как правило при значениях t порядка 20–30 с. Подобное замедление объясняется ингибированием при адсорбции положительно заряженной частицы на одноименно заряженном электроде и низкой концентрацией не участвующих в комплексообразовании молекул кавитанда, адсорбция которых в этой области предпочтительна благодаря наличию на порталах электроно-донорных карбонильных групп. При развертке в направлении отрицательных потенциалов в этой области фиксируется формирование ступенек на С,Е-зависимостях, что свидетельствует о наличии некоторых относительно устойчивых в узких областях потенциала структур в адсорбционном слое. При обратном направлении развертки подобные структуры формируются только при малых значениях t. В целом различия в свойствах и формировании адсорбционных слоев комплексов кукурбитурилов при противоположных направлениях развертки потенциала можно объяснить тем, что при сканировании к положительным потенциалам одновременно с десорбцией происходит перестройка ранее сформированного адсорбционного слоя, а при противоположном направлении развертки идет формирование слоя адсорбата одновременно с диффузионным подходом адсорбирующихся частиц из объема раствора. Обнаруженный для систем СВns + 0.1 M Me2SO4 (Me: Na+, K+, Cs+) эффект формирования адсорбционных слоев с разными свойствами в зависимости от области потенциалов приводит к очевидному выводу о невозможности описать всю совокупность экспериментальных данных с использованием одного набора параметров адсорбции. В связи с этим адсорбционные параметры находились для этих систем с использованием метода регрессионного анализа [18] отдельно для каждого из рассмотренных выше участков области потенциалов адсорбции.
При проведении расчетов использовались следующие независимые адсорбционные параметры: φm – потенциал максимальной адсорбции в рациональной шкале; ln Bm – логарифм константы адсорбционного равновесия при потенциале максимальной адсорбции; am – параметр межмолекулярного взаимодействия в адсорбционном слое при θ = θm; Сm – емкость при предельном заполнении поверхности адсорбатом и θ = θm; A = = RTΓm, где Γm– предельная поверхностная концентрация адсорбата при θ = 1, R и T – газовая постоянная и температура, а также некоторые коэффициенты, характеризующие изменения параметров a и Сm с потенциалом. Полученные адсорбционные параметры приведены в нескольких работах [8–11]. Анализ этих данных приводит к выводу о значительном различии этих величин для двух участков области адсорбции. Так, значения ln Bm для области отрицательных потенциалов в 1.5–2 раза выше, чем для положительной области, что может быть объяснено значительным вкладом электростатического взаимодействия. Параметры аттракционного взаимодействия также существенно различны для двух этих областей. Если для отрицательной области характерны положительные значения параметра a, что свидетельствует о притягательном взаимодействии частиц в адсорбционном слое, то в положительной области значения a близки к нулю или отрицательны. Значительно, почти в два раза, различаются для слоев адсорбатов, отвечающих двум разным участкам области адсорбции, значения предельной адсорбции Γm. Для положительной области эта величина отвечает практически полному заполнению поверхности и соответствует площади, занимаемой молекулой СВn при ориентации кислородными группами портала к поверхности электрода. Такая ориентация обнаружена при адсорбции СВns и их комплексов на незаряженных поверхностях некоторых металлов [19]. Для отрицательной области значение Γm примерно в два раза выше, что может быть объяснено формированием в этой области бислойного адсорбционного слоя. Подобный слой может быть сформирован за счет одновременного связывания двух кавитандов СВn катионом натрия, один из кавитандов при этом находится на поверхности электрода, а другой ориентирован в сторону раствора. Именно такая бислойная структура обнаружена на золоте в растворах СВ6 в присутствии катионов натрия [19].
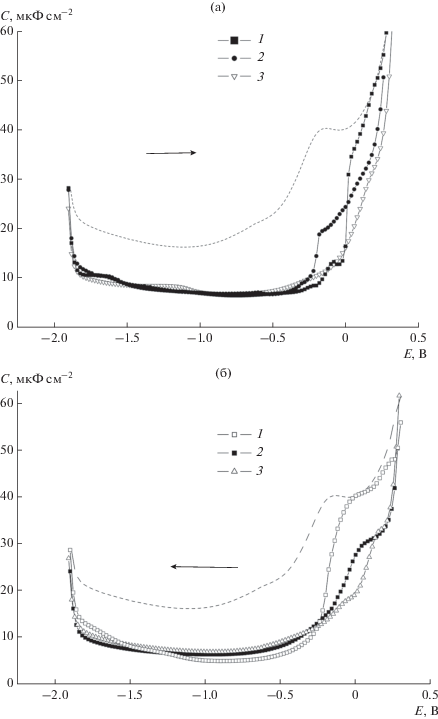
Представляет интерес сравнить экспериментальные данные, полученные для разных СВns с одинаковым катионом и для одного и того же СВn с разными катионами. На рис. 2 проведено сравнение С,Е-зависимостей для комплексов СВ6, СВ7 и СВ8 с катионом Na+. Очевидно, что в области отрицательных зарядов поверхности эти зависимости очень близки, а наибольшее расхождение наблюдается в области положительных ветвей С,Е-зависимостей, причем заметное расхождение между ними начинается вблизи ПНЗ. Как видно, область адсорбции комплекса СВ6 ⊂ Na+ меньше, чем для двух других комплексов, что объясняется значительно большей прочностью этого комплекса, как было указано выше. Это обусловливает существенно меньшую концентрацию свободного лиганда в растворе и, соответственно, практическую невозможность формирования смешанного адсорбционного слоя. Таким образом можно предположить, что скачкообразный подъем на С,Е-зависимости (рис. 2а) в растворе, содержащем комплекс СВ6 ⊂ Na+, отвечает десорбции именно этого комплекса. Следует отметить, что подобные скачкообразные изменения на С,Е-зависимостях при потенциалах адсорбции-десорбции характерны для соединений, образующих на электродах двумерные конденсированные слои [20]. Соответственно при обратной развертке потенциала снижение емкости в этом растворе (рис. 2б) происходит вследствие посадки на поверхность электрода также этого комплекса. Следует отметить, что значение С, отвечающее ступеньке на С,Е-зависимости для СВ6 ⊂ Na+, в два раза выше, чем для области более отрицательных потенциалов, что может быть объяснено двукратным уменьшением толщины слоя адсорбата. Области потенциалов адсорбции комплексов СВ7 и СВ8 шире за счет смещения ее положительной границы. В области, отвечающей положительным зарядам поверхности электрода, для этих комплексов наблюдается формирование ступенек на С,Е-зависимостях, что свидетельствует об образовании некоторых иных по структуре, чем в области отрицательных зарядов поверхности, адсорбционных слоев. Как уже было упомянуто выше, наиболее вероятным является предположение об участии в формировании слоя адсорбата при столь значительных положительных зарядах поверхности свободных молекул-лигандов.
Рис. 2.
С,Е- зависимости в растворах 0.1 М Na2SO4 в присутствии 10–5 M CBn, полученные при сканировании потенциала от отрицательных значений к положительным (а) и в противоположном направлении (б) при выдержке рабочего электрода при каждом значении Е в течение времени t = 35 с. 1 – CB6, 2 – CB7, 3 – CB8. Пунктир – С,Е-зависимость в 0.1 М Na2SO4.
Сопоставление данных для комплексов СВ6 ⊂ Na+ и СВ6 ⊂ K+ (рис. 3) свидетельствует, что области потенциалов адсорбции этих комплексов различны, причем для комплекса с более широкой областью наблюдается иная форма С,Е-зависимости в области положительных потенциалов с образованием характерных ступенек при относительно высоких значениях С. Как упоминалось выше, форма С,Е-зависимости в случае СВ6 ⊂ Na+ характерна для ПАОВ, образующих конденсированные адсорбционные слои. Таким образом, по форме С,Е-зависимостей и по расположению адсорбционной области можно делать качественные выводы о прочности катионного комплекса. Аналогичное сопоставление для катионных комплексов СВ7 представлено на рис. 4. Наряду с данными для комплексов неорганических катионов здесь представлены данные для инклюзивного комплекса СВ7 с катионом органического красителя DECI. Как и для ранее рассмотренных систем (рис. 2 и рис. 3), основные различия в адсорбционном поведении комплексов наблюдаются в области положительных зарядов поверхности. Наиболее поверхностно-активным в этой области является комплекс СВ7 ⊂ DEC+. Это может быть объяснено значительно меньшим влиянием электрического поля электрода на заряд катиона, инклюдированного в полость кавитанда. Высокая прочность этого комплекса также, как в случае СВ6 ⊂ Na+, приводит к скачкообразному изменению значений С при десорбции этого комплекса. Вероятно наименее прочным является комплекс СВ7 ⊂ Cs+, положительная ветвь С,Е-зависимости для которого наиболее растянута.
Рис. 3.
С,Е-зависимости в растворах 10–4 M CB6 в присутствии 0.1 М Na2SO4 (1) и 0.1 М K2SO4 (2), полученные при сканировании потенциала от отрицательных значений к положительным (а) и в противоположном направлении (б) при выдержке рабочего электрода при каждом значении Е в течение времени t = 30 с. Пунктир – С,Е-зависимость в 0.1 М Na2SO4.
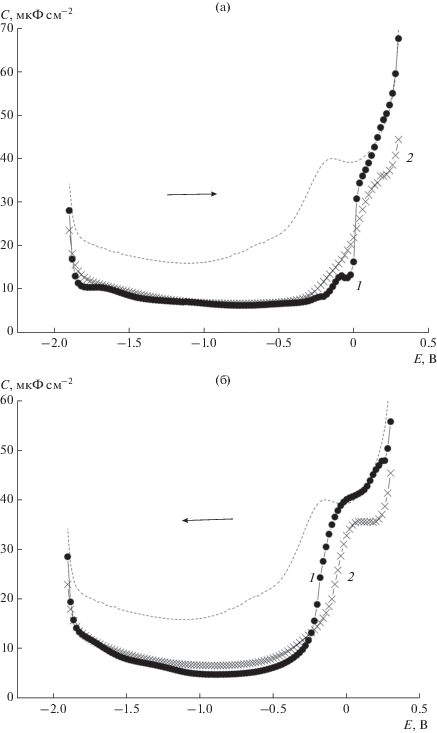
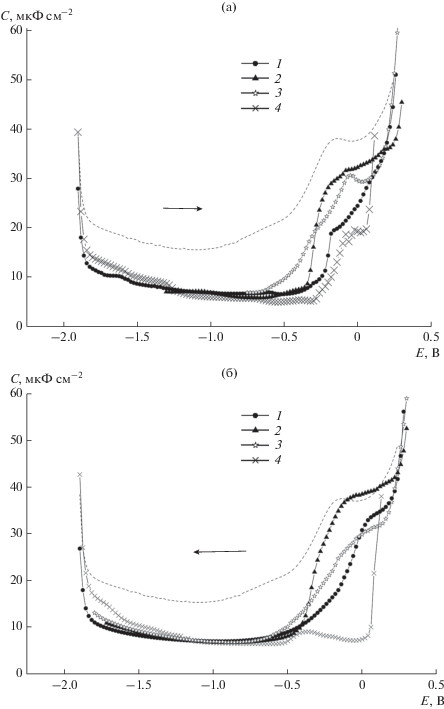
Рис. 4.
С,Е-зависимости в растворах 10–5 M CB7 в присутствии 0.1 М Na2SO4 (1), 0.1 М K2SO4 (2), 0.1 М Cs2SO4 (3) и в растворе 5 × 10–6 M CB7 в присутствии 0.1 М Na2SO4 + 5 × 10–6 M DEC (4), полученные при сканировании потенциала от отрицательных значений к положительным (а) и в противоположном направлении (б) при выдержке рабочего электрода при каждом значении Е в течение времени t = 30 с. Пунктир – С,Е-зависимость в 0.1 М Na2SO4.
Изучение электрохимического поведения систем, где одновременно возможно формирование комплекса кукурбитурила с нейтральным органическим веществом и катионом, до настоящего времени не проводилось. Нами изучены адсорбционные явления на границе электрод/раствор в растворе 0.1 М Na2SO4 в присутствии комплексов СВ7 с ферроценом и адамантанолом-1. Как упомянуто выше, эти соединения образуют с СВ7 чрезвычайно прочные комплексы. На рис. 5 и 6 представлены С,Е-зависимости, полученные для раствора 0.1 М Na2SO4 в присутствии эквимолярных количеств СВ7 и Fc (рис. 5) и СВ7 и AdOH-1 (рис. 6). Обнаруженные при изучении адсорбции в системе Na2SO4 + СВ7 + Fc основные закономерности близки к найденным ранее для комплексов СВns с катионом Na+: замедленность формирования адсорбционного слоя при положительных зарядах поверхности электрода, формирование в этой области некоторых промежуточных структур, эффекты гистерезиса. Можно таким образом полагать, что в изученной системе комплекс СВ7 ⊂ Fc, образованный путем включения Fc в гидрофобную полость СВ7, одновременно формирует комплекс с катионом Na+ за счет его взаимодействия с карбонильными группами порталов (так же, как это происходит в отсутствие Fc в системе). При этом при отрицательных и малых положительных зарядах поверхности адсорбционный слой формируется катионным комплексом СВ7 ⊂ Fc ⊂ Na+ , а с ростом положительного заряда в образовании адсорбционного слоя принимают участие нейтральные комплексы СВ7 ⊂ Fc.
Рис. 5.
С,Е-зависимости в растворах 0.1 М Na2SO4 в присутствии 10–5 M CB7 + 10–5 M Fc (1), 5 × 10–5 M CB7 + 5 × × 10–5 M Fc (2), 10–4 M CB7 + 10–4 M Fc (3), полученные при сканировании потенциала от отрицательных значений к положительным (а) и в противоположном направлении (б) при выдержке рабочего электрода при каждом значении Е в течение времени t = 30 с. На вставке: С,Е-зависимости в растворе 0.1 М Na2SO4 в присутствии 5 × 10–5 M CB7 + + 5 × 10–5 M Fc (t = 30 с), полученные при сканировании потенциала в противоположных направлениях. Пунктир – С,Е-зависимость в 0.1 М Na2SO4.
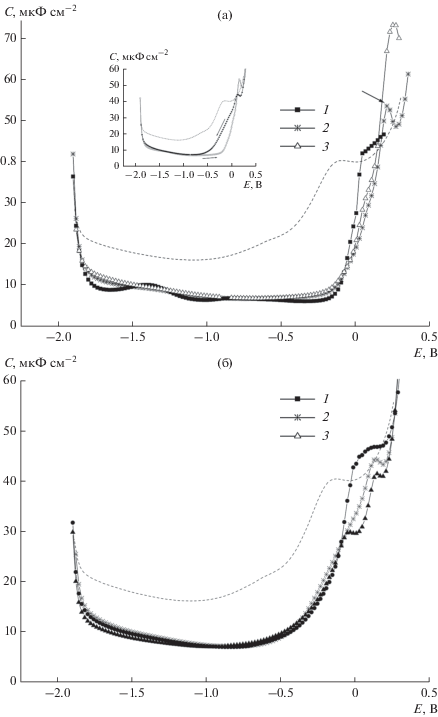
Рис. 6.
С,Е-зависимости в растворах 0.1 М Na2SO4 в присутствии: 2.5 × 10–4 M AdOH (1), 2.5 × 10–4 M CB7 (2), 2.5 × 10–4 M AdOH + 2.5 × 10–4 M CB7 (3). T = 35 с. Пунктир – С,Е-зависимость в 0.1 М Na2SO4.
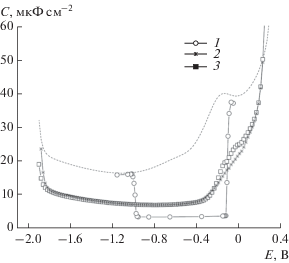
Данные рис. 6 наглядно иллюстрируют эффект формирования комплекса СВ7 с AdOH-1. Как видно (рис. 6, кривая 1) при отсутствии в системе кавитанда на электроде формируется прочный конденсированный слой из молекул AdOH-1, о чем свидетельствуют типичные особенности С,Е-зависимости, основными из которых являются резкие скачки емкости на границах области адсорбции, свидетельствующие о фазовом переходе в адсорбционном слое. Как видно, при добавлении в систему эквимолярного количества кавитанда отвечающие двумерной конденсации эффекты полностью исчезают вследствие практически полного включения молекул AdOH-1 в состав прочнейшего комплекса. Данный рисунок позволяет также наглядно сопоставить типичную для нейтральных органических веществ область потенциалов адсорбции и превышающую ее практически в два раза область потенциалов для изучаемых супрамолекулярных комплексов. Общий вывод, который следует из этих данных, заключается в том, что из растворов 0.1 М Na2SO4, содержащих эквимолярные количества СВ7 и Fc или СВ7 и AdOH-1, безусловно имеет место адсорбция на электроде катионных комплексов. Прежде всего об этом свидетельствует практическое совпадение областей потенциалов адсорбции в растворах 0.1 М Na2SO4 + СВ7 в присутствии и в отсутствие Fc и AdOH-1. Таким образом, очевидно, что присутствие инклюдированной в полость кавитанда нейтральной органической молекулы практически не отражается на способности кавитанда формировать комплексы с неорганическими катионами за счет их взаимодействия с карбонильными группами порталов.
ЗАКЛЮЧЕНИЕ
Результаты проведенного исследования свидетельствуют, что супрамолекулярные комплексы, образующиеся в растворах, содержащих сульфаты щелочных металлов (0.1 М) и кавитанды ряда кукурбитурилов, обладают высокой поверхностной активностью и адсорбируются на электроде в очень широкой области потенциалов. Установлено, что при противоположных зарядах поверхности электрода формируются адсорбционные слои различной структуры и свойств. В области отрицательных потенциалов адсорбционный слой имеет бислойную структуру. В области положительных зарядов поверхности вероятно образуется смешанный адсорбционный слой. Поскольку в формировании этого слоя должны участвовать свободные молекулы кавитанда, то все факторы, которые влияют на концентрацию этих молекул (прочность комплекса, концентрация электролита) должны оказывать существенное влияние на адсорбционные явления. Включение в полость кавитанда нейтральных органических молекул не препятствует одновременному образованию комплекса с неорганическими катионами. Очевидно, что в случае инклюзивных комплексов с органическими катионами картина должна кардинально измениться.
Список литературы
Lehn, J.M., Cryptate Inclusion Complexes, Effects on Solute-Solute and Solute-Solvent Interaction and on Ionic Reactivity, Pure & Appl. Chem., 1980, vol. 52, p. 2303.
Behrend, R., Meyer, E., and Rusche, F., Ueber Condensationsproducte aus Glicoluril und Formaldehyd, Justus Liebigs Ann. Chem., 1905, vol. 339, p. 1.
Freeman, W.A., Mock, W.L., and Shih, N.-Y., Cucurbituril, J. Amer. Chem. Soc., 1981, vol.103, p.7367.
Masson, E., Ling, X., Joseph, R., Kyeremeh-Mensah, L., and Lu, X., Cucurbituril chemistry: atale of supramolecular success, RSC Adv., 2012, vol. 2, p. 1213.
Assaf, Kh.I. and Nau, W.M., Cucurbiturils: from synthesis to high-affinity binding and catalysis, Chem. Soc. Rev., 2015, vol. 44, p. 394.
Герасько, О.А., Коваленко, Е.А., Федин, В.П. Макроциклические кавитанды кукурбит[n]урилы: перспективы применения в биохимии, медицине и нанотехнологиях. Успехи химии. 2016. Т. 85. С. 795. [Gerasko, O.A., Kovalenko, E.A., and Fedin, V.P., Macroscopic cavitands cucurbit[n]urils: perspectives of application in biochemistry, medicine and nanotechnologies, Russ. Chem. Rev., 2016, vol. 85, p. 795.]
Стенина, Е.В., Свиридова, Л.Н., Стенин, В.Ф. Монослои супрамолекулярных криптатных комплексов на межфазной границе электрод/раствор. Росс. хим. журн. 2016. Т. LX. С. 40. [Stenina, E.V., Sviridova, L.N., and Stenin, V.F., Monolayers of Supramolecular Cryptate Complexes at the Electrode/Solution Interface, Russ. J. General Chem., 2018, vol. 88(12), p. 2708.]
Stenina, E.V. and Sviridova, L.N., Characteristics of the cucurbit[5]uril adsorption layer on the electrode/solution interface, Mendeleev Commun., 2015, vol. 25, p. 59.
Stenina, E.V., Sviridova, L.N., and Ivanov, D.A., Adsorption of cucurbit[6]uril on the electrode/solution interface, Mendeleev Commun., 2016, vol. 26, p. 410.
Стенина, Е.В., Свиридова, Л.Н., Петров, Н.Х. Адсорбционные явления в системах, содержащих макроциклический кавитанд кукурбит[7]урил. Электрохимия. 2017. Т. 53. С. 114. [Stenina, E.V., Sviridova, L.N., and Petrov, N.Kh., Adsorption phenomena in the systems containing macrocyclic cavitand cucurbit[7]uryl, Russ. J. Electrochem., 2017, vol. 53, p. 103.]
Stenina, E.V., Sviridova, L.N., and Petrov, N.Kh., Properties of cucurbit[8]uril adsorption layer on the electrode/solution interface, Mendeleev Commun., 2018, vol. 28, p. 281.
Moghaddam, S., Yang, Ch., Rekharsky, M., Ko, Y. Ho., Kim, K., Inoue, Y., and Gilson, M.K., New ultrahigh affinity host-guest complexes of cucurbit[7]uril with bicyclo[2.2.2] octane and adamantane guests: thermodynamic analysis and evaluation of M2 affinity calculations, J. Amer. Chem. Soc., 2011, vol. 133, p. 3570.
Lu, C., Gadde, S., Li, W., and Kaifer, A.E., Electrochemistry of the inclusion complexes formed between the cucurbit[7]uril host and several cationic and neutral ferrocene derivatives, Langmuir, 2009, vol. 25, p. 13763.
Petrov, N.Kh., Ivanov, D.A., Golubkov, D.V., Gromov, S.P., and Alfimov, M.V., The effect of cucurbit[7]uril on photophysical properties of aqueous solution of 3,30-diethylthiacarbocyanine iodide dye, Chem. Phys. Lett., 2009, vol. 480, p. 96.
Bushmann, H.-J., Cleve, E., Jansen, K., Wego, A., and Schollmeyer, E., Complex formation between cucurbit[n]urils and alkali, alkaline earth and ammonium ions in aqueous solution, J. Inclusion Phenomena and Macrocyclic Chem., 2001, vol. 40, p. 117.
Ong, W. and Kaifer, A.E., Salt effects on the apparent stability of the of cucurbit[7] uril-methyl Viologen inclusion complex, J. Organomet. Chem., 2004, vol. 69, p. 1383.
Marquez, C., Hudgins, R.R., and Nau, W.M., Mechanism of host-guest complexation by cucurbituril, J. Amer. Chem. Soc., 2004, vol. 126(18), p. 5806.
Дамаскин, Б.Б., Сафонов, В.А., Батурина, О.А. Статистический метод определения адсорбционных параметров для простых органических веществ из неравновесных кривых дифференциальной емкости. Электрохимия. 1997. Т. 33. С. 117. [Damaskin, B.B., Safonov, V.A., and Baturina, O.A., Statistical Method of Determining Adsorption Parameters for Simple Organic Compounds from Nonequilibrium Differential Capacitance Curves, Russ. J. Electrochem., 1997, vol. 33, p. 105.]
Blanco, E., Quintana, C., Hernandez, L., and Hernandez, P., Atomic force microscopy study of new sensing platforms: cucurbit[n]uril (n = 6, 7) on gold, Electroanalysis, 2013, vol. 25, p. 263.
Stenina, E.V. and Damaskin, B.B., Some properties of two-dimensional condensed layers formed by some terpenoids and adamantine derivatives at the mercury/electrolyte interface, J. Electroanal. Chem., 1993, vol. 349, p. 31.
Дополнительные материалы отсутствуют.


