Электрохимия, 2020, T. 56, № 4, стр. 347-355
Кинетика индуцированного осаждения пленок на основе тетракис(4-аминофенил)порфирина
С. М. Кузьмин a, b, *, С. А. Чуловская a, В. И. Парфенюк a, c
a Институт химии растворов им. Г.А. Крестова РАН
153045 Иваново, ул. Академическая, 1, Россия
b Ивановский государственный энергетический университет
153003 Иваново, ул. Рабфаковская, 34, Россия
c Ивановский государственный химико-технологический университет
153000 Иваново, просп. Шереметевский, 7, Россия
* E-mail: smk@isc-ras.ru
Поступила в редакцию 19.02.2019
После доработки 22.04.2019
Принята к публикации 19.08.2019
Аннотация
В настоящей работе подтверждено формирование поверхностных пленок 5,10,15,20-тетракис(4-аминофенил)порфирина (H2T(4-NH2Ph)P) в диметилсульфоксиде в области потенциалов электровосстановления кислорода. Изучена кинетика изменения фарадеевских токов и характеристик межфазной границы при потенциалах рабочего электрода +0.5 В (электроокисление порфирина), ‒0.9 В (электровосстановление кислорода) и –1.25 В (совместное восстановление порфирина и кислорода). Показано, что при потенциале +0.5 В происходит пассивация поверхности рабочего электрода и быстрое снижение фарадеевских токов. При потенциалах –0.9 и –1.25 В пассивация поверхности рабочего электрода менее выражена. При анализе спектров электродного импеданса продемонстрировано, что в отличие от электроокислительных условий (+0.5 В) в электровосстановительных условиях (–0.9 и –1.25 В) на поверхности электрода формируется пленка, перенос заряда через которую можно охарактеризовать, моделируя импеданс межфазной границы. Кинетика изменения характеристик межфазной границы позволяет судить о стадийности формирования пленки и структурных перестройках формирующегося слоя.
ВВЕДЕНИЕ
Современный этап развития химии макрогетероциклических соединений характеризуется успехами в области синтеза порфиринов [1, 2], возрастающим интересом к изучению их физических и химических свойств [3], а также к вопросам практического применения материалов на их основе [4, 5]. Специфические особенности соединений порфиринового ряда, такие как высокая термическая и химическая стабильность макроцикла, возможность сформировать устойчивые комплексы с различными металлами, осуществимость изменения окислительного состояния центрального атома металла, превосходные хромофорные свойства π-сопряженной системы макроцикла, разнообразное супрамолекулярное поведение, высокая биосовместимость и др., делают этот класс соединений привлекательным для решения многих прикладных задач. В частности, высокая биосовместимость порфиринов позволяет рассматривать тетрафенилпорфирины как перспективные препараты для фотодинамической терапии рака [6, 7] и как возможный антиоксидантный агент [8–13]. Развитие методов формирования полифункциональных пленочных материалов на основе порфиринов [14] актуально для создания катализаторов [15], сенсоров [16], преобразователей электромагнитного излучения [17], электронных устройств [18] и др. Метод электрохимического осаждения отличается простотой аппаратурного оформления и позволяет получать хорошо воспроизводимые пленки контролируемой толщины. При этом, в случае аминофенилпорфиринов формирование пленки возможно как в результате полимеризации, вызванной электрохимическим окислением прекурсора [19–28], так и в результате взаимодействия порфирина с синтезируемым электрохимически супероксид анион-радикалом (${\text{O}}_{2}^{{\centerdot - }}$) [29–31].
Безметальный H2T(4-NH2Ph)P (рис. 1) можно рассматривать в качестве простейшего представителя гомологического ряда аминофенилпорфиринов. Поэтому детальное исследование процесса электрополимеризации данного порфирина представляется важным как для развития метода инициированного ${\text{O}}_{2}^{{\centerdot - }}$ электроосаждения пленок, так и для анализа влияния структуры прекурсора на процесс формирования пленок и их свойства.
Рис. 1.
Структура H2T(4-NH2Ph)P и нормированные спектры поглощения раствора порфирина в ДМСО, длина оптического пути 1 см (кривая 1); поли-H2T(4-NH2Ph)P-пленка (кривая 2), осажденная в потенциостатических условиях (–0.9 В относительно Hg/Hg2Cl2).
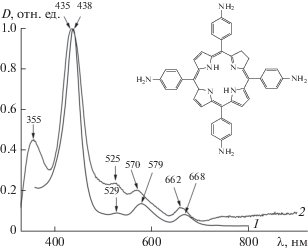
В настоящей работе процесс электрохимического осаждения полипорфириновой пленки изучен методом спектроскопии электродного импеданса в потенциостатических условиях при потенциалах, соответствующих электрохимическому окислению порфирина, электрохимическому восстановлению растворенного кислорода и совместному восстановлению порфирина и кислорода. Показано, что при потенциалах электроокисления порфирина происходит пассивации поверхности электрода, в то время как в электровосстановительных условиях на поверхности электрода формируется пленка (рис. 1, кривая 2), перенос заряда через которую можно охарактеризовать, моделируя импеданс межфазной границы.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
H2T(4-NH2Ph)P ситезирован методом восстановления тетранитрофенилпорфирина, который с высоким выходом получен конденсацией бензальдегидов с пирролом [32, 33]. Хроматографически очищенный H2T(4-NH2Ph)P исследован методами спектрометрии (Avantes АvaSpec-2048-2, Bruker Vertex 80), тонкослойной хроматографии, ЯМР спектроскопии (Bruker AVANCE-500).
5,10,15,20-тетракис(4-аминофенил)порфирин (H2T(4-NH2Ph)P):
Rf = 0.36; (1 : 2 гексан : ацетон); 1H NMR (500 MHz; DMSO-d6; Me4Si): δH, ppm –2.75 (2H, s), 5.58 (8H, s), 7.01,(8H, d, J = 7.5 Hz), 7.86 , (8H, d, J = 7.5 Hz), 8.88 ppm (8H, s); UV-VIS λmax, nm (logε): 437(5.25), 528(4.24), 578(4.41), 667(4.21).
Комплекс физико-химических исследований демонстрирует соответствие характеристик синтезированного аминофенилпорфирина (рис. 1) литературным данным [33].
В работе использовали 1 × 10–3 М растворы H2T(4-NH2Ph)P в диметилсульфоксиде (ДМСО) (>99.5%, Aldrich), содержащие 0.02 М тетрабутил-аммония перхлората (TBAP) в качестве фонового электролита. Растворы готовили весовым методом (“Sartorius” ME215S, Германия). Электрохимические исследования проводили в бездиафрагменной трехэлектродной электрохимической ячейке. В качестве рабочего электрода использовали отполированный торец платинового стержня диаметром 2.5 мм, запрессованного во фторопластовую втулку. В качестве электрода сравнения использовали каломельный электрод Hg/Hg2Cl2, Cl– (1 М LiCl) с капилляром Луггина, в качестве вспомогательного – диск ∅20 мм из платинированной платины. Перед каждым измерением активную поверхность рабочего электрода механически полировали до зеркального блеска, обезжиривали спиртом, выдерживали в хромовой смеси, тщательно промывали дистиллированной водой, затем ополаскивали исследуемым раствором и погружали в ячейку. Рабочий раствор насыщали кислородом в течение 30 мин. Режим естественной конвекции устанавливался через 3 мин после извлечения трубки из раствора. Во время эксперимента газ пропускали над раствором. Спектроскопию электродного импеданса осуществляли при помощи аппаратного комплекса, состоящего из измерителя импеданса Solartron 1260A и потенциостата Solartron 1287А (Великобритания). Амплитуда синусоидального измерительного напряжения составляла величину 10 мВ в диапазоне частот от 10–1 до 105 Гц. Результаты анализировали с использованием программ ZView2 и CView3.10.
При кинетических исследованиях методом электродного импеданса эксперимент включал в себя следующие этапы: 1) измерение характеристик импеданса при заданном потенциале рабочего электрода; 2) потенциостатическую поляризацию рабочего электрода в течение 600 с; 3) повторение этапов 1 и 2 заданное количество раз.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В присутствии кислорода в растворах порфирина наблюдаются RedOx-процессы в виде откликов тока на циклической вольтамперограмме (ЦВА-кривой) и изменения параметров эквивалентной схемы для импеданса межфазной границы. В частности, для раствора H2T(4-NH2Ph)P в ДМСО с естественной аэрацией наблюдается совпадение потенциалов RedOx-откликов на вольтамперограмме с потенциалами максимумов емкости двойного электрического слоя (ДЭС) (рис. 2), рассчитанной в рамках модели Рэндлса–Эршлера [34]. Это позволяет определить потенциалы, при которых исследование кинетики формирования полипорфириновой пленки в потенциостатическом режиме будет наиболее информативно.
Рис. 2.
Сопоставление потенциалов RedOx-откликов раствора H2T(4-NH2Ph)P в условиях естественной аэрации (кривая 1) и зависимости псевдоемкости ДЭС (кривая 2) от потенциала рабочего электрода, рассчитанной на основании спектроскопии электродного импеданса. Скорость сканирования потенциала при записи ЦВА составляла 20 мВ/с.
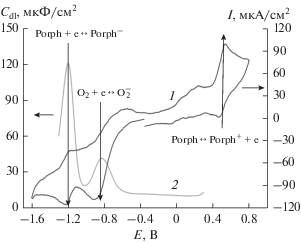
В случае H2T(4-NH2Ph)P в диапазоне потенциалов от –1.6 до +0.8 В области наиболее эффективного протекания RedOx-процессов следующие (относительно Hg/Hg2Cl2):
1. Электроокисление порфирина Porph ↔ ↔ Porph+ + е (вблизи +0.5 В).
2. Электровосстановление кислорода О2 + е ↔ ↔ ${\text{O}}_{2}^{ - }$ (вблизи –0.9 В).
3. Электровосстановление порфирина Porph + + е ↔ Porph– (вблизи –1.25 В).
Следует отметить, что при потенциале –1.25 В второй и третий процессы протекают совместно.
При наблюдении кинетики формирования пленки в потенциостатическом режиме, мониторинг тока электрохимического процесса измерений чередовался с импедансными измерениями. Информацию о среднем токе (при длительности процесса 10 мин) получали делением прошедшего через систему заряда к длительности потенцио-статического режима. Полученные токи приводили к безразмерному виду, находя отношение среднего тока на данном отрезке времени к среднему току, протекающему через систему при данном потенциале на первом шаге потенциостатического исследования (I/I10). Величина I10 составила 0.83, 1.49 и 2.02 мкА для потенциалов +0.5, ‒0.9 и –1.25 В соответственно. В условиях электрохимического окисления порфирина при потенциале +0.5 В наблюдается быстрое снижение тока процесса. Зависимости безразмерного тока от времени t (рис. 3) достаточно хорошо аппроксимируются функцией вида y = yо + Aexp(–t/τ), где yo – относительный ток при времени эксперимента, стремящемуся к бесконечности; А – амплитуда изменения относительного тока за время эксперимента; τ – характеристическое время изменения относительного тока.
Рис. 3.
Кинетика изменения относительного тока в потенциостатических условиях при потенциалах, В: +0.5 (1); –0.9 (2); –1.25 (3).
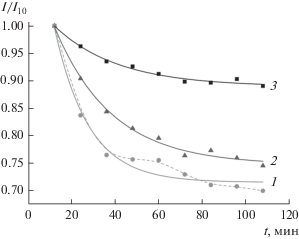
Параметры аппроксимации для потенциалов +0.5, –0.9, –1.25 В представлены в табл. 1. Для потенциала +0.5 В зависимость относительного тока от времени имеет ступенчатый характер: первый этап снижения тока заканчивается при временах около 30 мин, второй наблюдается в промежутке 60–80 мин. Этим объясняется более низкое значение коэффициента корреляции R при аппроксимации зависимости экспоненциальной функцией при этом потенциале.
Таблица 1.
Параметры аппроксимации кинетических зависимостей изменения относительного тока
| Параметры аппроксимации | Потенциал | ||
|---|---|---|---|
| 0.5 В | –0.9 В | –1.25 В | |
| yo | 0.72 | 0.75 | 0.89 |
| A | 0.60 | 0.39 | 0.17 |
| τ, мин | 15.70 | 26.38 | 29.26 |
| R | 0.98 | 0.99 | 0.99 |
| Q, мКл | 5.40 | 9.50 | 12.90 |
Анализируя зависимости относительного тока от времени, следует отметить, что в случае диффузионно-контролируемого процесса спад тока пропорционален t–0.5 [35]. Другой тип зависимости позволяет предположить, что причиной изменения тока с течением времени являются не диффузионные процессы. Другим фактором, влияющим на ток электрохимического процесса, может быть изменение концентрации электроактивного компонента в процессе электролиза. Для процесса, проведенного при +0.5 В, единственным электроактивным компонентом является порфирин. За время потенциостатической поляризации рабочего электрода в окислительных условиях перенесено 5.4 мКл, что значительно меньше общего содержания электроактивного материала в ячейке Qтот = nFcV, где n – число электронов переносимых в электрохимической стадии процесса, F – число Фарадея, c – концентрация порфирина в растворе, V – объем электрохимической ячейки. В предположении n = 1, Qтот составляет около 96.5 мКл, что не позволяет связывать спад тока с изменением содержания электроактивного материала в ячейке. В случае электровосстановительных условий электроактивными компанентами являются кислород и порфирин. При этом концентрация кислорода в растворе во время осаждения пленки близка к постоянной вследствие пропускания газа над раствором.
Таким образом, анализ зависимостей относительного тока от времени позволяет предположить, что наиболее вероятной причиной снижения тока в условиях выполненного эксперимента является формирование пассивирующей пленки на поверхности электрода. Спектроскопия электродного импеданса подтверждает это предположение.
Диаграммы Найквиста имеют характерный вид (рис. 4) для протекания электрохимической реакции с диффузией электроактивных частиц к межфазной границе.
Рис. 4.
Изменение диаграмм Найквиста для потенциалов +0.5 В (а); –0.9 В (б); –1.25 В (в) и диаграмм Боде для потенциала –0.9 В (г) при осаждении пленки. На вставках высокочастотная часть диаграмм Найквиста при соответствующих потенциалах.
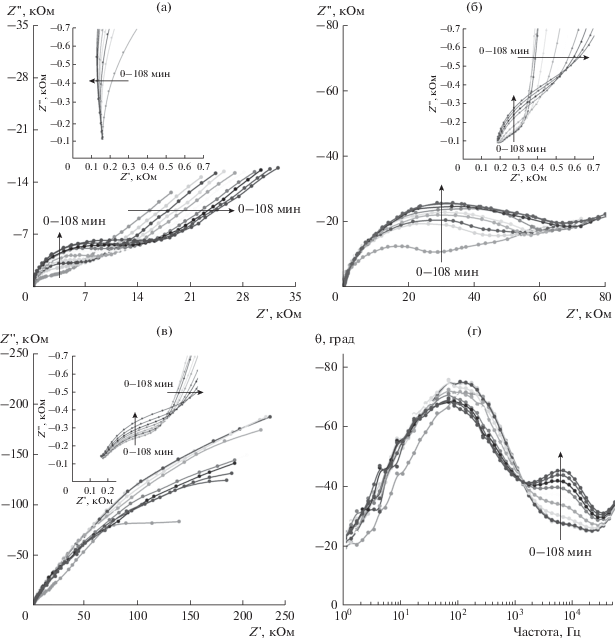
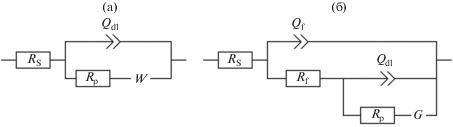
Для моделирования экспериментальных данных, полученных при потенциале +0.5 В, использовали эквивалентную схему Рэндлса–Эршлера (рис. 5а), где Rs – объемное сопротивление электролита, Qdl – элемент постоянной фазы, описывающий емкостные свойства межфазной границы, Rp – сопротивление переносу заряда на межфазной границе, W – диффузионный элемент Варбурга.
Рис. 5.
Эквивалентные электрохимические схемы в случае: протекания электрохимической реакции на электроде (а); электрохимического осаждения поли-H2T(4-NH2Ph)P-пленок (б). Расшифровка обозначений в тексте.
Изменение с течением времени диаграмм Найквиста и параметров модели характеризуют эволюцию состояния межфазной границы при формировании пленки.
Элемент Q представляют соотношением (1) [36]:
где A – предэкспоненциальный частотно независимый множитель; n – показатель степени, определяющий характер частотной зависимости (–1 < < n < 1); i – мнимая единица; ω = 2πf – круговая частота. Элемент Q характеризует импеданс емкостного типа при величине n, близкой к 1, и импеданс диффузионного типа при n около 0.5. Элемент Варбурга с конечным объемом диффузии W представляют соотношением (2): где Rdif – сопротивление диффузионного массопереноса, B – характеристическое время диффузионного переноса, р – безразмерный показатель степени, который может принимать значения от 0 до 1. В случае переноса электроактивных частиц между двумя параллельными однородными границами величина р близка к 0.5. Если р ≠ 0.5, следует предположить более сложный процесс диффузионного переноса, например диффузию к неоднородной поверхности [37].При потенциалах –1.25 и –0.9 В диаграммы Найквиста приобретают вид элемента полуокружности большего диаметра, длина наклонной части годографа уменьшается (рис. 4б, 4в). Это указывает на большее влияние кинетических ограничений в области отрицательных потенциалов, чем в области положительных потенциалов. При потенциалах –1.25 и –0.9 В в высокочастотной области годографа (рис. 4г, вставка на рис. 4б, 4в) с течением времени формируется элемент полуокружности, характеризующий перенос заряда в поверхностной пленке. Эквивалентная схема (рис. 5б) для моделирования состояния межфазной границы при потенциалах рабочего электрода –0.9 и –1.25 В включает в себя элементы Qf и Rf, характеризующие перенос заряда через формирующуюся пленку. Индуцированное ${\text{O}}_{2}^{{\centerdot - }}$ электрохимическое осаждение пленки предполагает осложнение диффузионного переноса супероксида в объем раствора протеканием химической реакции на поверхности электрода. Согласно [29–31], супероксид анион-радикал взаимодействует с порфирином, что приводит к образованию радикальной формы порфирина и запускает радикальный механизм полимеризации. Поэтому массоперенос моделировали элементом Геришера G (рис. 5б) [38]:
где Y – предэкспоненциальный частотно независимый множитель, k – константа скорости химической реакции.Для потенциала –1.25 В полученные диаграммы Найквиста в области низких частот образуют две группы кривых (рис. 4г), что указывает на скачкообразное изменение параметров электрохимического процесса при этом потенциале.
Как показывают результаты моделирования, предлагаемые эквивалентные схемы устойчиво сходятся к одному и тому же набору расчетных параметров при варьировании начального приближения и аппроксимируют экспериментальные данные (рис. 4) с приемлемыми статистическими показателями (χ2 критерий около 10–3). При этом во всех расчетах параметр n имеет величину близкую к 1 (см. сопроводительные материалы), что позволяет считать величину параметра Аdl приблизительно равной емкости ДЭС. При потенциале +0.5 В емкость ДЭС уменьшается с течением времени, а сопротивление переноса заряда на межфазной границе Rp возрастает (рис. 6а, 6б). В результате электрохимического процесса Rp возрастает в течение ∼30 мин приблизительно в 2.5 раза, затем стабилизируется. Длительность периода возрастания Rp совпадает с длительностью первого этапа снижения фарадеевского тока (рис. 2). Емкость ДЭС снижается приблизительно в 1.5 раза в течение 70 мин. Такие изменения параметров межфазной границы могут быть объяснены пассивацией поверхности рабочего электрода в результате электрохимического окисления поверхности электрода [39] и (или) блокированием поверхности тонкой полипорфириновой пленкой.
Рис. 6.
Изменение характеристик межфазной границы в условиях потенциостатической поляризации рабочего электрода при потенциалах, В: +0.5 (1), –0.9 (2) и –1.25 В (3) относительно Hg/Hg2Cl2, Cl–-электрода сравнения: а – емкость ДЭС, б – сопротивление переноса заряда через межфазную границу, в – сопротивление поверхностной поли-H2T(4-NH2Ph)P-пленки, г – константа скорости сопутствующей химической реакции.
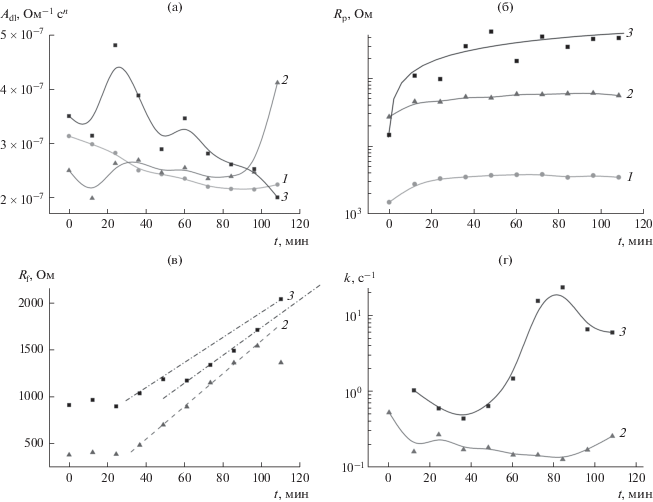
В электровосстановительных условиях (потенциалы –0.9 и –1.25 В) ток фарадеевского процесса заметно выше (рис. 2), несмотря на более высокое значение величины сопротивление переноса заряда на межфазной границе Rp (рассчитанной в рамках модельных представлений). Это объясняется меньшим вкладом диффузионных ограничений в протекание электродного процесса благодаря более высокому значению коэффициента диффузии молекул кислорода [9] и изменением поверхностной концентрации электроактивных частиц вблизи поверхности электрода вследствие протекания химического процесса. В начальный период формирования пленки (∼0–25 мин) наблюдается тенденция к возрастанию емкости межфазной границы (рис. 6а) и возрастанию сопротивления Rp (рис. 6б) при незначительном изменении сопротивления поверхностного слоя Rf (рис. 6в). Мы полагаем, что в этот промежуток времени происходит формирование островковой полипорфириновой пленки. При временах более 30 мин наблюдается тенденция к уменьшению ёмкости ДЭС, сопротивление поверхностной пленки Rf возрастает. Такие изменения могут быть связаны с образованием сплошной пленки и постепенным возрастанием ее толщины. Зависимости сопротивления Rf от времени имеют достаточно длительные линейные участки (рис. 6в). Изломы на линейных участках зависимости Rf от времени совпадают с моментами возрастания емкости ДЭС (рис. 6а), сопровождаются снижением поляризационного сопротивления Rp (рис. 6б), заметным изменением константы скорости сопутствующей химической реакции k (рис. 6г). В случае осаждения пленки при потенциале –1.25 В излом на зависимости Rf наблюдается при временах около 60 мин. Мы полагаем, что при этих временах происходит изменение состояния пленки, возможно, ее растрескивание.
Существенные различия параметров процесса формирования пленки при потенциалах –0.9 и ‒1.25 В позволяют предположить участие аниона порфирина в механизмах осаждения пленки [40, 41] и, по-видимому, образование аддуктов анионной формы порфирина с молекулярным кислородом [42] и продуктами химических реакций, протекающих при индуцированном супероксид анион-радикалом осаждении пленки [29–31].
Список литературы
Smith, K.M., Development of porphyrin syntheses, New J. Chem., 2016, vol. 40, p. 5644.
Hiroto, S., Miyake, Y., and Shinokubo, H., Synthesis and Functionalization of Porphyrins through Organometallic Methodologies, Chem. Rev., 2017, vol. 117, p. 2910.
Korolev, V.V., Lomova, T.N., Ramazanova, A.G., Korolev, D.V., and Mozhzhukhina, E.G., Phthalocyanine-based Molecular Paramagnets. Effect of double-decker structure on magnetothermal properties of gadolinium complexes, J. Organomet. Chem., 2016, vol. 819, p. 209.
Wang, K., Qi, D., Li, Y., Wang, T., Li, H., and Jiang, J., Tetrapyrrole macrocycle based conjugated two-dimensional mesoporous polymers and covalent organic frameworks: From synthesis to material applications, Coord. Chem. Rev., 2019, vol. 378, p. 188.
Ломова, Т.Н. Аксиально координированные металлопорфирины в науке и практике, М.: Красанд, 2018. 704 с. [Lomova, T., Axially coordinated metal porphyrins in science and applications (in Russian), Moscow: Krasand, 2018. 704 p.]
Kou, J., Dou, D., and Yang, L., Porphyrin photosensitizers in photodynamic therapy and its applications, Oncotarget, 2017, vol. 8, p. 81591.
Gomes, A.T.P.C., Neves, M.G.P.M.S., and Cavaleiro, J.A.S., Cancer, Photodynamic Therapy and Porphyrin-Type Derivatives, An. Acad. Bras. Ciênc., 2018, vol. 90, p. 993.
Kuzmin, S.M., Chulovskaya, S.A., and Parfenyuk, V.I., Mechanism and superoxide scavenging activity of hydroxy substituted tetraphenylporphyrins via coulometric approach, J. Electroanal. Chem., 2016, vol. 772, p. 80.
Kuzmin, S.M., Chulovskaya, S.A., and Parfenyuk, V.I., Substituent position influence on the electrochemical properties and antioxidant activity of tetra(aminophenyl)porphyrins, J. Porphyrins Phthalocyanines, 2014, vol. 18, p. 585.
Kuzmin, S.M., Chulovskaya, S.A., and Parfenyuk, V.I., The coulometric approach to the superoxide scavenging activity determination: The case of porphyrin derivatives influence on oxygen electroreduction, J. Porphyrins Phthalocyanines, 2015, vol. 19, p. 1053.
Kuzmin, S.M., Chulovskaya, S.A., and Parfenyuk, V.I., Hydroxyalkyloxy substituted tetraphenylporphyrins: Mechanism and superoxide scavenging activity, J. Porphyrins Phthalocyanines, 2016, vol. 20, p. 1477.
Kuzmin, S.M., Chulovskaya, S.A., and Parfenyuk, V.I., Estimation of antioxidant activity of tetrakis(p‑aminophenyl)porphine regard to superoxide ions by voltammetry method, Macroheterocycles, 2013, vol. 6, p. 334.
Kuz’min, S.M., Chulovskaya, S.A., Tesakova, M.V., Semeikin, A.S., and Parfenyuk, V.I., Substituted tetraphenylporphyrins as promising molecular systems with high antioxidant activity, Macroheterocycles, 2014, vol. 7, p. 218.
Kuzmin, S.M., Chulovskaya, S.A., and Parfenyuk, V.I., Structures and properties of porphyrin-based film materials part I. The films obtained via vapor-assisted methods, Adv. Colloid Interface Sci., 2018, vol. 253, p. 23.
Zhang, W., Lai, W., and Cao, R., Energy-Related Small Molecule Activation Reactions: Oxygen Reduction and Hydrogen and Oxygen Evolution Reactions Catalyzed by Porphyrin- and Corrole-Based Systems, Chem. Rev., 2017, vol. 117, p. 3717.
Paolesse, R., Nardis, S., Monti, D., Stefanelli, M., and Di Natale, C., Porphyrinoids for Chemical Sensor Applications, Chem. Rev., 2017, vol. 117, p. 2517.
Attia, A.A., El-Barry, A.M.A., EL-Shazly, E.A.A., and El-Deen, L.M.D., Studies on structural and optical properties of thermally evaporated nanocrystalline thinfilms of meso-Tetraphenylporphyrin manganese(III) chloride, J. Lumin., 2018, vol. 199, p. 391.
Jurow, M., Schuckman, A.E., Batteas, J.D., and Drain, C.M., Porphyrins as Molecular Electronic Components of Functional Devices, Coord. Chem. Rev., 2010, vol. 254, p. 2297.
Bettelheim, A., White, B.A., Raybuck, S.A., and Murray, R.W., Electrochemical polymerization of amino-, pyrrole-, and hydroxy-substituted tetraphenylporphyrins, Inorg. Chem., 1987, vol. 26, p. 1009.
Bedioui, F., Devynck, J., and Bied-Charreton, C., Immobilization of metalloporphyrins in electropolymerized films: design and applications, Acc. Chem. Res., 1995, vol. 28, p. 30.
Pailleret, A. and Bedioui, F., N4-Macrocyclic Metal Complexes, J.H. Zagal, F. Bedioui, J.-P. Dodelet, Eds., New York, Springer Science+Business Media, 2006, p. 363-438.
Li, G., Bhosale, S., Tao, S., Guo, R., Bhosale, S., Li, F., Zhang, Y., Wang, T., and Fuhrhop, J.-H., Very stable, highly electroactive polymers of zinc(II)-5,15-bisthienylphenyl porphyrin exhibiting charge-trapping effects, Polymer, 2005, vol. 46, p. 5299.
Durantini, J., Otero, L., Funes, M., Durantini, E.N., Fungo, F., and Gervaldo, M., Electrochemical oxidation-induced polymerization of 5,10,15,20-tetrakis[3-(N-ethylcarbazoyl)]porphyrin. Formation and characterization of a novel electroactive porphyrin thin film, Electrochim. Acta, 2011, vol. 56, p. 4126.
Schaming, D. and Ruhlmann, L., Electrochemistry of N4 Macrocyclic Metal Complexes, vol. 2: Biomimesis, Electroanalysis and Electrosynthesis of MN4 Metal Complexes, Zagal, J.H. and Bedioui, F., Eds., Springer International Publishing, 2016, p. 395-432.
Тесакова, М.В., Шейнин, В.Б., Парфенюк, В.И. Физико-химические свойства электропроводящей пленки на основе тетракис(пара-аминофенил)порфина. Журн. физ. химии. 2014. Т. 88. С. 338. [Tesakova, M.V., Sheinin, V.B., and Parfenyuk, V.I., Physicochemical Properties of an Electroconductive Film Based on Tetrakis(para-aminophenyl)porphyrine, Russ. J. Phys. Chem. A, 2014, vol. 88, p. 325.]
Tesakova, M.V., Semeikin, A.S., and Parfenyuk, V.I., Electroconductive films based on amino-substituted tetraphenylporphyrins and their metal copper complexes, J. Porphyrins Phthalocyanines, 2016, vol. 20, p. 793.
Kuzmin, S.M., Chulovskaya, S.A., Tesakova, M.V., Semeikin, A.S., and Parfenyuk, V.I., Solvent and electrode influence on electrochemical forming of poly-Fe(III)-aminophenylporphyrin films, J. Porphyrins Phthalocyanines, 2017, vol. 21, p. 555.
Кузьмин, С.М., Чуловская, С.А., Парфенюк В.И. Влияние анодного потенциала на процесс образования поли-порфириновой пленки в растворах тетракис(пара-аминофенил)порфина в дихлорметане. Электрохимия. 2014. Т. 50. С. 480. [Kuzmin, S.M., Chulovskaya, S.A., and Parfenyuk, V.I., Effect of anodic potential on process of formation of polyporphyrin film in solutions of tetrakis(p-aminophenyl)porphin in dichloromethane, Russ. J. Electrochem., 2014, vol. 50, p. 429.]
Kuzmin, S.M., Chulovskaya, S.A., and Parfenyuk, V.I., Superoxide-assisted electrochemical deposition of Mn-aminophenyl porphyrins: Process characteristics and properties of the films, Electrochim. Acta, 2018, vol. 292, p. 256.
Kuzmin, S.M., Chulovskaya, S.A., Koifman, O.I., and Parfenyuk, V.I., Poly-porphyrin electrocatalytic films obtained via new superoxide-assisted electrochemical deposition method, Electrochem. Commun., 2017, vol. 83, p. 28.
Kuzmin, S.M., Chulovskaya, S.A., and Parfenyuk, V.I., Electrochemically synthesized superoxide anion radical as an activator of electrodeposition of polyporphyrin films, Mendeleev Comm., 2017, vol. 27, p. 470.
Semeikin, A.S., Koifman, O.I., and Berezin, B.D., Synthesis of tetraphenylporphins with active groups in the phenyl rings. 1. Preparation of tetrakis(4-aminophenyl)porphin, Chem. Heterocycl. Compd., 1982, vol. 18, p. 1046.
Ormond, A.B. and Freeman, H.S., Effects of substituents on the photophysical properties of symmetrical porphyrins, Dyes and Pigments, 2013, vol. 96, p. 440.
Sluyters-Rehbach, M., Impedances of electrochemical systems: Terminology, nomenclature and representation – Part I: Cells with metal electrodes and liquid solutions (IUPAC Recommendations 1994), Pure Appl. Chem., 1994. vol. 66. p. 1831.
Bard, A.J. and Faulkner, L.R., Electrochemical methods: fundamentals and applications, 2nd edition, John Wiley & Sons, 2001. 864 p.
Стойнов, З.Б., Графов, Б.М., Саввова-Стойнова, Б.С., Елкин, В.В. Электрохимический импеданс, М.: Наука, 1991. 336 с. [Stoinov, Z.B., Grafov, B.M., Savvova-Stoinova, B.S., Electrochemical impedance (in Russian), Moscow: Nayka, 1991. 336 p.].
Pajkossy, T. and Nyikos, L., Diffusion to fractal surfaces—II. Verification of theory, Electrochim. Acta., 1989, vol. 34, p. 171.
Impedance Spectroscopy: Theory, Experiment, and Applications, Barsoukov, E. and Macdonald, J.R., Eds, John Wiley & Sons, 2018. 560 p.
Huang, Yi-F., Kooyman, P.J., and Koper, M.T.M., Intermediate stages of electrochemical oxidation of single-crystalline platinum revealed by in situ Raman spectroscopy, Nat. Commun., 2016, vol. 7, p. 12440.
Kariuki, J.K. and McDermott, M.T., Formation of Multilayers on Glassy Carbon Electrodes via the Reduction of Diazonium Salts, Langmuir, 2001, vol. 17, p. 5947.
Chira, A., Bucur, B., and Radu G.-L., Electrodeposited Organic Layers Formed from Aryl Diazonium Salts for Inhibition of Copper Corrosion, Materials, 2017, vol. 10, p. 235.
Samanta, S., Das, K.P., Chatterjee, S., Sengupta, K., Mondal, B., and Dey, A., O2 Reduction Reaction by Biologically Relevant Anionic Ligand Bound Iron Porphyrin Complexes, Inorg. Chem., 2013, vol. 52, p. 12963.
Дополнительные материалы отсутствуют.


