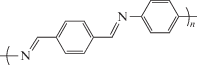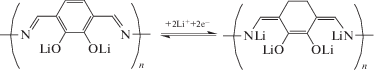Электрохимия, 2020, T. 56, № 4, стр. 336-346
Синтез и исследование дилитиевых солей полигидрохинонов с азометиновыми группами в качестве катодов для литий-органических аккумуляторов
А. Ф. Шестаков a, b, И. К. Якущенко a, А. А. Слесаренко a, П. А. Трошин a, c, О. В. Ярмоленко a, *
a Институт проблем химической физики РАН
142432 Московская обл., Черноголовка, просп. академика Семенова, 1, Россия
b Московский государственный университет им. М.В. Ломоносова,
факультет фундаментальной физико-химической инженерии
119991 Москва, Ленинские горы, 1, стр. 51, ГСП-1, Россия
c Сколковский институт науки и технологии, Сколковский инновационный центр
121205 Москва, ул. Нобеля, 3, Россия
* E-mail: oyarm@icp.ac.ru
Поступила в редакцию 25.01.2019
После доработки 14.03.2019
Принята к публикации 14.08.2019
Аннотация
Разработаны и охарактеризованы лабораторные макеты литиевых источников тока с органическими электродными материалами на основе двух дилитиевых солей полигидрохинонов с азометиновыми группами и исходного основания Шиффа для сравнения. Поли[3,6-бис(иминометилфенилен-1,2-диол)дилитий] и поли[3-(иминометил)-6-метилимино-N-(1-фенил-4-диил)бензол-1,2-диолдилитий] были синтезированы и изучены впервые. С помощью квантовохимического моделирования рассчитаны энергии присоединения атомов лития для данных структур, которое может осуществляться как к атому азота азометиновой группы, так и к атому кислороду карбонильной группы. Экспериментально показано, что лучшим по характеристикам емкости и стабильности работы в течение 90 циклов является полимер поли[3,6-бис(иминометилфенилен-1,2-диол) дилитий], который имел первоначальную емкость 140 мА ч/г в диапазоне циклирования 0.7–4.1 В отн. Li+/Li, что делает его перспективным катодным материалом для литиевых аккумуляторов.
ВВЕДЕНИЕ
Соединения с азометиновыми группами или основания Шиффа (R1HC=NR2) известны с середины 19-го века. Классические синтетические методы, описанные для получения азометиновых полимеров, основаны на реакциях поликонденсации [1–3], но существуют и другие методы синтеза [4].
Полиазометины можно отнести к малоисследованному классу органических веществ с точки зрения их использования в качестве электродов для литиевых и натриевых аккумуляторов. В последнее время интерес к данным веществам возрос, и появились работы и патенты по синтезу новых соединений данного класса и их использованию как в качестве активного материала электрода [5–12] или полимерного связующего [13], так и добавки в жидкий электролит [14].
Электрохимическая активность оснований Шиффа обусловлена наличием двойных связей C=N. Из ранних полярографических исследований ароматических оснований Шиффа следует, что эта активность проявляется при низких потенциалах относительно лития или натрия [15, 16]. Поэтому возможно, что данный класс соединений может выступать в качестве анодов. В работах [17, 18] были синтезированы и исследованы олигомерные основания Шиффа с карбоксилатными концевыми группами, которые являются электрохимически активными материалами при потенциалах ниже 1.2 В отн. Na+/Na. Их практическая емкость достигает 340 мА ч г–1, что делает их потенциальными анодными материалами для Na-ионных аккумуляторов.
В работе [19] исследовано основание Шиффа – сопряженный поли[N,N'-p-(бензилиден)-p-фенилендиамин] (полимер Р1, схема 1 ). Полимер P1 показал электрохимическую активность при потенциале ниже 1 В отн. Na+/Na, и его емкость около 180 мА ч–1 оставалась почти постоянной в течение 25 циклов заряда–разряда [19].
Схема 1 . Структура P1.
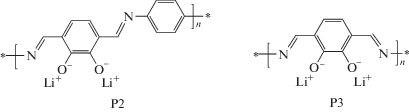
Можно ожидать, что за счет введения в основание Шиффа функциональных групп, а именно карбонильных, произойдет увеличение его сродства к электрону, что позволит его использовать в качестве катодного активного материала. Такие работы нам не известны, и в настоящей статье мы сообщаем о способе синтеза новых полимеров P2 и P3, представляющих собой литиевые соли дигидроксипроизводных оснований Шиффа (схема 2 ), и результатах их электрохимического исследования. Теоретическая емкость, рассчитанная на 2e для P1, P2 и P3, равна 260, 214 и 308 мА ч г–1 соответственно.
Схема 2 . Структуры P2 и P3.
P2 и P3 являются продуктами полного литирования окисленной ортохиноновой формы. В структурах Р2 и P3 возникают, в отличие от Р1, хелатные узлы, благоприятные для координации ионов лития. О синтезе соединения Р3 было сообщено в 1973 г. в работе [20], где исследовались его электропроводящие свойства. В настоящее время большие макроциклические лиганды, содержащие структуру Р3 в качестве фрагмента, активно изучаются с целью создания различных функциональных материалов [21–29].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы и приборы
Все исходные химические соединения и растворители были приобретены у Sigma-Aldrich и использовались в том виде, в котором они были получены. Элементный анализ проводили на элементном анализаторе CHNS/O “Vario Micro cube” Elementar GmbH (Германия). ИК-спектры были записаны с помощью прибора Perkin Elmer Spectrum BX 100 (США). Температуру плавления измеряли с помощью прибора BOETHIUS PHMK 05 (Германия). СЭМ-изображения образцов полимеров получали с помощью сканирующего автоэмиссионного электронного микроскопа ZEISS LEO SUPRA 25 (Германия).
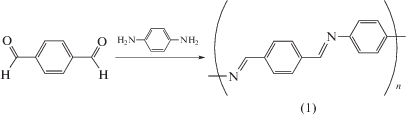
Синтез полимера P1 – поли[N,N'-p-(бензилиден)- p-фенилендиамина] (1)
Для синтеза Р1 в качестве исходного вещества использовали терефталевый альдегид, который при реакции с p-фенилендиамином давал конечный продукт (схема 3 ).
Схема 3 . Получение поли[N,N'-p-(бензилиден)-p-фенилендиамина] (1).
К раствору 0.6 г (4.5 мМ) терефталевого альдегида в 15 мл ледяной уксусной кислоты прибавляли раствор 0.48 г (4.5 мМ) p-фенилендиамина в 10 мл уксусной кислоты. Смесь перемешивали 3 ч при 70°С. Полученный осадок отфильтровывали, промывали на фильтре 100 мл воды, а затем обрабатывали в аппарате Сокслета последовательно метанолом и ацетоном (20 и 30 ч, соответственно). Целевой продукт сушили в вакууме над P2O5. Выход продукта 0.82 г (88% от теоретического).
Элементный анализ. Найдено, %: С 79.69; H 5.03; N 12.70. Брутто формула C14H10N2.
Вычислено, %: C 81.30; H 4.91; N 13.54.
ИК-спектр, см–1: 2917; 2875; 2854; 1699; 1623;1485; 1409; 1361; 1310; 1274; 1187; 1108; 1016; 968; 853; 563.
Синтез полимеров P2 и P3
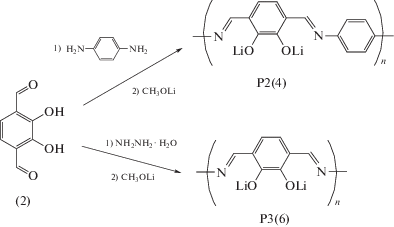
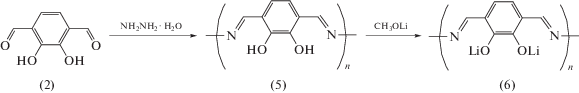
Для синтеза Р2 и Р3 в качестве исходного вещества использовался пирокатехин, из которого в результате реакций алкилирования и окисления был получен 2,3-дигидрокси-1,4-диформилбензол по методике [30]. Далее при конденсации этого промежуточного продукта с p‑фенилендиамином или гидразином с последующей обработкой метилатом лития были получены Р2 (4) и Р3 (6), соответственно (схема 4 ). Более подробный 2‑стадийный синтез полимера Р3 приведен на схеме 5 .
Схема 4 . Общая схема синтеза полимеров P2 и P3.
Синтез полимера P2 – поли[3-(иминометил)- 6-метилимино-N-(1-фенил-4-диил) бензол- 1,2- диолдилитий] (4)
Стадия 1. Поли[3-(иминометил)-6-метилимино-N-(1-фенил-4-диил) бензол-1,2 диол] (3). К раствору 0.332 г (2 мМ) соединения (2) в 4 мл AcOH прибавляли раствор 0.216 г (2 мМ) p-фенилендиамина в 4 мл AcOH. Реакционную смесь нагревали при перемешивании до 85–90°С в течение 5 ч и после охлаждения к ней прибавляли равный объем воды. Осадок неочищенного полимера (3) отфильтровывали и последовательно промывали водой (30 мл), метанолом (30 мл), ацетоном (30 мл). Порошок (3) дважды перемешивали с 25 мл ТГФ, каждый раз 3 ч, а затем экстрагировали в аппарате Сокслета сначала метанолом (6 ч), затем ацетоном (6 ч) и сушили в вакууме над P2O5. Получили 0.42 г целевого продукта (3). Выход 88.2% от теоретического. Вещество не плавится до 350°С.
Элементный анализ. Найдено, %: С 66.80; H 4.59; N 10.46. Брутто формула C14H10N2O2.
Вычислено,%: С 62.18; H 4.20; N 11.76; O 20.17.
ИК-спектр, см–1: 1612, 1546, 1489, 1435, 1297, 1201, 1002, 865, 843, 785.
Стадия 2. Поли[3-(иминометил)-6-метилимино-N-(1-фенил-4-диил)бензол-1,2-диолдилитий] (4). К 20 мл безводного MeOH прибавляли 70 мг гидрида лития (получили раствор, содержащий 8.75 × 10–3 моль метилата лития). К этому раствору прибавляли 380 мг соединения (3). Смесь перемешивали при комнатной температуре 24 ч, отфильтровывыли осадок, промывали его 50 мл безводного метанола, сушили в вакууме над P2O5, затем 7 ч в вакууме при 150–170°С. Получили 330 мг целевого продукта (4).
Элементный анализ. Найдено, %: С 62.74; H 4.12; N 10.60. Брутто формула C14H8N2O2Li2 ∙ H2O.
Вычислено, %: С 62.69; H 3.73; N 10.45; O 17.91; Li 5.22.
ИК-спектр, см–1: 1611, 1543, 1450, 1298, 1197, 1113, 865, 833, 789.
Синтез полимера P3 – поли[3,6-бис(иминометилфенилен-1,2-диол)дилитий] (6)
Схема 5 . Синтез полимера P3.
Стадия 1. Поли[3,6-бис(иминометилфенилен-1,2-диол] (5). К раствору 1.53 г (9.2 × 10–3 М) соединения (2) в 40 мл безводной AcOH, нагретому до 50°С, прибавляли по каплям раствор 0.46 г (9.2 × 10–3 М) гидразингидрата, растворенного в 3 мл AcOH. По окончании прибавления реагентов смесь нагревали до 70°С и выдерживали при этой температуре 7 ч. Затем смесь охлаждали до 20°С, отфильтровывали осадок полимера, промывали его на фильтре последовательно 20 мл AcOH, 35 мл метанола и сушили на воздухе. Неочищенный осадок перемешивали 8 ч с 50 мл диметилформамида, отделяли осадок, экстрагировали его 8 ч метанолом в аппарате Сокслета, а затем столько же – ацетоном. Соединение (5) сушили в вакууме над P2O5. Выход количественный. Вещество не плавится до 360°С.
Элементный анализ. Найдено, %: С 56.50; H 4.18; N 15.79. Брутто формула C8H6N2O2 · 0.5 H2O.
Вычислено, %: С 62.18; H 4.20; N 11.76; O 20.17.
ИК-спектр, см-1: 1616, 1546, 1429, 1286, 1228, 1184, 958, 838, 727.
Стадия 2. Поли[3,6-бис(иминометилфенилен-1,2-диол)дилитий] (6). В 30 мл безводного MeOH растворяли в инертной атмосфере 300 мг гидрида лития. К полученному раствору (содержит 0.0375 М метилата лития) прибавляли 0.95 г соединения (5) и смесь перемешивали при комнатной температуре 8 ч, отфильтровывали осадок, экстрагировали его метанолом в аппарате Сокслета, затем сушили в вакууме над P2O5 при комнатной температуре, затем дополнительно 4 ч в вакууме при 150–170°С. Получили 0.93 г соединения (6).
Элементный анализ. Найдено, %: С 48.92; H 3.84; N 13.31. Брутто формула C8H4N2O2Li2 · H2O.
Вычислено, %: С 50.00; H 3.13; N 14.58.
ИК-спектр, см–1: 1608, 1519, 1444, 1290, 1228, 958, 838, 779.
Данные сканирующей электронной микроскопии (СЭМ) порошков целевых продуктов представлены на рис. 1.
Из рис. 1 видно, что размер частиц данных порошков отличается друг от друга. Вид частиц сопряженного основания Шиффа P1 отличается от P2 и P3, причем P2 образует агломераты до 7–8 мкм в диаметре, а размер сферических частиц P3 составляет всего 2–3 мкм.
Изготовление и тестирование прототипов литий-органических аккумуляторов
Макеты литий-органических аккумуляторов собирали в виде ламинированных пакетов. Состав катода: 45 мас. % полимера P1 (P2, P3), 50 мас. % токопроводящей сажи (Timical Super C65) и 5 мас. % полимерного связующего поливинилидендифторида (ПВДФ) марки Kynarflex HSV 900, Arkema France. Все компоненты диспергировали в N-метилпирролидоне (99%, Aldrich) для получения суспензии, содержащей ~12% сухого вещества по весу, которая была механически гомогенизирована (Isolab – Homogenizer – Light Duty) в течение 10 мин, а затем обработана ультразвуком (SONOPULS HD 3200, 100 Вт) в течение 10 с. Катодную суспензию наносили на Al-токосъемник (фольга 20 мкм) и сушили при 120°С в вакууме. Органический катод (1.5 × 1.5 см) массой 3–4 мг и литиевый анод (1.5 × 1.5 см) собирали в ламинированные пакеты с использованием полипропиленового сепаратора (Celgard 2325, 25 мкм) и заливали 0.2 мл жидкого электролита 1 M LiPF6 в ЭК/ДМК (1/1). Сборку прототипов аккумуляторов проводили в аргоновом перчаточном боксе MBraun (Германия) с использованием вакуумного упаковщика Henkelman Minijambo (Голландия) для герметизации корпуса.
Электрохимические характеристики ячеек определяли с использованием потенциостата P-8 (Elins, Россия) и системы тестирования аккумуляторов BTS-5V10mA (Neware Technology Ltd., Китай) методами циклической вольтамперометрии и гальваностатического заряд-разрядного циклирования.
Квантовохимическое моделирование
Квантовохимическое моделирование проводили методом функционала плотности РВЕ (Perdew–Burke–Ernzerhof) [31] с использованием псевдопотенциала SBK (Stevens–Bash–Krauss) [32] и расширенного базисного набора C, N, O: [5s, 5p, 2d/3s, 3p, 2d], Li: [4s, 1p/2s, 1p], H: [5s, 1p/3s, 1p] для валентных оболочек. Все расчеты проводились с использованием программного комплекса “ПРИРОДА” [33].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На первом этапе работы было исследовано окислительно-восстановительное поведение всех трех материалов в собранных литий-органических ячейках методом циклической вольтамперометрии (ЦВА). Результаты экспериментов и расчетов приведены на рис. 2. Расчет зависимости разности потенциалов от количества присоединенного лития проводили аналогично статье [19], путем последовательного суммирования количества электричества dq = Idt за единичный интервал времени dt (1 шаг линейной развертки потенциала со скоростью 1 мВ/с соответствовал t = 50 с). С учетом массы активного вещества катода m и теоретической емкости С единичного звена полимера интегральное число атомов лития в материале катода на одно звено равно n = ΣIdt/mC.
Рис. 2.
ЦВА ячеек Li//органический катод, где (а) P1, (б) P2 и (в) P3. Скорость развертки потенциала 0.1 мВ с–1. Рядом даны расчетные графики зависимости потенциала от количества присоединенных ионов Li+ и электронов в течение данных циклов для P1 (а*), P2 (б*) и P3 (в*).
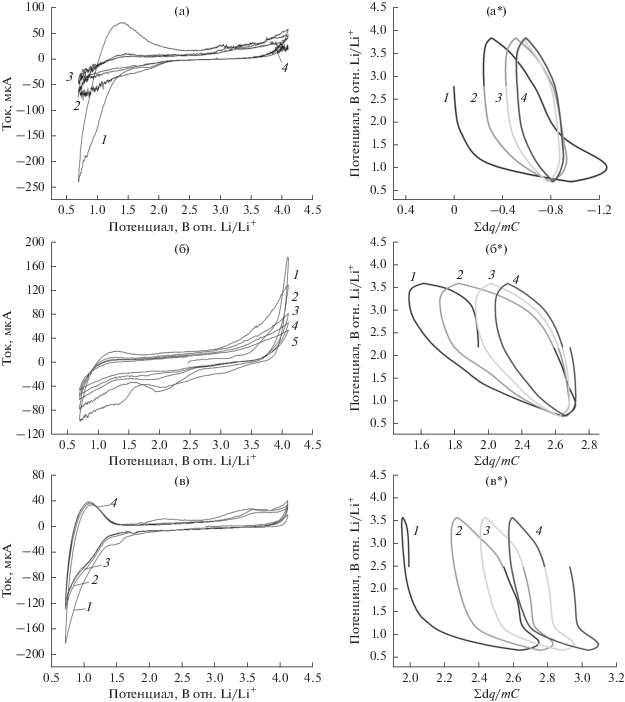
Основание Шиффа P1 в диапазоне циклирования 0.7–4.1 В имеет ярко выраженный необратимый первый цикл. В дальнейшем поляризация электрода оказывает слабое влияние на ток. Как было показано в работе [19], данное соединение обратимо окисляется–восстанавливается только в диапазоне от 0 до 1.0 В отн. Na+/Na. В нашем случае диапазон потенциалов 0.7–4.1 В был выбран для сравнения работы P1–P3.
Для соединения P2 также наблюдается необратимость редокс-процессов, причем “слабым звеном” здесь служит азометиновая группа, так как именно при потенциале 0.7 В не происходит внедрения лития, как видно из гальваностатической анаморфозы (рис. 2б*), полученной путем интегрирования протекающих токов в последовательных циклах ЦВА. Совсем другая картина на ЦВА соединения P3. Все циклы за исключением первого (формировочного) хорошо совпадают друг с другом. Из гальваностатической анаморфозы (рис. 2в*) хорошо видно, что значительное количество атомов лития входит в области низких потенциалов за счет их присоединения к азометиновым группам. На это однозначно указывает число атомов лития на звено >2 (схема 6 ). Молекулярное строение таких продуктов рассмотрено далее с использованием методов квантовой химии.
Схема 6 . Электрохимическая реакция полимера P3.
Рассмотрим, при каких потенциалах происходят редокс-процессы в данных соединениях. На рис. 3а приведены профили заряда–разряда для литиевых ячеек с катодами на основе P1–P3 на примере 3-го цикла. На рис. 3б–3г приведены профили заряда–разряда в двойных логарифмических координатах для всех трех соединений в течение 63–94 циклов. Такое представление позволяет явным образом выявить различные причины падения емкости. Так, в случае, когда часть материала катода перестает участвовать в электрохимических процессах, происходит уменьшение максимального значения емкости, Смакс. Если больше нет никаких изменений, то зависимость Е от С/Смакс в ходе циклирования будет сохраняться. В двойных логарифмических координатах это приведет к однородному смещению всей кривой влево. Другая причина искажения формы кривой происходит от изменения транспортных свойств катода в процессе циклирования. Это приводит к изменению его сопротивления. В этом случае только переменная часть прикладываемого потенциала Е будет действовать в качестве рабочего напряжения. В двойных логарифмических координатах это приведет к однородному смещению всей зарядной кривой вверх.
Рис. 3.
Заряд-разрядные характеристики ячеек Li//органический катод, где (а) P1, (б) P2 и (в) P3, (г) профиль третьего заряда–разряда для P1, P2, P3. Скорость С/20.

С этой точки зрения, основные изменения для полимеров Р1 и Р3 связаны с падением Смакс. Для полимера Р2 наблюдается также смещение кривых вдоль оси абсцисс.
Из рис. 3а видно, что в случае полимера P1 небольшое наклонное плато наблюдается только при крайних значениях потенциалов вблизи 1.0 и 4.0 В отн. Li+/Li. Для полимера P2 на разрядной кривой можно видеть 3 плато, и его разрядная емкость на 3-м цикле достигает 190 мА ч г–1. А на зарядной кривой для полимера P3 среднее плато при 2 В исчезает. Это указывает, что азометиновые группы дают незначительный вклад в емкость, которая в основном обусловлена карбонильными группами (наклонное плато в диапазоне 3–4 В дает около 120 мА ч г–1).
На разрядной кривой для соединения P3 (рис. 3а) имеется наклонное плато в диапазоне 1.2–0.7 В, в то время как наибольший прирост зарядной емкости приходится на диапазон 3.4–4.1 В отн. Li+/Li за счет участия карбонильных групп.
На рис. 4а приведена зависимость разрядной емкости от номера цикла при нормированном токе С/20. Из рис. 4а видно, что лучшим по характеристикам емкости и стабильности работы в течение 90 циклов является полимер P3.
Рис. 4.
Зависимость удельной разрядной емкости (а) и зависимость остаточного количества лития на звено полимера (б) от номера цикла при заряд-разрядном циклировании прототипов Li-органических аккумуляторов при скорости С/20.
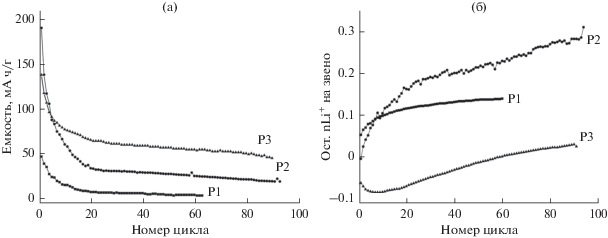
На рис. 4б приведена зависимость “остаточной емкости” от номера цикла, рассчитанная из данных, представленных на рис. 4а, как количество лития, приходящегося на одно звено полимера. Из рис. 4б видно, что наименьшая “остаточная емкость” также наблюдается у катода на основе P3. Кроме того, величины необратимого присоединения лития на звено полимера в несколько раз меньше, чем падение разрядной емкости при циклировании (см. рис. 4а). Это указывает на то, что падение емкости только отчасти может быть связано с необратимым присоединением лития в материал катода.
ТЕОРЕТИЧЕСКИЙ АНАЛИЗ
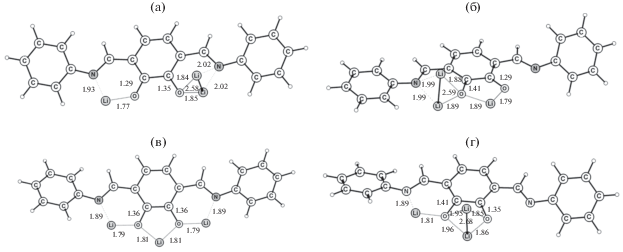
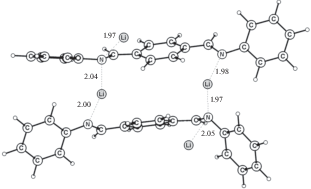
Рассмотрим, почему ячейка на основе полимера P3 показала лучшие результаты по заряд-разрядному циклированию? Полимеры Р2 и Р3 обладают сходным хелатным узлом для координации иона лития. Для исследования оптимального способа связывания ионов лития было рассмотрено взаимодействие одного звена Р2 с несколькими атомами лития. Полученные структуры для двух атомов лития приведены на рис. 5. Наиболее выгодной является координация одного Li+ по атому N и атому O карбонильной группы (рис. 5а). Удельное (на атом лития) запасание энергии при этом равно 2.19 эВ. Перемещение одного (рис. 5б) или двух (рис. 5в) атомов лития в область между двумя карбонильными группами дает снижение энергии до 2.03 и 1.67 эВ соответственно. Наименее выгодной является координация двух ионов лития между атомом N и атомом O карбонильной группы (рис. 5г), при которой энергия снижается до 1.26 эВ.
Рис. 5.
Взаимодействие двух Li с атомами N и O в разных звеньях P2 (a), одного атома Li с двумя O, второго атома Li с O и N (б), два Li между двумя O (в), два Li между N и O (г).
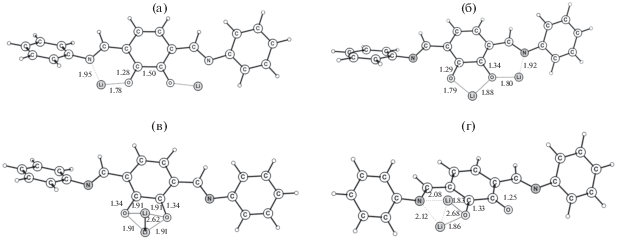
Присоединение следующего атома лития приводит к существенному снижению запасенной энергии до 1.40 эВ (рис. 6a), 1.33 эВ (рис. 6б), 1.69 эВ (рис. 6в) и 1.32 эВ (рис. 6г). В наиболее выгодной структуре отсутствуют близкорасположенные атомы лития.
При присоединении 4 атомов лития по трем хелатным узлам образование Li2-фрагмента является неизбежным (рис. 7). Все изомерные структуры имеют низкое и сравнимое запасание энергии 1.19 эВ (рис. 7a), 1.29 эВ (рис. 7б) и 1.18 эВ (рис. 7в).
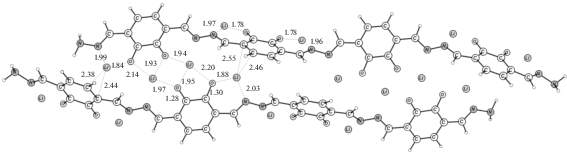
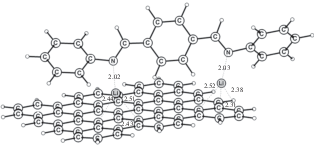
Полимер Р3 моделировали олигомером из 4 звеньев. Он имеет искаженную плоскую структуру из-за отталкивания орто-расположенных карбонильных групп. Однако переход в плоскую структуру требует незначительных затрат энергии 0.3 ккал/моль на звено. Для этого олигомера присоединение 8 атомов лития дает среднее запасание энергии 2.02 эВ. На рис. 8 приведена структура димера из двух литированных олигомеров. При этом только половина атомов лития между цепочками приобретает координационное число 4. Другая половина, координированная на атомах N и O, имеет еще слабую координационную связь с С2-фрагментом бензольного кольца.
При отсутствии карбонильных групп у полимера Р1 резко уменьшаются акцепторные свойства молекулы. Запасание энергии для изолированного одиночного звена составляет всего 0.1 эВ на атом лития. При межмолекулярных взаимодействиях между цепочками ион лития координируется между двумя атомами азота (рис. 9) и удельная запасенная энергия возрастает до 0.99 эВ для атомов лития с координационным числом 2.
Была рассмотрена также роль взаимодействия P1 с проводящими углеродными материалами. Они моделировались графеновым листом. Полученная структура приведена на рис. 10. Найдено, что энергия взаимодействия одного звена с литиированным графеновым листом равна 1.06 эВ, что означает сдвиг потенциала на 0.53 В в смеси углеродный материал + органический катод.
ЗАКЛЮЧЕНИЕ
В работе впервые синтезированы и изучены 2 производных основания Шиффа с карбонильными группами. Хотя исходное основание Шиффа относится к анодным материалам, была предпринята попытка модифицировать его структуру для повышения его редокс-потенциала. Испытания показали, что восстановление азометиновой группы (R1R2C=NR3) может происходить в синергизме с карбонильной группой, что дает более высокий рабочий потенциал электрохимической ячейки и позволяет использовать данный материал в качестве катода.
Методом квантовохимического моделирования показано, что наиболее выгодное присоединение лития происходит между азотом азометиновой группы и кислородом карбонильной группы, что находится в полном согласии с экспериментом.
Список литературы
Akitt, J.W., Kaye, F.W., Lee, B.E., and North, A.M., Conjugated polymeric Schiff bases. Thermally stable polymers with low electrical resistivity, Makromol. Chem., 1962, vol. 56, p. 195.
Li, X., Jiao, Y., and Li, S., The syntheses, properties and application of new conducting polymers, Europ. Polymer J., 1991, vol. 27, p. 1345.
Попов, Ю.А., Давыдов, Б.Э., Кубасова, Н.А., Кренцель, Б.А., Константинов, И.И. Синтез и свойства полишиффовых оснований. Высокомолек. соед. 1965. Т. 7. С. 835. [Popov, Y.A., Davydov, B.E., Kubasova, N.A., Krentse, B.A., and Konstantinov, I.I., Synthesis and properties of polymeric Schiff bases, Vysokomol. Soedineniya, 1965, vol. 7, p. 835.]
Cianga, I. and Ivanoiu, M., Synthesis of poly(Schiff-base)s by organometallic processes, Europ. Polymer J., 2006, vol. 42, p. 1922.
Kugler, T., Giguere, J.-B., Bourcet, F., and Toner, J., Composite electroactive materials for charge storage devices. Patent WO 2018162890. 2018.
Kugler, T., Giguere, J.-B., Toner, J., and Bourcet, F., Composite electroactive materials for charge storage devices. Patent GB 2560348. 2018.
Karushev, M.P., Belous, S.A., Lavrova, T.S., Chepurnaya, I.A., Timonov, A.M., and Kogan, S., Cathode for metal-air current sources and metal-air current source with such cathode. Patent WO 2016044857. 2016.
Karushev, M.P., Belous, S.A., Lavrova, T.S., Chepurnaya, I.A., Timonov, A.M., and Kogan, S., Method of producing porous metal-carbon materials. Patent WO 2016028589. 2016.
Cheng, H., Sun, Y., Sun, Y., Pan, Q., and Sun, H., Manufacturing of Schiff base polymer as anode material for secondary battery. Patent CN 105261758. 2016.
Ye, H., Jiang, F., Li, H., Xu, Z., Yin, J., and Zhu, H., Facile synthesis of conjugated polymeric Schiff base as negative electrodes for lithium ion batteries, Electrochim. Acta, 2017, vol. 253, p. 319.
Sun, Y., Sun, Y., Pan, Q., Li, G., Han, B., Zeng, D., Zhang, Y., and Cheng, H., A hyperbranched conjugated Schiff base polymer network: a potential negative electrode for flexible thin film Batteries, Chem. Commun., 2016, vol. 52, p. 3000.
Zhuang, X., Zhang, F., Wu, D., and Feng, X., Graphene Coupled Schiff-base Porous Polymers: Towards Nitrogen-enriched Porous Carbon Nanosheets with Ultrahigh Electrochemical Capacity, Adv. Materials, 2014, vol. 26, p. 3081.
Fernandez, N., Sanchez-Fontecoba, P., Castillo-Martinez, E., Carretero-Gonzalez, J., Rojo, T., and Armand, M., Polymeric Redox-Active Electrodes for Sodium-Ion Batteries, ChemSusChem, 2018, vol. 11, p. 311.
Daigle, J.-C., Asakawa, Y., Hovington, P., Zaghib, K., Schiff Base as Additive for Preventing Gas Evolution in Li4Ti5O12-Based Lithium-Ion Battery, ACS Appl. Materials & Interfaces, 2017, vol. 9(47), p. 41371.
Левченко, Н.Ф., Афанасиади, Л.Ш., Безуглый, В.Д. Влияние природы радикалов, связанных с азометиновой группой, на ее полярографическую активность. Журн. общей химии. 1967. Т. 37. С. 666. [Levchenko, N.F., Afanasiadi, L.Sh., and Bezuglyi, V.D., The influence of the nature of the radicals associated with the azomethine group on its polarographic activity, Zh. Obshch. Khim.,1967, vol. 37, p. 666.]
Китаев, Ю.П., Троепольская, Т.В. Полярографическое восстановление азометиновых соединений / Прогресс электрохимии органических соединений. Том 1. / Ред. Фрумкин, А.Н., Эршлер, А.Б. М.: Наука, 1969. С. 43–84. [Kitaev, Yu.P. and Troepol′skaya, T.V., Polarographic Reduction of Azomethine Compaunds / Progress in Electrochemistry of Organic Compounds. V. 1 / Ed. Frumkin, A.N., Ershler, A.B., London and N.Y.: Plenum Press, 1971, P. 43–84.
Lopez-Herraiz, M., Castillo-Martınez, E., Carretero-Gonzalez, J., Carrasco, J., Rojo, T., and Armand, M., Oligomeric-Schiff bases as negative electrodes for sodium ion batteries: unveiling the nature of their active redox centers, Energy Environ. Sci., 2015, vol. 8, p. 3233.
Xiao, Z., Han, J., Xiao, J., Song, Q., Zhang, X., Kong, D., Yang, Q.-H., and Zhi, L., A facile and processable integration strategy towards Schiff-base polymer-derived carbonaceous materials with high lithium storage performance, Nanoscale, 2018, vol. 10, p. 10351.
Castillo-Martinez, E., Carretero-Gonzalez, J., and Armand, M., Polymeric Schiff Bases as Low-Voltage Redox Centers for Sodium-Ion Batteries, Angewandte Chem., 2014, vol. 53, p. 5341.
Manecke, G., Wille, W.E., and Kossmehl, G., Preparation and properties of monomeric and polymeric Schiff bases derived from salicylaldehyde and 2,5-dihydroxyterephthalaldehyde. II. Electrical conductivity, Makromol. Chem., 1972, vol. 160, p. 111.
Mo, Y.-P., Liu, X.-H., Sun, B., Yan, H.-J., Wang, D., and Wan, L.-J., The intramolecular H-bonding effect on the growth and stability of Schiff-base surface covalent organic frameworks, Phys. Chem. Chem. Phys., 2017, vol. 19, p. 539.
Jiang, J., Dong, R.Y., and MacLachlan, M.J., Lyotropic liquid crystallinity in mixed-tautomer Schiff-base macrocycles, Chem. Commun., 2015, vol. 51, p. 16205.
Dunn, T.J., Ramogida, C.F., Simmonds, C., Paterson, A., Wong, E.W.Y., Chiang, L., Shimazaki, Y., and Storr, T., Non-Innocent Ligand Behavior of a Bimetallic Ni Schiff-Base Complex Containing a Bridging Catecholate, Inorg. Chem., 2011, vol. 50, p. 6746.
Akine, S., Sunaga, S., and Nabeshima, T., Multistep Oligometal Complexation of the Macrocyclic Tris(N2O2) Hexaoxime Ligand, Chemistry - A Europ. J., 2011, vol. 17, p. 6853.
Feltham, H.L.C., Clerac, R., Powell, A.K., and Brooker, S., A tetranuclear, macrocyclic 3d–4f complex showing single-molecule magnet behavior, Inorg. Chem., 2011, vol. 50, p. 4232.
Yamamura, M., Sasaki., Kyotani, M., Orita, H., and Nabeshima, T., Self-Assembled Nanostructures of Tailored Multi-Metal Complexes and Morphology Control by Counter-Anion Exchange, Chemistry – A Europ. J., 2010, vol. 16, p. 10638.
Jiang, J. and MacLachlan, M.J., Unsymmetrical Triangular Schiff Base Macrocycles with Cone Conformations, Organic Lett., 2010, vol. 12, p. 1020.
Gallant, A.J., Yun, M., Sauer, M., Yeung, C.S., and MacLachlan, M.J., Tautomerization in Naphthalenediimines: A Keto-Enamine Schiff Base Macrocycle, Organic Lett., 2005, vol. 7, p. 4827.
Gallant, A.J. and MacLachlan, M.J., Ion-induced tubular assembly of conjugated Schiff-basemacrocycles, Angewandte Chem., In. Ed., 2003, vol. 42, p. 5307.
Akine, S., Taniguchi, T., and Nabeshima, T., Helical Metallohost – Guest Complexes, J. Amer. Chem. Soc., 2006, vol. 128, p.15765.
Perdew, P., Burke, K., and Ernzerhof, M., Generalized gradient approximation made simple, Phys. Rev. Lett. 1996, vol. 77, p. 3865.
Stevens, W.J., Basch, H., and Krauss, M.J., Valence basis set for transition metals (available Li–Rn) with corresponding ECPs, J. Chem. Phys., 1984, vol. 81, p. 6026.
Laikov, D.N., Fast evaluation of density functional exchange-correlation terms using the expansion of the electron density in auxiliary basis sets, Chem. Phys. Lett., 1997, vol. 281, p. 151.
Дополнительные материалы отсутствуют.