Электрохимия, 2020, T. 56, № 5, стр. 416-426
Сравнительная оценка адсорбции диметилсульфоксида и диметилсульфона на гладком платиновом электроде в кислой среде
М. А. Ахмедов a, b, *, К. О. Ибрагимова b, Ш. Ш. Хидиров b, **
a Аналитический центр коллективного пользования ДФИЦ РАН
Махачкала, Россия
b ФБГОУ ВО Дагестанский государственный университет, Химический факультет
Махачкала, Россия
* E-mail: muhamadahmedov@mail.ru
** E-mail: khidirovdgu@mail.ru
Поступила в редакцию 27.02.2019
После доработки 14.06.2019
Принята к публикации 29.07.2019
Аннотация
В настоящей работе методами импульсной вольтамперометрии, молекулярной спектроскопии и сканирующей электронной микроскопии дана сравнительная оценка адсорбции диметилсульфоксида (ДМСО) и диметилсульфона (ДМСО2) на гладком платиновом (Pt) электроде в кислой среде в области анодных потенциалов. Установлено, что форма изотерм адсорбции в водородной области потенциалов в зависимости от концентраций ДМСО и ДМСО2 имеет S-образный вид. При объемных концентрациях адсорбата более 0.1 М степени заполнения адсорбционного слоя молекулами ДМСО и ДМСО2 имеют близкие величины и изменяются незначительно. Обнаружено существенное различие адсорбционных характеристик ДМСО и ДМСО2 в области потенциалов адсорбции кислорода. По данным степени заполнения кислорода в присутствии исследуемых веществ на поверхности Pt-электрода установлено, что величина их адсорбции максимальна только при объемной концентрации выше 0.1 М, здесь степень заполнения в присутствии ДМСО2 превышает значения степени заполнения кислорода в растворе фона.
ВВЕДЕНИЕ
В современной электрохимической практике диметилсульфоксид (ДМСО) и диметилсульфон (ДМСО2) являются широко известными и часто используемыми растворителями для получения различных систем электролитов и ионообменных мембран при производстве химических источников тока (ХИТ) [1–6].
Благодаря высокой диэлектрической проницаемости и электрохимической устойчивости низкомолекулярные сульфоны и сульфоксиды достаточно хорошо растворяют и ионизируют почти все литиевые соли [7–12], поэтому исследование кинетики электродных реакций и процессов адсорбции на границе раздела металл/раствор представляет фундаментальный и практический интерес. Известно [13], что исследование процессов адсорбции органических соединений (АОС) на поверхности границы твердый электрод–индифферентный электролит позволяет расширить теоретические представления о строении двойного электрического слоя и механизмах электродных процессов в растворах органических соединений. Исследования АОС на твердых электродах методами вольтамперометрии [14–17] позволили детально изучить кинетику и механизмы процессов адсорбции и анодного окисления органических веществ на поверхности платины и металлов платиновой группы [18–22]. Исследования в области АОС [23–34] показывают, что сочетание современных электрохимических методов анализа с методами молекулярной спектроскопии позволяет развить модельные представления о процессах адсорбции на поверхности твердых электродов как молекул простых веществ, так и сложных биологических объектов.
Первые данные о закономерностях поведения металлов платиновой группы в растворах ДМСО появились в работах [35, 36], где показано, что адсорбция ДМСО из водных растворов на гладких Pt-, Pd-, а также Pt/Pt-электродах сопровождается глубокими химическими изменениями с образованием прочных хемосорбированных частиц ДМСО, ориентированных атомами серы к поверхности Pt-электрода. Было также установлено, что при потенциалах выше 600 мВ диметилсульфоксид легко окисляется до диметилсульфона, который десорбируется с поверхности Pt/Pt в объем раствора [36]. Восстановление ДМСО до диметилсульфида протекает в две стадии в диапазоне потенциалов адсорбции водорода [36–38]. В работе [39] показано, что на поверхности рабочего поликристаллического дискового Pt-электрода в 0.1 М растворе H2SO4 в присутствии ДМСО (за счет адсорбции его молекул) подавляется процесс образования оксида Pt–О. Расчетами методом функционала плотности авторы показали, что молекула ДМСО сильно взаимодействует с поверхностью Pt благодаря атому S в группе SO, а модификация поверхностной электронной структуры Pt ограничена атомом Pt, контактирующим непосредственно с атомом S. Расчетная энергия адсорбции Pt на поверхности (Pt (100)) составила 108 кДж/моль.
В работах [40, 41] методом лазерной фотоэмиссии установлено, что с ДМСО взаимодействуют вторичные продукты захвата •ОН-радикалов, которые на первой стадии распадаются с расщеплением C–S-связи с образованием короткоживущих радикалов, таких как •СН3 и аддукта СН3SO•(OH). На второй стадии полученный аддукт окисляется на электроде с получением метансульфокислоты (МСК). В работах [42–47] установлено, что при электроокислении молекулы ДМСО на гладком Pt-электроде происходит разрыв по C–S-связи с образованием ДМСО2 и МСК как в кислой, так и щелочной средах. Аналогичные исследования, проведенные в работах [48, 49] показали, что образование диметилдисульфона (${\text{C}}{{{\text{H}}}_{3}}{\text{S}}{{({\text{O}})}_{2}}{\text{S}}{{({\text{O}})}_{2}}{\text{C}}{{{\text{H}}}_{3}}$) и метансульфоновой кислоты (${\text{C}}{{{\text{H}}}_{3}}{\text{S}}{{{\text{O}}}_{3}}{\text{H}}$) при электролизе водных растворов диметилсульфона на гладкой платине в анодном отделении диафрагменного электролизера происходит на поверхности электрода с разрывом C–S-связи [48‒53]. Следует отметить, что ДМСО и ДМСО2 отличаются химическим составом, степенью окисления серы и могут быть подвергнуты взаимному превращению или электроокислению до МСК [42, 48].
Однако электрохимическое поведение ДМСО и ДМСО2 на границе раздела электрод/индифферентный электролит изучено в недостаточной степени. В настоящей работе методами импульсной вольтамперометрии, молекулярной спектроскопии и сканирующей электронной микроскопии дана сравнительная оценка адсорбции диметилсульфоксида и диметилсульфона на гладком Pt-электроде в кислой среде в области анодных потенциалов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использованы следующие реактивы без дополнительной очистки: серная кислота (H2SO4) марки “ос. ч.”, диметилсульфон и диметилсульфоксид марки “х. ч.”. Для приготовления растворов использовали бидистиллированную, деионизованную воду. Исследования проводили в трехэлектродной электрохимической ячейке объемом 100.0 мл с разделенными керамической диафрагмой со стеклянным шлифом анодными и катодными отделениями. Потенциалы измеряли относительно обратимого водородного электрода сравнения (о. в. э.), при температуре 20 ± 2°С. Измерения проводили методом вольтамперометрии с использованием автоматизированного потенциостата-гальваностата IPC-Pro MF (НТФ “Вольта”, Россия). Водород со степенью чистоты 99.9999 получали с помощью генератора ГВЧ-6 (НПП Химэлектроника, Россия). Электрод сравнения, присоединенный к ячейке с помощью электролитического мостика, подводится непосредственно к рабочему электроду через капилляр Луггина. Исследуемый раствор в ячейке продували инертным газом (аргон), через гидравлический затвор. Рабочим и вспомогательным электродами служила гладкая Pt. Точечный рабочий электрод в форме сферы имел геометрическую площадь 0.016 см2. Истинная поверхность рабочего гладкого Pt-электрода, определенная гальваностатическим методом в 0.5 М ${{{\text{H}}}_{2}}{\text{S}}{{{\text{O}}}_{4}}$ по методике [54], составила 0.02 см2, фактор шероховатости (f) – 1.25.
Изучение процессов адсорбции ДМСО и ДМСО2 проводили методом адсорбционного вытеснения. Мерой адсорбции частиц на поверхности электрода служила степень заполнения поверхности водородом–кислородом. Степень заполнения поверхности органической компонентой может быть оценена на основании величины пропущенного заряда при десорбции водорода–кислорода. Эта величина закономерно изменяется при вытеснении водорода–кислорода из адсорбционного слоя органической компонентой [17, 55, 56]. Предельное заполнение поверхности платины определяли как в водородной (30–400 мВ), так и в кислородной (1200–30 мВ с катодной разверткой) областях в растворе фона (серная кислота) в присутствии ДМСО и ДМСО2 с различной концентрацией. Скорость развертки потенциала – 1.0 В/с. Для получения воспроизводимых результатов рабочий электрод предварительно подвергали многократному циклированию в растворе фона, после чего стабилизировали при исходном потенциале 0.03 В.
Количество заряда (Q), затрачиваемое на десорбцию водорода или кислорода, определяли с использованием программы IPC2000.exe (НТФ “Вольта”, Россия) из импульсных вольтамперограмм интегрированием тока в соответствующей области потенциалов по соотношению (1):
Степень заполнения (θ) рассчитывали по соотношениям (2) и (3):
(2)
$\theta _{{\text{H}}}^{{{\text{в - ва}}}} = \frac{{{{Q}_{{\text{H}}}} - Q_{{\text{H}}}^{{{\text{в - ва}}}}}}{{{{Q}_{{\text{H}}}}}},$(3)
$\theta _{{\text{O}}}^{{{\text{DMSO}}}} = \frac{{{{Q}_{{\text{O}}}} - Q_{{\text{O}}}^{{{\text{в - ва}}}}}}{{{{Q}_{{\text{O}}}}}},$Исследование адсорбции продуктов электрохимического окисления ДМСО и ДМСО2 на поверхности гладкой платины проводили с использованием сканирующего электронного растрового микроскопа Aspex ExPress VP (Aspex, США), совмещенного с энергодисперсионным (EDX) микроанализатором. При проведении съемок методом сканирующей электронной микроскопии (СЭМ) образцы закрепляли на держателях с помощью двухстороннего проводящего углеродного скотча. Микрофотографии получены при ускоряющем напряжении 20 кВ в режиме регистрации вторичных электронов при увеличении от 200 до 25000 в нескольких точках. Детектор энергодисперсионного микроанализатора – твердотельный OMEGA MAX, SDD EDX с диапазоном определяемых микроэлементов от B до U.
Продукты электроокисления ДМСО и ДМСО2 в растворе анализировали с помощью рамановского спектрометра комбинационного рассеяния DXR Smart Raman Research (Thermo Fisher Scientific, США) с лазерным возбуждением (λ = 532 нм и мощностью 10 мВт), спектральный диапазон измерения 50–3500 см–1 с разрешением 3−5 см−1, время интегрирования каждого скана 20 с. Для измерения спектров комбинационного рассеивания света (КРС) анализируемый образец помещали в кварцевую ампулу, из которой с помощью вакуумного насоса откачивали воздух и другие газы. Затем ампулу заполняли инертным газом – аргоном и запаивали. Анализ и идентификацию полученных веществ проводили на основе справочной информации [57, 58].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На рис. 1 представлены анодные импульсные вольтамперограммы в 1.0 М растворе ${{{\text{H}}}_{2}}{\text{S}}{{{\text{O}}}_{4}}$ (1) и в присутствии ДМСО (a) и ДМСО2 (б), снятые в потенциодинамическом режиме со скоростью 1 В/с. На водородном участке фоновой кривой, полученной в 1.0 М растворе ${{{\text{H}}}_{2}}{\text{S}}{{{\text{O}}}_{4}},$ проявляются 2–3 максимума тока, отвечающие процессам десорбции и ионизации слабо- и прочносвязанных частиц водорода на поверхности Pt-электрода [56].
Рис. 1.
Импульсные вольтамперограммы гладкого Pt-электрода в 1.0 М растворе ${{{\text{H}}}_{2}}{\text{S}}{{{\text{O}}}_{4}}$ (1) и в присутствии ДМСО (а) и ДМСО2 (б) при концентрациях, М: 0.001 (2); 0.01 (3); 0.05 (4); 0.1 (5) и 0.2 (6). Скорость развертки потенциала 1.0 В/с.
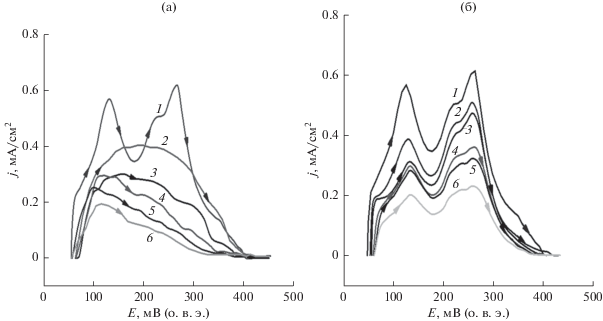
Из представленных анодных импульсных вольтамперограмм на рис. 1 видно, что адсорбция водорода уменьшается соответственно с увеличением концентрации ДМСО и ДМСО2 (кривые 2–6).
На рис. 2 степень заполнения (θ) платинового электрода водородом в присутствии различных концентраций ДМСО и ДМСО2 имеет S-образный вид. Следует отметить, что по мере увеличения их концентраций кривые зависимости степени заполнения водородом практически сливаются. Рисунок 2 показывает, что ДМСО вытесняет преимущественно сильно связанный водород, а ДМСО2 вытесняет сильно и слабо связанный водород приблизительно в одинаковой степени. Это указывает на достаточно сильное различие в адсорбции ДМСО и ДМСО2 области адсорбции водорода.
Рис. 2.
Изотермы адсорбции водорода на Pt-электроде в присутствии ДМСО (1) и ДМСО2 (2) при различных концентрациях.

На рис. 3 представлены катодные вольтамперограммы в кислородной области потенциалов гладкого Pt-электрода в 1.0 М растворе ${{{\text{H}}}_{2}}{\text{S}}{{{\text{O}}}_{4}}$ (1) и в присутствии различных концентраций ДМСО (а) и ДМСО2 (б). На фоновой кривой 1 (рис. 3а и 3б), можно выделить электродные процессы на поверхности гладкого Pt-электрода связанные c:
Рис. 3.
Катодные импульсные вольтамперограммы гладкого Pt-электрода в 1.0 М растворе ${{{\text{H}}}_{2}}{\text{S}}{{{\text{O}}}_{4}}$ (1) и в присутствии ДМСО (a) и ДМСО2 (б) при концентрациях, М: 0.1 (2); 0.2 (3); 0.4 (4); 1.2 (5); 1.6 (6) и 2.0 (7). Скорость развертки потенциала, 1.0 В/с.
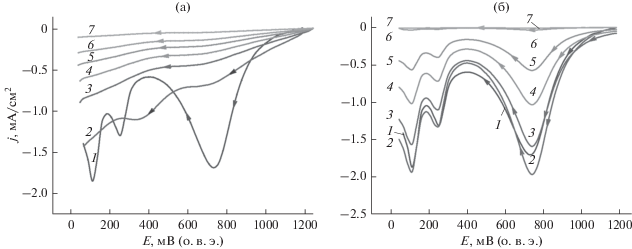
– адсорбцией прочно (H2ads) и слабосвязанных (Hads) частиц водорода (0.03–0.4 В) [22, 56]:
– двойнослойной областью (0.4–0.6 В), отвечающей за заряд емкости двойного слоя [22, 56];
– десорбцией адсорбированных частиц кислорода в растворе ${{{\text{H}}}_{2}}{\text{S}}{{{\text{O}}}_{4}}$ (0.6–1.2 В), протекающей по схеме [19, 56]:
(7)
${{{\text{O}}}_{{{\text{ads}}}}} + 2{{{\text{H}}}^{ + }} + 2\bar {e} \to {{{\text{H}}}_{2}}{\text{O}}{\text{.}}$Пик восстановления кислорода с увеличением концентраций исследуемых сераорганических веществ уменьшается. Вместе с тем следует отметить, что по влиянию на адсорбцию кислорода характер и форма кривых в присутствии ДМСО и ДМСО2 существенно различается. Например, пик восстановления кислорода четко не выявляется в растворах диметилсульфоксида, в то время как в растворах диметилсульфона пик восстановления кислорода имеет четко выраженный характер, за исключением концентраций 1.2, 1.6 и 2.0 М ДМСО2, когда фактически происходит полное подавление адсорбированного кислорода.
На рис. 4 приведены данные по адсорбции кислорода на гладком Pt-электроде в фоновом растворе и в присутствии различных концентрациях ДМСО и ДМСО2. До концентрации 0.1 М адсорбирующихся сераорганических соединений адсорбция кислорода максимальна, при более высоких концентрациях она уменьшается, а адсорбция ДМСО и ДМСО2 возрастает, причем степень заполнения ДМСО превышает степень заполнения кислородом поверхности платины в фоновом растворе. По-видимому, это связано с изменением строения поверхностного оксида платины [48]. Из приведенных изотерм также видно, что численные соотношения атомов платины и кислорода в фоновом растворе и в растворах различных концентраций ДМСО и ДМСО2, рассчитанные при потенциале 0.4–1.2 В, имеют дробные значения.
Рис. 4.
Изотерма адсорбции кислорода при потенциале 1.2 В на Pt-электроде в фоновом растворе (1), и в присутствии различных концентраций ДМСО (2) и ДМСО2 (3).

На рис. 5 представлены изображения СЭМ и EDX-анализа, снятые для изучения адсорбции ДМСО и ДМСО2 на поверхности гладкой платины. Перед снятием, исследуемые образцы гладкого Pt-электрода были первоначально подвергнуты электролизу в диафрагменном электролизере при потенциале 1.2 В в среде растворителей ДМСО (а), (б) и ДМСО2 (в), (г) и высушены в потоке инертного Ar. Из данных рентгенограмм (рис. 5) видно, что исследуемый Pt-электрод хорошо адсорбирует (или хемосорбирует) молекулы ДМСО (б) и ДМСО2 (г). В случае адсорбции (или хемосорбции) ДМСО поверхность исследуемого рабочего электрода практически не изменяется. Однако, после электролиза проведенного в присутствии ДМСО2, при потенциале 1.2 В на поверхности Pt-электрода, по данным EDX-анализа, наблюдаются существенные изменения, связанные с перекрыванием сигналов (рис. 5в, 5г). По-видимому, это может быть связано с более сильными абсорбционными связями ДМСО2 на поверхности гладкого платинового электрода.
Рис. 5.
Изображения СЭМ и данные EDX-анализа на гладком платиновом электроде после анодной поляризации в 1.0 М растворе ${{{\text{H}}}_{2}}{\text{S}}{{{\text{O}}}_{4}}$ в присутствии ДМСО (а, б) и ДМСО2 (в, г) при Е = 1.2 В.

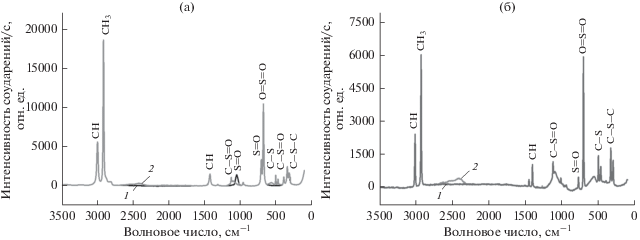
Для идентификации возможных продуктов электроокисления ДМСО и ДМСО2 на гладкой платине при контролируемом анодном потенциале E = 1.2 В нами был проведен препаративный электролиз в течении 18 ч в диафрагменном электролизере на гладком платиновом электроде с геометрической поверхностью 1 см2 в 1.0 М растворе ${{{\text{H}}}_{2}}{\text{S}}{{{\text{O}}}_{4}}$ в присутствии исследуемых сераорганических веществ при пропускании заряда 0.1 А ч. Диафрагмой служила перфторированная катионитовая мембрана марки МФ-4СК. Температура при стационарном электролизе поддерживалась 30–40°С. Выделяющийся газ на аноде в обоих случаях пропускали через стеклянную трубку в раствор хлорида кальция. Выпадение осадка по истечении всего времени электролиза при потенциале E = 1.2 В как в присутствии ДМСО, так и ДМСО2 не наблюдалось. При анализе анолита в 1.0 М растворе ${{{\text{H}}}_{2}}{\text{S}}{{{\text{O}}}_{{\text{4}}}}$ в присутствии ДМСО после электролиза методом КРС (рис. 6а) обнаружилось наличие содержания диметилсульфона. Тогда как при исследовании анолита 1.0 М H2SO4 в присутствии ДМСО2 после электролиза также никаких изменений на КРС-спектрах (рис. 6б) не наблюдалось.
Рис. 6.
КРС-спектры продуктов электроокисления ДМСО (a) и ДМСО2 (б) при Е = 1.2 В до (1) и после (2) электролиза в 1.0 M ${{{\text{H}}}_{2}}{\text{S}}{{{\text{O}}}_{4}}$.
Следует отметить, что на адсорбцию молекул ДМСО и ДМСО2 на поверхности гладкого платинового электрода также может оказывать влияние природа упорядоченного строения их кристаллических упаковок. Ранее в работах [59, 60] было исследовано строение элементарных ячеек ДМСО (I) и ДМСО2 (II), показывающее ближайшее расположение их атомов вдоль оси b (рис. 7) в кристаллическом состоянии. На основании этих данных можно предположить, что молекула ДМСО2 (рис. 7, II) имеет возможность образования более прочных адсорбционных связей на поверхности гладкой платины в сравнении с ДМСО (рис. 7, I).
Таким образом, приведенные выше данные по адсорбции ДМСО и ДМСО2 на гладкой платине методами вольтамперометрии и молекулярной спектроскопии подтверждают, что диметилсульфон более прочно связывается с поверхностью платины, чем ДМСО и не окисляется при потенциалах выше 0.6 В. По-видимому, это объясняется как различием состава и строения исследуемых сераорганических растворителей, так и особенностями поверхности гладкой платины в зависимости от потенциала.
ЗАКЛЮЧЕНИЕ
На основании результатов вольтамперометрических измерений установлено, что различие адсорбции ДМСО и ДМСО2 в водородной области потенциалов пренебрежимо мало. С увеличением их концентрации изотермы адсорбции водорода практически сливаются. Однако в области адсорбции кислорода характер импульсных вольтамперограмм отличается в зависимости от концентрации, а степень заполнения кислородом поверхности платинового электрода максимальна до концентраций ДМСО и ДМСО2 0.2 М, при более высоких концентрациях она уменьшается, а ${{\theta }_{{{\text{ДМС}}{{{\text{О}}}_{2}}}}}$ даже превышает θО, что обусловлено изменением природы поверхностного оксида платины.
Данные СЭМ- и EDX-анализа подтверждают образование более прочной связи ДМСО2 с поверхностью платины, чем ДМСО. Методом КРС-спектроскопии установлено, что при контролируемом потенциале электролиза E = 1.2 В с объемной концентрацией ДМСО2cм ≥ 0.2 М, в отличие от ДМСО никаких изменений функциональных групп и образования новых связей не происходит.
Список литературы
Zhang, H., Li, Ch., Piszcz, M., Coya, E., Rojo, T., Rodriguez-Martinez, L.M., Armand, M., and Zhou, Z., Single lithium-ion conducting solid polymer electrolytes: advances and perspectives, Chem. Soc. Rev. 2017, vol. 46, no. 3, p. 797. https://doi.org/10.1039/c6cs00491a
Hilbig, P., Ibing, L., Wagner, R., Winter, M., and Cekic-Laskovic, I., Ethyl methyl sulfone – based electrolytes for lithium ion battery applications, Energies, 2017, vol. 10, no. 9, p. 1312. https://doi.org/10.3390/en10091312
Shota, F. and Thomas, J.M., Sulfone-containing methacrylate homopolymers: wetting and thermal properties, Langmuir, 2016, vol. 32, no. 3, p. 765. https://doi.org/10.1021/acs.langmuir.5b04265
Ярмоленко, О.В., Юдина, А.В., Игнатова, А.А. Современное состояние и перспективы развития жидких электролитных систем для литий-ионных аккумуляторов. Электрохим. энергетика, 2016. № 4 (16). С. 155. [Yarmolenko, O.V., Yudina, A.V., and Ignatova, A.A., The state of the art and prospects for the development of electrolyte systems for lithium power sources, Electrochem. energy (in Russian), 2016, no. 4 (16), p. 155.] https://doi.org/10.18500/1608-4039-2016-4-155-195
Гафуров, М.М., Кириллов, С.А., Горобец, М.И., Рабаданов, К.Ш., Атаев, М.Б., Третьяков, Д.О., Айдемиров, К.М. Фазовые равновесия и ионная сольватация в системе тетрафторборат лития-диметилсульфоксид. ЖПС. 2014. № 4 (81). С. 824. [Gafurov, M.M., Kirillov, S.A., Gorobets, M.I., Rabadanov, K. Sh., Ataev, M.B., Tretyakov, D.O., and Aydemirov, K.M., Phase equilibrium and ionic solvation in the lithium tetrafluoroborate-dimethylsulphoxide system, JAS, 2014, no. 6 (81), p. 912.] https://doi.org/10.1007/s10812-015-0028-9
Гафуров, М.М., Рабаданов, К.Ш., Атаев, М.Б., Алиев, А.Р., Ахмедов, И.Р., Какагасанов, М.Г., Крамынин, С.П. Колебательные спектры системы LINO3–(CH3)2SO2. ЖПС. 2012. № 2 (79). С. 200. [Gafurov, M.M., Rabadanov, K.S., Ataev, M.B., Aliev A.R., Ahmedov, I.R., Kakagasanov, M.G., and Kraminin, S.P., Vibrational spectra of an LiNO3–(CH3)2SO2 system, JAS, 2012, no. 2 (79), p. 184.] https://doi.org/10.1007/s10812-012-9581-7
Fanny, B., Yuhui, Ch., Lee, J., Schaltin, S., Jan, F., and Bruce P.G., Sulfone-based electrolytes for nonaqueous Li–O2 batteries, Phys. Chem. C, 2014, vol. 118, no. 33, p. 18892. https://doi.org/10.1021/jp5048198
Maca, J., Frk, M., Rozsivalova, Z., and Sedlarikova, M., Properties of sulfolane based aprotic electrolytes, Electrochim. Acta, 2013, vol. 31, no. 6, p. 321. https://doi.org/10.4152/pea.201306321
Маркарян, Ш.А., Азнаурян, М.Г., Казоян, Е.А. Физико-химические свойства водных растворов диметил- и диэтилсульфонов. ЖФХ. 2011. № 12 (85). С. 2291. [Markaryan, Sh.A., Aznauryan, M.G., and Kazoyan, E.A., Physicochemical properties of aqueous solutions of dimethyl- and diethylsulfones, Russ. J. Phys. Chem., 2011, no. 12 (85), p. 2138.] https://doi.org/10.1134/S0036024411120211
Колосницын, В.С., Кострюкова, Н.В., Легостаева, М.В. Электропроводность и термические свойства гелевых полимерных электролитов на основе сульфонов. Электрохими. энергетика. 2004. № 2 (4). С. 90. [Kolosnitsyn, V.S., Kostryukova, N.V., and Legostaeva, M.V., Electrical conductivity and thermal properties of gel polymer electrolytes based on sulfones, Electrochem. energy (in Russian), 2004, no. 2 (4), p. 90.]
Vandermeeren, L., Leyssens, T., and Peeters, D., Theoretical study of the properties of sulfone and sulfoxide functional groups, J. Molecular Structure: THEOCHEM, 2007, vol. 804, no. 3, p. 1006. https://doi.org/10.1016/j.theochem.2006.10.006
Xu, K. and Angela, C.A., High anodic stability of a; new electrolyte solvent: un-symmetric noncyclic aliphatic sulfone, Electrochem. Soc., 1998, vol. 145, no. 4, p. 70.
Frumkin, A.N., Damaskin, B.B., Grigoryev, N.B., and Bagotskaya, I.A., Potentials of zero charge, interaction of metals with water and adsorption of organic substances. I. Potentials of zero charge and hydrophilicity of metals, Electrochim. Acta, 1974, vol. 19, no. 2, p. 69. https://doi.org/10.1016/0013-4686(74)85058-9
Казаринов, В.Е. Адсорбция анионов на платине при анодных потенциалах. Электрохимия. 1966. Т. 2. № 12. С. 1389. [Kazarinov, V.E., Adsorption of anions on platinum at anodic potentials, Russ. J. Electrochem., 1966, vol. 2, no. 12, p. 1389.]
Багоцкий, В.С. Основы электрохимии, М.: Химия, 1988. 400 с. [Bagotsky, V.S., Basics of electrochemistry (in Russian), Moscow: Chemistry, 1988. 400 p.]
Петрий, О.А. Адсорбционные явления на электродах из металлов группы платины. Успехи химии. 1975. № 11 (44). С. 2048. [Petrii, O.A., Adsorption phenomena on platinum group metal electrodes, Russ. Chem. Rev, 1975, vol. 44, no. 11, p. 973.]
Дамаскин, Б.Б., Некрасов, Л.Н., Петрий, О.А., Подловченко, Б.И., Стенина, Е.В., Федорович, Н.В. Электродные процессы в растворах органических соединений, М.: МГУ, 1985. 312 c. [Damaskin, B.B., Nekrasov, L.N., Petrii, O.A., Podlovchenko, B.I., Stenina, E.V., and Fedorovich, N.V., Electrode processes in solutions of organic compounds (in Russian), Moscow: Moscow State University, 1985. 312 с.]
Clavilier, J., The role of anion on the electrochemical behaviour of a {111} platinum surface; an unusual splitting of the voltammogram in the hydrogen region, J. Electroanal. Chem. and Interfacial Electrochem., 1980, vol. 107, no. 1, p. 211. https://doi.org/10.1016/s0022-0728(79)80023-6
Данилов, А.И., Молодкина, Е.Б., Полукаров, Ю.М. Поверхностный и подповерхностный кислород на платине. Раствор 0.5 М H2SO4. Электрохимия. 2004. Т. 40. С. 667. [Danilov, A.I., Molodkina, E. B., and Polukarov, Yu.M., Surface and subsurface oxygen on platinum. Solution 0.5 M H2SO4, Russ. J. Electrochem., 2004, vol. 40, p. 667.]
Вотченко, Е.Ю., Кубанова, М.С., Смирнова, Н.В., Петрий, О.А. Адсорбция и электроокисление диметилового эфира на платинированном платиновом электроде в сернокислом растворе. Электрохимия. 2010. Т. 46. С. 221. [Votchenko, E.Y., Kubanova, M.S., Smirnova, N.V., and Petrii, O.A., Adsorption and electrooxidation of dimethyl ether on platinized platinum electrode in sulfuric acid, Russ. J. Electrochem., 2010, vol. 46, p. 212.] https://doi.org/10.1134/S1023193510020138
Петрий, О.А. Потенциалы нулевого заряда платиновых металлов и работы выхода электрона (обзор). Электрохимия. 2013. Т. 49. С. 451. [Petrii, O.A., Zero charge potentials of platinum metals and electron work functions (review), Russ. J. Electrochem., 2013, vol. 49, p. 401.] https://doi.org/10.7868/S0424857013050149
Тарасевич, М.Р., Корчагин, О.В. Электрокатализ и pH (обзор). Электрохимия. 2013. Т. 49. С. 676. [Tarasevich M. R. and Korchagin, O. V., Electrocatalysis and pH (review), Russ. J. Electrochem., 2013, vol. 49, p. 676.] https://doi.org/10.1134/S102319351307015X
Турыгин, В.В., Томилов, А.П. Возможные направления развития прикладного электрохимического синтеза органических соединений (обзор). Электрохимия. 2015. Т. 51. С. 1132. [Turygin, V.V. and Tomilov, A.P., Possible trends in the development of applied electrochemical synthesis of organic compounds (review), Russ. J. Electrochem., 2015, vol. 51, p. 999.] https://doi.org/10.1134/S1023193515110191
Baturina, O.A., Gould, B.D., Korovina, A., Garsany, Y., Stroman, R., and Northrup, P.A., Products of SO2 adsorption on fuel cell electrocatalysts by combination of sulfur K-edge XANES and electrochemistry, Langmuir, 2011, vol. 27, no. 24, p. 14930. https://doi.org/10.1021/la2033466
Garcia-Araez, N., Climent, V., Rodriguez, P., and Feliu, J.M., Elucidation of the chemical nature of adsorbed species for Pt (111) in H2SO4. Solutions by Thermodynamic Analysis, Langmuir, 2010, vol. 26, no. 14, p. 12408. https://doi.org/10.1021/la101112b
Hoshi, N., Nakamura, M., Sakata, O., Nakahara, A., Naito, K., and Ogata, H., Surface X-ray scattering of stepped surfaces of platinum in an electrochemical environment: Pt(331) = 3(111)–(111) and Pt(511) = 3(100)–(111), Langmuir, 2011, vol. 27, no. 7, p. 4236. https://doi.org/10.1021/la200199b
Jerkiewicz, G., Vatankhah, G., Tanaka, S., and Lessard, J., Discovery of the potential of minimum mass for platinum electrodes, Langmuir, 2011, vol. 27, no. 7, p. 4220. https://doi.org/10.1021/la200153n
Кривенко, А.Г., Коткин, А.С., Курмаз, В.А. Механизм электродных реакций органических интермедиатов с участием и без участия донора/акцептора протонов. Рос. хим. журн. (ЖРХО им. Д.И. Менделеева). 2005. 5 (49). С. 17. [Krivenko, A.G., Kotkin, A.S., and Kurmaz, V.A., Mechanism of electrode reactions of organic intermediates with and without the participation of a proton donor/acceptor, Russ. J. General Chem., 2005, vol. 49, no. 5, p. 17.]
Krivenko, A.G., Kotkin, A.S., and Kurmaz, V.A., Mechanism of electroreduction of intermediates with and without a proton donor, Electrochim. Acta, 2002, vol. 47, no. 24, p. 3891. https://doi.org/10.1016/S0013-4686(02)00358-4
Shah, J., Kansara, S., Sanjeev, K.G., and Yogesh, S., Oxygen adsorption on palladium monolayer as a surface catalyst, Physics Letters A, 2017. vol. 381. p. 3084. https://doi.org/10.1016/j.physleta.2017.07.024
Ruge, M., Drnec, J., Rahn, B., Reikowski, F., Harrington, D. A., Carlà, F., and Magnussen, O.M., Structural reorganization of Pt(111) electrodes by electrochemical oxidation and reduction, J. Amer. Chem. Soc., 2017, vol. 139, no. 12, p.4532. https://doi.org/10.1021/jacs.7b0103
Gómez-Marín, A.M. and Feliu, J.M. Oxygen reduction on platinum single crystal electrodes, Reference Module in Chemistry, Molecular Sci. and Chem. Engineering (Encyclopedia of Interfacial Chemistry), 2018, p. 820. https://doi.org/10.1016/B978-0-12-409547-2.13333-5
Кривенко, А.Г., Комарова, Н.С., Стенина, Е.В., Свиридова, Л.Н. Адсорбция поверхностно-активных соединений с каркасной структурой молекул из растворов в диметилсульфоксиде на углеродных нанотрубках. Электрохимия. 2012. Т. 48. С. 42. [Krivenko, A.G., Komarova, N.S., Stenina, E.V., and Sviridova, L.N., Adsorption of surface-active compounds with the skeleton molecular structure from dimethylsulfoxide solutions on carbon nanotubes, Russ. J. Electrochem., 2012, vol. 48, p. 36.] https://doi.org/10.1134/S1023193512010107
Стенина, Е.В., Свиридова, Л.Н., Петров, Н.Х. Адсорбционные явления в системах, содержащих макроциклический кавитанд кукурбит[7]урил. Электрохимия. 2017. Т. 53. С. 114. [Stenina, E.V, Sviridova, L.N., and Petrov, N.K., Adsorption phenomena in the systems containing macrocyclic cavitand cucurbit [7]uryl, Russ. J. Eleсtrochem., 2017, vol. 53, p. 103.] https://doi.org/10.1134/S102319351701013X
Алексеева, Е.Ю., Сафонов, В.А., Петрий, О.А. Потенциалы нулевого заряда и строение двойного электрического слоя на платине и палладии в среде диметилсульфоксида. Электрохимия. 1984. Т. 20. С. 945. [Alekseeva, E.Yu., Safonov, V.A., and Petry, O.A., Potentials of zero charge and the structure of the electric double layer on platinum and palladium in dimethyl sulfoxide, Russ. J. Electrochem., 1984, vol. 20, p. 945.]
Sobkowski, J. and Szklarczyk, M., The behaviour of high polar organic solvents on platinum electrodes–I. The study of adsorption and electrode reactions of dimethylsulphoxide, Electrochim. Acta, 1980, vol. 25, p. 383. https://doi.org/10.1016/0013-4686(80)87027-7
Dabkowski, J., Zagórska, I., Dabkowska, M., Koczorowski, Z., and Trasatti, S., Adsorption of DMSO at the free surface of water: surface excesses and surface potential shifts in the low concentration range, J. Chem. Soc., Faraday Trans., 1996, vol. 92, p. 3873. https://doi.org/10.1039/FT9969203873
Осадченко, И.М., Томилов, А.П. Электрохимическое окисление диметилсульфида в водном растворе. Электрохимия. 2002. Т. 38. С. 740. [Osadchenko, I. M. and Tomilov, A.P., Electrochemical oxidation of methyl sulfide in aqueous solutions, Russ. J. Electrochem., 2002, vol. 38, p. 658.] https://doi.org/10.1023/a:1016014920832
Tanaskovic, V., Pasti, I. A., Gavrilov, N., and Mentus, S.V., Dimethylsulfoxide as a modifier of platinum electrocatalytic activity toward oxygen reduction reaction in aqueous solutions: Combined theoretical and experimental study, J. Electroanalyt. Chem., 2014, vol. 714–715, p. 11. https://doi.org/10.1016/j.jelechem.2013.12.020
Курмаз, В.А., Коткин, А.С., Симбирцева, Г.В. Исследование электрохимического поведения вторичных продуктов захвата ОН-радикалов молекулами диметилсульфоксида методами лазерной фотоэмиссии. Вестн. МГУ. Сер. 2 Химия. 2013. 6 (54). С. 321. [Kurmaz, V.A., Kotkin, A.S., and Simbirtseva, G.V., Investigation of Electrochemical Behavior of Secondary Products of Capture of OH Radicals by Dimethyl Sulfoxide Molecules Using Laser Photoemission, Moscow Univer. Chem. Bull., 2013, vol. 68, no. 6, p. 273.] https://doi.org/10.3103/S0027131413060023
Kurmaz, V.A., Kotkin, A.S., and Simbirtseva, G.V., Laser photoemission generation and electrochemical study of methyl radicals as secondary products of OH radicals capture by dimethyl sulfoxide molecules, J. Solid State Electrochem., 2011, vol. 15, no. 10, p. 2119. https://doi.org/10.1007/s10008-011-1534-1
Хибиев, Х.С., Омарова, К.О., Хидиров, Ш.Ш. Электрохимический синтез диметилсульфона и метансульфокислоты из диметилсульфоксида. Электрохимия, 2010. Т. 46. № 8. С. 1021. [Khibiev, Kh.S., Omarova, K.O., and Khidirov, Sh.Sh., Electrochemical synthesis of dimethylsulfone and methanesulfonic acid from dimethylsulfoxide, Russ. J. Electrochem., 2010, vol. 46, no. 8, p. 960.] https://doi.org/10.1134/S1023193510080161
Хидиров, Ш.Ш., Омарова, К.О. Адсорбция кислорода и диметилсульфоксида на моноатоме гладкой поверхности платинового анода при высоких потенциалах. Вестн. ДГУ. 2013. № 1 (28). С. 177. [Khidirov, Sh.Sh. and Omarova, K.O., Adsorption of oxygen and dimethyl sulfoxide on the mono atom of the smooth surface of the platinum anode at high potentials, Herald DGU (in Russian), 2013, no. 1 (28), p. 177.]
Хидиров, Ш.Ш., Омарова, К.О., Хибиев, Х.С. О механизме анодного окисления диметилсульфоксида на платине в щелочной среде. Вестник ДГУ. 2013. № 6 (28). С. 176. [Khidirov, Sh.Sh., Omarova, K.O., and Hibiev, Kh.S., The mechanism of anodic oxidation of dimethyl sulfoxide on platinum in an alkaline medium, Herald DGU (in Russian), 2013, no. 6 (28), p. 176.]
Омарова, К.О., Хидиров, Ш.Ш., Хибиев, Х.С. Адсорбция диметилсульфоксида на гладком платиновом электроде. Вестн. ДГУ. 2013. № 1 (28). С. 194. [Omarova, K.O., Khidirov, Sh.Sh., and Khibiev, Kh.S., Adsorption of dimethyl sulfoxide on a smooth platinum electrode, Herald DSU (in Russian), 2013, no. 1 (28), p. 194.]
Хидиров, Ш.Ш., Омарова, К.О., Хибиев, Х.С. Способ получения диметилсульфона, Пат. 2377235 (Россия). 2009. [Khidirov, Sh.Sh., Omarova, K.O., and Khibiev, Kh.S., Method of producing dimethyl sulfone, Patent 2377235 (Russia), 2009.] https://goo-gl.su/JCBiAJ3.
Хидиров, Ш.Ш., Омарова, К.О., Хибиев, Х.С. Способ получения метансульфокислоты. Пат. 2344126 (Россия). 2009. [Khidirov, Sh.Sh., Omarova, K.O., and Khibiev, Kh.S., Method of producing methanesulfonic acid, Patent 2344126 (Russia), 2009.] https://goo-gl.su/a7RuRXMd
Ахмедов, М.А., Хидиров, Ш.Ш., Капарова, М.Ю., Хибиев Х.С. Электрохимический синтез метансульфокислоты из водных растворов диметилсульфона. Изв. вузов. Сер. Химия и хим. технология. 2016. № 12 (59). С. 100. [Akhmedov, M.A., Khidirov, Sh.Sh., Koparova, M.Y., and Khibiev, Kh.S., Electrochemical synthesis of methanesulfonic acid from aqueous solutions of dimethyl sulfone, Izv. Vyssh. Uchebn. Zaved. Khim. Khim. Tekhnol., 2016, no. 12 (59), p. 100 (in Russian)] https://doi.org/10.6060/tcct.20165912.5345
Ахмедов, М.А., Хидиров, Ш.Ш., Капарова, М.Ю. Электрохимическое окисление диметилсульфона в щелочной среде. Изв. вузов. Сер. Химия и хим. технология. 2018. № 8 (61). С. 32. [Akhmedov, M.A., Khidirov, Sh.Sh., and Koparova, M.Yu., Electrochemical oxidation of dimethyl sulfone in alkaline medium, Izv. Vyssh. Uchebn. Zaved. Khim. Khim. Tekhnol. (in Russian), 2018, vol. 61, no. 8, p. 32.] https://doi.org/10.6060/ivkkt.20186108.5707
Хидиров, Ш.Ш., Ахмедов, М.А., Хибиев, Х.С., Омарова, К.О. Способ получения метансульфокислоты. Пат. 2496772 (Россия). 2013. [Khidirov, Sh.Sh. Akhmedov, M.A., Khibiev, Kh.S., and Omarova, K.O., Method of producing methanesulfonic acid, Patent 2496772 (Russia), 2013.] https://goo-gl.su/5WOgLhxS
Хидиров, Ш.Ш., Ахмедов, М.А., Рабаданов, М.Х. Способ получения метансульфокислоты. Пат. 2554880 (Россия). 2015. [Khidirov, Sh.Sh., Akhmedov, M.A., and Rabadanov M.Kh., Method of producing methanesulfonic acid, Patent 2554880 (Russia), 2015.] https://goo-gl.su/L0WTTTz
Хидиров, Ш.Ш., Ахмедов, М.А., Рабаданов, М.Х., Капарова М.Ю. Способ получения диметилдисульфона. Пат. 2641302 (Россия). 2018. [Khidirov, Sh.Sh., Akhmedov, M.A., Rabadanov, M.Kh., and Koparova, M.Y., Method of producing dimethyl disulfon, Patent 2641302 (Russia), 2018.] https://goo-gl.su/mHzIEP.
Ахмедов, М.А., Хидиров, Ш.Ш. Анодные процессы в концентрированном растворе метансульфокислоты на платиновом электроде. Электрохимия. 2019. Т. 55. № 6. С. 757. [Akhmedov, M.A., Khidirov, Sh.Sh., Anodic processes at smooth platinum electrode in concentrated solution of methanesulfonic acid, Russ. J. Electrochem., 2019, vol. 55, no. 6, p. 579.] https://doi.org/10.1134/S1023193519060028
Trasatti, S. and Petrii, O.A., Real surface area measurements in electrochemistry, J. Electroanalyt. Chem., 1992, vol. 327, p. 353. https://doi.org/10.1016/0022-0728(92)80162-w
Шольц, Ф. Электроаналитические методы. Теория и практика, М: Бином. Лаборатория знаний. 2014. 326 с. [Scholz, F., Electro-analytical methods. Guide to experiments and applications, Berlin-Heidelberg: Springer-Verlag, 2002. 326 p.]
Дамаскин, Б.Б., Петрий, О.А. Введение в электрохимическую кинетику, М.: Высшая школа. 1983. 400 с. [Damaskin, B.B., and Petrii, O.A., Introduction to electrochemical kinetics (in Russian), Moscow: Higher School, 1983. 400 p.]
Martens, W.N., Frost, R.L., Kristof, J., and Theo Kloprogge, J., Raman spectroscopy of dimethyl sulphoxide and deuterated dimethyl sulphoxide at 298 and 77 K, Raman Spectroscopy, 2002, vol. 33, p. 84. https://doi.org/10.1002/jrs.827
McLachlan, R.D. and Carter, V.B., Vibrational spectra of crystalline dimethyl sulfone, Spectrochem. Acta Part A: Molecular Spectroscopy, 1970, vol. 26, p. 1121. https://doi.org/10.1016/0584-8539(70)80016-2
Reuter, H., Structural parameters of dimethyl sulfoxide, DMSO, at 100 K, based on a redetermination by use of high-quality single-crystal X-ray data, Acta Cryst., 2017, vol. E73, p. 1405. https://doi.org/10.1107/S2056989017012464
Thomas, S.P., Shi, M.W., Koutsantonis, G.A., Jayatilaka, D., Edwards, A.J., and Spackman, M.A., The elusive structural origin of plastic bending in dimethyl sulfone crystals with quasi-isotropic crystal packing, Angewandte Chemie, 2017, vol. 129, no. 29, p. 8588. https://doi.org/10.1002/ange.201701972
Дополнительные материалы отсутствуют.



