Электрохимия, 2020, T. 56, № 5, стр. 427-441
Перспективы использования в условиях in situ и ex situ водных растворов пероксида водорода, электросинтезированных из кислорода
В. Л. Корниенко a, *, Г. А. Колягин a, Г. В. Корниенко a, b, Т. А. Кенова a
a Федеральный исследовательский центр “Красноярский научный центр СО РАН”,
Институт химии и химической технологии СО РАН
660036 Красноярск, Академгородок, 50, стр. 24, Россия
b Сибирский государственный университет науки и техники имени акад. М.Ф. Решетнева
660049 Красноярск, просп. Мира, 82, Россия
* E-mail: kvl@icct.ru
Поступила в редакцию 18.03.2019
После доработки 30.04.2019
Принята к публикации 16.09.2019
Аннотация
Обсуждены результаты и перспективы использования в условиях in situ (в объеме ячейки) и ex situ (вне объема ячейки) водных растворов пероксида водорода, электросинтезированных из кислорода в сажевых газодиффузионных электродах (ГДЭ). Показано, что при использовании ГДЭ на основе технического углерода А-437Э (ацетиленовая сажа) и мезоструктурированного углерода СМК-3 возможно получение раствора Н2О2 с концентрацией более 3 М. Установлено, что электросинтезированный пероксид водорода с высокой эффективностью может быть использован in situ, как для непрямого электросинтеза востребованных целевых органических и неорганических продуктов, так и для разрушения органических и неорганических поллютантов в сточных водах различного происхождения. В условиях ex situ возможно получение еще более концентрированных растворов Н2О2, органических пероксокислот, неорганических пероксосольватов и проведение минерализации экзометаболитов в системах автономного жизнеобеспечения. Полученные результаты могут быть полезными при выборе наиболее рационального варианта использования растворов пероксида водорода, электросинтезированных из кислорода, для решения конкретных задач.
ВВЕДЕНИЕ
В концепции развития современных химических технологий, соответствующих принципам “Green Chemistry” и устойчивого развития, большое внимание уделяется широкому использованию водных растворов пероксида водорода как экологически чистого окислителя [1]. Область его применения необычайно широка: водные растворы Н2О2, полученные по промышленным технологиям, используют в целлюлозно-бумажной промышленности, при производстве моющих и дезинфицирующих средств, на предприятиях гидрометаллургии, при очистке сточных вод, жидкофазном окислении экзометаболитов в замкнутых системах жизнеобеспечения, и во многих других сферах жизнедеятельности, где требуется экологически чистый окислитель [2].
В последние 20 лет большое внимание уделяется непрямому электрокаталитическому окислению органических и неорганических субстратов активными формами кислорода (АФК) (О3, Н2О2, ${\text{H}}{{{\text{O}}}^{\centerdot }}$, ${\text{HO}}_{2}^{ - }$, ${\text{HO}}_{2}^{\centerdot }$, RООН и т.д.), которые могут быть генерированы при анодном окислении воды и пероксида водорода на Pt, допированных бором алмазных электродах (ДБАЭ) и электродах на основе диоксидов свинца, олова, марганца и т.п., и катодном восстановлении кислорода до пероксида водорода на углеграфитовых материалах [3–8]. Предполагается, что на их базе можно создать высокоэффективные прогрессивные окислительные процессы “Advanced Oxidation Processes” (OAPs) [8]. Однако более широкое использование пероксида водорода ограничено его сравнительно высокой стоимостью при производстве по традиционным технологиям [9, 10]. В связи с этим в течение многих лет предпринимаются попытки разработки более дешевого и простого способа производства его водных растворов необходимой концентрации.
Известно [2, 9–12], что пероксид водорода сравнительно просто получают электровосстановлением кислорода на углеграфитовых электродах в щелочных растворах (процесс Берля [11]):
(1)
${{{\text{О}}}_{2}} + 2{\text{е}} + {{{\text{Н}}}_{2}}{\text{О}} \to {\text{Н}}{{{\text{О}}}_{2}}^{ - } + {\text{О}}{{{\text{Н}}}^{ - }},$(2)
${{{\text{О}}}_{2}} + 2{{{\text{Н}}}^{ + }} + 2{\text{е}} \to {{{\text{Н}}}_{2}}{{{\text{О}}}_{2}}.$Следует отметить, что этот способ является безотходным и позволяет получать Н2О2 на месте потребления в виде разбавленных водных растворов и использовать их в качестве товарного продукта без предварительного выделения Н2О2, что значительно снижает его стоимость [2, 10, 12]. При этом водные растворы пероксида водорода легко поддаются концентрированию ввиду того, что давление пара воды более чем на порядок выше давления пара Н2О2 (17 мм рт. ст. против 1.36, 20°С) [13], что позволяет с высокой эффективностью по затратам получать растворы с необходимой концентрацией Н2О2 и использовать их в условиях ex situ, т.е. вне объема электролизера.
Известно, что пероксид водорода в гомогенных реакциях способен взаимодействовать с субстратами и кислородсодержащими интермедиатами ${\text{OH}}_{2}^{ - }$, ${\text{HO}}_{2}^{\centerdot }$, ${\text{H}}{{{\text{O}}}^{\centerdot }}$, собственная активность которых различается на 5–6 порядков [14]. Общепринято, что наиболее активным из указанных радикалов является ${\text{H}}{{{\text{O}}}^{\centerdot }}$ (Е0${\text{H}}{{{\text{O}}}^{\centerdot }}$/Н2О = 2.8 В), наименее – ${\text{HO}}_{2}^{\centerdot }$ (Е0${\text{HO}}_{2}^{\centerdot }$/Н2О = 1.65 В) [6]. В связи с этим при использовании Н2О2 возможно проведение окислительных процессов разной глубины в условиях in situ с использованием сопряженных реакций гетерогенного восстановления кислорода до пероксида водорода и гомогенного окисления органических и неорганических субстратов в объеме электролита [15–17], чему посвящено большое количество статей и обзоров в отечественной и зарубежной литературе, например [2–6, 15, 17–32].
Целью представленной статьи является анализ и обобщение экспериментальных результатов, полученных группой исследователей в Институте химии и химической технологии ФИЦ КНЦ СО РАН, в ходе многолетнего комплексного исследования процесса электросинтеза водных растворов Н2О2 из О2 в сажевых газодиффузионных электродах (ГДЭ) и обсуждение перспектив практического использования данного подхода в условиях in situ и ex situ.
ЭЛЕКТРОСИНТЕЗ Н2О2 ИЗ О2
Ранее полученные результаты электросинтеза пероксида водорода из кислорода в ГДЭ на основе отечественных углеграфитовых материалов (ацетиленовая сажа А437-Э, печные сажи П268Э, П324-Э, П701, П602, П805-Э, П399-ЭТ) в растворах с различным рН обобщены в [12, 17]. При тестировании разработанных ГДЭ на основе ацетиленовой сажи А437-Э с площадью видимой поверхности 64 см2 в электролизере фильтр-прессного типа в электролите состава K2SO4 (0.5 М) + H2SO4 (0.2 М) + ТБАБ (0.005 М) получен раствор Н2О2 с концентрацией 3.0 М через 9 ч электролиза с выходом по току (ВТ) в пределах 80.0%. Близкие результаты были получены при испытаниях образцов ГДЭ аналогичного состава с площадью видимой поверхности 900 см2. Полученные данные свидетельствуют о том, что значительное увеличение (в 14 раз) габаритных размеров площади видимой поверхности разработанных ГДЭ практически не влияет на показатели электросинтеза. Кроме этого было установлено, что наиболее эффективным электрокатализатором в ряду изученных марок саж является ацетиленовая сажа А437-Э.
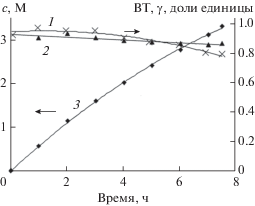
В течение последних лет нами продолжены исследования по подбору и тестированию новых марок технического углерода отечественного производства (ООО “Омсктехуглерод”) в качестве перспективных электрокатализаторов для электросинтеза Н2О2 из О2 в ГДЭ [33, 34]. Установлено, что для ГДЭ на основе углеродных материалов марок N220, С140 и СН85 восстановление кислорода в щелочном и кислом электролитах протекает через стадию образования гидропероксид-иона и пероксида водорода со сравнительно высокой селективностью (γ = 0.8). Так, в ГДЭ на основе техуглерода марки N220 были получены растворы пероксида водорода с концентрацией 0.56 М в течение 1 ч при выходе по току 87%. Полученные результаты указывают на перспективность использования новых марок в качестве электрокатализаторов для электросинтеза Н2О2 из О2. Особенно интересные данные были получены при исследовании мезоструктурированного углерода СМК-3. Мезоструктурированные мезопористые углеродные материалы являются новым классом перспективных материалов для различных приложений в электрохимии. Основным преимуществом мезоструктурированных углеродных материалов, полученных методом темплатного синтеза, по сравнению с другими наноформами углерода, является большая площадь поверхности, упорядоченная мезопористая структура, высокая электропроводность и относительно низкая стоимость [35]. В [36, 37] приведены данные по исследованию мезоструктурированного углерода СМК-3 (Carbon Mesostructured by KAIST), в качестве электрокатализатора для электросинтеза Н2О2 из О2 в газодиффузионном электроде в щелочном и кислом растворах. Результаты препаративного электросинтеза Н2О2 представлены на рис. 1, откуда видно, что кинетика накопления Н2О2 подчиняется параболическому закону, а выход по току и селективность процесса составляют более 80% и 0.8 соответственно. За 7.5 ч электролиза при плотности тока 1500 А/м2 получена концентрация пероксида водорода более 3 М в растворе состава 0.5 М K2SO4 : 0.1 М H2SO4 (3 : 1). Приведенные характеристики эффективности синтеза водных растворов Н2О2 заметно превосходят результаты, имеющиеся в мировой литературе [38], что указывает на перспективность использования данного материала в газодиффузионных электродах для практически значимых применений.
ПРОЦЕССЫ in situ
Окисление формальдегида до муравьиной кислоты
В [39] исследовано окисление формальдегида ${\text{HO}}_{2}^{ - }$, in situ генерированным из О2 в сажевом ГДЭ в 1 М NaOH в ячейке с разделенными катионообменной мембраной МФ-4СК-100 катодным и анодным пространствами при 20°С. Установлено, что окисление формальдегида протекает только до муравьиной кислоты с количественным выходом в соответствии с уравнением:
(3)
$\begin{gathered} 2{\text{НСНО}} + {\text{НО}}_{2}^{ - } + {\text{ О}}{{{\text{Н}}}^{--}} \to \\ \to 2{\text{НСО}}{{{\text{О}}}^{--}}~ + {\text{ }}{{{\text{Н}}}_{2}}{\text{О}} + {{{\text{Н}}}_{2}}{\kern 1pt} \uparrow . \\ \end{gathered} $Наличие в объеме формальдегида и муравьиной кислоты практически не влияет на поляризацию электрода и на генерацию иона ${\text{НО}}_{2}^{ - }$, а увеличение плотности тока от 250 до 2000 А/м2 не изменяет ВТ ${\text{НО}}_{2}^{ - }$.
Окисление малеиновой кислоты до яблочной
В [40] исследована кинетика и селективность процесса окисления малеиновой кислоты в ячейке с газодиффузионным сажевым катодом, платиновым анодом, и катионообменной мембраной в 1 М Na2SO4 при плотности тока 500 и 1000 А/м2, с исходной концентрацией субстрата 0.215 М при 12–30°С. Анализ исследуемых проб методом ИК-спектроскопии показал, что продукты представляют собой смесь соли яблочной кислоты в качестве основного продукта, непрореагировавшей малеиновой кислоты и незначительного количества эпоокиси. Установлено, что увеличение плотности тока и температуры практически не влияют на скорость окисления субстрата, а конверсия после 12 ч электролиза составляла 56–58%. Было показано, что при электролизе в ячейке без мембраны происходит ее минерализация, т.к. конечными продуктами окисления малеиновой кислоты являются только СО2 и Н2О, и предложен маршрут ее протекания:
(4)
$\begin{gathered} {\text{Н}}{{{\text{О}}}_{2}}{\text{ССН = СНС}}{{{\text{О}}}_{2}}{\text{Н}} \to \\ \to {\text{Н}}{{{\text{О}}}_{{\text{2}}}}{\text{ССН}}{\kern 1pt} - {\kern 1pt} {\text{СН}}\left( {{\text{ОН}}} \right){\text{С}}{{{\text{О}}}_{2}}{{{\text{Н}}}^{ \bullet }} \to \\ \to {\text{Н}}{{{\text{О}}}_{2}}{\text{СС}}{{{\text{Н}}}_{2}}{\kern 1pt} - {\kern 1pt} {\text{СН}}\left( {{\text{ОН}}} \right){\text{С}}{{{\text{О}}}_{2}}{\text{Н}} \to {\text{С}}{{{\text{О}}}_{2}} + {{{\text{Н}}}_{2}}{\text{О}}. \\ \end{gathered} $Непрямой электросинтез адипиновой кислоты из циклогексанола
Адипиновая кислота является широко востребованным продуктом и до настоящего времени предпринимаются попытки разработки более экологически чистых способов ее получения [41]. В [42, 43] исследована возможность получения адипиновой кислоты путем редокс-медиаторного окисления циклогексанола и циклогексанона на оксидо-гидроксидно-никелевом электроде –Ni(O)OH-аноде (ОГНЭ) и представлен механизм окисления циклогексанола на Ni(O)OH-электроде в водном растворе NaOH. Было установлено, что процесс окисления идет через лимитирующую стадию образования циклогексанона с последующим окислением его до адипиновой кислоты:
(5)
$\begin{gathered} {\text{С}}{{{\text{Н}}}_{2}}{{\left( {{\text{С}}{{{\text{Н}}}_{2}}} \right)}_{4}}{\text{СНОН}} \to {\text{С}}{{{\text{Н}}}_{2}}{{\left( {{\text{С}}{{{\text{Н}}}_{2}}} \right)}_{4}}{\text{СО}} \to \\ \to {\text{С}}{{{\text{О}}}_{2}}{\text{Н}}{{\left( {{\text{С}}{{{\text{Н}}}_{2}}} \right)}_{4}}{\text{С}}{{{\text{О}}}_{2}}{\text{Н}}. \\ \end{gathered} $В [44] проведено исследование влияния на эффективность этого процесса ряда факторов (плотности тока, концентрации субстрата, количества пропущенного электричества) при его проведении на пористом Ni(O)OH-электроде с участием АФК. Установлено, что выход по току адипиновой кислоты достигает максимального значения при плотности тока 220 А/м2 с выходом по току 50.0%, и по веществу 50.0% в схеме с добавлением пероксида водорода. Селективность образования адипиновой кислоты также растет с увеличением плотности тока и достигает 91.0% при 250 А/м2 в присутствии Н2О2 в растворе электролита, однако выход по току целевого продукта снижается и составляет 42%. Побочными продуктами являются глутаровая и янтарная кислоты.
Из анализа данных электронного парамагнитного резонанса (ПМР) было установлено, что селективность образования адипиновой кислоты может достигать 89% при оптимальной плотности тока электролиза (220 А/м2) и при наличии источников АФК, т.е. появление дополнительного количества АФК увеличивает селективность образования адипиновой кислоты. При этом одновременно реализуются два канала окисления – гетерогенный электрокаталитический и гомогенный химический. Увеличение количества пропущенного электричества сверх необходимого (Q/Qтеор) до 3 приводит к снижению селективности синтеза адипиновой кислоты за счет увеличения образования побочных продуктов (глутаровой и янтарной кислот). На основании полученных результатов можно сделать вывод, что при редокс-медиаторном окислении циклогексанола на ОГНЭ-аноде с высшими оксидами никеля, сопровождающимся in situ генерирацией АФК из Н2О2 и О2, оптимизация его проведения позволяет достигать рекордной селективности 89% и получать целевой продукт в одну стадию.
Непрямое электрокаталитическое окисление алифатических спиртов до карбоновых кислот
Алифатические карбоновые кислоты, их соли и эфиры находят широкое применение в фармацевтической, витаминной, косметической и пищевой промышленности [45]. Известно, что химические способы получения карбоновых кислот путем окисления алифатических спиртов имеет ряд недостатков, связанных с использованием сравнительно дорогих и токсичных химических окислителей, таких как перманганат калия, соединения хрома и т.п. [45, 46]. По этой причине проводится поиск альтернативных, в том числе электрохимических способов синтеза. Ранее было установлено, что для окисления спиртов наиболее подходящим анодным материалом, эффективно превращающим насыщенные алифатические спирты в карбоновые кислоты в щелочной среде, являются ОГНЭ со сформированными на них высшими оксидами никеля [4, 43, 46].
В [47–50] нами изучено непрямое окисление бутилового, гексилового, нонилового и децилового спиртов до масляной, капроновой, пеларгоновой и каприновой кислот активными формами химически связанного кислорода in situ генерированными из О2, Н2О и Н2О2 с использованием в качестве анодов ОГНЭ, диоксида свинца и ДБАЭ. Были реализованы три схемы электролиза: 1-я – окисление на аноде, где процесс может протекать как в гомогенных, так и в гетерогенных условиях; 2-я схема – окисление на аноде с добавлением Н2О2; 3-я схема – парный электролиз – окисление на аноде с параллельной генерацией ${\text{HO}}_{2}^{ - }$ на графитовом катоде при обдувании его кислородом.
Установлено, что в парных электросинтезах окисление спиртов протекает с большим выходом по току до соответствующей карбоновой кислоты по псевдо-первому порядку, и оптимальными являются плотности тока 50–100 А/м2. Согласно данным УФ-спектроскопии и определения химического потребление кислорода (ХПК) с увеличением плотности тока в интервале 150–500 А/м2 окисление идет с последующей минерализацией до СО2 и Н2О.
Препаративные опыты по наработке и выделению целевых продуктов – кислот с использованием схемы парного электролиза показали следующие результаты: на ОГНЭ в 1.2 М NaOH получены масляная кислота с ВТ 168%, капроновая с ВТ 148%, каприновая с ВТ 64%, на ДБАЭ в 0.1 M H2SO4 получена пеларгоновая кислота с выходом по току 98%. В [50] представлены результаты приближенных расчетов расхода электроэнергии на 1 т произведенного целевого продукта.
Таким образом, установлено, что наибольшая эффективность окисления спиртов до целевых карбоновых кислот достигается в условиях парного электролиза при параллельной с основным процессом генерации активных форм кислорода, обеспечивающих дополнительный канал гомогенного окисления субстрата.
Непрямое окисление уксусной кислоты до перуксусной
Интерес к перуксусной кислоте обусловлен широким спектром ее использования в качестве сильного окислителя [51]. Перуксусная кислота является идеальным дезинфицирующим средством в медицине и пищевой промышленности [52]. Однако ее широкому применению препятствует высокая стоимость, которая отчасти связана с ее ограниченным производством. Перуксусную кислоту получают взаимодействием концентрированного пероксида водорода с ледяной уксусной кислотой в присутствии кислотного катализатора по реакции:
(6)
${\text{С}}{{{\text{Н}}}_{3}}{\text{СООН}} + {{{\text{Н}}}_{2}}{{{\text{О}}}_{2}} \to {\text{С}}{{{\text{Н}}}_{3}}{\text{СОООН}} + {{{\text{Н}}}_{2}}{\text{О}}.$Интерес к in situ получению перуксусной кислоты обусловлен потенциально бóльшей безопасностью вследствие использования разбавленных растворов пероксида водорода и уксусной кислоты.
В работах [53, 54] впервые была показана возможность получения перуксусной кислоты с использованием in situ генерированного H2O2 в газодиффузионном катоде при восстановлении О2 с использованием в качестве катализатора Nafion и Pt. Однако нарабатываемые концентрации перуксусной кислоты были низкими и составляли 0.0021–0.0062 М при концентрации H2O2 – 0.147 М. В [55] нами исследовано влияние состава электролита, плотности тока и природы катализаторов на эффективность непрямого электросинтеза более высоких концентраций перуксусной кислоты с использованием in situ электрогенерированного пероксида водорода в ГДЭ на основе технического углерода А 437-Э и платинового анода. Установлено, что добавление в электролит серной кислоты в качестве кислотного катализатора увеличило концентрацию нарабатываемой перуксусной кислоты до 0.0092 М. Увеличение концентрации уксусной кислоты более 3.5 М отрицательно сказалось на работе ГДЭ – наблюдалось существенное снижение его электрохимической активности. Добавление молибденовокислого аммония в качестве катализатора-активатора Н2О2 положительно повлияло на эффективность процесса. С увеличением количества пропущенного электричества и плотности тока до 1500 А/м2 одновременно возрастают нарабатываемые концентрации перуксусной кислоты до 0.021 М и концентрация H2O2 до 1.46 М. Установлено, что при выдерживании растворов после электролиза (10 и 25°С) в условиях ex situ происходит увеличение выхода CH3CO3H со временем до равновесной концентрации, составляющей 0.056 M. Это свидетельствует о замедленной кинетики химической стадии. При этом, чем выше концентрации полученных при электролизе CH3CO3H и H2O2, тем выше концентрация перуксусной кислоты, образующейся на стадии “дозревания”. Использование двух типов катализаторов: серной кислоты и молибденовокислого аммония увеличивают скорость образования перуксусной кислоты в ходе электролиза, а одновременное их использование позволяет нарабатывать растворы с концентрацией 0.021 M, т.е. на порядок более высокой по сравнению с нарабатываемыми в [51, 53, 54]. Близкие результаты были нами получены в [56] при электросинтезе пероксида водорода из кислорода в водных растворах электролитов K2SO4 + + H2SO4 в присутствии муравьиной, уксусной и масляной кислот. Более высокие результаты, полученные нами, связаны с высокой производительностью газодиффузионного катода по генерации Н2О2 при плотности 1500 А/м2 против 27 А/м2 в [51, 53, 54].
Разрушение органических и неорганических поллютантов
Известно [2], что расход электроэнергии для обеззараживания органических токсикантов в сточных водах пропорционален их концентрации и числу электронов, необходимых для их деструкции до СО2. Как правило, для столь глубокого окисления органических молекул требуется от 20 до 150 электронов. Расход электроэнергии на электросинтез Н2О2 из О2, согласно патенту [57], составляет 4.5 кВт ч в расчете на 1 кг 100% Н2О2. Таким образом на получение молекулы Н2О2 из О2 требуется два электрона, а на минерализацию органических поллютантов необходимо затратить от 10 до 75 молекул пероксида. Из этого следует, что использование метода непрямого окисления при низких концентрациях (перед направлением на биологическую очистку) органических субстратов-“хвостов”, содержащихся в сточных водах, электрогенерируемым Н2О2 экономически целесообразно. В качестве примера непрямого деструктивного разрушения органических и неорганических субстратов нами исследованы процессы окисления наиболее широко распространенных поллютантов в технологических и сточных водах различного происхождения.
Минерализация формальдегида и муравьиной кислоты
В [58, 59] исследовано окисление формальдегида в присутствии солей Fe(II) в кислых растворах (электро-Фентон), где происходит образование гидроксильных радикалов по реакции:
(7)
${{{\text{Н}}}_{2}}{{{\text{О}}}_{2}} + {\text{F}}{{{\text{e}}}^{{2 + }}} \to {\text{Н}}{{{\text{О}}}^{\centerdot }} + {\text{F}}{{{\text{e}}}^{{3 + }}} + {\text{O}}{{{\text{H}}}^{ - }}.$Установлено, что продуктами окисления являются НСООН, СО2 и Н2О. Оптимальные условия реализуются в диапазоне рН 3–4 и 60°С. Увеличение плотности тока от 250 до 2000 А/м2 не влияет на степень конверсии формальдегида – она близка к 100%, но приводит к увеличению скорости конверсии и уменьшению продолжительности электролиза в 8 раз. Кинетика процесса лимитирована скоростью генерации Н2О2. Конечными продуктами окисления являются СО2 и Н2О.
В [59] исследовано деструктивное окисление муравьиной кислоты интермедиатами $^{\centerdot }{\text{OH}}$, ${\text{HO}}_{2}^{\centerdot }$, генерируемыми in situ из Н2О и Н2О2 в бездиафрагменной ячейке с платиновым анодом и ГДЭ-катодом в электролитах с различным рН. Установлено, что при повышении плотности тока до 1000 А/м2 конверсия НСООН растет и далее не изменяется, в кислых электролитах она более высокая, чем в щелочных и составляет ~99.0% при рН 3.2. Продуктами окисления являются, как и следовало ожидать, СО2 и Н2О.
Деструктивное окисление фенола
Известно, что фенол – один из наиболее распространенных и трудно окисляемых экотоксикантов, содержание которого может колебаться в широких пределах (0.106–2.12 мМ), способен окисляться пероксидом водорода до СО2 и Н2О по реакции:
(8)
${{{\text{С}}}_{6}}{{{\text{Н}}}_{5}}{\text{ОН}} + 14{{{\text{Н}}}_{2}}{{{\text{О}}}_{2}} \to 6{\text{С}}{{{\text{О}}}_{2}} + 17{{{\text{Н}}}_{2}}{\text{О}}.$В [60–62] нами изучено непрямое деструктивное окисление фенола в электрохимической ячейке с катионообменной мембраной и без нее, с сажевым газодиффузионным катодом, платиновым и диоксидно-свинцовым анодами, в щелочной, нейтральной и кислой средах в интервале плотностей тока 250–1500 А/м2 при 20°С. В [60] установлено, что в щелочной среде в трехкамерной ячейке с катионообменной мембраной МФ-4СК-100 продуктами окисления являются органические кислоты и кетоны, промежуточные продукты с сопряженными двойными связями накапливаются при недостатке окислителя, а на эффективность процесса при выбранных плотностях тока существенное влияние оказывает концентрация гидроксида натрия. Наибольшая эффективность окисления (78%) была достигнута в 0.1 М растворе NaOH в течение 3 ч при плотности тока 500 А/м2.
В [61] исследована зависимость скорости и эффективности деструктивного окисления фенола пероксидом водорода, электрохимически генерированным из кислорода в газодиффузионном электроде в щелочной среде в электролизере без катионообменной мембраны в растворах NaOH 0.05, 0.1, 0.5 М при плотности тока 250, 500, 1000, 1500 А/м2. В качестве анода использовали гладкую платину. В электролизере без катионообменной мембраны ${\text{HO}}_{2}^{ - }$ по условиям электропереноса будет переноситься к аноду и окисляться до пергидроксильного радикала ${\text{HO}}_{2}^{\centerdot }$. Кроме того, ОН–, окисляясь на аноде, будет давать радикалы $^{\centerdot }{\text{OH}}$. Поэтому в электролизере без катионообменной мембраны с участием платинового анода можно ожидать более глубокое окисление фенола вплоть до его минерализации. Найденные значения характерных времен деструкции при различных плотностях тока показывают, что оптимальные условия реализуются в 0.1 М растворе при плотности тока 1000 и 1500 А/м2. Эффективность окисления фенола снижается с увеличением его исходной концентрации – при начальной концентрации 0.265, 0.53, 1.06 и 2.12 мМ она составила 86, 85, 70 и 60% соответственно. Методами ИК- и УФ-спектроскопии установлено, что окисление фенола протекает по двум каналам: прямое окисление на аноде с образованием смолистых соединений и его гомогенное окисление активными интермедиатами ($^{\centerdot }{\text{OH}}$, ${\text{HO}}_{2}^{\centerdot }$) в прианодном слое. После электролиза в течение 2–3 ч в электронных спектрах отсутствуют полосы поглощения фенола и промежуточных продуктов (карбоновые кислоты с полосами поглощения 3350 и 1725 см–1, β-дикетоны в енольной форме с полосами 1592 и 2900, хиноны и α-дикетоны), что свидетельствует о практически полной минерализации фенола при плотности тока 1000 и 1500 А/м2 и его исходной концентрации 0. 265–0.53 мМ.
В [62] изучено непрямое окисление фенола в кислых (рН 2–3) и нейтральных (рН 6–7) средах в бездиафрагменном электролизере с газодиффузионным катодом, платиновым и диоксидносвинцовым анодами при плотности тока 500 и 1000 А/м2. Результаты УФ-спектроскопии, полученные при анализе растворов в ходе проведения электролиза при одинаковом количестве пропущенного электричества, указывают на различную глубину окисления фенола в кислом и нейтральном электролитах. Так, в кислых электролитах окисление фенола протекает с образованием хинона и гидрохинона (в качестве промежуточных продуктов), с последующим раскрытием ароматического кольца, образованием комплексов железа с лигандами карбоксильного типа и их дальнейшим разрушением до СО2 и Н2О. В нейтральных растворах обнаружены полосы поглощения, характерные для дикетонов и карбоновых кислот. Следует отметить, что близкие результаты получены в ряде зарубежных работ в близких условиях [30, 63–66], но при менее эффективной работе ГДЭ при электросинтезе пероксида водорода.
Таким образом, можно констатировать, что процесс окисления фенола с 96–98% минерализацией до СО2 и Н2О возможен в щелочном электролите (0.1 М NaOH) без катионообменной мембраны с участием $^{\centerdot }{\text{OH}}$, ${\text{HO}}_{2}^{\centerdot }$ и в кислых электролитах, где окисляющим агентом является НО•, а в нейтральной среде непрямое окисление протекает с участием менее активных ион-радикалов ${\text{HO}}_{2}^{\centerdot }$, что позволяет перевести трудноокисляемый фенол в простые моно- и дикарбоновые кислоты, которые могут быть утилизированы микроорганизмами в ходе дальнейшей биохимической очистки.
Деструктивное окисление N-метил-n-аминофенола (метола)
Ароматические амины широко используются в промышленности, например, в качестве исходных и промежуточных продуктов в производстве красителей, лекарственных препаратов и являются типичными загрязнителями гидросферы [67].
В [68–70] нами проведено исследование непрямого электрохимического окисления N-метил-n-аминофенола активными формами кислорода, in situ генерированными из О2, Н2О и Н2О2. Окисление N-метил-n-аминофенола проводили в бездиафрагменном электролизере с газодиффузионным сажевым и графитовым катодами и анодами из Pt, и PbO2 в щелочных и кислых электролитах. Установлено, что эффективность окисления возрастает с увеличением плотности тока, при этом процесс протекает более эффективно в щелочном электролите, чем в кислом. В щелочном электролите при 700 А/м2 эффективность минерализации составила 98–99%, а в кислом электролита при 200 А/м2 – 30%. В общем случае непрямое окисление метола пероксидом водорода протекает c минерализацией до СО2 и Н2О на 98% в 0.1 М NaOH, а в 0.2 М NaOH эффективность минерализации снижается и составляет 65%.
Результаты УФ-спектроскопии показывают, что окисление метола при различных рН протекает по различным каналам последовательного окисления: при рН 2–3 образуются промежуточные продукты в основном карбоксилатного типа, а при рН 9–10 – продукты гидроксилирования метола с последовательным переходом в алифатические кислоты, которые далее окисляются до СО2 и воды. Подобная схема окисления метола описана в литературе [71, 72]. В заключение необходимо отметить, что в щелочной среде окисление метола с минерализацией до СО2 и Н2О в бездиафрагменных ячейках происходит с эффективностью 97–99% на всех изученных анодных материалах.
Деструктивное окисление β-нафтола
Сточные воды целлюлозно-бумажного производства содержат нафтол в значительных количествах и содержание его строго контролируется. ПДК для нафтола составляет 1.39 мМ [73]. Известно, что процесс деструктивного окисления β‑нафтола описывается брутто-уравнением [74]:
(9)
${{{\text{С}}}_{{10}}}{{{\text{Н}}}_{8}}{\text{О}} + 19{{{\text{Н}}}_{2}}{\text{О}} \to 10{\text{С}}{{{\text{О}}}_{2}} + 46{{{\text{Н}}}^{ + }} + 46{\text{е}}.$Из представленного уравнения следует, что в идеальном случае для полной минерализации молекулы β-нафтола необходимо затратить 46 электронов, т.е. этот процесс сравнительно энергоемкий. В связи с этим возможно наиболее экономически эффективным вариантом нейтрализации нафтола является остановка процесса на стадии образования биоутилизируемых алифатических карбоксильных соединений.
В [75, 76] нами проведено исследование непрямого электрокаталитического окисления β‑нафтола активными формами кислорода, in situ генерированными из О2, Н2О и Н2О2 в бездиафрагменном электролизере с газодиффузионным сажевым и графитовым катодами и анодами из Pt, Pb/PbO2 в щелочных и кислых электролитах состава 0.1 М NaOH и 0.5 М H2SO4. Установлено, что скорость окисления β-нафтола в электрохимической ячейке с газодиффузионным катодом и Pt-анодом растет симбатно с увеличением плотности тока (т.е. с увеличением скорости генерации окислителя). Для оценки эффективности работы электрохимической ячейки в процессе деструктивного окисления β-нафтола определяли ее коэффициент полезного действия (η) как в [77], позволяющий сравнивать эффективность различных ячеек и выбирать оптимальные условия проведения электролиза. Так, например, для ячейки с газодиффузионным катодом при концентрации нафтола 1.387 мМ окисление целесообразно проводить при плотности тока 500 А/м2, при этом η = 16%, при i = 1500 А/м2 η = 7.5%, для концентраций субстрата 6.94 мМ при i = 900–1000 А м–2 η = 29%. Аналогичные данные были получены в [78]. Это свидетельствует о том, что наиболее эффективно ячейка с газодиффузионным катодом работает в области малых значений плотности тока. Для ячейки с графитовым катодом и барботированием кислорода в щелочном электролите при пропускании тока 0.50 А и исходных концентраций нафтола 2.081 и 3.47 мМ лучшие использовать платиновый анод (η = 18%), чем свинцовый (η = 6.5%). Для кислых электролитов можно использовать как свинцовый анод, так и платиновый (η = 15.6%) при одинаковых условиях проведения электролиза. Величина η принимает большие значения при увеличении концентрации субстрата, что, вероятно, определяется скоростью диффузии растворенных веществ в зону реакции. Результаты определения ХПК показали, что эффективность минерализации β-нафтола снижается с увеличением его исходной концентрации в исследуемом растворе. Так при исходной концентрации β-нафтола 1.389 мМ эффективность составляет 95%, а при 6.94 мМ – 75% при плотности тока 900 А/м2.
На основании результатов УФ-спектроскопии предложена следующая схема последовательного окисления нафтола: β-нафтол → гидроксилированные производные нафтола → хиноны → кетоны → органические кислоты → продукты минерализации (СО2 и Н2О). Полученные результаты свидетельствуют о том, что эффективность окислении β-нафтола в ячейке с ГДЭ зависит от плотности тока и концентрации субстрата, в ячейке с графитовым катодом и барботированием кислорода через раствор лучшим анодным материалом в кислом электролите является Pt, а в щелочном – Pb/PbO2, эффективность окисления зависит от концентрации субстрата.
Деструктивное окисление бензола
В [69] нами изучено непрямое деструктивное окисление бензола интермедиатами, in situ генерированными из О2, Н2О и Н2О2 в 2- и 3-камерных электролитических ячейках с использованием сажевого газодиффузионного катода, генерирующего Н2О2 из О2, с анодами из Pt и диоксида свинца в водных растворах с различным рН. Реализованы схемы с in situ генерированным Н2О2 из О2 и с добавлением пероксида водорода в электролит. Установлено, что гидроксилирование бензола до фенола с газодиффузионным катодом в 2-камерной ячейке малоэффективно из-за пассивации сажевого катода за счет адсорбции бензола. Окисление бензола в 3-камерной ячейке с фильтрующей диафрагмой, предотвращающей непосредственный контакт бензола с ГДЭ, протекало с минерализацией до СО2 и Н2О, степень окисления составила от 94.8% (Pb/PbO2, pH 2), до 63.5% (Pt-анод, рН 2.8, $c_{{{\text{Fe}}}}^{{2 + }}$ = 7.1 × 10–6 М (вариант электро-Фентона). Основными интермедиатами являлись фенол, гидрохинон, резорцин, n-бензохинон. Аналогичные промежуточные продукты наблюдали авторы [79] при окислении бензола на вращающемся дисковом ДБА-аноде. Более низкая эффективность окисления при использовании схемы с электро-Фентоном в ячейке с платиновым анодом, по-видимому, связана с образованием трудноокисляемых оксалатных комплексов с Fe3+, наличие которых подтверждают результаты УФ-спектроскопии. Конечными продуктами окисления бензола для всех вариантов деструкции являлись СО2 и Н2О. Сопоставление полученных нами данных с литературными [79] позволяют сделать вывод, что в зависимости от материала анода возможно эффективное непрямое окисление бензола до фенола и далее через раскрытие бензольного кольца до его полной минерализации в присутствии Н2О2 и с анодами из оксидов металлов, in situ генерирующими радикалы НО• путем окисления Н2О, по брутто-реакции:
Деструктивное окисление анилина
Анилин является высокотоксичным и канцерогенным веществом. Его содержание в воде строго регламентируется. В [80] нами проведено исследование непрямого окисления анилина на Pb/PbO2 и ДБАЭ в сернокислом электролите с участием АФК при различных схемах их генерации в бездиафрагменном электролизере при плотностях тока 250, 500 и 1000 А/м2 при 20°С. Исходное содержание анилина в растворах составляло 0.537, 1.074, 2.147 мМ. Установлено, что процесс непрямого окисления анилина на Pb/PbO2 электроде при рН 2–3 наиболее эффективно протекает при использовании схемы – анодное окисление + реагент Фентона. При увеличении плотности тока эффективность процесса становится мало зависящей от способа генерации АФК. На ДБАЭ в 0.1 М H2SO4 эффективность окисления анилина составляет 90.0% для схемы окисления – анодное окисление + Н2О2. Методом УФ-спектроскопии установлено, что непрямое окисление анилина протекает через интермедиат n-бензохинон, причем в присутствии пероксида водорода скорость окисления всех промежуточных продуктов увеличивается примерно в 2 раза. На основании полученных результатов можно заключить, что процесс непрямого окисления анилина может рассматриваться в качестве альтернативного (экстракционным и адсорбционным методам) для его деградации в сточных водах промышленных предприятий на электродах Pb/PbO2 и ДБАЭ.
Деструктивное окисление тиоцианатов
Основным источником водных растворов тиоцианатов (роданидов) являются гидрометаллургические процессы извлечения золота и серебра из сульфидсодержащих руд и концентратов. Сточные и оборотные воды, содержащие тиоцианаты, перед сбросом или повторным использованием необходимо подвергать глубокой очистке от этих высокотоксичных компонентов, которая осуществляется хлорсодержащими реагентами, использование которых приводит к быстрому коррозионному износу оборудования и осложнению экологической обстановки.
Деструктивное окисление тиоцианатов пероксидом водорода протекает по брутто-реакции:
(11)
${\text{SC}}{{{\text{N}}}^{ - }} + 5{{{\text{Н}}}_{2}}{{{\text{О}}}_{2}} \to {\text{SО}}_{4}^{{2 - }} + {\text{NН}}_{4}^{ + } + {\text{CО}}_{3}^{{2 - }} + 3{{{\text{Н}}}_{2}}{\text{О}}$В [81, 82] нами изучена кинетика и эффективность окисления тиоцианатов в кислой и щелочной средах с использованием Pt-анода и газодиффузионного катода, генерирующего пероксид водорода из кислорода, в электролитических ячейках с катионообменной мембраной и без мембраны. Установлено, что при окислении тиоцианатов в щелочной среде в ячейке с мембраной при увеличении силы тока от 0.25 до 0.50 А эффективная скорость окисления увеличивается приблизительно в 3 раза. Эффективность деструкции тиоцианатов с начальной концентрацией c0 = 18.36 мМ при пропускании одинакового количества электричества (1 А ч) составила 65.0 и 80.0% для силы тока 0.25 и 0.50 А соответственно. Продуктами окисления тиоцианатов являются в основном ${\text{CO}}_{3}^{{2 - }}$, ${\text{SO}}_{4}^{{2 - }}$, ${\text{NH}}_{4}^{ + }$, а также в небольшом количестве CNO−. При проведении процесса в ячейке без мембраны наряду с окислением SCN− пероксидом водорода, возможно также его прямое окисление на Pt-аноде. Кроме того, на аноде возможно окисление получаемого ${\text{HO}}_{2}^{ - }$, а также воды или гидроксил-ионов до ${\text{HO}}_{2}^{\centerdot }$ и НО•. Появление в системе дополнительного окисляющего агента в виде ${\text{HO}}_{2}^{\centerdot }$ приводит к увеличению как скорости, так и эффективности окисления тиоцианатов. Например, за 30 мин электролиза при токе 0.50 А эффективность составила 96% при наработке в газодиффузионном электроде пероксида водорода, тогда как только при анодном окислении – 62%. Установлено, что в кислой среде окисление тиоцианатов более эффективно протекает в ячейке без мембраны, чем по классической схеме реагентом Фентона в ячейке с мембраной. Конверсия тиоцианатов за 30 мин электролиза составила 71 и 52% соответственно.
При проведении процесса в ячейке без мембраны следует учитывать тот факт, что прямое окисление SCN− в кислой среде протекает до СN−-ионов, которые могут подвергаться либо дальнейшему окислению, либо гидролизу с образованием токсичного цианистого водорода.
Необходимо отметить, что при высоких исходных концентрациях тиоцианатов возможно проведение процесса в ячейке без мембраны с целью регенерации цианидов и их повторного использования в процессе выщелачивания [81]. Однако при низких концентрациях такой способ экономически нецелесообразен, а без организации улавливания выделяющегося HCN экологически небезопасен. В этом случае наиболее приемлемым является, на наш взгляд, способ окисления тиоцианатов в щелочной среде.
ПРОЦЕССЫ ex situ
Непрямой электросинтез пероксосольватов – продуктов молекулярного присоединения
Известно, что Н2О2 образует с большим количеством различных веществ молекулярные соединения, которые обладают высокой стабильностью и их можно выделить в твердом состоянии (пероксосольваты, пероксогидраты) и долго хранить [83]. В [84] нами проведено исследование электросинтеза Н2О2 из кислорода в газодиффузионном электроде на основе техуглерода А437-Э в растворах солей, образующих с ним молекулярные соединения, а также последующего получения их концентрированных растворов и выделения в твердом виде. В качестве электролитов были выбраны KF, натриевые и калийные соли фосфорной кислоты различного состава.
После электролиза некоторые полученные растворы Н2О2 подвергали концентрированию. Для этого растворы держали на воздухе в открытых полиэтиленовых сосудах при комнатной температуре в условиях, не допускающих воздействия прямого солнечного света и искусственного освещения, в течение 10–15 сут. Как было отмечено выше, в таких условиях происходит увеличение концентрации Н2О2 [13]. Концентрирование растворов с КF и KCl проводили до выделения соединений в твердом виде и последующей их сушке. При концентрировании растворов фосфатов получали густую гелеобразную массу. Установлено, что использование для электросинтеза веществ, образующих соединения с Н2О2, позволяет получать высокие концентрации пероксида водорода с высоким выходом по току. Наилучшие результаты получены в растворах КF (рН 7–8), который образует наиболее прочные соединения с Н2О2: за 7.5 ч при плотности тока 1500 А/м2 получен раствор пероксида водорода с концентрацией 3.6 М с выходом по току 92%. Близкие результаты получены в растворе Na2HPO4. Меньше всего выход по току и концентрация Н2О2 в растворах фосфатов калия. Полученные растворы Н2О2 подвергли концентрированию, например, раствор с KF был сконцентрирован до 20 М и далее в течение 20 сут подвергнут хранению в закрытом сосуде с целью предотвращения испарения воды и Н2О2. Наименьшие потери Н2О2 получены при концентрировании растворов с KF. Так при концентрировании растворов с KF с добавлением H3PO4 до рН 5–6 получен раствор с содержанием пероксида водорода 26.9 М и целевой продукт в твердом состоянии с концентрацией Н2О2 ~ 50.0 мас. %, с соотношением компонентов в молях 1 KF + 1.7 Н2О2. Установлено, что в течение этого времени концентрация Н2О2 практически не изменилась, что показывает высокую стабильность полученных растворов и твердых пероксосольватов. На основании полученных результатов можно сделать вывод, что водные растворы солей, образующих соединения с электросинтезированным Н2О2 в условиях in situ, в условиях ex situ могут представить интерес для использования их для концентрирования разбавленных растворов Н2О2 вплоть до 26.9 М, а также получения целевого продукта в твердом состоянии KF ⋅ 1.7 Н2О2 с концентрацией Н2О2 ~ 50.0 мас. % (см. табл. 2 в [84]).
Электросинтез Н2О2 в водных растворах минерализованных жидких и твердых отходов жизнедеятельности человека
Одной из важных проблем создания систем автономного жизнеобеспечения (САЖО) является переработка отходов жизнедеятельности человека на основе биологических массообменных процессов. Наиболее успешно эта задача решается при жидкофазном окислении экзометаболитов в присутствии 30% Н2О2 под воздействием переменного тока [85]. В то же время существенным недостатком этого способа является необходимость хранения значительных объемов пероксида водорода в замкнутой системе, что небезопасно и существенно ограничивает ресурс жизнеспособности системы в целом. В связи с этим для повышения безопасности и ресурса САЖО необходимо in situ получать растворы Н2О2 из имеющихся в замкнутом пространстве веществ и концентрировать их в условиях ex situ. Электросинтез Н2О2 из О2 и Н2О в ГДЭ отвечает всем этим требованиям.
В [86] нами исследован процесс электросинтеза Н2О2 в водных растворах (рН 1–9) минерализованных жидких и твердых отходов жизнедеятельности человека. В качестве католита использовали раствор минерализованных экзометаболитов (МЭМ), полученный в Институте биофизики СО РАН (г. Красноярск, Россия), анолита – одномолярный раствор H2SO4. Установлено, что генерация пероксида водорода проходит при потенциалах более положительных, чем потенциал выделения водорода в этих условиях, что повышает безопасность и эффективность его производства. Очевидно, что скорость накопления Н2О2 в электролите определяется разностью скоростей электросинтеза в ГДЭ и его химического разложения в электролите [12]. В растворах МЭМ достигается его более высокие концентрация и выход по току, чем в 0.5 М КОН, причем изменение рН растворов не влияет на эффективность синтеза целевого продукта. Высокая во всех синтезах селективность процесса показывает, что в объеме электрода не происходит разложение Н2О2 или дальнейшее его восстановление до воды. Это свидетельствует о том, что присутствие в МЭМ большого числа различных соединений не ухудшает показатели процесса синтеза Н2О2, а даже способствует его накоплению. Подобное явление мы наблюдали при электросинтезе Н2О2 в щелочной водной суспензии бурого угля, которая содержит большое количество разнообразных органических и неорганических соединений [87, 88]. При плотности тока 2000 А/м2 в этом растворе значение γ составляло 0.97–0.95.
Результаты электросинтеза Н2О2 в ГДЭ с рабочей поверхностью 64 см2 при плотности тока 1000 А/м2 свидетельствуют о накоплении целевого продукта до 1.6 М при ВТ 50%. Более низкие показатели ВТ в данном случае связаны с повышением температуры электролиза до 40°С и разложением пероксида. Для проверки устойчивости полученных растворов Н2О2 их держали в условиях ex situ на воздухе в закрытых полиэтиленовых стаканах в течение 10 сут – опыты показали, что растворы устойчивы и целевой продукт практически не разлагается. При нахождении растворов в открытых сосудах в течение 5 сут концентрация Н2О2 увеличилась с 2.4 до 11.3 М, а в течение следующих 5 сут – до 19 М. Потери Н2О2 при этом составили менее 20%. Эти эксперименты показали возможность концентрирования пероксида водорода в растворах МЭМ, и перспективность электролитического метода его получения на основе биологических массообменных процессов, что практически принципиально важно для процесса минерализации экзометаболитов в САЖО.
Полученные результаты принципиально показывают возможность значительного расширения области применения электросинтезированных в ГДЭ из кислорода растворов пероксида водорода в условиях ex situ, например, для их концентрирования, непрямого электросинтеза органических пероксокислот, жидких и твердых неорганических продуктов с высоким содержанием активного кислорода, и минерализации экзометаболитов в САЖО.
ЗАКЛЮЧЕНИЕ
На основании всей совокупности известных из литературы и полученных нами экспериментальных результатов можно констатировать, что растворы пероксида водорода, электросинтезированные из кислорода и воды могут быть с высокой эффективностью использованы в условиях in situ в традиционной области для отбелки целлюлозных полуфабрикатов, непрямого электросинтеза целевых органических и неорганических продуктов, а также разрушения и минерализации органических и неорганических поллютантов в технологических и сточных водах различного происхождения. В условиях ex situ такие растворы можно концентрировать до значительных величин (26.9 М и более) и использовать для получения органических пероксокислот, неорганических пероксосольватов и минерализации экзометаболитов в САЖО. Следует отметить, что из двух направлений использования электросинтезированных растворов Н2О2 из О2 в настоящее время наиболее развито направление in situ и менее развито ex situ, с которым связаны, на наш взгляд, большие перспективы.
Кроме того, высокоэффективная катодная генерация растворов пероксида водорода из кислорода с концентрацией более 3 М в сажевых газодиффузионных электродах на основе ацетиленовой сажи А437-Э и мезоструктурированного углерода СМК-3 в ячейках – электролизерах разнообразных конструкций и получение на его основе активных форм кислорода, обладающих несходной окислительной способностью, позволяет осуществлять окислительные процессы различной глубины, а использование различных схем электролиза (парный электролиз) позволяет проводить этот процесс с высокой эффективностью. Необходимо отметить, что производство таких растворов можно наладить в местах их конкретного потребления, например, в малодоступных районах, достаточно обеспеченных электроэнергией, из кислорода “технической” чистоты, а также из кислорода воздуха со снижением показателей электролиза на ~25–30%. Полученные результаты могут быть полезными при выборе наиболее рационального варианта использования растворов пероксида водорода, электросинтезированных из кислорода, для решения конкретных задач.
Список литературы
Anastas, P.T. and Warner, J.C., Green Chemistry: Theory and Practice. London: Oxford University Press, 1998. 144 p.
Pletcher, D., Indirect oxidations using electrogenerated hydrogen peroxide, Acta Chem. Scand., 1999, vol. 53, p. 745.
Корниенко, В.Л. Непрямое окисление органических веществ пероксидом водорода, электрохимически генерированным in situ из кислорода. Химия в интересах устойчивого развития. 2002. Т. 10. С. 391. [Kornienko, V.L., Indirect oxidation of organics by hydrogen peroxide electrochemically generated in situ from oxygen, Chemistry for sustainable development (in Russian), 2002, vol. 10, p. 391.]
Огибин, Ю.Н., Элинсон, М.Н., Никишин, Г.И. Органический электросинтез с использованием медиаторных систем окисления. Успехи химии. 2009. Т. 78. С. 99. [Ogibin, Yu.N., Elinson, M.N., and Nikishin, G.I., Mediator oxidation systems in organic electrosynthesis, Russ. Chem. Rev., 2009, vol. 78, p. 89.]
Brillas, E., Bastida, R.M., and Llosa, E., Electrochemical Destruction of Aniline and 4-Chloroaniline for Wastewater Treatment Using a Carbon–PTFE–O2 Fed Cathode, J. Electrochem. Soc., 1995, vol. 142, p. 1733.
Brillas, E., Sires, I., and Oturam, M.A., Electro-Fenton Process and Related Electrochemical Technologies Based on Fenton’s Reaction Chemistry, Chem. Rev., 2009, vol. 109, p. 6570.
Giomo, M., Boso, A., Sandona, G., Boye, B., and Farnia, G., A small-scale pilot plant using an oxygen-reducing gas-diffusion electrode for hydrogen peroxide electrosynthesis, Electrochim. Acta, 2008, vol. 54, p. 808.
Noyori, R., Pursuing practical elegance in chemical synthesis, Chem. Comm., 2005, p. 1807.
Шамб, У., Сеттерфилд, Ч., Вентворс, Р. Перекись водорода. М.: Изд-во ин. лит., 1958. 578 с. [Schumb, W.C., Satterfield, C.N., and Wentworth, R.L., Hydrogen peroxide. N. Y., Chapman and London, Hall Ltd., 1958. 578 p.]
Химия и технология перекиси водорода. Под ред. Серышева, Г.А., Л.: Химия, 1984. 200 с. [Chemistry and technology of hydrogen peroxide, Seryshev, G.A., Ed., L.: Chemistry, 1984, 200 p.]
Berl, B.E., A new cathodic process for the production H2O2, Trans. Electrochem. Soc., 1939, vol. 76, p. 359.
Корниенко, В.Л., Колягин, Г.А., Салтыков, Ю.В. Электросинтез Н2О2 из О2 на углеграфитовых электродах в щелочной среде. Журн. прикл. химии. 1999. Т. 72. С. 353. [Kornienko, V.L., Kolyagin, G.A., and Saltykov, Yu.V., Electrosynthesis Н2О2 from О2 at carbon electrodes in alkali medium, Russ J. Appl. Chem., 1999, vol. 72, p. 353.]
Титова, В.К., Никольская, В.П., Буянов, В.В., Супрун, И.П. Способы концентрирования и получения безводного пероксида водорода. Журн. прикл. химии. 2002. Т. 75. С. 1943. [Titova, V.K., Nikol’skaya, V.P., Buyanov, V.V., and Suprun, I.P., Methos for concentration of hydrogen peroxide to obtain it in anhydrous form, Russ. J. Appl. Chem., 2002, vol. 75, p. 1903.]
Высоцкая, Н.А. Реакционная способность радикалов НО•, О•–, ${\text{HO}}_{2}^{\centerdot }$ и атомов кислорода в водных растворах ароматических соединений. Успехи химии. 1973. Т. 42. С. 1843. [Vysotskaya, N.A., Reactivity of НО•, О•–, ${\text{HO}}_{2}^{\centerdot }$ radicals and oxygen atoms in aqueous solutions of aromatic compounds, Uspekhi Khimii (in Russian), 1973, vol. 42, p. 1843.]
Корниенко, В.Л., Чаенко, Н.В., Корниенко, Г.В. Непрямое электрохимическое окисление органических веществ активными формами кислорода. В кн.: Электрохимия органических соединений в начале XXI века. Под ред. Гультяя, В.П., Кривенко, А.Г., Томилова, А.П., М.: Комп. Спутник+, 2008. С. 147–177. [Kornienko, V.L., Chaenko, N.V., and Kornienko, G.V., Indirect electrochemical oxidation of organics by active oxygen forms, in Electrochemistry of organic compounds in the beginning of XXI century (in Russian), Guľtyay, V.P., Krivenko, A.G., and Tomilov, A.P., Eds., M.: Sputnic+, 2008, p. 147–177.]
Нагиев, Т.М. Сопряженные реакции окисления перекисью водорода. Успехи химии. 1985. Т. 54. С. 1654. [Nagiev, T.M., Conjugate reactions of oxidation by hydrogen peroxide, Uspekhi Khimii (in Russian), 1985, vol. 54, p. 1654.]
Корниенко, В.Л., Колягин, Г.А., Салтыков, Ю.В. Электросинтез в гидрофобизированных электродах. Отв. ред. А.П. Томилов. Новосибирск: Изд-во СО РАН, 2011. С.109–132. [Kornienko, V.L., Kolyagin, G.A., and Saltykov, Yu.V., Electrosintez v gidrofobizirovannykh elektrodakh (in Russian) (Electrosynthesis in Hydrobized Electrodes), Tomilov, A.P., Ed., Novosibirsk: Sib. Otd. Nauk, 2011. p. 109–132. ]
Brillas, E., Mur, E., and Casado, I., Iron(II) Catalysis of the Mineralization of Aniline Using a Carbon–PTFE–O2 Fed Cathode, J. Electrochem. Soc., 1996, vol. 143, p. L.49.
Brillas, E., Sauleda, R., and Casado, I., Peroxi-coagulation of Aniline in Acidic Medium Using an Oxygen Diffusion Cathode, J. Electrochem. Soc., 1997, vol. 144, p. 2374.
Moreira, F.C., Boaventura, R.A.R., Brillas, E., and Vilar, V.J.P., Electrochemical advanced oxidation processes: A review on their application to synthetic and real wastewaters, Appl. Catal. B: Environ., 2017, vol. 202, p. 217.
Kahoush, M., Behary, N., Cayla, A., and Nierstrasz, V., Bio-Fenton and Bio-electro-Fenton as sustainable methods for degrading organic pollutants in wastewater, Process Biochem., 2018, vol. 64, p. 237.
Chen, Z., Dong, H., Yu, H., Yu, H., Zhao, M., and Zhang, X., Performance and mechanism of in situ electro-catalytic flue gas desulfurization via carbon black-based gas diffusion electrodes doped with MWCNTs, Electrocatal., 2017, vol. 8, p. 103.
Vijapur, S. H., Hall, T.D., Snyder, S.T., Inman, M., Taylor, E.J., and Skinn, B.T., Electrochemical Peroxide Generation, ECS Trans., 2017, vol. 77, p. 947.
Fukuzumi, S. and Yamada, Y., Hydrogen Peroxide used as a Solar Fuel in One-Compartment Fuel Cells, ChemElectroChem., 2016, vol. 3, p. 1978.
Gravotto, G., Di Carlo, S., Ondruschka, B., Tumiatti, V., and Roggero, C.M., Decontamination of soil containing POPs by the combined action of solid Fenton-like reagents and microwaves, Chemosphere, 2007, vol. 69, p. 1326.
Mousset, E., Trellu, C., Oturan, N., Rodrigo, M.A., and Oturan, M. A., Soil Remediation by Electro-Fenton Process: in Electro Fenton Process, HEC, 2017, vol. 61, p. 399.
Корниенко, В.Л., Колягин, Г.А., Корниенко, Г.В., Чаенко, Н.В., Кошелева, А.М., Кенова, Т.А. Васильева, И.С. Использование водных растворов пероксида водорода, полученных катодным восстановлением кислорода, для непрямого окисления химических веществ в условиях in situ: Достижения и перспективы. Журн. прикл. химии. 2014. Т. 87. С. 3. [Kornienko, V.L., Kolyagin, G.A., Kornienko, G.V., Chaenko, N.V., Kosheleva, A.M., Kenova, T.A., and Vasil’eva, I.S., Use of aqueous hydrogen peroxide solutions prepared by cathodic reduction of oxygen for indirect oxidation of chemical substances in situ: achievements and prospects, Russ. J. Appl. Chem., 2014, vol. 87, p. 3.]
Garcia-Rodriguez, O., Lee, Y.Y., Olvera-Vargas, H., Deng, F., Wang, Z., and Lefebvre, O., Mineralezationof wastewater by electro-Fenton with on enhanced graphene – based gas diffusion cathode, Electrochim. Acta, 2018, vol. 276, p. 12.
Zhang, Z., Meng, H., Wang, Y., Shi, L., Wang, X., and Cha, S., Fabrication of graphene graphite-based gas diffusion electrode for improving H2O2 generation in electro-Fenton process, Electrochim. Acta, 2018, vol. 260, p. 112
Luo, H., Li, C., Wu, C., Zheng, W., and Dong, X., Electrochemical degradation of phenol by in situ electro-generated and electro-activated hydrogen peroxide using an improved gas diffusion cathode, Electrochim. Acta, 2015, vol. 186, p. 486.
Харламова, Т.А., Алиев, З.М. Применение электролиза под давлением для деструктивного окисления фенола и азокрасителей. Электрохимия. 2016. Т. 52. С. 291. [Kharlamova, T.A. and Aliev, Z.M., Use of electrolysis under pressure for destructive of phenol and azodyes, Russ. J. Electrochem., 2016, vol. 52, p. 251.]
Perazzolo, V., Durante, C., and Gennaro, A., Nitrogen and sulfur doped mesoporous carbon cathodes for water treatment, J. Electroanal.Chem. 2016, vol. 782, p. 264.
Корниенко, Г.В., Колягин, Г.А., Корниенко, В.Л., Парфенов, В.А. Исследование углеграфитовых материалов для электросинтеза Н2О2 из О2 в газодиффузионных электродах. Электрохимия. 2016. Т. 52. С. 1104. [Kornienko, G.V., Kolyagin, G.А., Kornienko, V.L., and Parfenov, V.A., Graphitized Carbon Materials for Electrosynthesis of H2O2 from O2 in Gas – Diffusion Electrodes, Russ. J. Electrochem., 2016, vol. 52, p. 983.]
Корниенко, В.Л., Колягин, Г.А., Корниенко, Г.В., Парфенов, В.А., Петин, А.А. Электросинтез Н2О2 из О2 в газодиффузионных электродах на основе сажи СН 600. Электрохимия. 2017. Т. 53. С. 1487. [Kornienko, V.L., Kolyagin, G.A., Kornienko, G.V., Parfenov, V.A., and Petin, A.A., Electrosynthesis of H2O2 from O2 in Gas Diffusion Electrodes Based on Soot CH600, Russ. J. Electrochem., 2017, vol. 53, p. 1329.]
Соляникова, А.С., Чайка, М.Ю., Боряк, А.В., Кравченко, Т.А., Глотов, А.В., Пономаренко, И.В., Кирик, С.Д. Композитные электроды электрохимических конденсаторов на основе углеродных материалов различной структуры. Электрохимия. 2014. Т. 50. С. 470. [Solyanikova, A.S., Chayka, M.Yu., Boryak, A.V., Kravchenko, T.A., Glotov, A.V., Ponomarenko, I.V., and Kirik S.D., Composite electrodes of electrochemical capacitors based on carbon materials with different structure, Russ. J. Electrochem., 2014, vol. 50, p. 419.]
Колягин, Г.А, Корниенко, Г.В., Корниенко, В.Л., Пономаренко, И.В. Электровосстановление кислорода до пероксида водорода в газодиффузионном электроде на основе мезопористого углерода. Журн. прикл. химии. 2017. Т. 90. С. 935. [Kolyagin, G.A., Kornienko, G.V., Kornienko, V.L., and Ponomarenko I.V., Electrochemical reduction of oxygen to hydrogen peroxide in gas–diffusion electrode based on mesoporous carbon, Russ. J. Appl. Chem., 2017, vol. 90, p. 1143.]
Корниенко, В.Л., Колягин, Г.А., Корниенко, Г.В., Парфенов, В.А., Пономаренко, И.В. Электросинтез Н2О2 из О2 в газодиффузионном электроде на основе мезоструктурированного углерода СМК-3. Электрохимия. 2018. Т. 54. С. 299. [Kornienko, V.L., Kolyagin, G.A., Kornienko, G.V., Parfenov, V.A., and Ponomarenko, I.V., Electrosynthesis of H2O2 from O2 in Gas Diffusion Electrodes Based on Mesostructured Carbon CMK-3, Russ. J. Electrochem., 2018, vol. 54, p. 192.]
Luo, H., Li, C., Wu, C., and Dong, X., In situ electrosynthesis of hydrogen peroxide with an improved gas diffusion cathode rolling by carbon black and PTFE, RSC Advances, 2015, vol. 5, p. 6527.]
Васильева, И.С., Колягин, Г.А., Корниенко, В.Л. Высокоселективное непрямое электрохимическое окисление формальдегида in situ ${\text{HO}}_{2}^{ - }$, генерированным из О2 в газодиффузионном электроде в щелочном электролите. Журн. прикл. химии. 2000. Т. 73. С. 1036. [Vasiľeva, I.S., Kolyagin, G.A., and Kornienko, V.L., Highly selective indirect electrochemical oxidation of formaldehyde in situ ${\text{HO}}_{2}^{ - }$ generated from О2 in a gas diffusion electrode in alkali medium, Russ. J. Appl. Chem., 2000, vol. 73, p. 1036.]
Чаенко, Н.В., Павленко, Н.И., Корниенко, В.Л. Непрямое электрохимическое окисление малеиновой кислоты пероксидом водорода, генерированным in situ из кислорода в газодиффузионном электроде. Химия в интересах устойчивого развития. 2002. Т. 10. С. 497. [Chaenko, N.V., Pavlenko N.I., and Kornienko, V.L., Indirect electrochemical oxidation of maleic acid by hydrogen peroxide in situ generated from oxygen in a gas diffusion electrode, Chemistry for sustainable development (in Russian), 2002, vol. 10, p. 497.]
Sato, K., Aoki, M., and Noyori, R.A., A “green” route to adipic acid: direct oxidation of cyclohexenes with 30 percent hydrogen peroxide, Science, 1998, vol. 281, № 5385, p. 1646.
Лялин, Б.В., Петросян, В.А. Электросинтез адипиновой кислоты в условиях бездиафрагменного электролиза. Изв. АН Сер. хим. 2004. С. 657. [Lyalin, B.V. and Petrosyan, V.A., Electrosynthesis of adipic acid in conditions of diaphragm free electrolysis, Russ. Chem. Bull., 2004, p. 657.]
Лялин, Б.В., Петросян, В.А. Окисление органических соединений на NiOOH-электроде. Электрохимия. 2010. Т. 46. С. 1283. [Lyalin, B.V. and Petrosyan, V.A., Oxidation of organic compounds on NiOOH electrode, Russ. J. Electrochem., 2010, vol. 46, p. 1199.]
Чаенко, Н.В., Корниенко, Г.В., Соколенко, В.А., Корниенко, В.Л. Редокс-медиаторное окисление циклогексанола до адипиновой кислоты на оксидно-никелевом аноде с участием активных форм кислорода. Журн. прикл. химии. 2014. Т. 87. С. 451. [Chaenko, N.V., Kornienko, G.V., Sokolenko, V.V., and Kornienko, V.L., Redox-mediated oxidation of cyclohexanone to adipic acid on oxide-nickel anode, with active forms of oxygen involved, Russ. J. Appl. Chem., 2014, vol. 87, p. 444.]
Pillai, U.R. and Sahle-Demessie, Oxidation of alcohols over Fe3+/montmorillonite-K10 using hydrogen peroxide, Appl. Catal. A: Gen., 2003, vol. 245, p. 103.
Реморов, Б.С., Авруцкая, И.А., Фиошин, М.Я. Влияние материала электрода на электроокисление изобутилового спирта в щелочной среде. Электрохимия. 1981. Т. 17. С. 1547. [Remorov, B.S., Avrutskaya, I.A., and Fioshin, M.Ya., Effect of Electrode Material on Isobutyl Alcohd Electrooxidation in Alkaline Solution, Sov. Electrochem. 1981, vol. 17, p. 1287.]
Чаенко, Н.В., Корниенко, Г.В., Кошелева, А.М., Максимов, Н.Г., Корниенко, В.Л. Непрямое электрохимическое окисление алифатических спиртов до карбоновых кислот активными формами кислорода в водных средах. Электрохимия. 2011. Т. 47. С. 1228. [Chaenko, N.V., Kornienko, G.V., Kosheleva, A.M., Maksimov, N.G., and Kornienko, V.L., Indirect electrochemical oxidation of aliphatic alcohols to carboxylic acids by active oxygen forms in aqueous media, Russ. J. Electrochem., 2011, vol. 47, p. 1146.]
Кошелева, А.М., Чаенко, Н.В., Корниенко, Г.В., Власенко, В.И., Корниенко, В.Л. Окисление нонанола-1 на оксидноникелевом электроде с использованием активных форм кислорода. Электрохимия. 2013. Т. 49. С. 105. [Kosheleva, A.M., Chaenko, N.M., Kornienko, G.V., Vlasenko, V.I., and Kornienko, V.L., Nonanol-1 oxidation on nikel oxide electrode with the involvement of active oxygen forms, Russ. J. Electrochem., 2013, vol. 49, p. 96.]
Кошелева, А.М., Максимов, Н.Г., Корниенко, Г.В., Корниенко, В.Л. Исследование кинетики непрямого электрокаталитического окисления алифатических спиртов до карбоновых кислот in situ активными формами кислорода. Электрохимия. 2015. Т. 51. С. 1216. [Kosheleva, A.M., Maksimov, N.G., Kornienko, G.V., and Kornienko, V.L., Studies of kinetics of indirect in situ electrocatalytic oxidation of aliphatic alcohols to carboxylic acids by active forms of oxygen, Russ. J. Electrochem., 2015, vol. 51, p. 1079.]
Корниенко, В.Л., Кошелева, А.М., Корниенко, Г.В. Электросинтез карбоновых кислот непрямым электрокаталитическим окислением алифатических спиртов с участием активных форм кислорода. Химия в интересах устойчивого развития. 2016. Т. 24. С. 613. [Kornienko, V.L., Kosheleva, A.M., and Kornienko, G.V., Electrosynthesis of carboxylic acids by indirect electrocatalytic oxidation with active forms of oxygen, Chemistry for sustainable development (in Russian), 2016, vol. 24, p. 613.]
Llanos, J., Moraleda, I., Sáez, C., Rodrigo, M.A., and Cañizares, P., Optimization of a cell for the electrochemical synergistic production of peroxoacetic acid, Electrochim. Acta, 2018, vol. 260, p. 177.
Kitis, M., Disinfection of wastewater with peracetic acid: a review, Environ. Int., 2004, vol. 30, p. 47.
Saha, M.S., Denggerile, A., Nishiki, Y., and Ohsaka, T., Synthesis of peroxyacetic acid using in situ electrogenerated hydrogen peroxide on gas diffusion electrode, Electrochem. Commun., 2003, vol. 5, p. 445.
Saha, M.S., Nishiki, Y., Furuta, T., and Ohsaka, T., Electrolytic Synthesis of Peroxyacetic Acid Using In Situ Generated Hydrogen Peroxide on Gas Diffusion Electrodes, J. Electrochem. Soc., 2004, vol. 151, p. 93.
Чаенко, Н.В., Корниенко, Г.В., Корниенко, В.Л. Непрямой электросинтез перуксусной кислоты с использованием in situ генерированного пероксида водорода в газодиффузионном электроде. Электрохимия. 2011. Т. 47. С. 246. [Chaenko, N.V., Kornienko, G.V., and Kornienko, V.L., Indirect electrosynthesis of peracetic acid using hydrogen peroxide generated in situ a gas diffusion electrode, Russ. J. Electrochem., 2011, vol. 47, p. 230.]
Колягин, Г.А., Васильева, И.С., Корниенко, В.Л. Влияние состава кислых растворов и присутствия органических кислот на электровосстановление кислорода до пероксида водорода в газодиффузионном электроде. Электрохимия. 2011. Т. 47. С. 303. [Kolyagin, G.A., Vasiľeva, I.S., and Kornienko, V.L., Effect of the composition of acid solutions and the presence of organic acid on oxygen electroreduction to hydrogen peroxide in a carbon black gas-diffusion electrode, Russ. J. Electrochem., 2011, vol. 47, p. 282.]
Grangaard, D.H., Method for the production of peroxide, Patent 3591470 (US). 1971.
Васильева, И.С., Корниенко, В.Л., Колягин, Г.А. Непрямое электрохимическое окисление формальдегида пероксидом водорода, генерированным из кислорода, в присутствии солей Fe(II) в кислых растворах. Химия в интересах устойчивого развития. 2001. Т. 9. С. 529. [Vasil’eva, I.S., Kornienko, V.L., and Kolyagin, G.A., Indirect electrochemical oxidation of formaldehyde by hydrogen peroxide generated from oxygen in the presence of Fe(II) salts in acidic solutions, Chemistry for sustainable development (in Russian), 2001, vol. 9, p. 529.]
Васильева, И.С., Корниенко, В.Л. Минерализация муравьиной кислоты интермедиатами ${\text{O}}{{{\text{H}}}^{\centerdot }}$ и ${\text{HO}}_{2}^{\centerdot }$ в электролизере без мембраны в электролитах с различным рН. Химия в интересах устойчивого развития. 2003. Т. 11. С. 713. [Vasil’eva, I.S., and Kornienko, V.L., Mineralization of formic acid by intermediates ${\text{O}}{{{\text{H}}}^{\centerdot }}$ and ${\text{HO}}_{2}^{\centerdot }$ in cell without membrane in electrolytes with different pH, Chemistry for sustainable development (in Russian), 2003, vol. 11, p. 713.]
Корниенко, Г.В., Корниенко, В.Л., Максимов, Н.Г., Павленко, Н.И. Окисление фенола пероксидом водорода, генерированном in situ в газодиффузионных электродах в щелочном электролите. Химия в интересах устойчивого развития. 2001. Т. 9. С. 35. [Kornienko, G.V., Kornienko, V.L., Maksimov, N.G., and Pavlenko, N.I., Oxidation of phenol by hydrogen peroxide in situ generated in a gas-diffusion electrode in alkali electrolyte, Chemistry for sustainable development (in Russian), 2001, vol. 9, p. 35.]
Корниенко, Г.В., Максимов, Н.Г., Корниенко, В.Л., Павленко, Н.И. Деструктивное окисление фенола пероксидом водорода в щелочной среде в электролизере без мембраны. Химия в интересах устойчивого развития. 2002. Т. 10. С. 321. [Kornienko, G.V., Maksimov, N.G., Kornienko, V.L., and Pavlenko, N.I., Destructive oxidation of phenol by hydrogen peroxide in alkali medium in cell without membrane, Chemistry for sustainable development (in Russian), 2002, vol. 10, p. 321.]
Корниенко, Г.В., Чаенко, Н.В., Корниенко, В.Л. Непрямое электрохимическое окисление фенола пероксидом водорода, генерированным in situ в газодиффузионном электроде в кислой и нейтральной средах. Химия в интересах устойчивого развития. 2006. Т. 14. С. 23. [Kornienko, G.V., Chaenko, N.V., and Kornienko, V.L., Indirect electrochemical oxidation of phenol by hydrogen peroxide in situ generated in a gas-diffusion electrode in acidic and neutral mediums, Chemistry for sustainable development (in Russian), 2006, vol. 14, p. 23.]
Turkay, O., Barisci, S., Ozturk, B., Öztürk, H., and Dimoglo, A., Electro-peroxone treatment of phenol: Process comparison, the effect of operational parameters and degradation mechanism, J. Electrochem. Soc., 2017, vol. 164, p. 180.
Yalfani, M.S., Contreras, S., Medina, F., and Sueiras, J., Phenol degradation by Fenton’s process using catalytic in situ generated hydrogen peroxide, Appl. Catal., 2009, vol. 89, p. 519.
Mousset, E., Frunzo, I., Esposito, G., van Hullebusch, E.D., Oturan, N., and Oturan, M. A., A complete phenol oxidation pathway obtained during electro-Fenton treatment and validated by a kinetic model study, Appl. Catal. B: Environmental, 2016, vol. 180, p. 189.
Pimentel, M., Oturan, N., Dezotti, M., and Oturan, M.A., Phenol degradation by advanced electrochemical oxidation process electro-Fenton using a carbon felt cathode, Appl. Catal., 2008, vol. 83, p. 140.
Максимов, В.Ф., Вольф, И.В., Винокурова, Т.А. Очистка и рекуперация промышленных выбросов, М.: Лесн. пром-сть, 1989. 416 с. [Maksimov, V.F., Volf, I.V., and Vinokurova, T.A., Purification and recuperation of industrial emissions, M.: Forest Ind., 1989. 416 p.]
Корниенко, Г.В., Чаенко, Н.В., Корниенко, В.Л., Максимов, Н.Г. Обезвреживание N-метил-n-аминофенола путем непрямого электрохимического окисления активными формами кислорода при различных рН. Химия в интересах устойчивого развития. 2007. Т. 15. С. 441. [Kornienko, G.V., Chaenko, N.V., Kornienko, V.L., and Maksimov, N.G., Neutralization of N-methyl-n-aminophenol by indirect electrochemical oxidation with reactive oxygen species different pH, Chemistry for sustainable development (in Russian), 2007, vol. 15, p. 171.]
Корниенко, В.Л., Чаенко, Н.В., Корниенко, Г.В. Непрямое деструктивное окисление ароматических соединений активными формами кислорода. Электрохимия. 2007. Т. 43. С. 1311. [Kornienko, V.L., Chaenko, N.V., and Kornienko, G.V., Indirect electrochemical destructive oxidation of aromatic compounds with reactive oxygen species, Russ. J. Electrochem., 2007, vol. 43, p. 1243.]
Корниенко, Г.В., Чаенко, Н.В., Корниенко, В.Л. Непрямое электрохимическое окисление N-метил-n-аминофенола активными формами кислорода, in situ генерированными из О2, Н2О2 и Н2О. Журн. прикл. химии. 2008, Т. 81. С. 1285. [Kornienko, G.V., Chaenko, N.V., and Kornienko, V.L., Indirect electrochemical oxidation of N-methyl-n-aminophenol by active oxygen species generated in situ from O2, H2O, and H2O2, Russ. J. Appl. Chem. 2008, vol. 81, p. 1364.]
Lunar, L., Sicilia, D., Rubio, S., Pérez-Bendito, D., and Nickel, U., Identification of metol degradation products under Fenton’s reagent treatment using liquid chromatography-mass spectrometry, Water Res., 2000, vol. 34, p. 3400.
Aceituno, M., Stalikas, C.D., Lunar, L., Rubio, S., and Pérez-Bendito, D., H2O2/TiO2 photocatalytic oxidation of metol identification of intermediates and reaction pathways, Water Res., 2002, vol. 36, p. 3582.
Сан. Пин. № 4630-88, Санитарные правила и нормы охраны поверхностных вод от загрязнителей, М.: Минздрав СССР, 1988. 62 с. [SAN. PIN. №4630-88, Sanitary rules and regulations for the protection of surface waters from pollutants, M.: Ministry of Health USSR, 1988. 62 p.]
Panizza, M., Michaud, P.A., Cerisola, G., and Comninellis, Ch., Anodic oxidation of 2-naphthol at boron-doped diamond electrodes, J. Electroanal. Chem., 2001, vol. 507, p. 206.
Корниенко, Г.В., Чаенко, Н.В., Максимов, Н.Г., Корниенко, В.Л. Деструкция β-нафтола активными формами кислорода, генерированными в электрохимических ячейках. Журн. прикл. химии. 2009. Т. 82. С. 961. [Kornienko, G.V., Chaenko, N.V., Maksimov, N.G., and Kornienko, V.L., Oxidation of β‑Naphthol by active oxygen species generated in electrochemical cells, Russ. J. Appl. Chem., 2009, vol. 82, p. 1018.]
Чаенко, Н.В., Корниенко, Г.В., Корниенко, В.Л. Электрохимическая минерализация β-нафтола in situ активными формами кислорода. Химия в интересах устойчивого развития. 2010. Т. 18. № 2. С. 171. [Chaenko, N.V., Kornienko, G.V., and Kornienko, V.L., Electrochemical mineralization of β-Naphthol by in situ active oxygen species, Chemistry for sustainable development (in Russian), 2010, vol. 18, no. 2, p. 171.]
Panizza, M., Bocca, C., and Cerisola, G., Electrochemical treatment of wastewater containing polyaromatic organic pollutants, Water Res., 2000, vol. 34, p. 2601.
Le Naour, C., Moisy, P., Arpigny, S., and Madic, C., Electro-oxidation of dihydroxymalonic acid on polycrystalline platinum electrode, Electrochim. Acta, 1999, vol. 44, p. 3505.
Oliveira, R.T.S., Salazar-Banda, G.R., Santos, M.C., Calegaro, M. L., Miwa, D. W., Machado, S.A.S., and Avaca, L. A., Electrochemical oxidation of benzene on boron-doped diamond electrodes, Chemosphere, 2007, vol. 66, p. 2152.
Корниенко, Г.В., Кенова, Т.А., Корниенко, В.Л., Максимов, Н. Г., Бахарева, М.Ю. Непрямое электрохимическое окисление анилина в кислом электролите с участием активных форм кислорода. Журн. прикл. химии. 2016, Т. 89. С. 1290. [Kornienko, G.V., Kenova, T.A., Kornienko, V.L., Maksimov, N.G., and Balhareva, M.Ya., Indirect electrochemical oxidation of aniline in acid electrolyte with active oxygen species, Russ. J. Appl. Chem., 2016, vol. 89, p. 1612.]
Кенова, Т.А., Корниенко, В.Л., Махова, Н.В. Материалы IV Международного симпозиума “Золото Сибири: геохимия, технология, экономика”, Красноярск: КНИИГ и МС, 2006. С. 96. [Kenova, T.A., Kornienko, V.L., and Machova, N.V., Materials of IV International symposium “Gold of Siberia: geochemistry, technology, economy” (in Russian), Krasnoyarsk: KNIIG MS, 2006. p. 96.]
Кенова, Т.А., Корниенко, В.Л., Дроздов, С.В. Влияние Н2О2 на эффективность электрохимического окисления тиоцианатов в растворах цианирования золотосодержащих руд и концентратов. Журн. прикл. химии. 2010. Т. 83. С. 1489. [Kenova, T.A., Kornienko, V.L., and Drozdov, S.V., On electrochemical oxidation of thiocyanates in solutions for cyanidation of gold-containing ores and concentrates, Russ. J. Appl. Chem., 2010, vol. 83, p. 1589.]
Титова, К.В. Пероксид водорода в синтезе пероксосольватов, Журн. неорган. Химии. 2000. Т. 45. С. 320. [Titova, K.V., Hydrogen peroxide in synthesis peroxo solvates, Russ. J. Inorg. Chem., 2000, vol. 45, p. 320.]
Колягин, Г.А., Корниенко, В.Л. Электросинтез пероксида водорода в растворах солей, образующих с ним продукты молекулярного присоединения – пероксосольваты. Электрохимия. 2014. Т. 50. С. 884. [Kolyagin, G.A. and Kornienko, V.L., Electrosynthesis of hydrogen peroxide in solutions of salts that form molecular addition products (peroxo solvates) with it, Russ. J. Electrochem., 2014, vol. 50, p. 798.]
Куденко, Ю.А., Павленко, Р.А. Способ утилизации отходов жизнедеятельности человека и несъедобной биомассы растений, приводящей к получению из них удобрений. Пат. 2111939 (Россия). 1998. [Kudenko, Ya.A. and Pavlenko, R.A., Method of recycling of human waste and inedible plant biomass, resulting in the production of fertilizers from them. Patent 2111939 (Russia). 1998.]
Колягин, Г.А., Корниенко, В.Л., Куденко, А.А., Тихомиров, А.А., Трифонов, С.В. Электросинтез пероксида водорода из кислорода в газодиффузионном электроде в растворах минерализованных экзометаболитов. Электрохимия. 2013. Т. 49. С. 1120. [Kolyagin, G.A., Kornienko, V.L., Kudenko, A.A., Tikhomirov, A.A., and Trifonov, S.V., Electrosynthesis of hydrogen peroxide from oxygen in gas-diffusion electrode in solutions of mineralized exometabolites, Russ. J. Electrochem., 2013, vol. 49, p. 1004.]
Kornienko, V.L. and Kolyagin, G.A., Indirect Electrochemical oxidation of brown coal on gas-diffusion electrodes in aqueous electrolyte, Transactions of the SAEST, 1999, vol. 34, p. 32.
Колягин, Г.А., Корниенко, В.Л., Ветошкина, О.В. Непрямое электрохимическое окисление бурого угля пероксидом водорода, генерируемым из кислорода в газодиффузионном электроде. Журн. прикл. химии. 2000. Т. 73. С. 1734. [Kolyagin, G.A., Kornienko, V.L., and Vetoshkina, O.V., Indirect electrochemical oxidation of brown coal by hydrogen peroxide generated from oxygen in a gas-diffusion electrode, Russ. J. Appl. Chem., 2000, vol. 73, p. 1734.]
Дополнительные материалы отсутствуют.