Электрохимия, 2020, T. 56, № 6, стр. 500-510
Влияние модифицирующих добавок на электропроводность метацирконата лития
А. В. Калашнова a, *, С. В. Плаксин a, Г. Ш. Шехтман a, **
a Институт высокотемпературной электрохимии УрО РАН
620137 Екатеринбург, ул. Академическая, 20, Россия
* E-mail: kalashnova@ihte.uran.ru
** E-mail: shekhtman@ihte.uran.ru
Поступила в редакцию 04.04.2019
После доработки 24.06.2019
Принята к публикации 05.09.2019
Аннотация
Синтезированы образцы в системах Li2 – 2xMxZrO3 (M = Ca, Zn), Li2– xZr1– xNbxO3 и Li2 +xZr1– xYxO3, определены ориентировочные границы однофазных областей твердых растворов на основе метацирконата лития Li2ZrO3, исследованы температурные в интервале 300–600°С и концентрационные зависимости их электропроводности. На основании особенностей кристаллической структуры Li2ZrO3 сделаны предположения о механизме проводимости допированных образцов. В исследованном интервале температур синтезированные материалы представляют собой типичные твердые электролиты с примесной разупорядоченностью и относительно невысокой литий-катионной проводимостью 10–2–10–5 См см–1.
ВВЕДЕНИЕ
В настоящее время среди химических источников тока одними из наиболее перспективных являются источники тока с анодом из лития или его сплавов (ЛХИТ), которые обеспечивают наибольшие значения напряжения и удельной энергии. Особый интерес вызывает разработка полностью твердофазных литиевых источников тока, которые отличаются простотой конструкции и технологии изготовления, многократным увеличением срока сохранности и, главное, безопасностью работы. Создание полностью твердофазных ХИТ предполагает использование твердых электролитов. Главными требованиями, предъявляемыми к твердым электролитам для ЛХИТ, являются высокая литий-катионная проводимость в низкотемпературной области, вплоть до комнатной температуры, и химическая устойчивость в контакте с электродными материалами. Что касается высокой литий-катионной проводимости, то в последние десятилетия в данной области достигнут определенный прогресс [1–4]. Однако круг высокопроводящих твердых электролитов, устойчивых к действию металлического лития, весьма ограничен. Одной из немногочисленных групп соединений, термодинамически стабильных в контакте с металлическим литием, являются цирконаты лития [5]. В связи с этим в последнее время предпринимаются попытки использовать их в качестве компонентов электродных масс [6–10] или твердых электролитов [11, 12] для полностью твердофазных ЛХИТ.
Согласно последним данным, в системе Li2O–ZrO2 образуются три соединения: Li2ZrO3, Li6Zr2O7 и Li8ZrO6 [13, 14], существование ортоцирконата лития Li4ZrO4 [15] впоследствии не подтвердилось. Все три цирконата обладают литий-катионной проводимостью. Электропроводность Li8ZrO6 при 400°С составляет ~10–3 См см–1 и быстро уменьшается с понижением температуры вследствие высокой энергии активации (Е = = 0.93 эВ) [16]. Близкие значения проводимости имеет Li6Zr2O7: 9.4 × 10–6 См см–1 при 300°С и энергии активации 0.84 эВ [17]. В последнее время активно исследуется влияние на электропроводность Li6Zr2O7 и Li8ZrO6 гетеровалентных замещений различного типа [17–21]. Литературные сведения о литий-катионной проводимости метацирконата лития Li2ZrO3 противоречивы [11, 22–24]. По данным [11, 24] она составляет 10–6–10–4 См см–1 в интервале 300–600°С, т.е. имеет тот же порядок, что и Li6Zr2O7. Электропроводность последнего соединения, однако, согласно литературным данным, может быть существенно увеличена введением модифицирующих добавок [17, 18]. Так, литий-катионная проводимость твердого раствора Li5.85Zr1.85Ta0.15O7 достигает 1.7 × 10–3 См см–1 при 300оС [18]. Что касается метацирконата лития, то влияние на его проводимость различных кристаллохимических замещений практически не изучено, за исключением системы Li2 – 2xSrxZrO3 [25], в которой однофазная область твердых растворов на основе Li2ZrO3 очень узка, в результате чего электропроводность находится на уровне недопированного метацирконата лития.
В настоящей работе приводятся результаты исследования влияния на литий-катионную проводимость Li2ZrO3 модифицирующих добавок трех типов. В первом случае (системы Li2 – 2xMxZrO3, M = Ca, Zn) катионы лития замещали на двухзарядные катионы Ca2+ или Zn2+ по схеме:
во втором (система Li2– xZr1– xNbxO3) – замещали ионы циркония катионами Nb5+:(2)
${\text{L}}{{{\text{i}}}^{ + }}\,\, + {\text{Z}}{{{\text{r}}}^{{4 + }}} \to {\text{N}}{{{\text{b}}}^{{5 + }}} + {{{\text{V}}}_{{{\text{Li}}}}},$В системах первого и второго типа избыточный положительный заряд модифицирующего катиона компенсировали дефицитом лития, предполагая образование литиевых вакансий, в третьем случае для компенсации заряда вводили избыточные межузельные катионы Li+.
МЕТОДИКА ЭКСПЕРИМЕНТА
Исследуемые вещества получали твердофазным синтезом, исходя из Li2CO3 (“х. ч.”), ZrO2 (“ч. д. а.”) и ZnO (“х. ч.”), Y2O3 (“х. ч.”), Nb2O5 (“ч. д. а.”) или CaCO3 (“ч. д. а.”). Исходные компоненты для синтеза смешивали путем совместного перетирания в фарфоровой ступке и спекали в алундовых тиглях на воздухе. Для компенсации потерь Li2O во время синтеза при повышенных температурах во все исходные смеси вводили небольшой (2–3 мас. %) избыток карбоната лития [24].
Сначала смеси выдерживали при 750°С в течение 6–8 ч для удаления СО2, а затем, после гомогенизации, при 1000°С в течение 10–12 ч с промежуточным перетиранием через 5–6 ч. Полученные после заключительной стадии термообработки продукты измельчали и из фракции порошка с частицами менее 50 мкм прессовали образцы, которые затем спекали при 1000°С. Для снижения потерь оксидных соединений лития вследствие их летучести при повышенных температурах спекание проводили в засыпке из порошка того же состава. В случае образцов системы Li2 +xZr1– xYxO3 для завершения фазообразования требовалась более высокая температура, поэтому их выдерживали при 1300°С в течение 3–4 ч. На этой стадии совмещалось достижение равновесного фазового состава и получение плотной керамики. Спеченные образцы использовали для рентгенофазового анализа и измерения электропроводности.
Рентгенофазовый анализ проводили на установке Rigaku Dmax-2200 (Япония) в медном Kα-излучении. Полученные результаты использовались для автоматизированного поиска по базе данных PDF 2.
Электросопротивление образцов измеряли в ячейке с серебряными электродами в интервале температур 300–600°С с помощью потенциостат-гальваностата P-40Х (Elins, Россия) в диапазоне частот 50 Гц–500 кГц. При каждой температуре измерения делали выдержку до установления постоянного значения электросопротивления (15–20 мин). Сопротивление образцов определяли путем анализа частотной дисперсии импеданса. Измерение проводили в режиме ступенчатого охлаждения с шагом 20°С. Выборочные измерения, проведенные при нагреве, совпадали с результатами, полученными при охлаждении.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для метацирконата лития известны две кристаллические модификации. При синтезе из ZrO2 и Li2O (Li2CO3) ниже ~700°С образуется тетрагональная форма Li2ZrO3 со структурой типа α-LiFeO2 [26], которая при дальнейшем нагреве необратимо переходит в моноклинную, пространственная группа С2/с [27]. Моноклинная модификация также образуется из исходных компонентов непосредственно, если температура синтеза превышает 700°С [14]. В настоящей работе для рентгенофазового анализа использовали порошок, полученный измельчением спеченных таблеток. Поскольку, вне зависимости от условий синтеза, температура спекания образцов превышала 700°С, на рентгенограммах во всех случаях наблюдались рефлексы моноклинной модификации Li2ZrO3.
Фазовые диаграммы систем Li2 – 2xMxZrO3 (M = Ca, Zn) к настоящему времени не исследованы. Рентгенофазовый анализ показал, что в обеих системах при 0 < х < 0.1 образуются твердые растворы, сохраняющие моноклинную решетку метацирконата лития. При х ≥ 0.10 на рентгенограммах присутствуют рефлексы диоксида циркония (рис. 1, 2).
Рис. 1.
Рентгенограммы образцов системы Li2 ‒ 2xCaxZrO3: х = 0.025 (а); 0.05 (б); 0.075 (в); 0.1 (г). * – линии ZrO2.

Рис. 2.
Рентгенограммы образцов системы Li2 ‒ 2xZnxZrO3: х = 0.025 (а); 0.05 (б); 0.075 (в); 0.1 (г). * – линии ZrO2.

Замещение в Li2ZrO3 Zr4+ на Nb5+ или Y3+ с компенсацией заряда соответственно литиевыми вакансиями или межузельными катионами лития исследовалось в [28]. Были синтезированы образцы состава Li2– xZr1– xNbxO3 (x = 0.05; 0.10 и 0.25) и Li2 +xZr1– xYxO3 (х = 0.05 и 0.10). Согласно результатам рентгенофазового анализа, образцы ниобийсодержащей системы уже при минимальном содержании Nb5+ (x = 0.05) наряду с моноклинной фазой Li2ZrO3 содержали примесь ZrO2 и Li3NbO4, количество которых возрастало с увеличением “х”. Тем не менее, авторы отмечают, что рефлексы на рентгенограммах при этом сдвигаются в область больших углов, что свидетельствует об уменьшении параметров элементарной ячейки и, следовательно, об образовании твердых растворов. Образование твердых растворов на основе метацирконата лития в разрезе Li2ZrO3–LiNbO3 (или, в другой форме записи, Li2– xZr1– xNbxO3) отмечали также авторы [29] при исследовании тройной системы Li2O–Nb2O5–ZrO2. Граница однофазной области в статье не приведена, поскольку основное внимание авторы направили на изучение перовскитоподобных фаз вблизи LiNbO3. Мы при синтезе образцов в системе Li2– xZr1– xNbxO3 появление примесных фаз наблюдали при х = 0.075 (рис. 3). Присутствие примесных фаз при меньших содержаниях добавки Nb5+, отмечавшееся в [28], может быть связано с потерей Li2O при термообработке вследствие летучести.
Рис. 3.
Рентгенограммы образцов системы Li2 ‒ xZr1 – xNbxO3: х = 0.025 (а); 0.05 (б); 0.075 (в). * – линии ZrO2.

В системе Li2 +xZr1– xYxO3, согласно [28], на рентгенограмме образцов с х ≥ 0.05 наряду с рефлексами моноклинной фазы Li2ZrO3 присутствуют линии очень небольшой интенсивности, которые не удалось индицировать. Авторы [30] отмечают, что при х > 0.05 в рассматриваемой системе в качестве второй фазы присутствует цирконат лития Li6Zr2O7. Это подтверждается результатами настоящей работы. По нашим данным Li6Zr2O7 в системе Li2 +xZr1– xYxO3 появляется при х = 0.075 (рис. 4в).
Рис. 4.
Рентгенограммы образцов системы Li2 + xZr1 –xYxO3: х = 0.025 (а); 0.05 (б); 0.075 (в). * – линии Li6Zr2O7.

На рис. 5 приведены годографы импеданса для ячейки Ag|Li1.95Zn0.025ZrO3|Ag. Они имеют обычный для твердого ионного проводника с блокирующими электродами вид. При относительно низких температурах (рис. 5а) годографы включают высокочастотный фрагмент дуги окружности со смещенным центром и низкочастотный луч, связанный с процессами на электроде. С повышением температуры фрагмент дуги сокращается (рис. 5б) и, начиная с ~500°С, фиксируется практически один низкотемпературный участок (рис. 5в, 5г). Экстраполяция высокочастотного участка дуги (рис. 5а) на ось активных сопротивлений дает 0, таким образом, разделить суммарное сопротивление электролита на зернограничную и объемную составляющие в данном случае не удается. Поэтому в дальнейшем мы оперировали суммарным сопротивлением электролита, которое находили путем экстраполяции низкочастотного луча на ось активных сопротивлений.
Рис. 5.
Годографы импеданса электрохимической ячейки Ag|Li1.95Zn0.025ZrO3|Ag при температурах 300 (а); 395 (б); 520 (в); 600°С (г).

Введение в Li2ZrO3 ионов Са2+ и Zn2+ сопровождается увеличением электропроводности по сравнению с недопированным Li2ZrO3 (рис. 6). Максимальная проводимость наблюдается при х = 0.075, т.е. отвечает границам однофазных областей. Температурные зависимости электропроводности в исследованном интервале температур линейны в координатах Аррениуса (рис. 7). Энергия активации проводимости чистого Li2ZrO3 составляет 83.5 кДж/моль, что близко к значению, приведенному в [11] (90 кДж/моль), и слабо меняется при введении М2+.
Рис. 6.
Изотермы удельной электропроводности в системах Li2 – 2xМxZrO3, M = Ca (а), Zn (б). 1 – 300; 2 – 400; 3 – 500; 4 – 600°С.
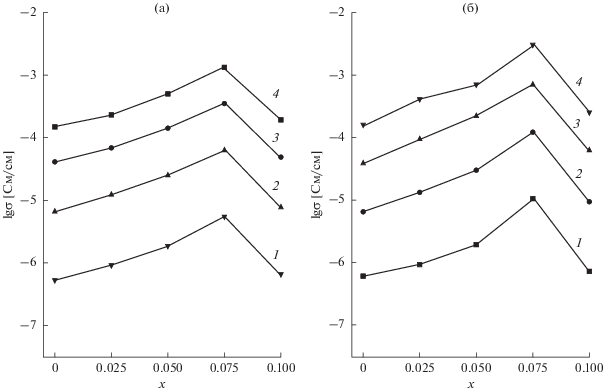
Рис. 7.
Температурные зависимости удельной электропроводности в системах Li2 – 2xМxZrO3, M = Ca (а), Zn (б). х = 0(1); 0.025(2); 0.05(3); 0.075(4); 0.10(5).
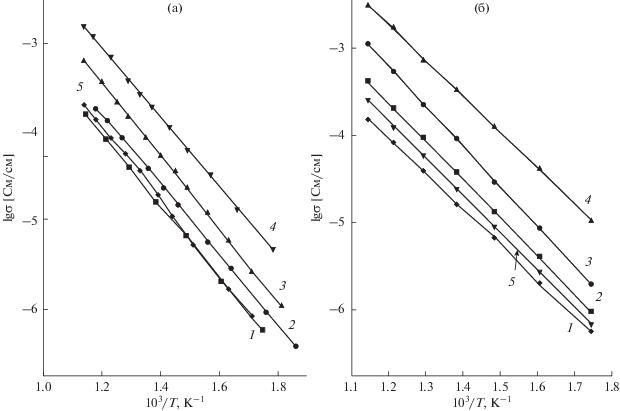
В системе Li2– xZr1– xNbxO3 во всем исследованном интервале температур (300–600°С) и в системе Li2 +xZr1–xYxO3 при 400°С и выше при введении модифицирующих катионов также наблюдается возрастание электропроводности (рис. 8), причем максимум проводимости в обоих случаях отвечает границам однофазных областей. Температурные зависимости удельной электропроводности линейны в координатах Аррениуса (рис. 9), как и в ранее рассмотренных системах с двухзарядными модифицирующими ионами, однако в отличие от последних введение катионов Nb5+ и Y3+ сопровождается резким возрастанием энергии активации проводимости (рис. 10), т.е. снижением подвижности катионов лития. Качественно объяснить такое поведение можно, исходя из особенностей кристаллической структуры Li2ZrO3.
Рис. 8.
Изотермы удельной электропроводности в системах Li2– xZr1– хNbxO3 (а) и Li2 +xZr1– xYxO3 (б). 1 – 300; 2 – 400; 3 – 500; 4 – 600°С.

Рис. 9.
Температурные зависимости удельной электропроводности в системах Li2– xZr1– xNbxO3 (а) и Li2 +xZr1 –xYxO3 (б). х = 0(1); 0.025(2); 0.05(3); 0.075(4).

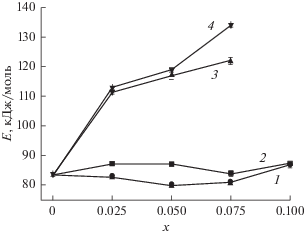
Рис. 10.
Концентрационные зависимости энергии активации электропроводности в системах Li2 – 2xCaxZrO3 (1), Li2 – 2xZnxZrO3 (2), Li2– xZr1 –xNbxO3 (3) и Li2 +xZr1– xYxO3 (4).
Структура моноклинной модификации метацирконата лития, которую имеют твердые растворы, исследованные в настоящей работе, является производной от NaCl [31], пространственная группа С2/c, a = 5.4218(2), b = 9.0216(4), c = = 5.4187(2) Å, β = 112.709(2)°. Анионы кислорода образуют искаженную кубическую плотноупакованную подрешетку. Катионы занимают октаэдрические позиции и образуют слои, перпендикулярные оси “с” моноклинной элементарной ячейки, соотношение катионов Li+ и Zr4+ в каждом слое составляет 2 : 1. Тетраэдрические позиции анионной подрешетки вакантны [27].
В [32] на основе нейтронографического исследования кристаллической структуры была с применением пакета программ TOPOS [33] построена карта миграции катионов Li+ в недопированном Li2ZrO3 и рассмотрено влияние температуры на размер пустот, которые могут занимать катионы лития, и на радиус каналов их миграции. Было установлено наличие 5 типов элементарных пустот, три из которых (ZA1, ZA2 и ZA3) совпадают с тетраэдрическими позициями, а две (ZA4 и ZA5) – с октаэдрическими. Из этих пяти пустот одна (ZA3) во всем исследованном интервале температур имеет радиус, значительно меньший радиуса значимой пустоты, т.е. пустоты минимального радиуса, допускающего размещение катиона Li+ в окружении анионов кислорода. Радиус тетраэдрических пустот двух других типов (ZA1 и ZA2) с повышением температуры приближается к радиусу значимой пустоты, но тем не менее остается несколько меньше. Такие пустоты рассматриваются как вероятностные. Это значит, что перенос по этим позициям возможен, но затруднен.
Установлено также существование в моноклинной элементарной ячейке Li2ZrO3 шести элементарных каналов миграции. Эти каналы имеют зигзагообразную форму и предполагают перенос катионов Li+ из одной октаэдрической позиции в другую через вакантную тетраэдрическую позицию. Согласно [34], минимальный радиус значимого канала, т.е. канала, доступного для переноса катионов лития, в оксидных соединениях составляет 1.845 Å. Каналы с меньшим значением радиуса являются вероятностными. Размер каналов монотонно увеличивается с ростом температуры вследствие термического расширения решетки, однако четыре канала из шести во всей исследованной области температур остаются вероятностными. Размеры двух оставшихся каналов с повышением температуры приближаются к критическому значению 1.845 Å, однако трехмерная карта миграции катионов лития в целом состоит преимущественно из вероятностных каналов. Это тем не менее не дает оснований исключать такие каналы из карты проводимости. Геометрический анализ, разновидностью которого является метод Вороного–Дирихле, характеризует статическую модель кристаллической структуры. При миграции носителей тока кристаллическая решетка претерпевает значительные искажения, в результате становится возможным перенос подвижных ионов через каналы, которые в статическом состоянии имеют размер несколько меньше критического [35]. Недостаточная ширина каналов миграции, однако, приводит к тому, что подвижность носителей тока невысока, ионный перенос затруднен и характеризуется высокой энергией активации, в случае Li2ZrO3, например, по разным данным ~80–90 кДж моль–1. Таким образом, анализ карты миграции катионов лития в Li2ZrO3 показывает, что главной причиной низкой литий-катионной проводимости последнего являются геометрические затруднения.
При кристаллохимических замещениях радиусы замещающего и замещаемого иона могут существенно отличаться, поэтому гетеровалентные замещения помимо концентрации дефектов могут влиять также на геометрические соотношения в элементарной ячейке. Ионы Li+ и Zn2+ имеют близкие величины ионных радиусов, соответственно 0.90 и 0.88 Ǻ для октаэдрической координации11. Поэтому при замещении катионов лития ионами цинка объем элементарной ячейки практически не меняется (рис. 11, прямая 1) и существенного изменения межатомных расстояний, а значит, и размеров каналов миграции не происходит. В результате электропроводность при таком замещении несколько возрастает (рис. 6б) вследствие увеличения концентрации литиевых вакансий, а подвижность носителей тока и, соответственно, энергия активации проводимости практически не меняется (рис. 10, кривая 2).
Рис. 11.
Концентрационные зависимости объема элементарной ячейки твердых растворов в системах Li2 ‒ 2xZnxZrO3 (1), Li2 – 2xCaxZrO3 (2), Li2 ‒ xZr1 ‒ xNbxO3 (3).

Замещение ионов лития более крупными катионами Са2+ (r = 1.14 Å) сопровождается возрастанием объема элементарной ячейки (рис. 11, кривая 2) и, по-видимому, некоторым расширением каналов, что приводит к небольшому снижению энергии активации (рис. 10, кривая 1).
Ион Nb5+ имеет меньший радиус (0.78 Å), чем ион Zr4+ (0.86 Å), поэтому замещение Zr4+ + Li+ → → Nb5+ + VLi приводит к уменьшению объема элементарной ячейки (рис. 11, прямая 3), сужению каналов миграции и возрастанию энергии активации (рис. 10, кривая 3).
При замещении ионов Zr4+ ионами Y3+ для компенсации заряда вводились дополнительные катионы Li+. Поскольку в стехиометрическом метацирконате лития все октаэдрические позиции заняты, избыточные катионы лития располагаются в тетраэдрических пустотах ZA1 и ZA2. В вакансионных твердых растворах, рассмотренных ранее, перенос ионов лития осуществляется по следующему механизму: занятый ионом Li+ октаэдр → вакантный тетраэдр → вакантный октаэдр [32]. При этом тетраэдрические пустоты, пребывание катионов лития в которых энергетически невыгодно, служат промежуточными позициями. В Li2ZrO3, допированном иттрием, вакантных октаэдрических позиций нет. Поэтому для трансляционного движения ион лития должен из октаэдрической позиции перейти в тетраэдрическое междоузлие, в освободившуюся октаэдрическую пустоту может перейти катион Li+ из тетраэдрической позиции или из ближайшей октаэдрической позиции через вакантное тетраэдрическое междоузлие. При этом время пребывания катионов лития в энергетически не выгодных тетраэдрических позициях увеличивается, что сопровождается возрастанием энергии активации (рис. 10, кривая 4).
Сопоставление транспортных свойств твердых растворов, исследованных в данной работе, и твердых электролитов на основе Li6Zr2O7 [17, 18] показывает, что лучшие из твердых электролитов на основе метацирконата лития при 300°С имеют по сравнению с последними приблизительно на два порядка более низкую удельную электропроводность. Причиной невысокой ионной проводимости синтезированных в настоящей работе твердых растворов является, с одной стороны, малая растворимость модифицирующих добавок. Кроме того, как в чистом, так и в допированном метацирконате лития, ионный транспорт, по-видимому, связан со значительными геометрическими затруднениями.
В заключение следует отметить два момента:
1. В [37] авторы на основании данных ЯМР определили, что термически активируемая диффузия катионов лития в Li2ZrO3 начинается выше 500 К. Поскольку измеренная величина литий-катионной проводимости при температурах порядка 500 К составляет ~10–8 См см–1 [12, 24], следует полагать, что диффузия в этом случае связана, по-видимому главным образом с локальным, а не с трансляционным движением катионов лития.
2. При исследовании температурных зависимостей электропроводности Li2ZrO3 с модифицирующими добавками трех типов, выполненном в данной работе, мы не наблюдали скачкообразного увеличения литий-катионной проводимости вблизи ~430°С, связанного с переходом в суперионное состояния, о котором сообщается в [22, 38]. Исследованные образцы допированного метацирконата лития во всей исследованной области температур являются типичными твердыми электролитами с примесной разупорядоченностью и относительно невысокой электропроводностью ~10–2–10–5 См см–1.
ЗАКЛЮЧЕНИЕ
В настоящей работе исследовано влияние на электропроводность метацирконата лития гетеровалентных замещений трех типов. Во всех случаях введение добавок сопровождается относительно небольшим увеличением литий-катионной проводимости. Связано это, с одной стороны, с малой растворимостью модифицирующих добавок, однако главной причиной являются геометрические затруднения при миграции катионов Li+, поскольку трехмерная карта миграции включает в основном вероятностные каналы, а гетеровалентные замещения приводят к некоторому росту проводимости за счет увеличения концентрации носителей тока, однако подвижность их остается низкой.
Полученные значения проводимости, 10–5–10–2 См см–1 в интервале 300–600°С, довольно низки. Поэтому для использования исследованных твердых растворов в качестве электролитов полностью твердофазных ЛХИТ необходимо принятие мер для максимального снижения внутреннего сопротивления источника, например, путем использования электролита в виде тонких пленок. Кроме того, термодинамическая стабильность в контакте с металлическим литием позволяет использовать исследованные твердые растворы, как и недопированный метацирконат лития, в качестве конструкционного материала и компонента электродных масс.
Список литературы
Cao, C., Li, Z.-B., Wang, X.-L., Zhao, X.-B., and Han, W.-Q., Recent advances in inorganic solid electrolytes for lithium batteries, Frontiers in Energy Research, 2014, vol. 2, p. 25.
Bachman, J.Ch., Muy, S., Girmaud, A., Chang, H.-H., Pour, N., Lux, S.F., Paschos, O., Maglia, F., Lupart, S., Lamp, P., Giordano, L., and Shao-Horn, Y., Inorganic Solid-State Electrolytes for Lithium Batteries: Mechanisms and Properties Governing Ion Conduction, Chem. Rew., 2016, vol. 116, no. 1, p. 140.
Zheng, F., Kotobuki, M., Song, S., Lai, M.O., and Lu, L., Review on solid electrolytes for all-solid-state lithium-ion batteries, J. Power Sources, 2018, vol. 389, p. 198.
Robertson, A.D., West, A.R., and Ritchie, A.G., Review of crystalline lithium-ion conductors suitable for high temperature battery applications, Solid State Ionics, 1997, vol. 104, nos. 1–2, p. 1.
Hellstrom, E.E., and Van Gool, W., Constraints for the selection of lithium solid electrolytes, Rev. Chim. Miner., 1980, vol. 17, p.263.
Dong, Y., Zhao, Y., Duan, H., and Huang, J., Electrochemical performance and lithium-ion insertion/extraction mechanism studies on the novel Li2ZrO3 anode materials, Electrochim. Acta, 2015, vol. 161, p. 219.
Miao, X., Ni, H., Zhang, H., Wang, C., Fang, J., and Yang, G., Li2ZrO3 coated 0.4Li2MnO3 · · 0.6LiNi1/3Co1/3Mn1,3O2 for high performance cathode material in lithium-ion battery, J. Power Sources, 2014, vol. 265, p. 147.
Yi, H., Wang, X., Ju, B., Shu, H., Wen, W., Yu, R., Wang, D., and Yang, X., Effective enhancement of electrochemical performance for spherical spinel LiMn2O4 via Li-ion conductive Li2ZrO3 coating, Electrochim. Acta, 2014, vol. 134, p. 143.
Huang, S., Wilson, B., Wang, Bo., Fang, Y., Buffington, K., Stein, A., and Truhlar, G., Y-doped Li8ZrO6: A Li-ion Battery Cathode Material with High Capacity, J. Amer. Chem. Soc., 2015, vol. 137, no. 34, p. 10992.
Huang, S., Wilson, B., Smyrl, W.H., Truhlar, D.G., and Stein, A., Transition-Metal-Doped M-LiZrO (M = Mn, Fe, Co, Ni, Cu, Ce) as High-Specific-Capacity Li-Ion Battery Cathode Materials: Synthesis, Electrochemistry, and Quantum Mechanical Characterization, Chem. mater., 2016, vol. 28, no. 3, p. 746.
Hellstrom, E.E. and Van Gool, W., Lithium-ion conduction in Li2ZrO3, Li4ZrO4 and LiScO2, Solid State Ionics, 1981, vol. 2, no. 1, p. 59.
Murthy, A.S.R., Gnanasekaran, T., and Jayaraman V., Preparation and characterization of some lithium-ion conductors, Solid State Ionics, 2017, vol. 303, p. 138.
Martel, L.C. and Roth, R.S., Phase-equilibria and crystal-chemistry in ternary oxide system containing Li2O–MO2–Ta2O5 (M = Ti, Sn, Zr, Th), Amer. Ceram. Soc. Bull., 1981, vol. 60, no. 3, p. 376.
Vyers, G.P. and Cordfunke, E.H.P., J. Nucl. Mater., Phase relations in the system Li2O–ZrO2, 1989, vol. 168, nos. 1–2, p. 24.
Enriquez, L.J., Quintana, P., and West, A.R., Compound Formation in the System Li2O–ZrO2, Trans. British Ceram. Soc., 1982, vol. 81, p. 17.
Delmas, C., Maazaz, A., Guillen F., Fouassier, C., Reau, J.M., and Hagenmuller, P., Des conducteurs ioniques pseudo-bidimensionnels: Li8MO6 (M = Zr, Sn), Li7LO6 (L = Nb, Ta) et Li6In2O6, Mat. Res. Bull., 1979, vol. 14, no. 5, p. 619.
Liao, Y., Singh, P., Park, K.S., Li, W., and Goodenough, J.B., Li6Zr2O7 interstitial lithium-ion solid electrolyte, Electrochim. Acta, 2013, vol. 102, p. 446.
Rao, R.P., Reddy, M.V., Adams, S., and Chowdary, B.V.R., Preparation and mobile ion transport studies of Ta and Nb doped Li6Zr2O7 Li-fast ion conductors, Mat. Sci. Eng.B, 2012, vol. 177, no. 5, p. 100.
Пантюхина, М.И., Щелканова, М.С., Плаксин, С.В. Ионная проводимость твердых растворов Li8 ‒ 2xMgxZrO6. Электрохимия. 2010. Т. 46. С. 831. [Pantyukhina, M.I., Shchelkanova, M.S., and Plaksin, S.V., Ionic conduction of Li8 – 2xMgxZrO6 solid solutions, Russ. J. Electrochem., 2010, vol. 46, no. 7, p. 780]
Пантюхина, М.И., Щелканова, М.С., Плаксин, С.В. Ионная проводимость Li8 – 2xSrxZrO6. Неорган. Материалы. 2012. Т. 48. С. 451. [Pantyukhina, M.I., Shchelkanova, M.S., and Plaksin, S.V., Ionic conductivity of Li8 – 2xSrxZrO6, Inorg. Materials, 2012, vol. 48, no. 4, p. 382.]
Пантюхина, М.И., Щелканова, М.С., Плаксин, С.В. Ионная проводимость твердых растворов Li8 ‒ xZr1 –xNbxO6. ФТТ. 2013. Т. 55. С. 650. [Pantyukhina, M.I., Shchelkanova, M.S., and Plaksin, S.V., Synthesis and electrochemical properties of Li8 ‒ xZr1 –xNbxO6 solid solutions, Phys. Solid State, 2013, vol. 55, no. 4, p. 707.]
Андреев, О.Л., Пантюхина, М.А., Антонов, Б.Д., Баталов, Н.Н. Синтез и электрические свойства метацирконата лития. Электрохимия. 2000. Т. 36. С. 1507. [Andreev, O.L., Pantyukhina, M.I., Antonov, B.D., and Batalov, N.N., Synthesis and Electrical Properties of Lithium Metazirconate, Russ. J. Electrochem., 2000, vol. 36, p. 1335.]
Бакланова, Я.В., Журавлев, Н.А., Максимова, Л.Г., Денисова, Т.А., Леонидова, О.Н., Расковалов, А.А., Таракина, Н.В. Синтез и физико-химические свойства твердых растворов Li2MxZr1 –xO3 – δ (M = = Nb, Ti; x = 0.05, 0.1). Изв. РАН. Сер. физ. 2014. Т. 78. С. 409. [Baklanova, Y.V., Zhuravlev, N.A., Maximova, L.G., Denisova, T.A., Leonidova, O.N., Raskovalov, A.A., and Tarakina, N.V., Synthesis and physicochemical properties of Li2MxZr1 –xO3 – δ (M = = Nb, Ti; x = 0.05, 0.1) solid solutions, Bull. Russ. Acad. Sci.: Physics, 2014, vol. 78, no. 4, p. 320.]
Калашнова, А.В., Плаксин, С.В., Вовкотруб, Э.Г., Шехтман, Г.Ш. Электропроводность метацирконата лития. Электрохимия. 2018. Т. 54. С. 813. [Kalashnova, A. V., Plaksin, S. V., Vovkotrub, E. G., and Shekhtman, G. S., Electric Conductivity of Lithium Metazirconate, Russ. J. Electrochem., 2018, vol. 54, no. 9, p. 709.]
Пантюхина, М.И., Калашнова, А.В., Плаксин, С.В. Электрические свойства твердых растворов Li2 ‒ 2xSrxZrO3. Бутлеровские сообщения. 2014. Т. 40. С. 132. [Pantyukhina, M.I., Kalashnova, A.V., and Plaksin, S.V., Butlerov Communications, 2014, vol. 40, no. 11, p. 132. ROI: jbc-02/14-40-11-132]
Quintana, P., Leal, J., Howie, R.A., and West, A.R., Li2ZrO3: A new polymorph with the α-LiFeO2 structure, Mat. Res. Bull., 1989, p. 1385.
Hodeau, J.L., Marezio, M., Santoro, A., and Roth, R.S., Neutron Profile Refinement of the Structures of Li2SnO3 and Li2ZrO3, J. Solid State Chem, 1982, vol. 45, no. 2, p. 170.
Dunstan, M.T., Schlogelhofer, H.L., Griffin, J.M., Dyer, M.S., Gaultois, M.W., Lau, S.Y., Scott, S.A., and Grey, C.P., Ion Dynamics and CO Absorption Properties Nb, Ta and Y-doped Li2ZrO3 Studied by Solid-State NMR, Thermogravimetry and First-Principle Calculations, J. Phys. Chem. C, 2017, vol. 121, no. 40, p. 21877.
Villafuerte-Castrejon, M.E., Kuhilger, C., Ovando, R., Smith, R.I., and West, A.R., New Perovskite Phases in the Systems Li2O–(Nb2O5, Ta2O5)–ZrO2, J. Mater. Chem., 1991, vol. 1, no. 5, p. 747.
Zou, Y. and Petric, A., Preparation and Properties of Yttrium-Doped Lithium Zirconate, J. Electrochem. Soc., 1993, vol. 140, no. 5, p. 1388.
Mather, G.C., Dussarat, C., Etourneau, J., and West, A.R., A review of cation-ordered rock salt superstructure oxides, J. Mater.Chem., 2000, vol. 10, no. 10, p. 2219.
Sherstobitova, E.A., Gubkin, A.F., Bobrikov, I.A., Kalashnova, A.M., and Pantyukhina, M.I., Bottle-necked ionic transport in Li2ZrO3: High temperature neutron diffraction and impedance spectroscopy, Electrochim. Acta, 2016, vol. 209, p. 574.
Anurova, N.A., Blatov, V.A., Ilyushin, G.D., Blatova, O.A., Ivanov-Schits, A.K., and Dem’yanets, L.N., Migration maps of Li+ cations in oxygen-containing compounds, Solid State Ionics, 2008, vol. 179, no. 39, p. 2248.
Blatov, V.A., Ilyushin, G.D., Blatova, O.A., Anurova, N.A., Ivanov-Schits, A.K., and Dem’yanets, L.N., Analysis of migration paths in fast-ion conductors with Voronoi-Dirichlet partition, Acta Cryst. B, 2006, vol. 62, no. 6, p. 1010.
Fedotov, S.S., Kabanov, A.A., Kabanova, N.A., Blatov, A.V., Zhugayevych, A., Abakumov, A.M., Khasanova, N.R., and Antipov, E.V., Crystal Structure and Li-Ion Transport in Li2CoPO4F High-Voltage Cathode Material for Li-Ion Batteries, J. Phys. Chem. C, 2017, vol. 121, no. 6, p. 3194.
Shannon, R.D., Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides, Acta Cryst. A, 1976, vol. 32, no. 5, p. 751.
Baklanova, Ya.V., Arapova, I.Yu., Buzlukov, A.L., Gerashenko, A.P., Verkhovskii, S.V., Mikhalev, K.N., Denisova, T.A., Shein, I.R., and Maksimova, L.G., Lokalization of vacancies and mobility of lithium ions in Li2ZrO3 as obtained by 6,7Li NMR, J. Solid State Chem., 2013, vol. 208, p. 43.
Пантюхина, М.И., Андреев, О.Л., Антонов, Б.Д., Баталов, Н.Н. Синтез и электрические свойства цирконатов лития. Журн. неорган. Химии. 2002. Т. 47. № 11. С. 1778. [Pantyukhina, M.I., Andreev, O.L., Antonov, B.D., and Batalov, N.N., Synthesis and electrical Properties of Lithium Zirconates, Russ. J. Inorg. Chem., 2002, vol. 47, no. 11, p. 1778.]
Дополнительные материалы отсутствуют.


