Электрохимия, 2020, T. 56, № 9, стр. 831-836
Коррозионное поведение квазикристаллических сплавов системы Al–Cu–Fe–Cr в щелочной среде
Д. Б. Чугунов a, *, Л. Л. Мешков b, А. К. Осипов a, А. В. Баландина a, **
a ФГБОУ ВО “МГУ им. Н.П. Огарёва”
Москва, Россия
b Химический факультет МГУ имени М.В. Ломоносова, кафедра общей химии
Москва, Россия
* E-mail: iman081@gmail.com
** E-mail: balandina.av@yandex.ru
Поступила в редакцию 19.09.2019
После доработки 20.12.2019
Принята к публикации 06.03.2020
Аннотация
Потенциодинамическим методом изучено электрохимическое поведение трех сплавов системы Al65Cu25Fe10 –хCrх переменного состава в зависимости от количества квазикристаллических фаз в щелочной и нейтральных средах. Большую стабильность показали сплавы c хромом, в которых существует квазикристаллическая структурная (декагональная и икосаэдрическая) составляющая. Установлено, что с ростом pH растворов коррозионная стойкость образцов уменьшается.
ВВЕДЕНИЕ
С момента открытия в 1984 году Шехтманом, к квазикристаллам (КК) проявляется огромный интерес, так как они отличаются от периодических соединений наличием запрещенных кристаллографией осей симметрии 5, 8, 10 и 12 порядков. Ряд полезных физических свойств КК – это низкая электро- и теплопроводность, малый коэффициент термического расширения, большая твердость, интересны для практического применения. Однако, высокая хрупкость КК-фаз ограничивает их использование в качестве конструкционных материалов. Квазикристаллы нашли применение в виде наноразмерных упрочнителей алюминиевых сплавов, защитных покрытий в химически агрессивных средах и катализаторов в органическом синтезе [1].
В работе [2] показано, что коррозионная стойкость КК-сплавов определяется исключительно химическим составом с оптимальным соотношением компонентов, а не зависит от их структуры и фазового состава. Однако микроструктура многокомпонентных алюминиевых сплавов и покрытий содержит апериодические фазы, которые сосуществуют с родственными кристаллическими фазами – аппроксимантами (АПР) [4, 5]. Это означает, что состав не только КК-фаз, но и АПР-фаз, присутствующих в легированных сплавах, может влиять на их коррозионное поведение.
Химические поведение материалов на основе Al обусловлено существованием защитного оксидного слоя Al2O3 на поверхности сплава и его растворением в активных средах [6]. Показано [7], что введение хрома в алюминиевые сплавы повышает их коррозионную стойкость. Состав модифицированного пассивного слоя позволяет уменьшить адсорбцию агрессивных анионов на поверхности. При этом хром, входящий в защитный слой, уменьшает растворимость оксида алюминия. В работе [3] установлено, что сплав системы Al–Cu–Fe–Cr состава (66.9 ат. % Al, 11.6 ат. % Cu, 11.6 ат. % Fe, 10.6 ат. % Cr) при анодной поляризации переходит в пассивное состояние как в 1 М H2SO4, так и 1 М NaOH средах.
Цель данной работы представляет изучение коррозионного поведения в щелочной среде легированных хромом алюминиевых квазикристаллических (КК) сплавов, содержащих родственные кристаллические аппроксимантные (АПР) фазы, в зависимости от их количества и вида. Оценка структурных и фазовых превращений в сплавах в результате термообработок и поляризационных экспериментов проводилась по данным рентгенофазового анализа (РФА) и сканирующей электронной микроскопии (СЭМ).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исходными материалами для образцов служили алюминий электролитический 99.9% чистоты, электролитическая медь (99.9%), железо карбонильное и хром чистотой 99%. Образцы сплавов состава Al65Cu25Fe10, Al65Cu25Fe5Cr5, Al65Cu25Cr10 готовили трехкратным переплавом навески металлов (навеска 2 г) в электродуговой печи в атмосфере аргона, время плавки 15 с при напряжении 75 В.
Микроструктурный анализ и элементный состав образцов изучали на сканирующем электронном микроскопе LEO EVO-50 XVP (Karl Zeiss, Германия) с приставкой энергодисперсионного анализа “INCA energy 450” (Oxford Instruments, Великобритания) при ускоряющем напряжении 15 кВ.
Для изучения коррозионного поведения образцы с площадью рабочей поверхности 0.50 см2 запаивались в пластик. Перед началом исследования поверхность электрода шлифовалась наждачной бумагой различной зернистости (200, 400, 800, 1200, 2500), затем обезжиривалась спиртом, промывалась водой и высушивалась.
Для определения типа и количества фаз в образцах использовали рентгенофазовый анализ (РФА), который осуществлялся методом порошка на рентгеновском дифрактометре Empyrean (PANalytical, Великобритания) на CuKα-излучении с автоматической щелью 16 мм, затем приводились к постоянной щели в 1°. Время экспозиции в каждой точке составляло 3 с. Обработка рентгенограмм проводилась с применением пакета программ X-ray. Анализ рентгеновских спектров осуществлялся с помощью программы количественного фазового анализа PHAN% с использованием модернизированного метода Ритвельда [8].
Коррозионные исследования сплавов, такие как снятие анодно-поляризационных кривых в растворах 1 М NaOH и 1 М Na2SO4, проводили на потенциостате Reference 3000 (Gamry, Канада) с применением трехэлектродной ячейки Dr. Bob’s Cell, в которой пространство рабочего и электрода сравнения отделялось с помощью полупроницаемой мембраной для предотвращения перехода Cl–-ионов из пространства хлоридсеребряного в емкость с рабочим электродом. Скорость развертки во всех экспериментах составляла 1.5 мВ/с. Электрохимические измерения проводились в свежеприготовленных растворах, объем электролита, используемый для эксперимента, – 30 мл. Анодные поляризационные кривые снимали в 1 М растворах Na2SO4 (х. ч.) и 1 М растворах NaOH (х. ч.) потенциодинамическим методом.
В качестве вспомогательного использовали платиновый электрод, а электродом сравнения служил хлоридсеребряный. Результаты приведены относительно водородного электрода.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
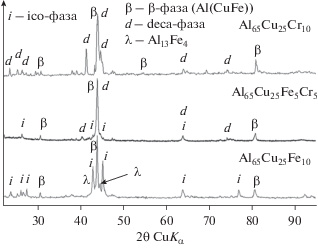
Подготовке поверхности электродов для исследования, их составу и морфологии уделялось особое внимание, так как незначительное изменение химического состава КК-образцов приводит к изменению как их морфологии, так фазового состава [4, 5]. Анализ данных СЭМ (рис. 1) показал, что во всех сплавах после кристаллизации формируется многофазная структура, данные о количестве и составе которых приведены в табл. 1.
Таблица 1.
Фазовый и химический состав сплавов системы Al–Cu–Fe–Cr
| № сплава | Состав сплава | Фаза | Содержание фаз, мас. % | Концентрация, ат. % (±0.6%) | |||
|---|---|---|---|---|---|---|---|
| Al | Cu | Fe | Cr | ||||
| № 1 | Al65Cu25Fe10 | i | 49.8 ± 0.4 | 60.8 | 24.5 | 14.7 | – |
| λ | 23.8 ± 0.5 | 66.5 | 4.6 | 28.9 | – | ||
| β | 26.4 ± 0.4 | 54.5 | 41.4 | 4.1 | – | ||
| № 2 | Al65Cu25Fe5Cr5 | d | 74.4 ± 0.2 | 67.1 | 16.4 | 8.4 | 8.1 |
| i | 13.1 ± 0.1 | 65.0 | 22.5 | 6.6 | 5.9 | ||
| β | 12.5 ± 0.1 | 50.1 | 46.4 | 2.7 | 0.8 | ||
| № 3 | Al65Cu25Cr10 | d | 92.3 ± 0.4 | 70.8 | 12.4 | – | 16.8 |
| β | 7.7 ± 0.2 | 46.9 | 52.7 | – | 0.4 | ||
В литом образце № 1 (табл. 1) КК i-фаза образуются в результате перитектической реакции: L + λ + β ⇔ i [9]. Замена железа на хром существенно меняет микроструктуру. По данным РФА, после кристаллизации кроме i-фазы в сплаве с 5% хрома присутствует d-фаза в количестве 74 мас. %. Легированный хромом сплав Al–Cu–Fe, как видно из рис. 2, при быстром охлаждении образует КК d-фазу, а в медленно твердеющих образцах, по литературным данным, вырастает ромбический АПР с параметрами решетки a = = 2.36 нм, b = 1.24 нм, c = 3.24 нм, который трудно различим методом РФА [10, 11].
Детальный анализ микроструктур позволил выявить морфологическую особенность литых сплавов i-, d- и КК-фаз, которые образуют смесь кристаллов (рис. 1б). Подобное фазовое состояние наблюдали и объяснили работе [5] локальным изоморфизмом родственных КК-структур и особенностями, связанными с неравновесной кристаллизацией расплавов. Замена атомов железа на хром сопровождается уменьшением количества i-фазы в литых сплавах с одновременным появлением большого количества d-составляющей. Данные микроструктурного и рентгенофазового анализа (СЭМ и РФА) настоящего исследования хорошо согласуются и дополняют друг друга (рис. 1, 2).
Для получения равновесного состояния КК-образцов был проведен отжиг сплавов при температуре 800°С в течение 50 ч. После термообработки, по данным электронной микроскопии, морфология образов в целом сохранилась, но поменялся их фазовый состав. Содержание КК-фаз в сплавах увеличилось на 5–7%. В Al65Cu25Fe5Cr5 фаза Al2Cu (2%) полностью растворилась. Поэтому для анодной поляризации использовались в основном отожженные образцы.
Исследования анодного поведения сплавов в щелочной среде проводились с целью выяснения влияния добавки Cr на стойкость многофазных КК-материалов.
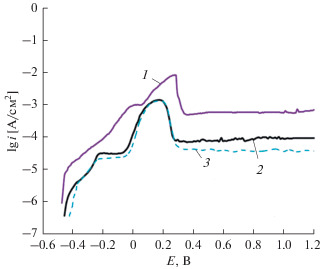
На рис. 3 представлены анодно-поляризационные кривые (АПК) сплавов в растворе 1 М NaOH. В сильнощелочной среде потенциалы свободной коррозии у сплавов значительно различаются. Сдвиг φкоррi-фазы в отрицательную область, связан с большей активностью Al в щелочной среде, чем в нейтральной [12]. Из рис. 3 (кривые 1–3) и рис. 4 (кривые 1–3) видно, что рост величины рН с нейтральной (Na2SO4) до щелочной (NaOH) активизирует анодное растворение сплавов, о чем свидетельствуют бóльшие токи коррозии (токи анодного растворения), и сдвигает анодно-поляризационные (АП) зависимости к отрицательным потенциалам. Плотность токов анодного растворения сплавов при pH 14 на порядок, а при pH 7 на два порядка меньше, чем в кислой среде [3]. Химически более стойкими, с учетом значений потенциалов: φ(Al65Cu25Fe5Cr5) ~ ~ ‒1.1 В и φ(Al65Cu25Cr10) –1.0 В, являются сплавы легированные хромом.
Рис. 3.
Анодные поляризационные кривые сплавов в 1 М растворе NaOH: 1 – Al65Cu25Fe10, 2 – Al65Cu25Fe5Cr5, 3 – Al65Cu25Cr10, 4 – Al.

Рис. 4.
Анодные поляризационные кривые сплавов в 1 М растворе Na2SO4: 1 – Al65Cu25Fe10, 2 – Al65Cu25Fe5Cr5, 3 – Al65Cu25Cr10.
В нейтральной среде (рис. 4) процессы локальной коррозии проявляются незначительно. Выщелачивание алюминия, по данным СЭМ, из первичных АПР-фаз не наблюдается. Потенциалы свободной коррозии отличаются мало, области пассивного состояния широкие, а токи пассивации различаются меньше, чем на порядок. Потенциалы свободной коррозии сплавов, содержащих β-фазу в количестве более 10 мас. % менее благородные, чем сплавы, содержащие КК-структуры. Другими словами, сплавы Al–Cu–Fe–Cr устойчивее к коррозии, чем сплавы системы Al‒Cu–Fe.
АПК сплавов в 1 М растворе NaOH показывают, что все образцы образуют значительные области с постоянным анодным током и фактически переходят в пассивное состояние, минуя область активно-пассивного растворения. При смещении потенциала поляризации в интервале значений φ = –1.3…–0.5 В это состояние сохраняется у всех сплавов.
Ток растворения алюминия больше на 2 порядка, чем у i-сплава, и на 3 порядка, чем у сплавов, легированных Cr. По данным сканирующей электронной микроскопии, на микрофотографии образца после анодной поляризации (рис. 5) видно, что на поверхности произошло значительное вытравливание алюминия с последующим образованием нового состава поверхности и продуктов коррозии. Также после анодной поляризации на поверхности электрода значительно увеличилась концентрация меди и железа, а кислород равномерно распределен по всей площади.
Рис. 5.
Микрофотография и энергодисперсионный спектр образца Al65Cu25Fe10 после АП в 1 М растворе NaOH.

На кривой № 1 (рис. 3) при φ = –0.4 В появляется пик активного растворения. Аналогичный результат получен также в работе [11], который авторы отнесли к специфическому влиянию меди в щелочном растворе, связанному с образованием Cu2O и Cu(OH)2 на поверхности, что подтверждается наличием на энергодисперсионном спектре образца после поляризации интенсивных пиков меди и кислорода (рис. 5).
Сплав Al65Cu25Fe5Cr5 при потенциале свободной коррозии имеет самые низкие токи (5 × 10–5 А/см2) анодного растворения. Замена железа на хром в сплавах заметно снижает плотность тока растворения и сдвигает φкорр в положительном направлении, а также несколько расширяется (~200 мВ) область пассивации.
По данным электронной микроскопии и энергодисперсионного анализа, в результате АП наблюдается активное растворение основного металла (алюминия) с последующим образованием защитной пленки из продуктов коррозии (рис. 6). Состав КК-фаз после эксперимента в образцах не изменился. Некоторые изменения произошли на образце № 2 с составом β-фазы: количество Al уменьшилось на 5 ат. %, а Cr увеличилось на 7 ат. %. Видно, что в β-фазе (образец № 3) составом: Al 40 ат. %, Cu 55 ат. %, Cr 5 ат. % количество Cr увеличилось на 5%, Cu на 3%, по сравнению со сплавом до коррозионных испытаний, а содержание алюминия уменьшилось на 6% (рис. 7). Отметим, что поведение сплава № 3 аналогично как при pH 14 (рис. 3), так и при pH 7 (рис. 4). После эксперимента на поверхности возрастает концентрация Cu, Fe и Cr, а алюминия уменьшается. При этом хром, который повышает стабильность сплава при pH 14, присутствует в виде оксигидроксида (CrО(ОН)) во внешнем слое, а гидроокись железа, как показано в [2], может дополнительно способствовать стабилизации пассивной пленки Al–Cu–Fe–Cr-сплавов.
Рис. 6.
Микрофотография и энергодисперсионный спектр образца Al65Cu25Fe5Cr5 после АП в 1 М растворе NaOH.

Рис. 7.
Микрофотография и энергодисперсионный спектр образца Al65Cu25Cr10 после АП в 1 М растворе NaOH.

Несмотря на наибольшую концентрацию алюминия, в КК-фазах они практически не подвергаются растворению. Селективное растворение электрохимически активных фаз, имеющих отрицательные величины локальных коррозионных потенциалов, к которым относятся β-AlFe(Cu) и меньше λ-Al13Fe4, приводит не только к изменению морфологии поверхности, но определенно влияет на состав поверхностного пассивного слоя.
Результаты анодной поляризации в сильнощелочном растворе показали, что полное замещение железа на хром, переход Al65Cu25Fe10 → → Al65Cu25Fe5Cr5 → Al65Cu25Cr10, не приводит к смещению открытого коррозионного потенциала в положительную сторону (φкорр(Al65Cu25Cr10) = = ‒1.0 В), но сопровождается заметным снижением скорости растворения (рис. 3). Так, плотность тока пассивации снижается, как видно, примерно на два порядка по сравнению со сплавом № 1 (Al65Cu25Fe10). Сплавы содержащие квазикристалические фазы (табл. 1), имеют примерно на 1.0 В более благородные потенциалы свободной коррозии, чем чистый Al.
Близкие величины потенциалов свободной коррозии для сплавов Al65Cu25Fe5Cr5 и Al65Cu25Cr10, в которых основной структурной составляющей является декагональная фаза, позволяют утверждать, что апериодические структуры вносят дополнительный вклад в коррозионную стабильность КК-материалов. Значительные различия плотности пассивного тока дают новую информацию о влиянии КК-структур на коррозию многокомпонентных алюминиевых сплавов. Из проведенных АП-экспериментов и анализа литературных результатов Massiani [11] трудно четко отделить наблюдаемое положительное влияние КК-структуры на образование стабильного оксидного слоя от вклада, связанного с различием скорости диффузии компонентов в КК- и АПР-фазах, что несомненно, приводит к различной кинетике растворения компонентов и специфике их электрохимического окисления.
Таким образом, РФА- и СЭМ-методами установлено, что в щелочных растворах поведение исследованных сплавов определяется не только химическим, но и фазовым составом. Коррозионная стойкость КК-сплавов с изменением основности (pОH) раствора связана, в значительной степени, с микроструктурными особенностями поверхности электрода, а также со спецификой поведения в щелочной среде защитной оксидной пленки, включающей атомы хрома.
ЗАКЛЮЧЕНИЕ
Анодная поляризация квазикристаллических алюминиевых сплавов показала, что в щелочной среде их коррозионное поведение определяется металлом – основой. Образцы активно растворяются от отрицательных потенциалов свободной коррозии и не образуют переходной активно-пассивной области. Снижение плотности пассивного тока на два порядка относительно чистого алюминия, определенно, отражает стабилизирующее влияние легирующего компонента на устойчивость поверхностного пассивного оксидного слоя.
По данным рентгенофазового анализа и сканирующей электронной микроскопии, основными структурными составляющими сплавов системы Al–Cu–Fe–Cr являются апериодические икосаэдрические и декагональные структуры, которые также вносят дополнительный вклад в коррозионную стабильность квазикристаллических материалов. После поляризации видно, что КК-фазы (как икосаэдрические, так и декагональные) не подверглись растворению, и их состав не изменился. Незначительное различие в коррозионном поведении КК связано с существованием на их поверхности сложных оксидных пленок определенного состава, замедляющих диффузию компонентов и растворение сплавов.
Список литературы
Dubois., J.-M., Quasicrystals, J. Phys.: Condensed Matter, 2001, vol. 13, no. 34, p. 7753.
Rüdiger, A. and Köster, U., Corrosion of Al–Cu–Fe quasicrystals and related crystalline phases, J. Non-Cryst. Solids, 1999, vols. 250–252, p. 898.
Ura-Binczyk, E., Homazava, N., Ulrich, A., Hauert, R., Lewandowska, M., Kurzydlowski, K. J., and Schmutz, P., Passivation of Al–Cr–Fe and Al–Cu–Fe–Cr complex metallic alloys in 1 M H2SO4 and 1 M NaOH solutions, Corr. Sci., 2011, vol. 53, p. 1825.
Huttunen-Saarivirta, E., Microstructure, fabrication and properties of quasicrystalline Al–Cu–Fe alloys: a review, J. Alloys Compd., 2004, vol. 363, p. 150.
Чугунов, Д.Б., Мешков, Л.Л., Калмыков, К.Б., Осипов, А.К. Синтез квазикристаллических фаз в системе Al–Cu–Fe–Cr, Журн. неорган. химии. 2016. Т. 61. № 1. С. 13. [Chugunov, D. B., Meshkov, L. L., Kalmykov, K. B., and Osipov, A. K., Synthesis of Quasi-Crystalline Phases in the Al–Cu–Fe–Cr System, Russ. J. Inorganic Chem., 2016, vol. 61, no. 1, p. 11.]
Jenks, C.J. and Thiel, P.A., Surface Properties of Quasicrystals, Mater. Res. Soc. Bull. 1997, vol. 22, no. 11, p. 55.
Ura-Binczyk, E., Beni, A., Lewandowska, M., and Schmutz, P., Passive oxide film characterisation on Al–Cr–Fe and Al–Cu–Fe–Cr complex metallic alloys in neutral to alkaline electrolytes by photo- and electrochemical methods, Electrochimica Acta, 2014, vol. 139, p. 289.
Шелехов, Е.В., Свиридова, Т.А. Программы для рентгеновского анализа поликристаллов. МиТОМ. 2000. №8. С. 16. [Shelekhov, E.V. and Sviridova T.A., Programmy dlya rentgenovskogo analiza polikristallov, MiTOM, 2000, vol. 8, p. 16.]
Raghavan, V., Al–Cu–Fe (Aluminum–Copper–Iron), J. Phase Equilibria and Diffusion, 2005, vol. 26, no. 1, p. 59.
Veys, D., Rapin, C., Li, X., Aranda, L., Fourne, V., and Dubois, J.M., Electrochemical behavior of approximant phases in the Al–(Cu)–Fe–Cr system, J. Non-Crystalline Solids, 2004, vol. 347, p. 1.
Massiani, Y., Ait, Yaazza S., and Crousier, J.P., Electrochemical behaviour of quasicrystalline alloys in corrosive solutions, J. Non-Crystalline Solids, 1993, vol. 159, p. 92.
Huttunen-Saarivirta, E. and Tiainen, T., Corrosion behaviour of Al–Cu–Fe alloys containing a quasicrystalline phase, Mater. Chem. and Phys., 2004, vol. 85, p. 383.
Дополнительные материалы отсутствуют.