Электрохимия, 2020, T. 56, № 9, стр. 837-843
Бездиафрагменный электросинтез дифенилфосфата
В. А. Загуменнов a, *, И. П. Косачев b, **
a Казанский (Приволжский) Федеральный университет, Химический институт им. А.М. Бутлерова
Казань, Россия
b Институт органической и физической химии им. А.Е. Арбузова ФИЦ Казанский научный центр РАН
Казань, Россия
* E-mail: vzagumen@kpfu.ru
** E-mail: kosachev@iopc.ru
Поступила в редакцию 10.06.2019
После доработки 22.12.2019
Принята к публикации 06.03.2020
Аннотация
Изучен процесс медиаторного бездиафрагменного электросинтеза (анод – платина, катод – никель) дифенилфосфата из дифенилфосфита с использованием в качестве медиаторов галогенидов щелочных металлов (KI, LiBr) в водно-органической (ацетонитрил, бензол) среде. Установлено, что при пропускании через электролит 2 Ф электричества на 1 моль дифенилфосфита в реакционной смеси фиксируются два фосфорсодержащих вещества – исходный дифенилфосфит и целевой дифенилфосфат. Наибольшее содержание дифенилфосфата наблюдается при проведении электросинтеза в смеси вода–ацетонитрил–бензол. Обнаружено, что избыток протонов в электролите ускоряет реакцию гидролиза исходного дифенилфосфита.
ВВЕДЕНИЕ
Диалкилфосфиты обладают способностью к таутомерному переходу из фосфитной формы I с трехвалентным атомом фосфора к фосфонатной II с четырехкоординированным фосфором (уравнение (1)).
(1)
$\begin{gathered} {{\left( {{\text{RO}}} \right)}_{2}}{\text{POH}} \rightleftarrows {{\left( {{\text{RO}}} \right)}_{2}}{\text{P(O}}){\text{H}}{\text{.}} \hfill \\ \,\,\,\,\,\,\,\,\,\,\,\,I\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,II \hfill \\ \end{gathered} $Возможность равновесного сдвига из одной формы в другую в зависимости от условий эксперимента обуславливает широкое синтетическое применение диалкилфосфитов [1]. Это обстоятельство, а также высокая лабильность связи фосфор–водород в таутомерной форме II послужили причиной изучения электрохимических свойств (RO)2P(O)H. Как было установлено, для синтеза различных соединений диалкилфосфиты можно использовать как в катодных [2–4], так и анодных реакциях [6–14].
Катодные реакции основаны на способности (RO)2P(O)H восстанавливаться на электродах из переходных металлов (Pt, Ni, Fe, Cu) c выделением газообразного водорода и образованием активного диалкилфосфит-аниона (уравнение (2)) [2]. Так, при катодном генерировании фосфит-анионов в присутствии алкилгалогенидов были синтезированы ряд алкилфосфонатов (уравнение (3)) [3]. Использование бездиафрагменного электролизера с растворимыми анодами приводит к получению солей диалкилфосфористых кислот (уравнение (4)) [4].
(2)
$2{{\left( {{\text{RO}}} \right)}_{2}}{\text{P(O}}){\text{H}}\xrightarrow{{ + 2{\text{e}}}}2{{\left( {{\text{RO}}} \right)}_{2}}{\text{P}}{{{\text{O}}}^{ \ominus }} + {{{\text{H}}}_{2}},$(3)
${{\left( {{\text{RO}}} \right)}_{2}}{\text{P}}{{{\text{O}}}^{ \ominus }} + {\text{R'Hal}} \to {{\left( {{\text{RO}}} \right)}_{2}}{\text{P(O}}){\text{R'}} + {\text{Ha}}{{{\text{l}}}^{ \ominus }},$(4)
$n{{\left( {{\text{RO}}} \right)}_{2}}{\text{P}}{{{\text{O}}}^{ \ominus }} + {{{\text{M}}}^{{n + }}} \to {{\left[ {{{{\left( {{\text{RO}}} \right)}}_{2}}{\text{PO}}} \right]}_{n}}{\text{M}},$R = Me, Et, Ph; R′ = Me, PhCH6; Hal = Cl, I; M = анодно растворяющийся металл.
Известно, что диалкилфосфиты на платиновом электроде в обычной области анодных потенциалов (0.0–2.4 В относительно электрода сравнения Ag/Ag+ (0.1 М р-р в CH3CN)) не окисляются [5], поэтому для проведения анодных синтезов с участием (RO)2P(O)H применяли непрямое электроокисление. Были использованы три метода: 1) получение активных замещенных фосфатов (путем первоначального анодного генерирования свободных галогенов или диродана, уравнение (5)), реагирующих далее с нуклеофилами (вода, спирты, амины, тиолы, дисульфиды). Такие реакции подробно рассмотрены в обзоре [6]; 2) предварительный перевод диалкилфосфита в фосфитную форму I обработкой щелочным металлом с последующим электроокислением солей (RO)2POM (уравнение (6)). Таким способом были получены арилфосфонаты [7, 8], пирофосфиты [9], стирилфосфонаты [10], гипофосфаты [11], алкилфосфонаты [12]; 3) получение диалкилфосфонильных радикалов путем гомолитического разрыва связи P–H фосфонатной формы II генерируемыми на аноде катион-радикалами третичных фосфинов (фосфитов) (уравнение (7)). Таким способом было инициировано радикальное присоединение диэтилфосфита к алкенам [13, 14].
(5)
$\begin{gathered} 2{{{\text{X}}}^{ \ominus }}\xrightarrow{{ - 2{\text{e}}}}{{{\text{X}}}_{2}}\,\,\,\,\,{\text{X}} = {\text{Hal,}}\,\,{\text{SCN,}} \\ {{\left( {{\text{RO}}} \right)}_{2}}{\text{P(O}}){\text{H}} + {{{\text{X}}}_{2}}\, \to {{\left( {{\text{RO}}} \right)}_{2}}{\text{P(O}}){\text{X}} + {\text{HX,}} \\ {{\left( {{\text{RO}}} \right)}_{2}}{\text{P(O}}){\text{X}} + {\text{NuH}} \to {{\left( {{\text{RO}}} \right)}_{2}}{\text{P(O}}){\text{Nu}} + {\text{HX;}} \\ \end{gathered} $(6)
$\begin{gathered} {{\left( {{\text{RO}}} \right)}_{2}}{\text{POH}} + {\text{M}}\xrightarrow[{ - {1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}{{{\text{H}}}_{2}}}]{}{{\left( {{\text{RO}}} \right)}_{2}}{\text{POM}}\xrightarrow[{ - {{{\text{M}}}^{ \oplus }}}]{{ - {\text{e}}}} \\ \to {{\left( {{\text{RO}}} \right)}_{2}}{\text{P}}{{{\text{O}}}^{{\,\centerdot }}},\,\,\,\,\,\,\,\,\,\,{\text{M}} = {\text{Na,}}\,\,{\text{Li;}} \\ \end{gathered} $(7)
$\begin{gathered} {{{\text{X}}}_{3}}{\text{P}}\xrightarrow{{ - {\text{e}}}}{{{\text{X}}}_{3}}{{{\text{P}}}^{{ \oplus \,\centerdot }}}, \\ {{{\text{X}}}_{3}}{{{\text{P}}}^{{ \oplus \,\centerdot }}} + {{\left( {{\text{RO}}} \right)}_{2}}{\text{P(O}}){\text{H}} \to {{{\text{X}}}_{3}}{{{\text{P}}}^{ \oplus }}{\text{H}} + {{\left( {{\text{RO}}} \right)}_{2}}{{{\text{P}}}^{{\,\centerdot }}}{\text{O,}} \\ {\text{X = Bu,}}\,\,i{\text{ - PrO;}}\,\,\,{\text{R}}\,{\text{ = }}\,{\text{Et}}{\text{.}} \\ \end{gathered} $Однако можно отметить, что вышеприведенные примеры с участием (RO)2P(O)H в электрохимическом синтезе практически всецело относятся к алкильным производным. Есть только одна публикация, относящаяся к катодному синтезу фосфонатов по уравнению (3), где в качестве одного из реагентов был использован дифенилфосфит [3]. Тогда как наличие в (RO)2P(O)H ароматических групп может изменить направление протекания электрохимических процессов за счет электродной активации этих структурных фрагментов. В связи с этим было предпринято исследование возможности использования дифенилфосфита (PhO)2P(O)H (III) в электрохимических синтезах. Определенный интерес вызывает разработка метода синтеза дифенилфосфата (PhO)2P(O)OH, который находит применение как катализатор процессов полимеризации [15, 16] и при синтезе полимерных светодиодов [17]. Также дифенилфосфат входит в состав ионной жидкости, увеличивающей износостойкость стали [18]. Соли дифенилфосфата используются в качестве катализатора синтеза молекулярных магнитов [19] и входят в состав ингибиторов коррозии [20], а эфирные производные широко применяются как антипирены [21].
Химическими способами дифенилфосфат получают путем частичного гидролиза различных фосфатов, например хлорфосфатов [22], амидофосфатов [23] или третичных фосфитов общей формулы (PhO)2P(O)(OX) (уходящей группой ОХ может быть PhO [24], p-O2NC6H4 [25], R3SiO [26], ArC(O)CH2O [27]). Однако в литературе отсутствуют сведения о получении дифенилфосфата методом окисления, хотя для диалкилфосфитов такие реакции описаны [28, 29]. Таким образом, получение дифенилфосфата электрохимическим способом из дифенилфосфита – это принципиально новый путь синтеза (не гидролиз, а окисление).
В данной публикации представлены результаты по исследованию возможности электросинтеза дифенилфосфата из (PhO)2P(O)H.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Электрохимические эксперименты проводили в гальваностатическом режиме при таком значении силы тока, чтобы общее напряжение на ячейке не превышало 10 В. Источником постоянного тока служил потенциостат П5827М. Использовали двухэлектродную ячейку без разделения анодного и катодного пространств. Анодом служили платиновый цилиндр (площадь рабочей поверхности 37 см2), катодом – цилиндр из никеля, расположенный коаксиально внутри анода с площадью рабочей поверхности 30 см2. Во время электролиза электролит интенсивно перемешивали магнитной мешалкой. ЯМР-спектры на ядрах 31Р были получены на приборе “Varian Unity” на рабочей частоте 121 МГц (внешний стандарт – 85%‑ный раствор Н3РО4) в режимах как с развязкой от протонов (ЯМР31Р), так и без развязки от протонов (ЯМР31Р – {1H}). В работе были использованы реактивы марки “ч” (фенол, трихлорид фосфора, KI, LiBr), используемые без предварительной очистки. Бензол перегоняли над натрием. Ацетонитрил дважды перегоняли над пентаоксидом фосфора с небольшими добавками перманганата калия.
Синтез дифенилфосфита (III). В круглодонной колбе объемом 250 мл в 75 мл бензола растворяли 62 г (0.2 М) трифенилфосфита, полученного ранее взаимодействием фенола с треххлористым фосфором по методике, описанной в [30], затем добавляли 24 мл 33% водного раствора соляной кислоты [31]. Реакционную смесь кипятили 3 ч, далее отгоняли легколетучие примеси в вакууме водоструйного насоса. Оставшаяся вязкая жидкость представляет собой дифенилфосфит (37.4 г, выход по веществу 80%): δР = 0.5 м. д., JPH = 740 Гц, кип Т = 152–155оС (0.2 мм рт. ст.), $n_{d}^{{20}}$ = 1.5570. Литературные данные: δР = 0.5 м. д., JPH = 740 Гц [32], кип Т = 145–148оС (0.15 мм рт. ст.), $n_{d}^{{20}}$ = 1.5570 [33].
Условия электрохимических экспериментов с участием галогенидов щелочных металлов. Рабочий раствор, общим объемом приблизительно 20 мл, готовили растворением в водно-органической среде (ацетонитрил, бензол) 3.5 г III (0.015 М) и небольших количеств KI или LiBr (условия электролиза и количества веществ, составляющих электролит, приведены в табл. 1). По окончании электролиза реакционную смесь обрабатывали трижды 20 мл бензола, затем в делительной воронке отделяли водный слой от органического. Объединенный органический слой упаривали, остаток взвешивали, состав идентифицировали с помощью метода ЯМР31Р путем сравнения значений химсдвигов δР, полученных в экспериментах, с известными литературными величинами [32]. Дифенилфосфат (перекристаллизован из смеси хлористого метилена с гексаном): δР – 12 м. д.; пл Т = 68–70°С. Литературные данные: δР – 12 м. д. [32]; пл Т = 69–70°С [24]. Результаты обобщены в табл. 1.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Поскольку (PhO)2P(O)H при обычных анодных потенциалах не окисляется, то для вовлечения III в электрохимический процесс нами был выбран метод непрямого электроокисления с использованием медиаторной системы галогенид-ионы/галоген (уравнение (5)).
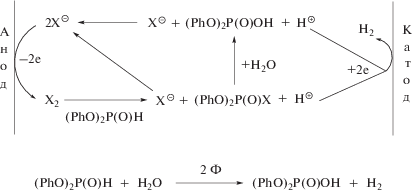
При получении дифенилфосфата (IV) из III в ходе электролиза должно образовываться значительное количество галогенводорода (уравнение (5), NuH = H2O), поэтому представляется целесообразным использование бездиафрагменного электролизера, в котором катодный процесс будет задействован для удаления появляющихся в растворе протонов. В этом случае суммарная схема процесса электросинтеза может быть представлена уравнением (8).
Согласно уравнению (8), для получения одного моля VI необходимо затратить 2 Ф электричества, а присутствие медиатора нужно в минимальном количестве, только для инициирования процесса и увеличения электропроводности раствора. Исходя из вышесказанного, при препаративном электросинтезе дифенилфосфата IV была использована бездиафрагменная электрохимическая ячейка с анодом из платины и никелевым катодом. В качестве медиаторов были выбраны соли щелочных металлов (KI и LiBr), аналогично методу синтеза диалкилфосфорных кислот, описанному в работе [34]. Однако в отличие от методики, принятой в работе [34], электролиз проводили не в водной, а в водно-органической (ацетонитрил, бензол) среде, поскольку исходное вещество III плохо растворимо в воде. Электролиз проводили при таком максимальном значении силы тока, чтобы напряжение на ячейке не превышало 10 В. Результаты экспериментов (состав электролита, условия электролиза и состав реакционной смеси после электролиза) представлены в табл. 1.
Таблица 1.
Результаты препаративного электросинтеза дифенилфосфата (IV). Медиатор – галогениды щелочных металлов
| № | Электролит | Условия электролиза | Реакционная смесь после электролиза | |
|---|---|---|---|---|
| J, мА | F1, Кл/моль | cоотношение IV/III2 | ||
| 1 | CH3CN (15 мл) H2O (5 мл) KI (1 г) |
250 | 2.0 | 2.6 |
| 2 | CH3CN (5 мл) H2O (15 мл) KI (1 г) |
250 | 2.0 | 2.7 |
| 3 | CH3CN (6 мл) H2O (6 мл) C6H6 (8 мл) KI (1 г) |
100 | 2.0 | 2.9 |
| 4 | CH3CN (15 мл) H2O (5 мл) LiBr (0.5 г) |
250 | 2.0 | 3.3 |
| 5 | C6H6 (10 мл) H2O (10 мл) LiBr (0.5 г) |
100 | 1.0 | 1.0 |
| 6 | CH3CN (6 мл) H2O (6 мл) C6H6 (8 мл) LiBr (0.5 г) |
100 | 2.0 | 3.5 |
Примечания: 1) величину определяли делением общего количества пропущенного электричества на концентрацию исходного дифенилфосфита (0,015 М); 2) определяли по отношению интенсивностей сигналов продуктов электролиза (бензольный экстракт) в спектре ЯМР 31Р (III, δР = 0.5 м. д., JPH = 740 Гц; IV, δР = –12 м. д.).
Как видно из табл. 1, после пропускания через раствор электролита 2 Ф электричества в реакционной смеси, по данным ЯМР 31Р, присутствуют лишь два фосфорных соединения – исходный фосфит III (приблизительно 20% от первоначального количества) и целевой продукт IV. Монофенилфосфата (PhO)(HO)P(O)OH (δР = –6 м. д. [30]), продукта частичного гидролиза III, аналогичного обнаруженным в ряде экспериментов при электросинтезе диалкилфосфатов [34], в реакционной смеси не зафиксировано. Наличие III показывает, что часть электричества затрачивалось не только на синтез IV (уравнение (8)), но и на иной процесс. Наиболее вероятно, что это процесс взаимодействия галогенов, генерируемых на аноде, с водой (уравнение (9)).
(9)
$\begin{gathered} 2{{{\text{X}}}^{ \ominus }} - 2{\text{e}} \to {{{\text{X}}}_{2}}, \\ {{{\text{X}}}_{2}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} \to {\text{HX}} + {\text{XOH}}. \\ \end{gathered} $Изменение соотношения компонентов среды (вода–ацетонитрил) практически не оказывает никакого влияния на ход процесса (табл. 1, № 1, 2). Относительное содержание целевого продукта в реакционной смеси (табл. 1, № 1, 4) несколько выше при использовании бромида лития, что объясняется, вероятно, более быстрым реагированием Br2 с III по сравнению с I2.
Поскольку продукты электросинтеза далее отделяются от электролита экстракцией бензолом, то с целью упрощения процесса (быстрое отделение III и IV от галогенидов после электролиза) было проведено электроокисление медиаторной системой X–/X2 соединения III в водно-бензольной среде (табл. 1, № 5). Однако попытка проведения электролиза в среде вода–бензол оказалось не совсем удачной. Процесс сопровождался пассивацией, что приводило к значительному повышению напряжения на ячейке. Так удалось пропустить через электролит при предельном напряжении на ячейке, равном 10 В, лишь 1 Ф электричества, что привело к уменьшению конверсии III. Кроме того, снизилось и соотношение выделенных после электролиза веществ (IV/III). Это связано, вероятно, с несколькими причинами. Во-первых, увеличением сопротивления раствора при добавлении бензола. Во-вторых, образованием двухфазной системы, в которой концентрация III в приэлектродном слое была понижена вследствие лучшей растворимости в бензоле. Очевидно, что одно из основных условий повышения эффективности процесса электросинтеза дифенилфосфата является гомогенность электролита, что обеспечивается добавлением в раствор ацетонитрила. Так, наибольшие выходы IV наблюдались в электролите, содержащем, кроме воды и галогенидов, еще и ацетонитрил с бензолом (табл. 1, № 6). По-видимому, такая смесь, будучи гомогенной, способствует более быстрой скорости реагирования III с галогеном благодаря наличию бензола.
Галогенводороды, обладающие хорошей электропроводностью в воде, легко удаляются из реакционной смеси при упаривании растворителей, что является определенным преимуществом при очистке продуктов электросинтеза. Поэтому представлялось целесообразным изучить процесс электросинтеза IV с использованием в качестве медиаторов галогенводородов HX (X = Cl, Br, I). Однако проведенные нами эксперименты, в которых галогениды щелочных металлов были заменены галогенводородными кислотами, оказались неудачными. В ходе этих электрохимических процессов вместо ожидаемого дифенилфосфата были выделены продукты гидролиза соединения III – фенол и фосфористая кислота. Вероятно, избыток протонов, присутствующих в электролите при проведении электросинтеза в экспериментах с НХ, значительно ускоряет гидролиз исходного дифенилфосфита. Отсутствие фенола и фосфористой кислоты в экспериментах с KI и LiBr (табл. 1) служит косвенным доказательством того, что катодный процесс заключается в быстром удалении протонов из электролита за счет электродного восстановления до водорода (уравнение (8)).
ЗАКЛЮЧЕНИЕ
Таким образом, при изучении процесса электроокисления дифенилфосфита в водно-органической (ацетонитрил, бензол) среде с использованием в качестве медиаторов галогенидов щелочных металлов (KI, LiBr) было установлено, что генерируемые на платиновом аноде в результате электродного окисления молекулы галогенов X2 взаимодействуют как с водой, так и исходным дифенилфосфитом с образованием галогенфосфата. Галогенфосфат далее быстро гидролизуется до целевого продукта – дифенилфосфата. Было обнаружено, что при избытке в электролите протонов в случае проведения электросинтеза дифенилфосфата с использованием в качестве медиаторов галогенводородных кислот НХ электролиз сопровождается гидролизом исходного дифенилфосфита. Роль катодного процесса заключается в электровосстановлении образующихся в последующих химических реакциях X2 с водой и (PhO)2P(O)H протонов на никелевом электроде до молекулярного водорода, что предотвращает закисление электролита и последующий гидролиз исходного соединения. Обнаружено, что наибольшее содержание дифенилфосфата в реакционной смеси наблюдается при проведении электролиза в смеси растворителей (вода–бензол–ацетонитрил), в которой бензол способствует лучшей растворимости дифенилфосфита в электролите, а ацетонитрил служит для создания гомогенности среды.
Список литературы
Пурдела, Д., Вылчяну, Р. Химия органических соединений фосфора. М.: Химия. 1972. С. 354. [Purdela, D. and Vilceanu, R., Chemistry of organic compounds of phosphorus (in Russian), Moskow: Chemistry, 1972, p. 354.]
Бухтиаров, А.В., Михеев, В.В., Лебедев, А.В., Кудрявцев, Ю.Г. Катодное расщепление связи P–H. Электрохимическое восстановление диалкилфосфитов. ЖОХ. 1991. Т. 61. С. 889. [Bukhtiarov, A.V., Mikheev, V.V., Lebedev, A.V., and Kudryavtsev, Y.G., Cathode spallation of the P–H bond. Electrochemical reduction of dialkylphosphites, Zh. obshchei khimii, 1991, vol. 61, p. 889.]
Петросян, В.А., Ниязымбетов, М.Е. Катодное алкилирование диалкил- и диарилфосфитов. Изв. АН СССР. Сер. Хим. 1988. Т. 37. С. 1945. [Petrosyan, V.A. and Niyazymbetov, M.E., Cathodic alkylation of dialkyl- and diaryl phosphates, Bull. AS USSR. Div. Chem. Sci., 1988, vol. 37, p. 1744.]
Павличенко, В.Ф., Преснов, А.Е., Томилов, А.П. Электрохимический синтез солей О,О'-диметилфосфористой кислоты со связью металл - фосфор. Электрохимия. 1995. Т. 31. С. 538. [Pavlichenko, V.F., Presnov, A.E., and Tomilov, A.P., Electrochemical synthesis of O,O'-dimethylphosphites with metal-phosphorus bond, Russ. J. Electrochem., 1995, vol. 31, p. 493.]
Ромахин, А.С., Косачев, И.П., Никитин, Е.В., Игнатьев, Ю.А., Каргин, Ю.М., Пудовик, А.Н. Электрокатализируемое фосфорилирование олефинов. ДАН СССР. 1987. Т. 294. № 6. С. 1413. [Romakhin, A.S., Kosachev, I.P., Nikitin, E.V., Ignatiev, I.A., Kargin, Y.M., and Pudovik, A.N., Electrocatalyzed phosphorylation of olefins, Dokl. Akademii nauk SSSR, 1987, vol. 294, no. 6, p. 1413.]
Томилов, А.П., Осадченко, И.М., Худенко, А.В. Электрохимические синтезы на основе элементного фосфора и эфиров фосфористой кислоты. Успехи химии. 1996. Т. 65. С. 1080. [Tomilov, A.P., Osadchenko, I.M., and Khudenko, A.V., Electrochemical syntheses based on elemental phosphorus and phosphorous esters, Uspekhi khimii, 1996, vol. 65, p. 1080.]
Никитин, Е.В., Ромахин, А.С., Паракин, О.В., Игнатьев, Ю.А., Романов, Г.В., Каргин, Ю.М., Пудовик, А.Н. Новая электрофильная реакция в ряду фосфорорганических соединений. Докл. АН СССР. 1981. Т. 258. С. 678. [Nikitin, E.V., Romakhin, A.S., Parakin, O.V., Ignatiev, I.A., Romanov, G.V., Kargin, Y.M., and Pudovik, A.N., A New electrophilic reaction in series of the organo-phosphorus compounds, Dokl. Akademii nauk SSSR, 1981, vol. 258, p. 678.]
Romakhin, A.S., Babkin, Y.A., Khusainova, D.R., Nikitin, E.V., and Kargin, Y.M., Competitive reactions method in electrochemistry—a new tool for investigating the anodic intermediates reactivity, Electrochim. Acta, 1989, vol. 34, p. 1417.
Ромахин, А.С., Паракин, О.В., Никитин, Е.В., Игнатьев, Ю.А., Загуменнов, В.А., Романов Г.В., Каргин, Ю.М., Пудовик, А.Н. Электрохимический синтез тетраалкилпирофосфитов. ЖОХ. 1985. Т. 55. С. 2208. [Romakhin, A.S., Parakin, O.V., Nikitin, E.V., Ignatiev, I.A., Zagumennov, V.A., Roma-nov, G.V., Kargin, Y.M., and Pudovik, A.N., Electrochemical synthesis of tetraalkylpyrophosphites, Zh. obshchei khimii, 1985, vol. 55, p. 2208.]
Ромахин, А.С., Загуменнов, В.А., Никитин, Е.В. Присоединение электрохимически генерируемых фосфон-радикалов к фенилацетилену. ЖОХ. 1995. Т. 65. С. 1229. [Romakhin, A.S., Zagumennov, V.A., and Nikitin, E.V., Attachment of electrochemically generated phosphone-radicals to phenylacetylene, Zh. Obshchei Khimii, 1995, vol. 65, p. 1229.]
Ромахин, А.С., Загуменнов, В.А., Никитин, Е.В. Электрохимическое окисление и взаимодействие с галогенами солей диалкилфосфористых кислот. ЖОХ. 1997, Т. 67. С. 1085. [Romakhin, A.S., Zagumennov, V.A., and Nikitin, E.V., Electrochemical oxidation of metal dialkyl phosphites and their reaction with halogens, Russ. J. Gen. Chem., 1997, vol. 67, no. 7, p. 1022.]
Ромахин, А.С., Косачев, И.П., Загуменнов, В.А., Никитин, Е.В. Анодно инициируемое свободно-радикальное фосфорилирование олефинов. ЖОХ. 1997. Т. 67. С. 244. [Romakhin, A.S., Kosachev, I.P., Zagumennov, V.A., and Nikitin, E.V., Free-radical phosphorylation of olefins initiated by anodic oxidation, Russ. J. Gen. Chem., 1997, vol. 67, no. 2, p. 227.]
Загуменнов, В.А., Никитин, Е.В, Ромахин, А.С., Косачев, И.П. Электрохимическая активация цепных радикальных процессов фосфорорганическими катион-радикалами. Электрохимия. 2000. Т. 36. С. 157. [Zagumennov, V.A., Nikitin, E.V., Roma-khin, A.S., and Kosachev, I.P., Electrochemical activation of chain radical processes by radical organophosphorus cations, Russ. J. Electrochem., 2000, vol. 36, p. 140.]
Nikitin, E.V. and Zagumennov, V.A., Initiation of homolytic addition to alkenes by means of organophosphorus radical-cations, Electrochim. Acta, 2000, vol. 45, p. 3983.
Ogawa, T., Nakazono, K., Aoki, D., Uchida, S., and Takata, T., Effective Approach to Cyclic Polymer from Linear Polymer: Synthesis and Transformation of Macromolecular[1]Rotaxane, ACS Macro Letters, 2015, vol. 4, p. 343.
Wang, X., Liu, J., Xu, S., Xu, J., Pan, X., Liu, J., Cui, S., Li, Z., and Guo, K., Traceless switch organocatalysis enables multiblock ring-opening copolymerizations of lactones, carbonates, and lactides: by a one plus one approach in one pot, Polimer chem., 2016, vol. 7, p. 6297.
Mullemwar, S., Zade, G., Kalyani, N.T., and Dhoble, S., Blue light emitting P-Hydroxy DPQ phosphor for OLEDs, Optik, 2016, vol. 127, p. 10546.
Khemchandani, B., Somers, A., Howlett, R., Jaiswal, A.K., Sayanna, E., and Forsyth, M., A biocompatible ionic liquid as an antiwear additive for biodegradable lubricants, Tribology international, 2014, vol. 77, p. 171.
Kuroda-Sowa, T., Fukuda, S., Miyoshi, S., Maekawa, M., Munakata, M., Miyasaka, H., and Yamashita, M., A chemical modification of a Mn-12 single-molecule magnet by replacing carboxylate anions with diphenylphosphate anions, Chem. Lett, 2002, vol. 7, p. 682.
Nam, N.D., Hien, P.V., Hoai, N.T., and Thu, V.T.H., A study on the mixed corrosion inhibitor with a dominant cathodic inhibitor for mild steel in aqueous chloride solution, J. Taiwan Inst. Chem. Engineers, 2018, vol. 91, p. 556.
van der Veen, I. and de Boer, J., Phosphorus flame retardants: Properties, production, environmental occurrence, toxicity and analysis, Chemosphere, 2012, vol. 88, p. 1119.
Lacasse, M.-Ch., Poulard, C., and Charette, A.B., Iodomethylzinc phosphates: Powerful reagents for the cyclopropanation of alkenes, JACS, 2005, vol. 127, no. 36, p. 12440.
Li, B.-J., Simard, R.D., and Beauchemin, A.M., o‑Phtalaldehyde catalysed hydrolysis of organophosphinic amides and other P(=O)–NH containing compounds, Chem. Commun, 2017, vol. 53, no. 62, p. 8667.
Nifant’ev, I.E., Tavtorkin, A.N., Korchagina, S.A., Gavrilenko, I.F., Glebova, N.N., Kostitsyna, N.N., Yakovlev, V.A., Bondarenko, G.N., and Filatova, M.P., Neogium tris-diarylphosphates: Systematic study of the structure—reactivity relationship in butadiene and isoprene polymerization, Appl. Catal. A: General, 2014, vol. 478, p. 219.
Knier, B.L., Durst, H.D., Burnside, B.A., Mackay, R.A., and Longo, F. R., Catalytic hydrolysis of phosphate esters in microemulsions, J. Solution Chem., 1988, vol. 17, no. 1, p. 77.
Кабачник, М.И., Захаров, Л.С., Молчанова, Г.Н., Дроздова, Т.Д., Петровский, П.В. Синтез кремнийсодержащих эфиров фосфорных кислот и изучение их термостабильности. 3. Термическая перегруппировка триорганосилилметиловых эфиров дифенилфосфорной кислоты. Изв. АН СССР. Сер. хим. 1989. Т. 38. № 7. С. 1664. [Kabachnik, M.I., Zakharov, L.S., Molchanova, G.N., Drozdova, T.D., and Petrovskii, P.V., Synthesis of silicon-containing esters of phosphorus acids and study of their thermal stability. 3. Thermal reaarangement of triorganosilylmethyl esters of diphenylphosphoric acid, Bul. AS USSR. Div. chem. sci., 1989, vol. 38, no. 7, p. 1527.]
Epstein, W.W. and Garrossian, M., p-Methoxyphenacyl esters as photodeblockable protecting groups for phosphates, JCS. Chem. Comm., 1987, no. 8, p. 532.
Петров, К.А., Нифантьев, Э.Е., Лысенко, Т.И. Новый синтез диалкилфосфатов. ЖОХ. 1961. Т. 31. № 6. С. 1709. [Petrov, K.A., Nifant’ev, E.E., Lisenko, T.I. New synthesys of dualkylphosphates, Zh. Obshei Khimii, 1961, vol. 31, no. 6, p. 1709.]
Wada, T., Ishukawa, K., and Hata, T., Nucleoside 3'‑N,N-dialkykphosphonamidates: novel building blocks for oligonucleotide synthesys, Tetrahedron Lett., 1990, vol. 31, p. 6363.
Кормачев, В.В., Федосеев, М.С. Препаративная химия фосфора. Пермь: Изд. УрО РАН, 1992. С. 86. [Kormachev, V.V. and Fedoseev, M.S., Preparative chemistry of phosphorus (in Russian), Perm: Izd. Ural division of RAS, 1992, p. 86.]
Арбузов, А.Е. Избранные труды. М.: Наука. 1976. С. 45. [Arbuzov, A.E., Electing works (in Russian), Moskow: Nauka, 1976, p. 45.]
Crutchfield, M.M., Dungan, C.H., Letcher, J.H., Mark, V., and Van Waser, J.R., 31P Nuclear Magnetic Resonance. In Topics in Phosphorus Chemistry. Van Waser, J. R., Eds, New York, London, Sidney: Intersci. Publ., a division of J. Willey & Sons, 1963, p. 227.
Петров, К.А., Нифантьев, Э.Е., Гольцова, Р.А., Щеголев, А.А., Бушмин, Б.В. Синтез и переэтерификация дифенилфосфита. ЖОХ. 1962. Т. 32. № 11. С. 3723. [Petrov, K.A., Nifant’ev, E.E., Goltsova, R.A., Shegolev, A.A., and Bushmin, B.V., Synthesis and reetherification of diphenylphosphite, Zh. Obshei Khimii, 1962, vol. 32, no. 11, p. 3723.]
Клюев, Б.Л., Либман, Б.Я., Томилов, А.П. Способ получения диалкилфосфорных кислот, А.С. 601284 (СССР). 1975. [Kluev, B.L., Libman B.Ya., and Tomilov, A.P., Method of obtaining of dialkylphosphorous acids, Pat. 601284 (USSR), 1975.]
Дополнительные материалы отсутствуют.