Электрохимия, 2020, T. 56, № 9, стр. 788-797
Новый безметковый иммуносенсор на основе электрохимически восстановленного оксида графена для определения гемоглобина A1c
М. Озге Карашаллы a, Дерья Коюнджу Зейбек a, *
a Университет Кютахья Думлупынар, Факультет естественных наук и искусств, Кафедра биохимии
Кютахья, Турция
* E-mail: derya.kzeybek@dpu.edu.tr
Поступила в редакцию 04.08.2019
После доработки 31.10.2019
Принята к публикации 20.12.2019
Аннотация
В данной работе был разработан новый иммуносенсор на основе стеклоуглеродного электрода (СУЭ), модифицированного электрохимически восстановленным оксидом графена (ЭВОГ), для чувствительного и безмаркерного выявления гликозилированного гемоглобина (HbA1c), используемого в качестве золотого стандарта для контроля гликемии. Полученный иммуносенсор, использующий ферроцианид/феррицианид в качестве медиатора, обеспечивает несложный и экономичный метод определения HbA1c. Предлагаемый иммуносенсор может непосредственно регистрировать изменения электрохимических сигналов при возникновении иммунореакции на поверхности сенсора. Специфическая иммунореакция антиген–антитело приводила к уменьшению амперометрического отклика медиатора, который диффундировал к поверхности электрода. Для исследования электрохимических характеристик иммуносенсора были использованы методы спектроскопии электрохимического импеданса (СЭИ) и циклической вольтамперометрии (ЦВА). По данным, полученным методом дифференциальной импульсной вольтамперометрии (ДИВА), была построена калибровочная кривая и получена линейная зависимость между откликом ДИВА и концентрацией HbA1c от 1 до 25%. При оптимальных условиях СУЭ/ЭВОГ/ HbA1c Ab-иммуносенсор обеспечивал высокую селективность и чувствительность обнаружения HbA1c в реальных образцах сыворотки крови.
ВВЕДЕНИЕ
Сахарный диабет (СД) характеризуется хронической гипергликемией, поражающей около 150 миллионов человек во всем мире. Согласно данным Международной диабетической федерации ожидается, что число людей, страдающих диабетом, возрастет с 371 миллиона в 2012 г. до 552 миллионов к 2030 г. Хроническая гипергликемия может поражать различные органы, особенно сердце, нервы, глаза, почки и кровеносные сосуды. Таким образом, для диагностики и лечения СД необходимо определять уровень глюкозы в крови (ГК). Количественное определение уровня глюкозы в крови натощак и 2-часовой уровень ГК являются наиболее часто используемыми методами для диагностики СД. Тем не менее при определении ГК таким способом ее значение может колебаться и зависеть от ежедневного рациона, и должно количественно определяться через определенные промежутки времени [1, 2]. Гемоглобин A1c (HbA1c) или биомолекула гликозилированного гемоглобина описывается как золотой стандарт для диагностики и мониторинга СД [3]. Уровень HbA1c представляет собой среднее значение ГК за 2–3 месяца и не зависит от суточных колебаний ГК. Следовательно, уровень HbA1c используется для диабетического гликемического контроля. Для обнаружения HbA1c было предложено несколько традиционных методов, таких как боронат-аффинная хроматография [4], капиллярный электрофорез [5] и высокоэффективная жидкостная хроматография [6]. Кроме того, электрохимические иммуносенсоры, основанные на взаимодействии антигена и антитела, привлекают повышенное внимание благодаря своим существенным преимуществам: малому времени обработки сигнала, простоте процедуры, точному и чувствительному измерению, малым аналитическим объемам, легкой миниатюризации, быстрому анализу, низкой стоимости и высокой чувствительности [7, 8]. Электрохимические иммуносенсоры можно разделить на две группы, такие как меченые и безметковые иммуносенсоры. По сравнению с мечеными иммуносенсорами, электрохимические иммуносенсоры без меток обладают очевидными преимуществами, которые заключаются в низкой стоимости, присущей им простоте, меньшем количестве времени и химических реактивов, требующихся для их изготовления, а также в отсутствие потребности во вторичных антителах из-за отсутствия трудоемких процессов маркировки [9, 10].
Графен, представляющий собой двумерный слой sp2-гибридных атомов углерода толщиной в один атом, в последнее время получил большой интерес благодаря своей высокой удельной поверхности, большой способности к переносу электронов, исключительной термостойкости и высокой электропроводности [11]. Поэтому оксид графена и его электрохимически восстановленная форма (ЭВОГ) широко применяются в качестве электродного модификатора при изготовлении электрохимических (био)сенсоров для определения глюкозы [12, 13], триглицеридов [14], фенольных соединений [15], NADH [16], белка теплового шока 70 [17] и пептида YY [18]. Кроме того, Чжоу и др. представили вольтамперометрический HbA1c-сенсор на основе пирролохинолин хинона, модифицированного фенилбороновой кислотой, и ЭВОГ композитов. Процесс анализа HbA1c был основан на измерении изменения интенсивности тока пирролохинолин хинона после того как HbA1c связывался с бороновой кислотой, присоединенной к пирролохинолин хинону [19].
Целью данной работы является создание нового электрохимического иммуносенсора на основе ЭВОГ для безмаркерного выявления белка HbA1c. Согласно литературным данным, еще не было разработано иммуносенсора без меток для анализа HbA1c с использованием СУЭ, модифицированного ЭВОГ. Электрохимические особенности иммуносенсора исследовали в ${\text{Fe}}({\text{CN}})_{6}^{{3 - /4 - }}$ редокс-паре посредством ЦВА, ДИВА и СЭИ. Количественное определение HbA1c осуществляли путем анализа изменений интенсивности пикового тока ДИВА редокс-пары, после того как на электроде протекли иммунореакции. Разработанный иммуносенсор может быть использован для практического анализа содержания HbA1c в образцах сыворотки крови, а также для сравнения данных с результатами, полученными посредством фермент-связанного иммуносорбентного анализа (ИФА).
МЕТОДИКА ЭКСПЕРИМЕНТА
Реагенты
Графитовый порошок был предоставлен Fluka и был использован для синтеза оксида графена (ОГ). Мышиные моноклональные антитела к гемоглобину A1c (anti-HbA1c), антитела к гемоглобину (anti-Hb), антитела к биотин-связанному гемоглобину A1c (B-Anti-HbA1c), человеческий гемоглобин A1c (HbA1c) и конъюгат стрептавидина с пероксидазой хрена (SA-HRP) были приобретены у компании MyBioSource (США). Бычий сывороточный альбумин (БСА, ≥98%), H2SO4 и 3,3',5,5'-тетраметилбензидин (ТМБ) были приобретены у компании Sigma (США). KCl, Na2HPO4 ∙ 12H2O и NaH2PO4 были приобретены у компании Merck (Германия). K4Fe(CN)6 ⋅ 3H2O и K3Fe(CN)6 ⋅ H2O были предоставлены Acros Organics (США). Фосфатный буферный раствор (ФБС) был приготовлен путем смешивания в соответствующих количествах исходных растворов NaH2PO4, Na2HPO4 и KCl. Антитело, антиген и раствор редокс-пары были приготовлены с использованием ФБС (рН 7.4).
Оборудование
Электрохимические исследования проводились с использованием электрохимической рабочей станции Autolab-PGSTAT 204 (Eco Chemie, Утрехт, Нидерланды), связанной с традиционным стендом с трехэлектродной ячейкой (Bioanalytical Systems, BAS, Inc., США). Измерения СЭИ проводились с помощью электрохимического анализатора Gamry Reference 3000 (Gamry Instruments, США). Вспомогательным электродом и электродом сравнения служили платиновая проволока (BAS MW-1032) и Ag/AgCl (3 М NaCl, BAS MF-2052) соответственно. СУЭ, предоставленный BAS (MF-2012, d = 3 мм, BAS, Inc., США), использовали в качестве рабочего электрода.
Программное обеспечение NOVA 1.11.2 (ECO Chemie) было использовано для анализа измерений ЦВА и ДИВА. Морфологию поверхностей модифицированного электрода и иммуносенсора изучали методом сканирующей электронной микроскопии с использованием микроскопа FEI Nova NanoSEM 650 (FEI, Нидерланды). Для измерения рН использовали Mettler Toledo FE20 pH-метр (Mettler Toledo, Китай). Стандартные измерения ИФА проводили с помощью автоматического фотометра для микропланшетов FLUOstar Omega (BMG Instruments, Германия) при длине волны 450 нм. Для приготовления всех растворов использовали ультрачистую воду, полученную из аппарата Millipore Synergy (Merck, Франция). Все измерения проводились в условиях окружающей среды.
Синтез оксида графена
Оксид графена был синтезирован согласно модифицированному методу Хаммерса [20, 21]. Сначала 2 г графитового порошка добавляли в 98%-ный раствор H2SO4 на ледяной бане. Затем 1 г NaNO3 добавляли к смеси и слегка перемешивали в течение 5 мин. После этого добавляли 8 г KMnO4, и смесь нагревали до 30°C (перемешивали в течение 30 мин). К смеси медленно добавляли 250 мл ультрачистой воды, а затем инкубировали ее при 98°C в течение 30 мин. Затем в реакционную смесь добавляли 500 мл ультрачистой воды и 40 мл 30% Н2О2, и ее цвет становился ярко-желтым. Это свидетельствует об окислении графита до оксида графита. Затем для удаления ионов металлов эту смесь последовательно подвергали фильтрации и промывали разбавленным раствором HCl. В конечном итоге полученный материал промывали ультрачистой водой до достижения нейтрального значения рН. После сушки был получен оксид графита. Дисперсию ОГ готовили путем диспергирования 1.0 мг образца в 1.0 мл ультрачистой воды под воздействием ультразвука.
Изготовление иммуносенсора
СУЭ полировали 0.05 мкм порошком алюминия. Для удаления остаточных продуктов СУЭ погружали в следующие растворы: 3 М HNO3, абсолютный этанол, ультрачистая вода. Очистку производили в ультразвуковой ванне в течение 2 мин. СУЭ обрабатывали электрохимическим методом посредством развертки потенциала в положительном направлении от –0.5 до 1.5 В (отн. Ag/AgCl) при скорости развертки 100 мВ с–1 в течение 20 циклов в 0.5 М H2SO4. В конечном итоге электрод промывали ультрачистой водой и давали ему высохнуть в условиях окружающей среды. Затем 10 мкл дисперсии, содержащей 1 мг ОГ в 1 мл ультрачистой воды, наносили пипеткой на чистую поверхность СУЭ, а потом высушивали в условиях окружающей среды. После этого ОГ электрохимически восстанавливали в 0.1 М KCl посредством циклической развертки потенциала от +0.6 до –1.5 В (отн. Ag/AgCl, 3 М KCl) со скоростью развертки 0.05 В с−1 (20 циклов). Затем на поверхность СУ/ЭВОГ-электрода капали 15 мкл раствора антител к гемоглобину A1c и инкубировали в течение различных периодов времени при 37°C. Такой электрод обозначим СУ/ЭВОГ/HbA1cAb-электродом. Предлагаемый электрод инкубировали с 5 мкл 0.2% БСА (в рН 7.4 ФБС) в течение 40 мин при 37°C для предотвращения возникновения неспецифических сайтов связывания. Такой электрод обозначим СУ/ЭВОГ/HbA1cAb/БСА-электродом. Затем поверхность электрода промывали ФБС и сушили при комнатной температуре. В конце концов, различные концентрации растворов белка HbA1c были добавлены в иммуносенсор и инкубированы в течение различных периодов времени при 37°C. Такой электрод обозначим СУ/ЭВОГ/ HbA1cAb/БСА/HbA1c-электродом.
Электрохимические измерения
Электрохимические характеристики СУ/ЭВОГ, СУ/ЭВОГ/HbA1cAb, СУ/ЭВОГ/HbA1cAb/БСА и СУ/ЭВОГ/HbA1cAb/БСА/HbA1c изучали СЭИ- и ЦВА-методами в 0.1 М KCl (10 мМ, pH 7.4 ФБС) растворе, содержащем 5 мМ K3[Fe(CN)6)]/K4[Fe(CN)6)]. Измерения СЭИ проводились при потенциале разомкнутой цепи в диапазоне частот от 100 кГц до 0.01 Гц с амплитудой 5 мВ. Циклические вольтамперограммы снимали разверткой в анодном направлении от –0.3 до +0.8 В (отн. Ag/AgCl) со скоростью развертки 0.05 В с−1. Дифференциальные импульсные вольтамперограммы регистрировали в 0.1 М KCl (10 мМ, pH 7.4 ФБС), содержащем 5 мМ K3[Fe(CN)6)]/K4[Fe(CN)6)], в диапазоне потенциалов от –0.1 до 0.6 В со скоростью развертки 0.05 В с−1 (амплитуда модуляции 0.05 В, время модуляции 0.02 с, время интервала 0.2 с). Изменения (Δi = i0 – i) или относительные изменения (Δi = (i0 – i)/i0 × 100%) значения тока пика редокс-пары были использованы для исследования формирования комплекса антитело-антиген (i0 – ток пика ДИВА после блокирования БСА и i – ток пика ДИВА после иммунной реакции на HbA1c) [22].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Морфология поверхности иммуносенсора
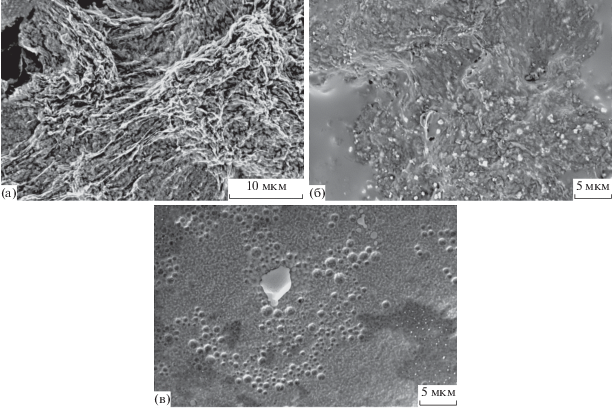
Формирование ОГ фиксировалось посредством СЭМ- и ПЭМ-изображений. СЭМ-изображения, выполненные на сканирующем полевом эмиссионном микроскопе, и ПЭМ-микрофотографии ОГ на рис. 1 явно подтверждают его структуру, напоминающую “скомканную” бумагу. Изображения поверхности модифицированных электродов, которые были получены посредством СЭМ, представлены на рис. 2. Морфология ЭВОГ представляла собой случайно склеенные, тонкие, смятые листы, тесно связанные друг с другом и образующие твердое тело геометрически неправильной фомы (рис. 2а) [23]. После иммобилизации антитела к гемоглобину A1c (HbA1cAb) на ЭВОГ изображение поверхности электрода изменилось, и зазоры между смятыми листами исчезли (рис. 2б). В случае ЭВОГ/HbA1cAb/БСА модифицированная поверхность электрода была покрыта слоем, включающим БСА.
Электрохимическое определение характеристик иммуносенсора
ЦВА-кривые регистрировали на каждой стадии модификации для характеристики процесса получения иммуносенсора. Как видно на рис. 3a, пара обратимых окислительно-восстановительных пиков ферроцианид/феррицианид-ионов наблюдалась на немодифицированном СУЭ (кривая а) в 0.1 М KCl растворе, содержащем 5 мМ ${\text{Fe}}({\text{CN}})_{6}^{{3 - /4 - }}$. После электрохимического восстановления ОГ пиковые токи возрастали, демонстрируя превосходную проводимость ЭВОГ-пленки (кривая б). Напротив, когда антитело было нанесено на поверхность СУ/ЭВОГ-электрода, то наблюдалось заметное уменьшение пиковых токов, что указывало на то, что поверхность электрода была покрыта антителом (кривая в). Впоследствии пиковые токи еще больше уменьшились после блокирования бычьим сывороточным альбумином (кривая г) и нанесения антигена HbA1c на СУ/ЭВОГ/HbA1cAb/БСА-электрод (кривая д) из-за образования белкового слоя, блокирующего перенос электронов. Эти результаты показывают, что СУ/ЭВОГ/HbA1cAb/БСА-электрод может применяться для безмаркерного выявления HbA1c. Процесс изготовления иммуносенсора был также верифицирован посредством регистрации ДИВА-кривых: аналогичная зависимость наблюдалась, как показано на рис. 3в.
Рис. 3.
(a) ЦВА- и (б) ДИВА-кривые: (a) немодифицированный СУЭ, (б) СУЭ/ЭВОГ, (в) СУЭ/ЭВОГ/HbA1cAb, (г) СУЭ/ЭВОГ/HbA1cAb/БСА и (д) СУЭ/ЭВОГ/HbA1cAb/БСА/HbA1c в 0.1 М KCl (10 мМ, pH 7.4 ФБС) растворе, содержащем 5 мМ ${\text{Fe}}({\text{CN}})_{6}^{{3 - /4 - }}$.

Кинетику работы иммуносенсора определяли посредством исследования влияния скорости развертки потенциала на процессы, происходящие на СУ/ЭВОГ/HbA1cAb/БСА-электроде в 0.1 М KCl (10 мМ, рН 7.4 ФБС) растворе, содержащем 5 мМ ${\text{Fe}}({\text{CN}})_{6}^{{3 - /4 - }}$. Как показано на рис. 4a, как в анодной, так и в катодной области значения тока в пиках увеличиваются с увеличением скорости развертки в диапазоне 20–100 мВ с−1. Кроме того, ipa и ipc демонстрировали линейную зависимость от квадратного корня скорости развертки, что позволяет предположить, что электродная реакция в основном является процессом, контролируемым диффузией (рис. 4б).
Рис. 4.
(a) ЦВА-кривые СУЭ/ЭВОГ/HbA1cAb/БСА-иммуносенсора в зависимости от скорости развертки (20–100 мВ с−1). (б) График зависимости пикового тока от квадратного корня скорости развертки. Измерения были выполнены в 0.1 М KCl (10 мМ, pH 7.4 ФБС) растворе, содержащем 5 мМ ${\text{Fe}}({\text{CN}})_{6}^{{3 - /4 - }}$.

СЭИ является одним из наиболее важных методов идентификации процесса изготовления иммуносенсора. На рис. 5a показан годограф импеданса на каждой стадии модификации в диапазоне частот от 105 до 10–2 Гц. Как известно, типичный годограф импеданса содержит полукруглый участок при высоких частотах и линейный участок при низких частотах. Полукруглые и линейные фрагменты относятся к ограниченному процессу переноса электронов и диффузионному процессу соответственно. Диаметр полукруга равен значению сопротивления переноса заряда (Rct) [24]. Экспериментальные годографы Найквиста были построены с использованием моделей эквивалентных схем, приведенных на рис. 5б. Эквивалентная схема на рис. 5б кривая а использовалась для модифицированного ЭВОГ электрода, а эквивалентная схема на рис. 5б кривая б использовалась для других модифицированных электродов. Эти модели эквивалентных схем включают в себя сопротивление раствора (Rs), сопротивление белкового слоя (Rl), элемент постоянной фазы (CPEl) для белкового слоя, сопротивление переноса заряда (Rct), элемент постоянной фазы для двойного слоя (CPEdl) и импеданс Варбурга (W). Значения элементов эквивалентной схемы приведены в табл. 1. В наших экспериментальных условиях работы существенного изменения значений Rs в процессе модификации не наблюдалось. В то же время изменения значения Rct были значительно выше, чем для других элементов импеданса. Поэтому изменения значения Rct расценивалось как подходящий сигнал для выявления межфазных особенностей разработанного иммуносенсора на всех этапах модификации поверхности [25]. Как видно из рис. 5а кривая а, годограф Найквиста демонстрирует почти прямую линию. А именно, ЭВОГ модифицированный электрод имеет наименьшее значение Rct благодаря своей высокой проводимости [26]. Годограф импеданса сильно изменился после иммобилизации белкового слоя. Поэтому следующие спектры импеданса в координатах Найквиста были оценены с помощью модели эквивалентной схемы, представленной на рис. 5б кривая б. Значительное увеличение значения Rct на годографе импеданса (рис. 5а, 5б) наблюдалось после обработки ЭВОГ-электрода слоем белка HbA1cAb, это было объяснено блокирующим действием HbA1cAb-антитела на перенос электронов редокс-пары. Другими словами, проводимость слоя ЭВОГ была снижена за счет образования ЭВОГ/HbA1cAb, что значительно увеличивает реальный импеданс и снижает проводимость электрохимической системы [27]. Аналогично значение Rct еще больше увеличилось после обработки белкового слоя HbA1cAb блокирующим белком БСА. Это можно объяснить образованием на электроде слоя белок-антитело, который действует как блокирующий слой передачи электронов и массопереноса, препятствуя тем самым доступу редокс-пары к поверхности электрода [25]. На последнем этапе инкубации иммуносенсора с HbA1c-антигеном значение Rct достигало наибольшей величины. Результаты свидетельствуют также о том, что перенос электронов к поверхности раздела электрод/раствор замедляется главным образом из-за позиционного барьера биомолекул [28]. Кроме того, значения Rl еще больше увеличивались после каждого этапа иммобилизации. Когда все экспериментальные результаты были приняты во внимание, то изготовление иммуносенсора было успешно реализовано.
Рис. 5.
(a) Годограф импеданса (a) СУ/ЭВОГ, (б) СУ/ЭВОГ/HbA1cAb, (в) СУ/ЭВОГ/HbA1cAb/БСА и (г) СУ/ЭВОГ/HbA1cAb/БСА/HbA1c в 0.1 М KCl (10 мМ pH 7.4 ФБС) растворе, содержащем 5 мМ ${\text{Fe}}({\text{CN}})_{6}^{{3 - /4 - }}$. (б) Модели эквивалентных схем, используемые для аппроксимации импедансного спектра модифицированных электродов.

Таблица 1.
Результаты, полученные посредством метода СЭИ для различных модифицированных электродов в 0.1 М KCl (10 мМ, pH 7.4 ФБС) растворе, содержащем 5 мМ ${\text{Fe}}({\text{CN}})_{6}^{{3 - /4 - }}$
| Электрод | Rs, Ом | CPEl, (мкФ)n1 | n1 | Rl, Ом | CPEdl, (мкФ)n2 | n2 | Rct, Ом | W, мкОм |
|---|---|---|---|---|---|---|---|---|
| СУ/ЭВОГ | 50.2 | – | – | – | 1215 | 0.45 | 249.2 | 762.5 |
| СУ/ЭВОГ/HbA1cAb | 49.2 | 1454 | 0.44 | 42.9 | 402.6 | 0.91 | 1966 | 2266 |
| СУ/ЭВОГ/HbA1cAb/БСА | 44.7 | 599 | 0.56 | 50.7 | 503.0 | 0.88 | 2311 | 1381 |
| СУ/ЭВОГ/HbA1cAb/БСА/HbA1c | 54.1 | 831 | 0.50 | 81.4 | 368.1 | 0.88 | 5625 | 1720 |
Оптимизация иммуносенсора
Продолжительность инкубации покрытия (анти-HbA1cAb) электрода является существенным фактором при изготовлении иммуносенсора. На электрод СУЭ/ЭВОГ наносили анти-HbA1cAb и инкубировали в течение различных периодов времени, также были рассчитаны относительные изменения (Δi = (i0 – i)/i0 × 100%). Как показано на рис. 6а, значение Δi возрастало с увеличением времени инкубации и достигало максимального значения для инкубации продолжительностью 18 ч. Таким образом, для последующих экспериментов инкубацию проводили в течение 18 ч.
Рис. 6.
(a) Зависимость относительного изменения ДИВА токового отклика от продолжительности инкубации покрытия (анти-HbA1cAb) электрода. (б) Зависимость изменения ДИВА токового отклика в 0.1 М KCl (10 мМ, pH 7.4 ФБС) растворе, содержащем 5 мМ ${\text{Fe}}({\text{CN}})_{6}^{{3 - /4 - }}$, от времени инкубации реакции антитела к HbA1c и антигена HbA1c.

Время инкубации реакции антитело–антиген является еще одним важным фактором для работы иммуносенсора. Электрод СУ/ЭВОГ/HbA1cAb/БСА инкубировали при постоянной концентрации HbA1c в течение различных периодов времени. Как показано на рис. 6б, значения Δi возрастали до инкубационного периода в 90 мин, а затем уменьшались. Поэтому в качестве оптимального времени инкубации было выбрано 90 мин.
Определение HbA1c
При оптимальных условиях работы динамический диапазон изготовленного безметкового иммуносенсора был изучен с использованием контрольных растворов HbA1c в диапазоне концентраций от 0 до 25% HbA1c в пересчете на общий гемоглобин. Как видно на рис. 7а, пиковые токи уменьшались с увеличением концентрации HbA1c, это было вызвано увеличением барьера для переноса электронов, создаваемого иммунокомплексом. На рис. 7б показано, что полученное значение Δi было линейным в диапазоне от 1 до 25% (процентное отношение HbA1c к общему количеству гемоглобина).
Рис. 7.
(a) ДИВА-кривые иммуносенсора после инкубации с HbA1c в 0.1 моль л−1 KCl (10 мМ, pH 7.4 ФБС) растворе, содержащем 5 мМ ${\text{Fe}}({\text{CN}})_{6}^{{3 - /4 - }}$, в диапазоне потенциалов от –0.1 до 0.6 В со скоростью развертки 0.05 В с−1. (б) Калибровочная кривая иммуносенсора для определения HbA1c.

Воспроизводимость и селективность иммуносенсора
Точность измерений для одного модифицированного электрода оценивалась посредством анализа трех различных концентраций 3 раза за один цикл в течение 10 ч. Аналогичным образом были определены чувствительность и воспроизводимость при измерении трех различных концентраций тремя различными электродами. Как видно из табл. 2, относительное стандартное отклонение в процентах составило менее 5%. Таким образом, точность и воспроизводимость предлагаемого иммуносенсора приемлемы.
Таблица 2.
Воспроизводимость результатов измерений для одного и трех электродов (иммуносенсоров)
| HbA1c, % | Относительное стандартное отклонение, % | |
|---|---|---|
| для одного электрода (n = 3) | для трех электродов (n = 3) | |
| 1 | 2.07 | 2.71 |
| 5 | 2.80 | 3.24 |
| 10 | 2.14 | 4.85 |
Также было изучено влияние различных мешающих агентов, присутствующих в крови, на развитый отклик иммуносенсора. На рис. 8 показан относительный отклик HbA1c-иммуносенсора в пробах, содержащих следующие соединения: гемоглобин (Hb), аскорбиновая кислота (AA), дофамин (DA), глюкоза (GLC), галактоза (GAL), а также для контрольной пробы. Из рис. 8 видно, что молекулы аскорбиновой кислоты, глюкозы и дофамина не оказывали влияния на HbA1c-отклик, что свидетельствует о достаточно хорошей селективности иммуносенсора. Однако присутствие гемоглобина приводило к небольшому увеличению дифференциально-импульсного отклика HbA1c за счет его адсорбции на поверхности электрода.
Рис. 8.
Влияние мешающих агентов в образцах на отклик HbA1c-иммуносенсора (a) 10 нг мл−1 HbA1c, (б) 10 нг мл−1 HbA1c + 100 нг мл−1 Hb, (в) 10 нг мл−1 HbA1c + 100 нг мл−1 AA, (г) 10 нг мл−1 HbA1c + + 100 нг мл−1 DA, (д) 10 нг мл−1 HbA1c + 100 нг мл−1 GLC, (е) 10 нг мл−1 HbA1c + 100 нг мл−1 GAL, (ж) контрольная проба.

Использование иммуносенсора для анализа реальных образцов
Возможность применения предложенного иммуносенсора для выявления HbA1c была исследована в реальных образцах сыворотки крови, полученных от четырех добровольцев. Результаты были сопоставлены с результатами, полученными стандартным методом ИФА. В табл. 3 показано, что показатели сходимости для этих образцов находились в диапазоне от 98.10 до 101.13%, что указывало на то, что оба метода хорошо согласуются и разработанный безметковый иммуносенсор может быть использован для клинического определения HbA1c в сыворотке крови.
ЗАКЛЮЧЕНИЕ
В этой работе был предложен и исследован новый электрохимический безметковый иммуносенсор для определения HbA1c на основе ЭВОГ, изготовление которого не требует использования трудоемких процедур. Разработанный иммуносенсор, характеризующийся простотой использования, продемонстрировал удовлетворительные показатели для обнаружения HbA1c с широким диапазоном действия и хорошей воспроизводимостью. Предложенная простая и экономически эффективная стратегия обнаружения антигенов может найти применение в клинических и биомедицинских приложениях.
Список литературы
Pundir, C.S. and Chawla, S., Determination of glycated hemoglobin with special emphasis on biosensing methods, Anal Biochem, 2014, vol. 444, p. 47.
Yazdanpanah, S., Abdolrahim, M., Rabie, M., and Tayebi, L., Glycated hemoglobin-detection methods based on electrochemical biosensors, Trends Analyt. Chem., 2015, vol. 72 (2015) 53–67, p. 53.
Tanaka, T., Izawa, K., Okochi, M., Lim, T.-K., ShugoWatanabe, Harada, M., and Matsunaga, T., On-chip type cation-exchange chromatography with ferrocene-labeled anti-hemoglobin antibody and electrochemical detector for determination of hemoglobin A1c level, Anal. Chim. Acta, 2009, vol. 638, p. 186.
Tanaka, T., Tsukube, S., Izawa, K., Okochi, M., Lim, T.-K., ShugoWatanabe, Harada, M., and Matsunaga, T., Electrochemical detection of HbA1c, a maker for diabetes, using a flow immunoassay system, Biosensors Bioelectron, 2007, vol. 22, p. 2051.
Siren, H., Laitinen, P., Turpeinen, U., and Karppinen, P., Direct monitoring of glycohemoglobin A in the blood samples of 1c diabetic patients by capillary electrophoresis Comparison with an immunoassay method, J. Chromatogr., 2002, vol. 979, p. 201.
Little, R.R. and Roberts, W.L., A Review of Variant Hemoglobins Interfering with Hemoglobin A1c Measurement, J Diabetes Sci Technol, 2009, vol. 3 (3), p. 446.
Danilowicz, C. and Manrique, J.M., A new self-assembled modified electrode for competitive immunoassay, Electrochem. Commun., 1999, vol. 1, p. 22.
Li, R., Wu, D., Li, H., Xu, C., Wang, H., Zhao, Y., Cai, Y., Wei, Q., and Du, B., Label-free amperometric immunosensor for the detection of human serum chorionic gonadotropin based on nanoporous gold and graphene, Anal. Biochem., 2011, vol. 414, p. 196.
Yang, L., Zhao, H., Fan, S., Deng, S., Lv, Q., Lin, J., and Li, C.-P., Label-free electrochemical immunosensor based on gold–silicon carbide nanocomposites for sensitive detection of human chorionic gonadotrophin, Biosensors Bioelectron, 2014, vol. 57, p. 199.
Alonso-Fernándeza, M., Mancera-Romero, J., Mediavilla-Bravo, J.J., Comas-Samper, J.M., López-Simarro, F., Pérez-Unanua, M.P., and Iturralde-Iriso, J., Glycemic control and use of A1c in primary care patients with type 2 diabetes mellitus, Prim Care Diabetes, 2015, vol. 9, p. 385.
Meyer, J.C., Geim, A.K., Katsnelson, M.I., Novoselov, K.S., Booth, T.J., and Roth, S., The structure of suspended graphene sheets, Nature, 2007, vol. 46, p. 60.
Yang, J., Deng, S., Lei, J., Ju, H., and Gunasekaran, S., Electrochemical synthesis of reduced graphene sheet–AuPd alloy nanoparticle composites for enzymatic biosensing, Biosensors Bioelectron, 2011, vol. 29 (1), p. 159.
Hua, L., Wu, X., and Wang, R., Glucose sensor based on an electrochemical reduced graphene oxide-poly(l-lysine) composite film modified GC electrode, Analyst, 2012, vol. 137 (24), p. 5716.
Bhardwaj, S.K., Mahapatro, A.K., and Basu, T., Benzymatic triglyceride biosensor based on electrochemically reduced graphene oxide, Int. J. Chemtech. Res., 2015, vol. 7 (2), p. 858.
Zhang, Y., Zhang, J., Wu, H., Guo, S., and Zhang, J., Glass carbon electrode modified with horseradish peroxidase immobilized on partially reduced graphene oxide for detecting phenolic compounds, J. Electroanal. Chem., 2012, vol. 681, p. 49.
Tabrizi, M.A., Azar, S.J., and Varkani, J.N., Eco-synthesis of graphene and its use in dihydronicotinamide adenine dinucleotide sensing, Anal. Biochem., 2014, vol. 460, p. 29.
Özcan, B. and Sezgintürk, M.K., Graphene oxide based electrochemical label free immunosensor for rapid and highly sensitive determination of tumor marker HSP70, Talanta, 2016, vol. 160, p. 367.
Guerrero, S., Martinez-Garcia, G., Serafin, V., Agui, L., Yanez-Sedeno, P., and Pingarron, J.M., Electrochemical immunosensor for sensitive determination of the anorexigen peptide YY at grafted reduced graphene oxide electrode platforms, Analyst, 2015, vol. 140 (22), p. 7527.
Zhou, Y., Dong, H., Liu, L., Hao, Y., Chang, Z., and Xu, M., Fabrication of electrochemical interface based on boronic acid-modified pyrroloquinoline quinine/reduced graphene oxide composites for voltammetric determination of glycated hemoglobin, Biosensors Bioelectron, 2015, vol. 64, p. 442.
Hummers, W.S. and Offeman, R.E., Preparation of Graphitic Oxide, J. Amer. Chem. Soc., 1958, vol. 80, p. 1339.
Pham, T.A., Kim, J.S., Kim, J.S., and Jeong, Y.T., One-step reduction of graphene oxide with L-glutathione, Coll. Surf. Physicochem. Eng. Aspects, 2011, vol. 384, p. 543.
Qiao, L., Wang, X., and Sun, X., A novel label-free amperometric immunosensor based on graphene sheets-methylene blue nanocomposite/gold nanoparticles, Intern. J. Electrochem. Sci., 2014, vol. 9 (3), p. 1399.
Stankovich, S., Dikin, D.A., Piner, R.D., Kohlhaas, K.A., Kleinhammes, A., Jia, Y., Wu, Y., Nguyen, S.T., and Ruoff, R.S., Synthesis of graphene-based nanosheets via chemical reduction of exfoliated graphite oxide, Carbon, 2007, vol. 45, p. 1558.
Wang, J., Study of Electrode Reactions and Interfacial Properties. In: Analytical Electrochemistry. 3rd edn., 2006, John Wiley & Sons, Inc., p 29. https://doi.org/10.1002/0471790303.ch2
Mishra, S.K., Srivastava, A.K., Kumar, D., Biradar, A.M., and Rajesh, Microstructural and electrochemical impedance characterization of bio-functionalized ultrafine ZnS nanocrystals–reduced graphene oxide hybrid for immunosensor applications, Nanoscale, 2013, vol. 5 (21), p. 10494.
Hu, X., Dou, W., and Zhao, G., Electrochemical immunosensor for Enterobacter sakazakii detection based on electrochemically reduced graphene oxide–gold nanoparticle/ionic liquid modified electrode, J. Electroanal. Chem., 2015, vol. 756, p. 43.
Ramanavicius, A., Finkelsteinas, A., Cesiulis, H., and Ramanaviciene, A., Electrochemical impedance spectroscopy of polypyrrole based electrochemical immunosensor, Bioelectrochem., 2010, vol. 79 (1), p. 11.
Wu, C.-C., Lin, C.-H., and Wang, W.-S., Development of an enrofloxacin immunosensor based on label-free electrochemical impedance spectroscopy, Talanta, 2009, vol. 79 (1), p. 62.
Дополнительные материалы отсутствуют.