Электрохимия, 2020, T. 56, № 9, стр. 798-807
Электроды-компакты из синтетического алмаза c платиной и ее влияние на электрохимическую активность электродов
Ю. В. Плесков a, *, М. Д. Кротова a, Р. А. Хмельницкий b, Е. А. Екимов b, c
a Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Ленинский просп., 31, Россия
b Физический институт им. П.Н. Лебедева РАН
119333 Москва, Ленинский просп., 53, Россия
c Институт физики высоких давлений им. Л.Ф. Верещагина РАН
142190 Москва, Троицк, Россия
* E-mail: pleskov33@mail.ru
Поступила в редакцию 20.11.2019
После доработки 20.11.2019
Принята к публикации 06.03.2020
Аннотация
Проводящие компактные композиционные электродные материалы получены в процессе превращения графита в алмаз при высоких давлениях и температурах в двух- и трехкомпонентных ростовых системах Pt–C и Pt–C–B; исследованы их физические и электрохимические свойства. Алмазно-платиновый электрод-компакт, полученный в двойной системе Pt–C, ведет себя в реакции анодного окисления ионов хлора качественно, как чисто платиновый, с поправкой на фактическое количество платины на его поверхности. Результаты вольтамперометрических измерений здесь хорошо согласуются с результатами измерения электрохимического импеданса в модах f-sweep и E‑sweep. Легирование алмаза бором в случае синтеза компактов в сиcтеме Pt–C–B дает электроды, электроактивные по отношению к реакции окисления хлорид-иона; их активность возрастает с ростом содержания платины на поверхности электрода. Показано, что введение катализатора (платины) все же более эффективно (по отношению к реакции анодного выделения хлора) непосредственно на поверхность алмазного компакта, чем в его объем в процессе синтеза.
ВВЕДЕНИЕ
Компакты из легированного бором алмаза, полученные термобарической обработкой смесей графита и карбида бора в области термодинамической стабильности алмаза, – новый электродный материал, исследование которого было начато в самое последнее время [1–3]. Как и всякий электродный материал, он имеет свои достоинства и недостатки. К числу первых следует отнести, как и в случае других алмазных, алмазсодержащих и алмазоподобных материалов (например, традиционных легированных бором тонкопленочных алмазных электродов, полученных осаждением в ходе химической газотранспортной реакции, CVD) [4–7], широкую область идеальной поляризуемости, низкий фоновый ток в растворах индифферентных электролитов, высокую коррозионную стойкость и хорошую воспроизводимость результатов.
Общим недостатком алмазных электродов, в том числе и компактов, является их сравнительно невысокая электрокаталитическая активность, проявляющаяся в высоком перенапряжении целевых реакций. Для повышения электрокаталитической активности алмазных электродов применяются разные приемы, такие как химическое модифицирование их поверхности органическими веществами (см., например, [8]), осаждение на нее микрокристаллов Pt [9] и др. Так, имплантация Cu в алмазный CVD-электрод эффективно способствует окислению глюкозы, что может быть использовано в электроанализе [10]. По нашим (предварительным) данным, примесь железа в алмазном компакте (вероятно, в форме точечного дефекта кристаллической решетки) образует на его поверхности окислительно-восстановительную пару, которая служит медиатором реакции анодного выделения Cl2 из раствора хлоридов [11].
В настоящей работе мы исследовали возможность повысить электрокаталитическую активность алмазных электродов-компактов путем добавления каталитическиактивного металла – платины.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез образцов и исследование их физических характеристик
Синтез алмазов в системах C(графит)–Pt и C(графит)–B–Pt осуществляли в камере высокого давления типа “тороид-15” при давлении 8 ГПа [12, 13]. Схема реакционной ячейки и вид характерного получаемого образца показаны на рис. 1. Температуру поднимали со скоростью 50–100 град/с пропусканием тока через нагреватель и реакционный объем. Начало процесса синтеза фиксировалось по падению тока, связанному с превращением графита в алмаз. Графит растворяется в ростовой среде, формируя пересыщенный углеродный раствор, из которого кристаллизуется алмаз. Ростовая среда в виде тонкой пленки продвигается через всю центральную часть графитового стержня (2), формируя за собой алмазный композиционный материал. Температуру процесса оценивали по предварительно построенной зависимости мощности в ячейке высокого давления от мощности электрического тока, подаваемого на нагрев. Температура начала синтеза алмаза в системе C‒Pt составляла 1800–1900°С, а в системе C–B–Pt – не менее 2000°С. Продолжительность синтеза – около 5–10 с. В случае синтеза образцов в системе C–Pt и C–B–Pt (с концентрацией бора в сплаве с платиной 1–2 мас. %) были получены образцы почти цилиндрической формы диаметром 3.5–4 мм и высотой 3–4 мм (рис. 1б). Некоторые образцы отмывались в кислотах от неалмазных фаз. Графит удаляли кипячением в HClO4 и смеси H2SO4 + HNO3 (3 : 1), остатки ростовой среды – кипячением в царской водке.
Ростовая система Pt–C
На рис. 2 показана микроструктура рабочей поверхности компакта-электрода после шлифовки его торцов: светлые объекты – платина, темные – алмазная матрица. Вид микроструктуры образца, синтезированного в системе Pt–C (рис. 2), свидетельствует о достаточно равномерном распределении включений платины на поверхности образца после шлифовки. По данным рентгенофазового анализа (рис. 3), образец содержит только две фазы: платину и алмаз. Содержание платины, по данным микрорентгеноспектрального анализа (EDX), по поверхности шлифа – 15–20 мас. %, оценка концентрации платины в образце, которую определили, как отношение заложенной в эксперименте платины к массе получившегося образца, дает значение 15 ± 5 мас. %.
Рис. 2.
Микроструктура синтезированного в системе С(графит)–Pt при 8 ГПа поликристаллического композиционного алмаза с включениями Pt (15–20 мас. %): а, б, в – изображения, полученные во вторичных электронах с разным увеличением, г – изображение в рентгеновском излучении Pt с поверхности на панели в.

Ростовая система Pt–C–B
Фазовый состав образцов, полученных в системе Pt–C–B, определяли (после дробления образцов) в конфигурации “на просвет” в ${\text{Cu}}{{K}_{{{{\alpha }_{1}}}}}$-излучении (рис. 4). Состав образца: алмаз + PtB + + B4C + неизвестная фаза (*). Присутствие платины в свободном состоянии не обнаружено.
Определение параметра решетки алмаза с использованием внутреннего стандарта – эталона кремния NIST640c – дало значение 0.3571 нм. Его отличие от параметра решетки нелегированного алмаза (0.3567 нм) свидетельствует о достаточно сильном легировании алмаза бором. Оценка концентрации бора в алмазной решетке по параметру решетки [1] дает величину, лежащую в интервале 0.5–1 ат. %.
Образцы исследовались также после химической обработки в царской водке и кипячения в HClO4. По данным EDX-микроанализа, характерный химический состав поверхности травленых образцов: Pt 0.3–0.6, C 95.3–95.4, O 4.0–4.4 ат. %. Изучение поверхности образцов во вторичных электронах и характеристическом рентгеновском излучении показывает однородность структуры распределения включений платины, а также присутствие каверн – результат химического удаления крупных поверхностных включений, содержащих платину (рис. 5). Размер включений, содержащих платину под исследуемой поверхностью (белые пятна на сером фоне), меньше, чем размеры каверн. Каверны имеют характерный размер около 1 мкм, включения – 0.5 мкм.
Электрохимические измерения
Измерения проводили в растворе индифферентного электролита (1 М KCl). Все значения потенциала в статье приведены по отношению к хлоридсеребряному (1 М КCl) электроду сравнения. Омический контакт к тыльной поверхности рабочего электрода (цилиндрического образца-компакта) выполнялся с помощью серебряного клея. Компакты закрепляли на стеклянных держателях, боковую поверхность и токоподвод изолировали слоем чистого парафина. Значения плотности тока и дифференциальной емкости в статье приводятся в расчете на 1 см2 геометрической рабочей поверхности электрода (которая составляла ~0.1 см2).
Вольтамперограммы при линейной развертке потенциала снимали с помощью электрохимического комплекса SOLARTRON (модель 1280B, Великобритания). Скорость развертки потенциала составляла 20 мВ/с.
Спектры электрохимического импеданса в интервале частот переменного тока f от 1 Гц до 20 кГц измеряли также с помощью прибора SOLARTRON 1280B. Значения элементов эквивалентной схемы получали путем сравнения экспериментально измеренных годографов импеданса с теоретически рассчитанными годографами для выбранной эквивалентной схемы и минимизации расхождения между ними. Такой эквивалентной схемой являлась схема Zarc, т.е. эквивалентная схема Эршлера–Рэндлса, в которой дифференциальная емкость заменена на элемент постоянной фазы (СРЕ).
Электрокаталитическую активность алмазных электродов обычно характеризуют с помощью модельной реакции в окислительно-восстановительной системе [Fe(CN)6]3–/[Fe(CN)6]4– (см., например, [14]). В настоящей работе для качественной оценки активности электродов мы использовали, в основном, значение потенциала начала анодного выделения хлора из раствора KCl (который в этой области потенциалов, естественно, уже не является индифферентным электролитом) и ток этой реакции.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Добавление только платины
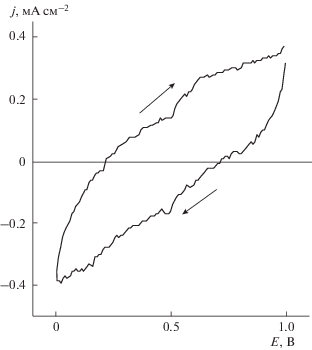
На рис. 6 приведены анодные вольтамперограммы электрода-компакта с примесью платины (~20%), снятые при линейной развертке электродного потенциала в 1 М растворах KCl и K2SO4. Они имеют привычный для Pt-электродов вид: потенциал выделения хлора при окислении ионов хлорида существенно ниже потенциала выделения кислорода при окислении воды. Вольтамперограмма этого же электрода-компакта и, для сравнения, такая же кривая для электрода из металлической Pt (проволочка диаметром 0.5 мм) в 1 М растворе KCl показаны на рис. 7. В области идеальной поляризуемости (0–1.1 В) фоновый ток компакта с примесью платины относительно невелик (см. рис. 9). В области же анодного выделения хлора на кривой для платинового анода (1) виден максимум, связанный с известным явлением пассивации платинового анода в хлоридном растворе [15, 16], что при снятии кривой в потенциодинамическом режиме естественным образом приводит к падению тока с последующим его ростом. Такую же форму – с максимумом тока – имеет и вольтамперограмма алмазного компакта с добавкой только платины (2). Прежде всего следует отметить, что не содержащий бора алмаз – диэлектрик, поэтому само по себе протекание постоянного тока означает, что платина в этом материале присутствует в достаточном количестве для того, чтобы превысить порог перколяции и создать в объеме алмаза непрерывную проводящую структуру, по которой и идет ток. Выходы платины на поверхность диэлектрика образуют активные участки, визуализированные на микрофотографии (см. выше, рис. 2 и 4), на которых и протекает электрохимическая реакция окисления ионов Cl– с образованием Cl2. По данным микрорентгеноспектрального анализа, содержание Pt на поверхности компакта равняется 15–20% – приблизительно такая часть поверхности электрода является проводящей. Отношение плотностей тока в максимумах для двух рассмотренных выше электродов (Pt и алмазный компакт с примесью Pt) составляет ~10, т.е. по порядку величины не слишком противоречит вышеприведенному значению. Таким образом, можно заключить, что ток электрода-компакта определяется окислением хлорида на проводящих участках поверхности – выходах Pt. Повторим, что здесь роль платины, помимо образования таких активных участков, заключается и в обеспечении протекания тока в объеме электрода.
Рис. 6.
Поляризационные кривые с линейной разверткой потенциала компакта с добавкой только Pt в 1 М растворах KCl и К2SO4.

Рис. 7.
Поляризационные кривые с линейной разверткой потенциала Pt-проволочки (1) и компакта с добавкой только Pt (2) в 1 М растворе KCl; (3) – фоновый ток.

Рис. 8.
Годографы импеданса электрода-компакта с примесью платины, записанные при различных потенциалах (указанных на рисунке) в 1 М растворе KCl.
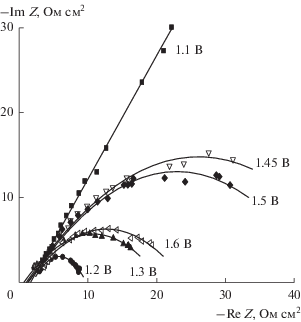
На рис. 8 приведены годографы импеданса этого электрода-компакта с примесью платины, записанные при различных постоянных потенциалах при развертке частоты переменного сигнала f (т.е., в режиме f-sweep). При потенциале 1.1 В (на краю области идеальной поляризуемости), практически в отсутствие тока, годограф представляет собой наклонную прямую, что характерно для присутствия элемента СРЕ в эквивалентной схеме электрода (который предположительно связывают с энергетической неоднородностью поверхности электрода [17]). В области протекания электродной реакции (выделение хлора) мы имеем полуокружности, диаметр которых дает сопротивление переноса заряда RF. Из-за наличия СРЕ в эквивалентной схеме эти полуокружности несколько приплюснуты. Отметим, что величина RF изменяется не монотонно с потенциалом Е: при 1.2–1.3 В она меньше, чем при более положительных потенциалах. Сравнение с вольтамперограммой этого электрода (рис. 7) показывает, что как раз в этой области наблюдается максимум тока. Таким образом, данные двух независимых методов – электрохимического импеданса в моде f-sweep и вольтамперометрии – хорошо согласуются между собой.
Рис. 10.
Поляризационный годограф электрода-компакта с примесью платины в 1 М растворе KCl. Частота измерительного сигнала 140 Гц.

Рисунок 10 представляет собой так называемый поляризационный годограф, снятый при фиксированной частоте переменного тока f = = 140 Гц с разверткой потенциала Е (т.е., в режиме Е-sweep). Согласно принятому анализу [2, 3], в простейшем случае (эквивалентная схема Эршлера–Рэндлса) годограф должен состоять из вертикальной прямой в области идеальной поляризуемости и “вертикальной” же полуокружности, обращенной к оси ординат (оси ImZ) в области протекания электродной реакции. Наличие СРЕ в эквивалентной схеме нашего электрода несколько искажает форму его годографа: в области идеальной поляризуемости (0.6–1.1 В, сравн. кривую 2 на рис. 7) вместо вертикальной прямой получается наклонная, а полуокружность в области выделения хлора (1.1–2.3 В) несколько искажена (как и в случае легированных бором тонкопленочных CVD-алмазных электродов [18, 19]). Обращает на себя внимание “петля” повышенного сопротивления ReZ вокруг потенциала ~1.5 В, т.е. как раз в той области, где на вольтамперограмме (рис. 7) наблюдается “провал” тока из-за пассивации платины. Яснее это видно на графике зависимости ReZ от потенциала Е (рис. 11): после максимума ReZ (т.е., фактически сопротивления переноса заряда RF) в области минимума тока (~1.5 В) следует спад этого сопротивления в области интенсивного выделения хлора. Таким образом, и в моде Е-sweep данные электрохимического импеданса согласуются с вольтамперометрическими данными.
Рис. 11.
Зависимость ReZ от потенциала для электрода-компакта с примесью платины (рассчитанная из рис. 10).

Одновременное добавление платины и бора
Поскольку любое практическое применение требует минимального употребления драгоценных металлов, мы синтезировали компакты с добавкой как Pt, так и бора, который, помимо прочего, обеспечивает хорошую проводимость в объеме электрода.
Электроактивность электрода-компакта с добавкой одновременно бора (~1%) и платины (~15%) была протестирована с помощью реакции анодного окисления иона хлора. Следует отметить, что активность электродов зависит от предварительной обработки их поверхности, если эта обработка влияет на количество Pt на поверхности электрода. В частности, травление в царской водке, как показано выше, удаляет бóльшую часть платины с поверхности алмазного компакта и снижает электроактивность электрода. Последующей шлифовкой можно снять верхний слой алмаза и открыть свежую поверхность с выходами платины, и таким образом вновь повысить активность электрода (рис. 12).
Рис. 12.
Поляризационные кривые анодного выделения хлора на электроде-компакте, с добавкой платины и бора: после удаления платины с поверхности травлением в царской водке (1) и после последующей шлифовки (2).

Рис. 13.
Поляризационные кривые электродов-компактов с добавкой (1) только платины и (2) платины и бора.

На рис. 13 приведены анодные вольтамперограммы двух электродов-компактов: кривая 1 для компакта с добавкой только платины (это кривая Pt на рис. 6 в увеличенном масштабе), и кривая 2 для компакта с добавкой одновременно бора и платины, но травленого в царской водке. Последний менее активен в реакции окисления хлорида, видимо, вследствие меньшего содержания платины на его поверхности. В то же время специфика платины все же просматривается, хотя и относительно слабо, в появлении плохо выраженного “плеча” на вольтамперограмме в той же области потенциалов, где на кривой 1 наблюдается максимум. Все же здесь основа электроактивности данного электрода – это, по-видимому, только бор в качестве допанта.
Годографы импеданса (снятые в режиме f‑sweep) приведены на рис. 14. В отличие от рис. 8, здесь с ростом положительного потенциала кривые сдвигаются монотонно, в согласии с практически монотонным изменением тока на вольтамперограмме (см. рис. 13, кривая 2). “Полуокружности” сильнее приплюснуты, по-видимому, из-за более заметного влияния элемента постоянной фазы.
Все же введение катализатора (платины) в объем легированного бором алмазного компакта представляется не очень целесообразным, так как при этом лишь относительно небольшая часть Pt реально попадает на поверхность и может непосредственно воздействовать на электродную реакцию, в то время как бóльшая ее часть (в объеме образца) остается не при деле. Мы продемонстрировали это различие, нанося платину на поверхность электрода-компакта с добавкой бора и платины и сравнивая токи анодного окисления иона хлора на исходном и платинированном электроде (рис. 15). Платину осаждали традиционным способом, нанося с помощью микропипетки на электрод раствор платинохлористоводородной кислоты H2PtCl6 и боргидрида в качестве восстановителя. Согласно оценке, содержание платины на поверхности составляет 160 мкг на электрод.
Рис. 15.
Поляризационные кривые анодного выделения хлора на исходном электроде-компакте, содержавшем платину только в объеме (1), и после осаждения платины на его поверхность (2).

Рисунок 15 подтверждает, что специально введенная на поверхность электрода платина более эффективна, как катализатор анодного выделения хлора, чем локальные выходы на поверхность платины, введенной в объем компакта в ходе его синтеза.
Список литературы
Плесков, Ю.В., Кротова, М.Д., Елкин, В.В., Екимов, Е.А. Электрохимическое поведение нового электродного материала–компакта из легированного бором синтетического алмаза. Электрохимия. 2016. Т. 52. С. 3. [Pleskov, Yu.V., Krotova, M.D., Elkin, V.V., and Ekimov, E.A., Electrochemical Behavior of New Electrode Material: Compact of Boron-doped Synthetic Diamond, Russ. J. Electrochem., 2016, vol. 52, p. 1.]
Pleskov, Yu.V., Krotova, M.D., Elkin, V.V., and Ekimov, E.A., Electrochemical Behaviour of Boron-doped Diamond Compacts—a New Electrode Material, Electrochim. Acta, 2016, vol. 201, p. 268.
Плесков, Ю.В., Кротова, М.Д., Елкин, В.В., Екимов, Е.А. Компакты из легированного бором синтетического алмаза: снижение температуры синтеза и его влияние на степень легирования и электрохимическое поведение. Электрохимия. 2017. Т. 53. С. 1529. [Pleskov, Yu.V., Krotova, M.D., Elkin, V.V., and Ekimov, E.A., Compacts of Boron-doped Synthetic Diamond: Lowering of Synthesis Temperature and Its Effect on the Doping Level and Electrochemical Behavior, Russ. J. Electrochem., 2017, vol. 53, p. 1345.]
Плесков, Ю.В., Сахарова, А.Я., Кротова, М.Д., Буйлов, Л.Л., Спицын, Б.В. Фотоэлектрохимическое поведение полупроводникового алмаза. Электрохимия. 1987. Т. 24. С. 69. [Pleskov, Yu.V., Sakharova, A.Ya., Krotova, M.D., Bouilov, L.L., and Spitsyn, B.V., Photoelectrochemical behavior of semiconductor diamond, Elektrokhimiya, 1987, vol. 24, p. 69.]
Electrochemistry of Diamond, Eds. Fujishima, A., Einaga, Y., Rao, T.N., and Tryk, D.A., Tokyo: BKC & Amsterdam: Elsevier, 2005.
Synthetic Diamond Films: Preparation, Electrochemistry, Characterization and Applications, Eds. Brillas, E., Martinez-Huitle, C.A., New York: Wiley, 2011.
Topics in Applied Physics, vol. 121, Ed. Yang, N., Springer, 2015.
Notsu, H., Yagi, I., Tatsuma, T., Tryk, D.A., and Fujishima, A., Surface carbonyl groups on oxidized diamond electrodes, J. Electroanal. Chem., 2000, vol. 492, p. 31.
Awada, M., Strojek, J.W., and Swain, G.M., Platinum particles deposited on synthetic boron-doped diamond, J. Electrochem. Soc., 1995, vol. 142, p. L42.
Watanabe, T., Ivandini, T.A., Makide, Y., Fujishima, A., and Einaga, Y., Selective detection method derived from a controlled diffusion process at metal-modified diamond electrodes, Anal. Chem., 2006, vol. 78, p. 7857.
Pleskov, Yu.V., Krotova, M.D., Maslakov, K.I., Sirotinkin, V.P., and Ekimov, E.A., Synthesis of Boron-doped Carbonado—a New Electrode Material—in C–Metal–B Growth Systems Aimed at the Lowering of the Synthesis Temperature without Loss of Electrochemical Activity, J. Solid State Electrochem., 2018, vol. 22, p. 3129.
Kondrina, K.M., Kudryavtsev, O.S., Vlasov, I.I., Khmelnitskiy, R.A., and Ekimov, E.A., High-pressure synthesis of microdiamonds from polyethylene terephthalate, Diamond Related Mater., 2018, vol. 83, p. 190.
Brazhkin, V.V., Ekimov, E.A., Lyapin, A.G., Popova, S.V., Rakhmanina, A.V., Stishov, S.M., and Kato, K., Lattice parameters and thermal expansion of superconducting boron-doped diamonds, Phys. Rev. B, 2006, vol. 74, p. 140502.
Angus, J.C., Martin, H.B., Landau, U., Evstefeeva, Y.E., Miller, B., and Vinokur, N., Conducting diamond electrodes: applications in electrochemistry, New Diamond Frontier Carbon Technol., 1999, vol. 9, p. 175.
Кокоулина, Д.В., Красовицкая, Ю.И., Кришталик, Л.И. О состоянии поверхности платинового анода в кислых растворах хлоридов. Электрохимия. 1971. Т.7. С. 1154. [Kokoulina, D.V., Krasovitskaya, Yu.I., and Krishtalik, L.I., The state of the platinum anode surface in acidic chloride solutions (in Russian), Elektrokhimiya, 1971, vol. 7, p. 1154.]
Кокоулина, Д.В., Красовицкая, Ю.И., Кришталик, Л.И. Сопоставление поляризационных кривых на платиновом аноде с характером поверхностного покрытия. Электрохимия. 1971. Т. 7, С. 1218. [Kokoulina, D.V., Krasovitskaya, Yu.I., and Krishtalik, L.I., Comparing of polarization curves at platinum anodes with the nature of surface coating (in Russian), Elektrokhimiya, 1971, vol. 7, p. 1218.]
Плесков, Ю.В. Электрохимия алмаза (обзор). Электрохимия. 2002. Т. 38. С. 1411. [Pleskov, Yu.V., Electrochemistry of Diamond: A Review, Russ. J. Electrochem., 2002, vol. 38, p. 1275.]
Елкин, В.В., Кротова, М.Д. Импеданс двухстадийного адсорбционного окисления с квадратичной зависимостью энергии активации от потенциала на легированном бором алмазном аноде. Электрохимия. 2015. Т. 51. С. 10. [Elkin, V.V. and Krotova, M.D., Impedance of Two-Stage Adsorptive Oxidation with Quadratic Dependence of Activation Energy on Potential on a Boron-Doped Diamond Anode, Russ. J. Electrochem., 2015, vol. 51, p. 7.]
Elkin, V.V., Krotova, M.D., Pleskov, Yu.V., Polarization complex-plane thin-film impedance for two-stage charge-transfer reaction complicated with an intermediate adsorption (by example of benzene oxidation at boron-doped diamond electrode), Electrochim. Acta, 2014, vol. 144, p. 412.
Дополнительные материалы отсутствуют.