Электрохимия, 2020, T. 56, № 9, стр. 808-819
Электрохимическое поведение м-нитросульфокислоты бензола в водных растворах различного состава
А. А. Конарев *
Федеральное государственное унитарное предприятие “Государственный научный центр “НИОПИК”
123995 Москва, ГСП-5, ул. Большая Садовая, 1, корп. 4, Россия
* E-mail: konarev.niopik@gmail.com
Поступила в редакцию 20.09.2019
После доработки 06.12.2019
Принята к публикации 06.03.2020
Аннотация
Исследовано электрохимическое поведение м-нитросульфокислоты бензола методами полярографии, вольтамперометрии на стеклоуглероде, электролиза при контролируемом потенциале и электролиза в гальваностатическом режиме. Показано, что отличительной особенностью электровосстановления м-нитросульфокислоты бензола от ароматических нитросоединений как на ртутном капающем электроде, так и стеклоуглероде является сильная зависимость параметров и формы поляризационных кривых от состава фонового раствора и рН в нейтральных и щелочных растворах, и наблюдаемые в них две волны связаны с восстановлением недиссоциированных молекул м-нитросульфокислоты бензола и ее анионов, а продуктом их восстановления является промежуточно образующаяся гидроксиламиносульфокислота бензола. Волна дальнейшего восстановления последней до м- аминосульфокислоты бензола скрыта разрядом фона. Аммиачно-буферные растворы могут быть рекомендованы для препаративного электросинтеза м-аминосульфокислоты бензола, так как в этих растворах в гальваностатическом режиме электролиза на никелевом катоде м-аминосульфокислота бензола получена с выходом по веществу 92.8% и выходом по току 82.0%.
ВВЕДЕНИЕ
м-Аминосульфокислота бензола (м-АСКБ) используется в производстве азокрасителей [1]. Исходным продуктом для промышленного синтеза м-АСКБ является нитробензол, который сульфируют олеумом, а полученная соответствующая м‑нитросульфокислота бензола (м-НСКБ) подвергается нейтрализации молотым мелом в присутствии карбоната натрия, а затем восстанавливается в виде натриевой соли с концентрацией 140–180 г/л чугунной стружкой в аммиачно-щелочном растворе при температуре кипения [2]. После восстановления реакционную массу нейтрализуют кальцинированной содой до рН 7.5–8.0, фильтруют и упаривают до концентрации м‑АСКБ 225–250 г/л. Выделение целевого продукта из раствора осуществляют подкислением аминораствора концентрированной серной кислотой до рН 1.5–2.0. Общий выход м-АСКБ по стадиям восстановления и выделения продукта из раствора составляет 76.0%. Недостатком химического способа получения м-АСКБ является многостадийность и трудоемкость процесса, большое количество твердых отходов в виде неутилизируемого железного шлама, невысокая чистота целевого продукта.
Для усовершенствования и упрощения стадии восстановления ароматических нитросульфокислот ведутся работы в двух направлениях: использование методов каталитического гидрирования и электрохимического восстановления. В патентной литературе [3] описан способ получения ароматических аминосульфокислот каталитическим гидрированием щелочных солей соответствующих ароматических нитросульфокислот в воде или водно-спиртовом растворе при температуре 50–100°С и повышенном давлении предпочтительно 50–200 атм. При гидрировании этим способом натриевой соли м-НСКБ выход м-АСКБ составляет 94%. Кроме того, в качестве катализатора для восстановления м-НСКБ (Na-соль) могут быть использованы сульфиды платины, палладия и рутения [4]. В работе [5] м-АСКБ получают каталитическим восстановлением м-НСКБ на скелетном никелевом катализаторе с выходом 85%.
Данные по электрохимическому восстановлению м-НСКБ немногочисленны и не дают полного представления об оптимальных условиях проведения процесса с целью достижения высоких выходов конечных продуктов. В работе [6] исследовано влияние температуры, плотности тока, концентраций нитросоединения и серной кислоты на процесс восстановления м-НСКБ на медном катоде. Высокие выходы по току и веществу м-АСКБ около 100% достигаются в сернокислых растворах с низкими концентрациями исходного нитросоединения (0.02–0.2 М) при плотности тока 0.25 А/дм2 и температуре 80°С. С увеличением плотности тока, концентраций серной кислоты и исходного нитросоединения в католите эффективность процесса снижается. Поэтому такой процесс не может представлять интерес для разработки технологии получения м-АСКБ электрохимическим восстановлением м-НСКБ из-за низкой его производительности и больших энергозатрат, связанных с упаркой аминораствора на стадии выделения целевого продукта. В то же время в нашем предшествующем исследовании [7] сообщалось, что препаративный электросинтез изомерной смеси 1,6- и 1,7-нафталинаминосульфокислот (Клеве-кислот) из соответствующих нитросульфокислот нафталина успешно осуществляется в аммиачно-буферной среде на катоде из никеля или из нержавеющей стали с выходом по веществу 88–93% и по току 58–60%. Поэтому представляло интерес более подробно исследовать электрохимическое поведение м‑НСКБ в аммиачно-буферных растворах, результаты которого могут быть использованы для разработки условий электросинтеза м-АСКБ, приемлемого для промышленного применения.
МЕТОДИКА ЭКСПЕРИМЕНТА
Полярограммы снимали с помощью полярографа ПУ-1. Ртутный капающий электрод (р. к. э.) с принудительным отрывом капли лопаточкой имел следующие характеристики, определенные в 0.1 N растворе КС1 при разомкнутой цепи и высоте столба ртути 50 см: m = 1.0 мг/с, t = 0.65 с. Потенциалы приведены относительно насыщенного каломельного электрода.
Фоновыми электролитами служили растворы Робинсона–Бриттона со значениями рН от 2.0 до 11.0 и постоянной ионной силой 0.5 М, растворы НС1, Н2SO4 и NaOH с концентрацией 0.1–1.0 N и аммиачно-буферные растворы с рН 5.0–9.0, а также растворы хлорида аммония с концентрацией 0.01–1.0 N.
Поляризационные кривые на стеклоуглероде марки СУ-2000 (СУ) регистрировали с помощью полярографа ПУ-1 в дифференциальном режиме. Применявшийся в работе стационарный электрод представлял собой торец стеклоуглеродного стержня диаметром 2 мм, вклеенный в стеклянный корпус [8].
Ячейка для регистрации поляризационных кривых представляла собой конический стеклянный сосуд объемом 20 см3 с термостатируемой рубашкой. Электродом сравнения служил насыщенный каломельный полуэлемент, относительно которого и приведены значения потенциалов. В качестве вспомогательного электрода использовали также насыщенный каломельный полуэлемент.
Для получения воспроизводимых результатов СУ шлифовали на мелкой шкурке, полировали до зеркального блеска фетром, пропитанным глицерином с оксидом алюминия. После промывки дистиллированной водой электрод выдерживали в концентрированной серной кислоте и снова тщательно промывали. Непосредственно перед записью каждой вольт-амперной кривой электрод промывали водой и протирали фильтровальной бумагой. Электролит, в который погружали электрод, деаэрировали инертным газом для удаления растворенного кислорода.
С целью идентификации продуктов восстановления м-НСКБ, а также оценки его эффективности проводили электролиз при контролируемых потенциалах с использованием электронного потенциостата П-5848. Электролиз на катодах из различных металлов осуществляли в стеклянной цилиндрической ячейке с термостатируемой рубашкой с разделенными катионообменной мембраной МК-40 анодным и катодным пространствами. Электрохимическая ячейка имела пришлифованную крышку со штуцерами для токоподводов, отбора проб, установки капилляра Луггина и подачи азота. Катод из исследуемого металла с поверхностью 0.15 дм2 устанавливали на дне ячейки. Токоподвод осуществляли с помощью ножки, впаянной в стеклянную трубку. Для перемешивания католита использовали магнитную мешалку. Анодом служила платиновая пластинка, анолитом – 10%-ный раствор серной кислоты. Объем католита составлял 70 мл.
Потенциалы задавали в соответствии с данными, полученными из поляризационных измерений на твердых электродах.
В ходе электролиза полярографически и вольтамперометрически контролировали изменение концентрации исходного нитросоединения и продуктов реакции [8].
Восстановление м-НСКБ в гальваностатическом режиме проводили в такой же стеклянной электрохимической ячейке, что и электролиз при контролируемом потенциале.
Для полярографических и вольтамперометрических исследований м-НСКБ и м-АСКБ очищали двойной перекристаллизацией из деионизованной воды.
Концентрацию промежуточно образующейся гидроксиламиносульфокислоты бензола определяли вольтамперометрически на фоне 1 М раствора NaOH в дифференциальном режиме [8], а концентрацию м-АСКБ – методом диазотирования, считая на диазотирующиеся продукты с молекулярной массой 173.
Выделение целевой м-АСКБ из раствора, полученного после электролиза, проводили его подкислением серной кислотой до рН реакционной массы 1.5–2.0 при температуре 75–80°С, с последующим охлаждением до 50°С, а затем до температуры 20–22°С.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Полярографическое восстановление м-НСКБ
На полярограммах натриевой соли м-НСКБ на фоне 0.1 N серной и соляной кислот, а также буферных растворов с рН 1.96–3.5, как показано на рис. 1, наблюдаются две волны, характерные для восстановления ароматических нитросоединений [9]. В кислых буферных растворах вторая волна выражена слабо и ее высота вдвое меньше высоты первой волны. При увеличении рН фона высота второй волны уменьшается, а при рН 4.6 волна полностью исчезает.
Рис. 1.
Полярограммы м-НСКБ при различных рН: 1 – 0.1 N Н2SO4; 2 – 1.96; 3 – 3.5; 4 – 4.6; 5 – 5.2; 6 – 6.4; 7 – 7.0; 8 – 8.1; 9 – 0.1 N NaOH. Фон – буферные растворы Бриттона–Робинсона, концентрация м‑НСКБ – 1.6 × 10–4 М.

Высота первой волны восстановления м‑НСКБ сохраняет примерно постоянное значение во всем исследованном диапазоне рН (рис. 1).
Е1/2 первой волны восстановления м-НСКБ при увеличении рН сдвигается в область более отрицательных значений. В интервале рН 1.0–8.0 ∆Е1/2/∆рН составляет 55.8 мВ/ед. рН. В растворах с рН выше 8.0 Е1/2 первой волны сохраняется постоянным и составляет –0.74…–0.76 В.
Для предельного тока первой волны восстановления м-НСКБ на фоне 0.1 N раствора Н2SO4 наблюдается линейная зависимость от концентрации вещества, а зависимость Id от корня квадратного из высоты ртутного столба также линейна и проходит через начало координат. Температурный коэффициент составляет 1.69%/град. Эти результаты указывают на диффузионную природу предельного тока.
Число электронов, принимающих участие в электродном процессе, оценивали сравнением высоты волны нитробензола, восстанавливающегося в сильнокислой среде в две стадии с суммарным потреблением шести электронов до аминосоединения, а в щелочной среде – четырех электронов до гидроксиламиносоединения [9] с высотой волны м-НСКБ в идентичных условиях. При этом высота волн м-НСКБ как в сильнокислой, так и в щелочной средах равна высоте волны нитробензола. Поэтому можно полагать, что полярографическое восстановление м-НСКБ протекает в сильнокислой среде с суммарным потреблением шести электронов: сначала с участием четырех электронов образуется соответствующий гидроксиламин (первая волна), а затем следует двухэлектронная стадия восстановления до м-АСКБ (вторая волна), а в щелочной среде с затратой четырех электронов до соответствующей м-гидроксиламиносульфокислоты бензола.
В аммиачно-буферных растворах (0.1 N NH4Cl + + NH4OH) с рН 5.0–9.0 на полярограммах м‑НСКБ наблюдается одна волна. При этом предельный ток и Е1/2 в исследованном интервале рН практически не изменяются, а высота волны незначительно уменьшается (табл. 1).
Таблица 1.
Влияние рН на полярографическое восстановление м-НСКБ в аммиачно-буферных (0.1 N NH4Cl + + NH4OH) растворах. Концентрация м-НСКБ – 1.6 × × 10–4 М
| рН | –Е1/2, В | Id, мкА |
|---|---|---|
| 5.0 | 0.81 | 1.64 |
| 6.3 | 0.82 | 1.62 |
| 7.3 | 0.82 | 1.62 |
| 9.0 | 0.83 | 1.58 |
Для предельного тока волны восстановления м-НСКБ в аммиачно-буферном растворе с рН 9.0 наблюдается линейная зависимость от концентрации вещества, проходящая через начало координат. В то же время зависимость Id от корня квадратного из высоты ртутного столба отсекает отрезок на оси абсцисс, а температурный коэффициент составляет 0.65–0.97%/град. Вероятно, эти данные указывают на влияние адсорбции исходного нитросоединения или продуктов восстановления на предельный ток волны электровосстановления м-НСКБ .
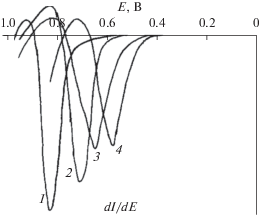
На р. к. э. исследовано влияние ионной силы раствора на восстановление м-НСКБ в аммиачно-буферном растворе с рН 8.8–8.9 (рис. 2) и в растворах NH4Cl с рН 4.9–5.0 (рис. 3). При низкой концентрации NH4Cl (0.01 N) как в слабокислой, так и слабощелочной средах на полярограмме м-НСКБ регистрируются две волны не характерные для ароматических нитросоединений [9], причем соотношение их высот зависит от концентрации фонового раствора и его рН. Как видно из рис. 2 и 3, с увеличением рН раствора до 8.8–8.9 высота первой волны уменьшается, а второй – увеличивается при концентрации NH4Cl 0.01 N в фоновом растворе. По мере увеличения концентрации электролита наблюдается слияние волн, а суммарная волна существенно сдвигается в область менее электроотрицательных значений потенциала. Так, с увеличением концентрации NH4Cl с 0.01 до 1.0 N раствора Е1/2 в слабокислых растворах сдвигается на 190 мВ, а в слабощелочных – на 230 мВ в анодную сторону, а высота суммарной волны при этом незначительно увеличивается.
Вольтамперометрические измерения на СУ
На электроде из СУ на катодной ветви циклических дифференциальных поляризационных кривых в 0.1 N растворе серной кислоты, а также в буферных растворах Бриттона–Робинсона с рН 1.96–7.02 наблюдается один необратимый пик восстановления м-НСКБ (табл. 2). Потенциал первого пика восстановления м-НСКБ, как видно из табл. 2, сдвигается в область более отрицательных значений, а в интервале рН 7.02–14.0 перестает зависеть от рН и составляет –0.91 и –0.92 В. В то же время потенциал второго катодного пика с увеличением рН фона от 8.1 до 14.0 сдвигается также в область более отрицательных значений от –1.2 до –1.46 В.
Таблица 2.
Влияние рН на электровосстановление м‑НСКБ на СУ в буферных растворах Бриттона–Робинсона. Концентрация м-НСКБ – 1.96 × 10–4 М
| рН | Катодный пик | Анодный пик | ||
|---|---|---|---|---|
| –Еp, В | Ip, мм | Еp, В | Ip, мм | |
| 0.1 N Н2SО4 | 0.68 | 120 | +0.14 | 41 |
| 1.96 | 0.73 | 120 | +0.13 | 30 |
| 2.50 | 0.75 | 119 | +0.12 | 25 |
| 3.50 | 0.81 | 118 | +0.11 | 20 |
| 4.60 | 0.87 | 119 | +0.09 | 18 |
| 5.20 | 0.88 | 112 | +0.05 | 14 |
| 6.40 | 0.90 | 97 | 0.00 | 10 |
| 7.02 | 0.91 | 79 | –0.02 | 8 |
| 8.10 | 0.91 1.20* |
53 16* |
–0.04 | 5 |
| 8.7 | 0.91 1.24* |
44 23* |
– | – |
| 9.6 | 0.91 1.28* |
32 35* |
||
| 0.1 N NaOH | 0.92 1.46* |
28 34* |
– | – |
При увеличении рН раствора высота пика восстановления м-НСКБ уменьшается, а на фоне буферных растворов с рН 8.1–9.6, а также в 0.1 N растворе NaOH пик разделяется на два с различным соотношением их высот. Причем высота первого катодного пика продолжает уменьшаться с увеличением рН фона, а высота второго катодного пика при этом возрастает.
При реверсе развертки от потенциала –1.5 В регистрируется анодный пик при потенциалах ‒0.04…+0.14 В в зависимости от рН фонового раствора. Для установления природы анодного пика исследовали электроокисление м-АСКБ на СУ в различных фоновых растворах. Как видно из рис. 4, м-АСКБ подвергается анодному окислению при более положительных потенциалах, чем наблюдаемые пики окисления, приведенные в табл. 2. Так, пик окисления м-АСКБ на фоне 0.1 N НСl, 0.1 N NH4Cl, а также аммиачно-буферных растворов с рН 7.3 и 9.0 наблюдается при Еp = = 0.81 В и Еp = 0.69 В, а также при Еp = 0.64 В и Еp = 0.57 В, соответственно, и по мере увеличения рН фона сдвигается в сторону менее электроположительных потенциалов (рис. 4). Поэтому анодные пики, приведенные в табл. 2, вероятно, отвечают окислению промежуточно образующегося гидроксиламинопроизводного до соответствующего нитрозосоединения. Ароматические гидроксиламиносоединения и, в частности, гидроксиламиносульфокислоты, на аноде легко окисляются [7–10].
Рис. 4.
Дифференциальные вольтамперограммы окисления м-АСКБ на СУ на фоне 0.1 N НСl (1), 0.1 N NH4Cl (2), а также аммиачных буферных растворах с рН 7.3 (3) и рН 9.0 (4). Концентрация м-АСКБ – 1.96 × 10–4 М.
В аммиачно-буферных растворах с рН 5.0–9.0, как следует из данных табл. 3, в области катодных потенциалов наблюдается также необратимый пик (волна) восстановления м-НСКБ, высота и Еp которого в исследованном интервале рН изменяются незначительно.
Однако с увеличением рН фонового раствора до 9.0 пик (волна) восстановления м-НСКБ расщепляется на два пика (волны). Аналогичный эффект наблюдается в щелочных буферных растворах Бриттона–Робинсона с рН 8.1–9.6 (табл. 2), а также на р. к. э. в этом интервале рН (рис. 2).
Влияние ионной силы фонового раствора на процесс электровосстановления м-НСКБ на СУ показано на рис. 5, из которого видно, что на катодной ветви вольтамперограмм наблюдаются два пика (две волны в классическом режиме: рис. 5а).
Рис. 5.
Классические (а) и циклические дифференциальные (б) вольтамперограммы восстановления м-НСКБ на СУ на фоне аммиачного буфера с рН 8.9–9.0 с добавкой NH4Cl, N: 1 – 0.01; 2 – 0.1; 3 – 1.0. Концентрация м-НСКБ – 2 × 10–4 М.

Как видно из рис. 5, для первого катодного пика (кривая 3 рис. 5б) Еp составляет –0.83 В, а для второго –1.05 В. С увеличением ионной силы раствора катодные пики (волны) м-НСКБ сдвигаются в область менее электроотрицательных значений потенциала. Так, с увеличением концентрации NH4Cl с 0.01 до 1.0 N раствора Еp первого и второго пиков (волн) сдвигаются на 170 и 470 мВ, соответственно, в анодную сторону. При этом существенно увеличивается высота первого катодного пика, а высота второго пика (волны) уменьшается. Однако высота суммарной волны при этом незначительно увеличивается (рис. 5а). При изменении развертки в анодном направлении от потенциала –1.65 В на вольтамперограммах регистрируются два пика окисления (для кривой 3 рис. 5б пик А1 с Еp = –0.83 В и пик А2 с Еp = –0.25 В). По-видимому, анодный пик А2, как и в буферных растворах Бриттона–Робинсона (табл. 2), отвечает окислению гидроксиламиносульфокислоты бензола, образующейся при электровосстановлении м-НСКБ, в соответствующее нитрозосоединение [7–10]. Так как анодные пики А1 (кривые 2 и 3) и первые катодные пики (кривые 2 и 3) наблюдаются при одном и том же Еp, составляющем –0.83 В, а высота анодных пиков А1 примерно в 4 раза меньше по сравнению с первыми катодными пиками, что указывает на одноэлектронный и обратимый характер процесса окисления, то можно предположить, что анодный пик А1 представляет обратимый процесс окисления анион-радикала в исходное соединение. Катодная волна образования анион-радикала, вероятно, скрыта суммарной четырехэлектронной волной синтеза гидроксиламинопроизводного.
Изменение соотношения высоты катодных пиков (волн) от состава фонового раствора не связано с селективностью электровосстановления нитрогруппы, а продуктом электровосстановления м-НСКБ является гидроксиламиносульфокислота бензола, которая легко окисляется, давая на вольтамперограмме анодный пик А2, что характерно для электровосстановления ароматических нитросоединений, в том числе ароматических нитросульфокислот [7–10]. К тому же, при регистрации циклических вольтамперограмм в этих фоновых растворах образование целевой м-АСКБ не наблюдается (рис. 5б), на что указывает отсутствие ее анодного пика, который должен регистрироваться при Еp = 0.57 В, как показано на рис. 4.
В то же время, как в сильнокислом (0.1 N Н2SO4), так и в аммиачно-буферном растворе (0.7 N NH4Cl + + NH4OH) с рН 8.4 при микроэлектролизе на СУ при потенциалах электрода –1.2…–1.4 и –1.4…–1.6 В, соответственно, в течение 10–30 мин и последующей развертке потенциала в анодном направлении на вольтамперограмме регистрируются не только два анодных пика А1 и А2 при потенциалах электрода –0.65… –0.85 и –0.25…+0.15 В, соответственно, но и пик окисления целевой м-АСКБ при потенциалах электрода 0.6–0.75 В, что подтверждается введением в раствор последней (пик А3рис. 6, пик А3рис. 7).
Рис. 6.
Классическая вольтамперограмма восстановления м-НСКБ (1), циклическая дифференциальная вольтамперограмма восстановления м-НСКБ (2) на фоне 0.1 N Н2SO4, а также дифференциальные вольтамперограммы окисления продуктов восстановления м-НСКБ, образующихся при различных потенциалах в течение 30 мин: Е = –1.2 В (3); Е = –1.4 В (4) и дифференциальная вольтамперограмма окисления м-АСКБ (5). Концентрация м-НСКБ – 1.96 × 10–4 М, концентрация м-АСКБ – 1.9 × 10–4 М, скорость развертки потенциала: 20 мВ/с.
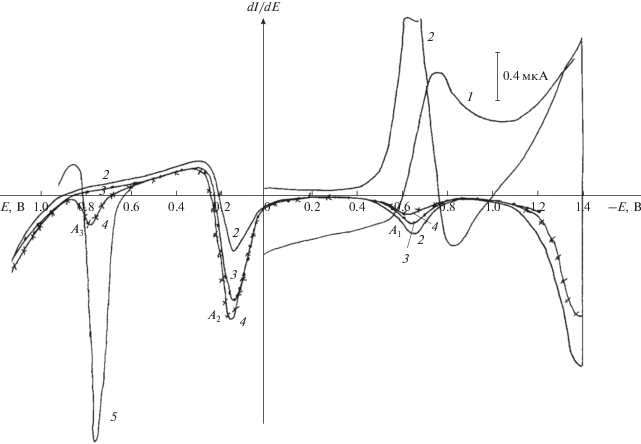
Рис. 7.
Классическая вольтамперограмма восстановления м-НСКБ (1), циклическая дифференциальная вольтамперограмма восстановления м-НСКБ (2) на фоне аммиачно-буферного раствора (0.7 N NH4Cl + NH4OH) с рН 8.4, а также дифференциальные вольтамперограммы окисления продуктов восстановления м-НСКБ, образующихся при различных потенциалах в течение 30 мин: Е = –1.4 В (3); Е = –1.6 В (4) и дифференциальная вольтамперограмма окисления м-АСКБ (5). Концентрация м-НСКБ – 1.9 × 10–4 М, концентрация м-АСКБ – 1.9 × 10–4 М, скорость развертки потенциала: 20 мВ/с.

Из рис. 6 и 7 видно, что соотношение анодных предельных токов, а следовательно, образующихся продуктов, зависит от задаваемого потенциала электрода, а также от природы и концентрации фонового раствора. Так, при микроэлектролизе в течение 30–60 мин на СУ на фоне аммиачно-буферного раствора с рН 9.0 и низкой концентрацией NH4Cl, составляющей 0.01 N, при потенциалах электрода –1.2 и –1.6 В, соответствующих предельным токам наблюдаемых волн на вольтамперограмме, не наблюдается образование м-АСКБ, а продуктом микроэлектролиза является м-гидроксиламиносульфокислота бензола (табл. 4).
Таблица 4.
Электровосстановление м-НСКБ на фоне различных электролитов на СУ и потенциостатический микроэлектролиз при потенциалах предельных токов. Концентрация м-НСКБ – 2 × 10–4 М, продолжительность микроэлектролиза 30 мин, температура 20–22°С
| Состав фонового раствора | Еp, В | Ip, мкА | Потенциал электрода, В | Продукты электролиза |
|---|---|---|---|---|
| 0.1 N H2SO4, рН 0.15 | –0.65 | 1.16 | –1.2 –1.4 |
Гидроксиламин Гидроксиламин и амин |
| 1 N NH4Cl, рН 4.4 | –0.80 | 1.34 | –0.9 –1.6 |
Гидроксиламин Гидроксиламин и амин |
| 1 N КСl, рН 6.9 | –0.84 | 0.82 | –0.9 –1.6 |
Гидроксиламин Гидроксиламин |
| 1 N NH4Cl + NH4ОН, рН 7.5 | –0.81 | 1.22 | –0.85…–1.4 –1.6…–1.7 |
Гидроксиламин Гидроксиламин и амин |
| 0.01 N NH4Cl + NH4ОН, рН 9.0 | –1.0 –1.45 |
0.40 0.47 |
–1.2 –1.6 |
Гидроксиламин Гидроксиламин |
Из приведенных выше результатов следует, что на СУ как в сильнокислых растворах на фоне 0.1 N Н2 SO4 (табл. 2; рис. 6, кривые 2 и 3), так и в нейтральной и щелочной средах на фоне буферных растворов Робинсона–Бриттона (табл. 2), а также в аммиачно-буферных растворах (рис. 7, кривые 2 и 3 ) м-НСКБ восстанавливается в одну четырехэлектронную стадию с образованием cоответствующего гидроксиламинопроизводного, что установлено регистрацией циклических вольтамперограмм ее восстановления и микроэлектролизом при потенциалах электрода, соответствующих предельным токам регистрируемых волн (пиков) (рис. 6 и 7), а также данными анодного поведения целевой м-АСКБ (рис. 4). Последующая двухэлектронная стадия, приводящая к образованию м-АСКБ, скрыта разрядом фона, что установлено микроэлектролизом при потенциалах электрода –1.4 и –1.6 В (рис. 6, кривая 4; рис. 7, кривая 4) и введением в фоновый раствор м-АСКБ (рис. 6, кривая 5; рис. 7, кривая 5).
Так как электровосстановление м-НСКБ протекает с участием протонов, то были проведены исследования ее восстановления на СУ в растворах различной кислотности в присутствии доноров протонов разной химической природы. Результаты электровосстановления м-НСКБ на фоне различных электролитов на СУ и потенциостатического режима микроэлектролиза при потенциалах предельных токов приведены в табл. 4.
Из данных, приведенных в табл. 4, следует, что в исследованных фоновых растворах продуктами электровосстановления м-НСКБ на СУ при потенциалах электрода, соответствующих предельным токам первой и второй волн, является соответствующее гидроксиламинопроизводное. При потенциалах электрода, близких к разряду фона (–1.6…–1.7 В), наряду с последним образуется м‑АСКБ. Аналогичные результаты получены на фоне 0.1 N H2SO4. Однако на фоне 1 N КСl и аммиачно-буферного раствора с 0.01 N NH4Cl и рН 9.0 даже при потенциале электрода –1.6 В дальнейшее восстановление гидроксиламинопроизводного в соответствующую м-АСКБ не наблюдается. Вероятно, это обусловлено трудностью протонизации промежуточно образующегося гидроксиламинапроизводного в этих фоновых растворах.
В растворах NH4Cl и аммиачно-буферных растворах с рН 7.5–8.4 процесс электровосстановления м-НСКБ не только сдвинут в область более положительных потенциалов по сравнению с растворами KCl, но и при этом облегчается дальнейшее восстановление гидроксиламинопроизводного в амин (табл. 4). По-видимому, это связано с высокой протонодонорной способностью ${\text{NH}}_{4}^{ + }$ по сравнению с водой (роль доноров протонов в растворах KCl выполняют молекулы воды), обеспечивающей протонирование нитро- и гидроксиламиновой групп, рекомбинацию анионов м-НСКБ с донорами протонов, а также возможное участие ${\text{NH}}_{4}^{ + }$ в образовании электроактивных частиц с анионами м-НСКБ (ионных пар) [11].
Отличительной особенностью электровосстановления м-НСКБ по сравнению с электровосстановлением ароматических нитросоединений [9] как на р. к. э., так и СУ является сильная зависимость параметров и формы поляризационных кривых от концентрации фонового раствора и его рН.
Наблюдаемые различия в электрохимическом поведении м-НСКБ в нейтральных и слабощелочных растворах по сравнению с нитробензолом и его производными [9], видимо, связаны с наличием в ее молекуле сульфогруппы. Известно, что ароматические сульфокислоты относятся к сильным кислотам (по силе близки к соляной и серной кислотам [12]) и в объеме раствора находятся в диссоциированном состоянии. Учитывая это, можно полагать, что м-НСКБ подвергается электровосстановлению в виде анионов и нейтральных молекул, соотношение концентраций которых зависит от рН раствора. С увеличением рН фона концентрация анионов м-НСКБ увеличивается и на полярографической кривой регистрируются две волны, первая из которых отвечает электровосстановлению м-НСКБ в виде нейтральных молекул, вторая, наблюдаемая при более электроотрицательных потенциалах, – в виде анионов. В слабокислых растворах концентрация анионов м-НСКБ уменьшается, вероятно, в результате рекомбинации анионов с донорами протонов, что приводит к изменению природы разряжающейся частицы, и, как видно на рис. 3, вторая волна слабо выражена. Напротив, в слабощелочных растворах доля анионов м-НСКБ, видимо, увеличивается и вторая волна на полярографической кривой проявляется четко (рис. 2). При этом суммарная волна незначительно увеличивается (рис. 2).
На скорость необратимых электрохимических реакций, в которых участвуют анионы, существенно оказывает влияние строение двойного слоя, зависящее от ионной силы раствора [13, 14]. Увеличение ионной силы раствора сводится к уменьшению ψ1-потенциала, снижению отрицательного заряда электрода, возрастанию адсорбции катионов фона, облегчая образование ионных пар разряжающихся анионов с катионами фона, что в целом приводит к сдвигу полярографической кривой в сторону положительных значений потенциала. Все это должно способствовать росту приэлектродной концентрации анионов м-НСКБ и увеличению скорости их электровосстановления. К тому же, изменение ψ1-потенциала может приводить к изменению рН в прикатодном слое по сравнению со значением рН в объеме раствора [10].
Действительно, увеличение концентрации фонового электролита с 0.01 до 1.0 N как в слабокислом с рН 4.9–5.0 (рис. 3), так и в щелочном растворах с рН 8.7–8.9 (рис. 2) сдвигает полярографическую кривую в сторону положительных значений потенциала и увеличивает скорость реакции электровосстановления м-НСКБ. Причем наибольший сдвиг полярографических кривых наблюдается в щелочных растворах, для которых характерна большая концентрация анионов м‑НСКБ и влияние строения двойного слоя проявляется в большей степени.
Аналогичные закономерности изменения параметров и форм волн электровосстановления м‑НСКБ в слабокислых и слабощелочных растворах в зависимости от концентрации фона и его рН наблюдаются и на СУ (табл. 2, рис. 5).
Электровосстановление м-НСКБ на металлических электродах
Поскольку результаты полярографических исследований, строго говоря, нельзя переносить на твердые электроды, а вольтамперометрические измерения на СУ не позволяют оценить в полной мере эффективность электросинтеза м-АСКБ, то для получения дополнительной информации по восстановлению м-НСКБ использовали электролиз при контролируемом потенциале на металлических электродах. Предварительно в аммиачно-буферном растворе (0.7 N NH4Cl + NH4ОН) с рН 8.4 сняли поляризационные кривые восстановления м-НСКБ на электродах из никеля и нержавеющей стали марки Х18Н10Т (рис. 8). Выбор материала катодов, а в качестве среды – аммиачно-буферный раствор, обусловлен результатами поляризационных измерений на СУ (рис. 7) и данными, приведенными в работе [7], показывающими возможность электросинтеза аминосульфокислот нафталина (Клеве-кислот) в аммиачно-буферном растворе с рН 6.1–9.1 на катоде из никеля и нержавеющей стали.
Рис. 8.
Поляризационные кривые восстановления м‑НСКБ в аммиачно-буферном растворе (0.7 N NH4Cl + NH4ОН) с рН 8.4 на никелевом (1) и стальном Х18Н10Т (2) катодах. Концентрация м-НСКБ – 4 × 10–2 М.

На поляризационных кривых восстановления м-НСКБ на катодах из стали Х18Н10Т и никеля регистрируется одна волна, потенциалы полуволн которых равны –0.90 и –0.87 В соответственно (рис. 8), и наблюдается при более электроотрицательных потенциалах по сравнению с СУ.
Данные по электровосстановлению м-НСКБ при контролируемом потенциале приведены в табл. 5.
Таблица 5.
Результаты электровосстановления м-НСКБ при контролируемом потенциале на различных электродах в аммиачно-буферном растворе (0.7 N NH4Cl + NH4ОН) с рН 8.4. Концентрация м-НСКБ 4 × 10–2 М
| Материал катода | Потенциал катода, В | Выход м-АСКБ, % | Выход м-гидроксиламино-сульфокислоты бензола, % | ||
|---|---|---|---|---|---|
| по веществу | по току | по веществу | по току | ||
| Сталь Х18Н10Т | –0.85 | 83.2 | 17.2 | 8.3 | 5.6 |
| –1.0 | 93.7 | 84.0 | – | – | |
| –1.3 | 77.2 | 27.0 | – | – | |
| i* = 1.0 А/дм2 | 77.8 | 46.5 | – | – | |
| Никель | –0.85 | 77.0 | 40.5 | 12.5 | 12.5 |
| –1.0 | 94.5 | 85.5 | – | – | |
| –1.3 | 87.8 | 34.0 | – | – | |
| i* = 1.0 А/дм2 | 92.8 | 82.0 | – | – | |
Полученные результаты по электролизу растворов м-НСКБ при контролируемом потенциале на никелевом катоде и катоде из нержавеющей стали позволяют количественно оценить эффективность электровосстановления м-НСКБ в аммиачно-буферной среде (табл. 5). Из табл. 5 видно, что продуктами восстановления м-НСКБ на катодах из стали Х18Н10Т и никеля являются соответствующие гидроксиламино- и аминосоединения, выход которых зависит от задаваемого потенциала. Так, при потенциалах электрода, близких к потенциалу полуволны (–0.85 В), восстановление м-НСКБ на никелевом электроде и катоде из стали Х18Н10Т протекает с преимущественным образованием м-АСКБ (77.0–83.2%) и небольшого количества м-гидроксиламиносульфокислоты бензола (8.3–12.5%), а при потенциале электрода –1.0 В, соответствующем предельному току поляризационных кривых, выход целевой м-АСКБ увеличивается до 93.7–94.5% в результате более полной конверсии гидроксиламиносульфокислоты бензола в м-АСКБ. Однако при потенциале электрода –1.3 В как на катоде из стали Х18Н10Т, так и на никеле выход м-АСКБ по веществу и по току снижается до 77.2–87.8 и 27–34%, соответственно, вероятно из-за протекания в этих условиях побочной реакции – восстановительного десульфирования исходного нитросоединения. Снижение выхода по току связано как с уменьшением выхода м-АСКБ по веществу, так и с увеличением доли тока на выделение водорода. При этом на поверхности катодов образуется сульфидная пленка металлов.
Данные по восстановлению м-НСКБ в гальваностатическом режиме также приведены в табл. 5, из которых следует, что восстановление разбавленных растворов м-НСКБ в гальваностатическом режиме в аммиачно-буферной среде с рН 8.4 при плотности тока 1.0 А/дм2 и температуре 25°С протекает с высокой эффективностью, как и в случае электролиза при контролируемом потенциале электрода –1.0 В. Так, на никелевом катоде при плотности тока 1.0 А/дм2 выход м-АСКБ по веществу составляет 92.8%, а по току – 82.0%, а на катоде из нержавеющей стали м-АСКБ получена с более низкими выходами. Поэтому никелевый катод рекомендуется для разработки технологии препаративного электросинтеза м-АСКБ, как и аммиачно-буферные растворы. К тому же, последние более предпочтительны по сравнению с кислой средой [6], так как они в коррозионном отношении менее активны, что упрощает выбор электродного и конструкционного материалов для электролизера, а также циркуляционных насосов и коммуникаций с арматурой.
ЗАКЛЮЧЕНИЕ
На основании полученных результатов можно сделать следующие основные выводы:
1. Методами полярографии, вольтамперометрии на СУ, микроэлектролиза в потенциостатическом режиме на СУ, электролиза при контролируемом потенциале и в гальваностатическом режиме установлены закономерности электрохимического восстановления м-НСКБ в сильнокислых, а также в хлоридоаммонийных и аммиачных буферных растворах.
2. Методом вольтамперометрии на СУ исследовано анодное окисление целевого продукта – м-АСКБ.
3. Установлена природа отдельных стадий катодного и анодного процессов для м-НСКБ и идентифицированы промежуточные и конечные продукты реакции: анион-радикалы, гидроксиламино- и аминосульфокислоты бензола, а также сульфиды катодных металлов.
4. Показано, что полярографическое восстановление м-НСКБ в сильнокислой среде на фоне 0.1 N H2SO4 протекает в две стадии с суммарным потреблением шести электронов: сначала с участием четырех электронов образуется соответствующий гидроксиламин, а затем следует двухэлектронная стадия восстановления до м-АСКБ, а в щелочной среде с затратой четырех электронов до соответствующей м-гидроксиламиносульфокислоты бензола.
5. Установлено, что электровосстановление м‑НСКБ на СУ как в сильнокислых растворах на фоне 0.1 N Н2SO4, так и в нейтральной и щелочной средах на фоне буферных растворов Робинсона–Бриттона, а также в аммиачно-буферных растворах протекает в одну четырехэлектронную стадию с образованием cоответствующего гидроксиламинопроизводного. Последующая двухэлектронная стадия, приводящая к образованию м-АСКБ, скрыта разрядом фона.
6. Показано, что отличительной особенностью электровосстановления м-НСКБ в нейтральных и слабощелочных растворах от ароматических нитросоединений как на р. к. э, так и СУ является сильная зависимость параметров и форм поляризационных кривых от концентрации и природы фонового электролита, а также рН последнего. Наблюдаемые в этих электролитах две волны связаны с восстановлением недиссоциированных молекул м-нитросульфокислоты бензола и ее анионов.
7. Аммиачно-буферные растворы с рН 7.5–8.4 и никелевый катод рекомендуются для разработки технологии электросинтеза м-АСКБ, так как в этих растворах в гальваностатическом режиме электролиза на никелевом катоде при плотности тока 1.0 А/дм2м-АСКБ и получена с выходом по веществу 92.8% и выходом по току 82.0%.
Список литературы
Ворожцов, Н.Н. Основы синтеза промежуточных продуктов и красителей. М.: Госхимиздат. 1955. 839 с. [Vorozhtsov, N.N., The fundamentals of synthesis of intermediate products and dyes (in Russian), Moscow: Goskhimizdat, 1955, 839 p.]
Венкатараман, К. Химия синтетических красителей. Л.: Госхимиздат. 1956. 803с. [Venkataraman, K., Chemistry of synthetic dyes (in Russian), Leningrad: Goskhimizdat, 1956, 803 p.]
Ehrmann, K., VerfahrenzurHerstellung von aromatischen Aminosulfonsӓuren, Pat. 1233408 (BRD), 1967.
Свидченко, В.Ф., Николаев, Ю.Т., Сокольский, Д.В. Сульфиды платиновых металлов как катализаторы восстановления нитросоединений. ЖФХ. 1973. Т. 47. С. 725. [Svidchenko, V.F., Nikolaev, Yu.T., and Sokolsky, D.V., Sulfides of platinum metals as catalysts forreduction of nitrocompounds, Russ. J. Phys. Chem., 1973, vol. 47, p. 725.]
Gait, R.J., Catalytic reduction of nitrobenzene sulphonic Acids. Pat. 1499589 (England), 1978.
Хомутов, Н.Е., Касатонова, И.В. Изучение электровосстановления натриевой соли нитробензол-м-сульфокислоты на медном катоде. ЖПХ. 1961. Т. 34. С. 860. [Khomutov, N.E. and Kasatonova, I.V., Studies of electrical reduction of sodium salt of nitrobenzene-m-sulfonic acid on the copper cathode, Russ. J. Appl. Chem., 1961, vol. 34, p. 860.]
Конарев, А.А. Электрохимический синтез Клеве-кислот. Электрохимия. 1998. Т. 34. С. 1166. [Konarev, A.A., Electrochemical synthesis of Cleves-acids, Russ. J. Electrochem., 1998, vol. 34, p. 1160.]
Конарев, А.А. Способ определения ароматических нитросоединений и продуктов их восстановления, Пат. 2159424 (Россия). 2000. [Konarev, A.A., Methodfor detection of aromatic nitrocompounds and products of their reduction, Pat. 2159424, Russia, 2000.]
Страдынь, Я.П. Полярография органических нитросоединений. Рига.: Из-во АН Латв. ССР, 1961. 163 с. [Stradyn, Ya.P., Polarography oforganic nitrocompounds, Riga: the AN publisher Latvian SSR, 1961, 163 p.]
Конарев, А.А. Исследование промежуточных продуктов, образующихся в условиях препаративного электровосстановления 1-нитро-3,6,8-трисульфокислоты нафталина. Электрохимия. 2012. Т. 48. С. 1. [Konarev, A.A., Studies of Intermediate Forms under the Conditions of Preparative Electroreduction of Naphthalene 1-Nitro-3,6,8-Trisulfo Acid, Russ. J. Electrochem., 2012, vol. 48, p. 922.]
Кварацхелия, Р.К., Кварацхелия, Е.Р. Об особенностях электрохимического поведения соединений I(5+) и I(7+) в растворах солей аммония. Электрохимия. 1996. Т. 32. С. 868. [Kvaratskheliya, R.K. and Kvaratskheliya, E.R., On peculiarities of electrochemical behavior of I(5+) and I(7+) compoundsin ammoniumsalt solutions, Russ. J. Electrochem., 1996, vol. 32, p. 868.]
Fierz, H.E. and Weissenbuch, P., Uber die Reduktion von Nitronaphtalinssulfosauren, Helv. Chim. Acta, 1920, Bd 3, S. 305.
Майрановский, С.Г. Двойной слой и его эффекты в полярографии. М.: Наука, 1971. 87 с. [Mayranovsky, S.G., Double layer and its effects in polarography (in Russian), Moscow: Nauka, 1971. 87 p.]
Майрановский, С.Г., Страдынь, Я.П., Безуглый, В.Д. Полярография в органической химии, Л.: Химия. 1975. 351с. [Mayranovsky, S.G., Stradyn, Ya.P., Bezugliy, V.D. Polarography in organic chemistry (in Russian), Leningrad: Chemistry, 1975, 351 p.]
Дополнительные материалы отсутствуют.




