Электрохимия, 2021, T. 57, № 2, стр. 75-87
Ионная подвижность и проводимость в соединении (NH4)6LiHf2Zr2F23
В. Я. Кавун a, *, Т. Ф. Антохина a, Н. Н. Савченко a, М. М. Полянцев a, А. Б. Подгорбунский a
a Институт химии ДВО РАН
Владивосток, Россия
* E-mail: kavun@ich.dvo.ru
Поступила в редакцию 23.10.2019
После доработки 03.06.2020
Принята к публикации 11.06.2020
Аннотация
Методами ЯМР 1H, 19F и импедансной спектроскопии исследованы ионная подвижность и проводимость в соединении (NH4)6LiHf2Zr2F23. Определены виды ионных движений во фторидной и аммонийной подрешетках соединения в диапазоне температур 150–450 K. В результате фазового перехода типа порядок–беспорядок выше 400 K образуется метастабильная высокотемпературная β‑модификация с диффузией ионов в обеих подрешетках соединения. Удельная проводимость в соединении при 450 K равна 4.5 × 10–3 См/см.
ВВЕДЕНИЕ
Исследования физико-химических свойств новых соединений во фторидных системах с целью получения на их основе новых функциональных материалов, включая материалы с высокой ионной подвижностью, представляют несомненный интерес [1, 2]. Обладая достаточно высокой электропроводностью, такие материалы имеют хорошую перспективу практической реализации при разработке твердых электролитов (ТЭЛ), твердотельных электрохимических устройств и др. К таким соединениям относятся ионные фториды, которые образуют большой класс соединений с аномально высокой анионной проводимостью и являются удобными модельными объектами для изучения механизмов диффузии и ионного транспорта [2, 3]. Переход от жидких и полимерных систем к твердым электролитам позволяет кардинально повысить прочность материала, расширить диапазон рабочих температур и обеспечить униполярный характер проводимости. Большое число работ по изучению проводимости во фторидных системах пришлось на конец 70-х начало 90-х гг. прошлого века, когда были установлены основные факторы, определяющие характер ионной проводимости в кристаллических и аморфных фторидах [4]. Результаты таких исследований и возможные применения твердых электролитов рассмотрены, например, в монографии [1, 2] и обзорах [5–8].
Академический интерес к процессам диффузии в ионных кристаллах, которая в значительной степени может влиять на фундаментальные свойства материалов, связан с проблемой суперионных проводников. Важность исследований характера ионных движений определяется возможностью прямого разделения эффектов ротационной (вращательной) диффузии, не связанной с переносом заряда, и трансляционной диффузии ионов, ответственной за возникновение и величину ионной проводимости в соединениях и твердых растворах (ТР), образующихся во фторидных системах.
Определенный интерес в плане поиска соединений с высокой ионной подвижностью представляют фториды, содержащие ионы аммония, и, в частности, фторидоцирконаты (гафнаты), поскольку в ионном транспорте, согласно данным [3, 9–14], могут принимать участие как ионы фтора, так и ионы аммония, что, несомненно, должно отразиться на электрофизических свойствах соединения или ТР. В частности, впервые было установлено [3, 10], что гексафторидоцирконат аммония является суперионным проводником, в котором трансляционная диффузия ионов фтора и аммония обеспечивает высокую проводимость, равную 2.0 × 10–2 См/см при 420 K. Это заключение было позже подтверждено данными релаксационных измерений, согласно которым суперионная проводимость в этом соединении действительно обусловлена трансляционной диффузией ионов фтора и аммония [11]. Следовательно, вполне оправданной задачей является поиск в системах, содержащих фториды циркония (гафния) с внешнесферными катионами аммония, новых фторидокомплексов Zr (Hf), высокая ионная проводимость в которых обусловлена трансляционной диффузией в анионной и/или катионной подрешетках. В отличие от фторидных соединений (твердых растворов), в большинстве которых ионный транспорт осуществляется преимущественно ионами фтора, установление механизма проводимости при наличии конкурирующих ионов разной природы в составе соединения представляет определенный интерес.
Кристаллохимия фторидокомплексов циркония (гафния) характеризуется высокими значениями координационных чисел центрального атома (6, 7 и 8), большим разнообразием форм координационных полиэдров, способов их соединения, структурных мотивов и т.п. [3, 15]. Достаточно широко в этом семействе представлены комплексные фториды с общей формулой M2AF6 (A = Zr4+, Hf4+; M – катионы щелочных металлов, аммония и таллия(I)), которые являются хорошими модельными объектами для решения многих задач неорганической химии и физики твердого тела.
Известно [3], что в результате замещения одного из внешнесферных катионов M+ в гексафторидокомплексах M2AF6 (A – элемент IV группы) с высокой ионной подвижностью на катион другой природы M' могут образоваться соединения с более низкой энергией активации ионных движений. Регулируя состав и количество замещающих катионов можно получить набор соединений с разной ионной подвижностью и, как следствие, разной проводимостью. При этом оказалось, что при замещении в анион-катионном суперионнике (NH4)2Zr(Hf)F6 одного из ионов аммония другим одновалентным катионом M+ состав и строение нового соединения зависит от природы катиона M+ [3]. Так, при замене в этих фторидокомплексах иона $NH_{4}^{ + }$ ионом Tl+ синтезированы суперионные соединения NH4TlZr(Hf)F6 [3], но если замещающим ионом выступал ион лития (натрия), то вместо ожидаемых соединений NH4LiZr(Hf)F6 были получены более сложные по составу фторидокомплексы (NH4)6LiZr(Hf)4F23 с суперионной проводимостью [16]. В дальнейшем с целью выяснения влияния состава внешнесферных катионов и природы комплексообразователей на электрофизические свойства был получен ряд комплексов циркония (гафния) с общей формулой (NH4)6M${\text{A}}_{x}^{'}$A4 –xF23 (M = Li–Cs; A, A′ = Zr, Hf; x = = 0–4) [16–19]. В гексафторидокомплексах циркония со смешанными гетероатомными катионами M2 –x(NH4)xZrF6 (M = K, Rb, x > 1.5) высокая проводимость (>10–4…10–3 См/cм) обусловлена диффузией ионов фтора и аммония [20, 21]. При замещении Zr4+ на Hf4+ полученные фторидокомплексы можно рассматривать как нестехиометрические фазы по центральному иону или как твердые растворы замещения [2, 18]. При этом эти фазы, как и “материнские” соединения, как правило, являются хорошими суперионниками [22]. В заключение следует отметить, что ограниченность данного обзора связана с отсутствием в литературе работ (кроме наших) по исследованию комплексов Zr (Hf) со смешанными катионами, но имеются сведения о характере ионной подвижности в “родоначальнике” этого семейства соединений (NH4)2ZrF6 [11, 23].
Цель работы заключалась в установлении особенностей ионной подвижности, фазовых переходов и проводимости в соединении (NH4)6LiHf2Zr2F23, которое, в принципе, можно считать твердым раствором, поскольку предполагается, что его строение и строение фторидокомплексов (NH4)6LiHf4 –xZrxF23 (x = 0, 1, 3, 4) одинаковое [16–19]. В новой редакции приведены основные результаты уточненной интерпретации данных ЯМР, на основании которых ранее была изучена ионная подвижность в (NH4)6LiHf2Zr2F23 [19], рассмотрены и предложены механизмы ее появления. Впервые представлены результаты исследований электрофизических свойств (NH4)6LiHf2Zr2F23 и проведено сравнение характера ионной подвижности и проводимости в твердых растворах (NH4)6LiHf3 –xZrxF23 (x = 1–3) и “материнских” соединениях (NH4)6LiZr4F23 и (NH4)6LiHf4F23 при вариациях температуры. Данные об особенностях характера ионной подвижности и проводимости в исследованных фторидокомплексах (NH4)6$MA_{x}^{'}{{A}_{{4 - x}}}$F23 (M = Li–Cs, A, A' = Zr, Hf; x = 0–4) в зависимости от состава, природы и концентрации внешнесферных катионов и комплексообразователей планируется представить в отдельном обзоре.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Соединение (NH4)6LiHf2Zr2F23 получено путем добавления фторидов аммония и лития к оксидам циркония и гафния, предварительно растворенных в 40%-ной фтористоводородной кислоте, при мольном отношении NH4F : LiF : ZrO2 : : HfO2, равном 6 : 1 : 2 : 2. Подробности синтеза и методик, используемых для определения индивидуальности и однофазности исследуемого (NH4)6LiHf2Zr2F23 (I) и модельных соединений (NH4)6LiZr4F23 (II), (NH4)6LiHf4F23 (III), а также результаты ДСК и РФА описаны ранее в работах [16, 19]. Поскольку структура соединений, полученных при замене в соединении (NH4)6LiZr4F23 части ионов Zr ионами Hf, сохраняется [19], то можно считать, что при таком замещении образуется непрерывный ряд твердых растворов.
Спектры ЯМР 19F, 1H записывали на спектрометре Bruker AV-300 на частотах 282.404 и 300.13 МГц, соответственно, в диапазоне температур 150–450 К. Расчет среднеквадратичной ширины (или вторых моментов S2) спектров ЯМР (в Гс2) проводили по специальной программе с использованием формул, приведенных в [24]. Ширину линии на половине высоты ΔH1/2 (в кГц) и химические сдвиги (ХС, δ) компонент спектров ЯМР 19F, 1H измеряли с точностью до 2%. Химические сдвиги сигналов ЯМР 19F и 1Н (м. д.) измеряли относительно эталонов C6F6 и тетраметилсилана (ТМС). Энергию активации локальных движений (диффузии) определяли, используя выражение Уо–Федина [25]: Ea = 0.0016 × Tc (эВ), где Tc – температура (в градусах K), при которой начинается сужение линии ЯМР или появляется “узкая” компонента, отвечающая локальным движениям ионов.
Разложение спектров ЯМР на индивидуальные компоненты с дальнейшим их отнесением к определенным группам ионов проводилось по программе, которая позволяет определять площади компонент в % от общей площади спектра, их химические сдвиги, формы линии – Гаусс, Лоренц и др. Ошибка при разложении спектров ЯМР 1H на компоненты не превышала 5%, а спектров ЯМР 19F доходила до 20%, поскольку не учитывался вклад анизотропии ХС в форму спектров ЯМР 19F для “жесткой” решетки.
Для корректной интерпретации данных ЯМР 19F необходимо отметить следующее. Асимметричная форма и ширина статических спектров ЯМР 19F комплексных фторидов с некубической структурой в отсутствие ионных движений с частотами выше 104 Гц определяются диполь-дипольными взаимодействиями, анизотропией хим. сдвига и неэквивалентностью структурных позиций атомов фтора в решетке [3, 24, 25]. Появление ионных движений (например, реориентаций фторидных группировок) приводит к уменьшению или к практически полному усреднению (при диффузии) вкладов анизотропии хим. сдвига и диполь-дипольных взаимодействий в ширину и форму спектра, что приводит к корректному разложению спектров ЯМР.
Электрофизические характеристики образца, спрессованного в таблетку диаметром 13 мм с относительной плотностью 53.3 г/см3, определяли с использованием высокоточного комплекса, включающего анализатор частотного отклика Impedance/Gain-Phase Analyzer SI 1260 и Solartron Dielectric Interface 1296. В качестве электродов была использована серебряная токопроводящая паста. Частотный диапазон измерений 1 Гц–1 МГц, амплитуда возбуждающего сигнала 0.5 В. При температурах, близких к комнатной, объемное сопротивление рассчитывалось в частотном диапазоне Гц–десятки кГц, а при более высоких (453 K) оно определялось в диапазоне долей МГц и по пересечению импедансного спектра с осью абсцисс в комплексной плоскости Z" = f(Z').
Для вычисления энергий активации переноса заряда удельная проводимость была линеаризована в координатах lg(σT) = f(T–1). В процессе расчета объемного сопротивления RC-цепочек моделирование импедансных спектров проводилось при повторном термоциклировании образцов с ошибкой менее 1%, что подтверждает выводы о высокой гомогенности и однофазности (NH4)6LiHf2Zr2F23, сделанные ранее в [19].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
1. Анализ данных ЯМР
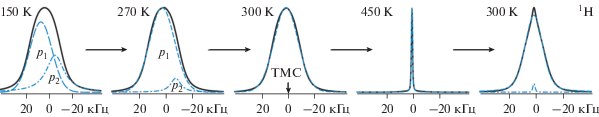
Анализ формы и ширины спектров ЯМР 1H (NH4)6LiHf2Zr2F23 (рис. 1, 2) с учетом значений S2(H) для различных моделей движения тетраэдрических ионов [3] показал, что при наличии в соединении, как и в “материнской” структуре (NH4)6LiZr4F23, двух сортов ионов аммония с разными H-связями [26] с большой долей вероятности ниже 250 K в решетке могут наблюдаться как анизотропные, так и изотропные реориентации ионов ${\text{NH}}_{{\text{4}}}^{ + }.$ Наименьшая ошибка (≈3%) достигается при разложении спектров ЯМР 1H ниже 200 K на две компоненты p1 и p2 (рис. 3). Теоретические оценки второго момента для ионов аммония при изотропных реориентациях (вокруг случайных осей симметрии) и анизотропных вокруг оси C3 (2C2) равны ~6–8 и 30–32 Гс2 [3, 27, 28]. Следовательно, экспериментальное значение S2 (~12 Гс2, 150 K) можно согласовать с расчетными, допустив наличие в аммонийной подрешетке как ионов ${\text{NH}}_{4}^{ + }$ с изотропной, так и с анизотропной реориентациями, число которых определяется из площадей компонент p1 и p2. Полученное отношение площадей этих компонент в спектре ЯМР при 150 K (65 : 35) в пределах ошибки оказалось сопоставимо с отношением числа неэквивалентных ионов аммония в структуре (NH4)6LiZr4F23 (2 : 1), образующих “разные” H-связи N–H…F [26]. В области 150 → 300 K площадь пика p2 уменьшается до нуля (рис. 3), а величины S2 до значения (6 ± 0.3 Гс2), характерного для изотропных реориентаций ионов аммония. Небольшое сужение спектров ЯМР 1H в области 150–300 K (рис. 2) вызвано локальной подвижностью ионов фтора выше 150 K, что приводит к уменьшению диполь-дипольных взаимодействий H–F – основного источника уширения спектров ЯМР диамагнитных твердых тел [24, 25].
Рис. 1.
Спектры ЯМР 1H исходной (a) и метастабильной (б) фазы соединения (NH4)6LiHf2Zr2F23 при вариациях температуры.
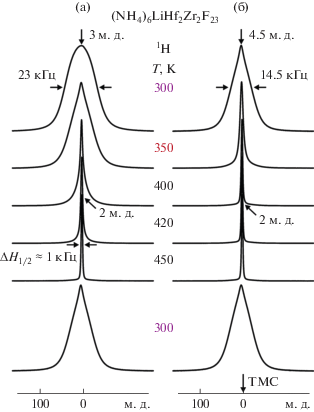
Рис. 2.
Температурные зависимости полуширины спектров ЯМР 1Н (1, 2) и 19F (3) соединения (NH4)6LiHf2Zr2F23. Вставка – спектр ЯМР 19F при 450 K (первый нагрев).
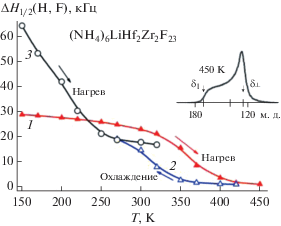
С повышением температуры (300 → 450 K) трансформация спектра ЯМР 1H образца (NH4)6LiHf2Zr2F23 связана с общим его сужением (рис. 1, 2) и регистрацией при 350 K узкой компоненты с шириной ~4 кГц, появление которой связано с развитием диффузии в аммонийной подрешетке (Ea ≈ 0.54 эВ). Отношение интегральных интенсивностей этих компонент, равное ≈9 : 91 при 350 K, растет с повышением температуры, и выше 430 K оно составляет 100 : 0 (S2 ≈ 0.05 Гс2, T = 450 K). При 450 K спектр ЯМР 1H состоит из симметричной лоренцевой линии с шириной ≈1 кГц (рис. 1–3) и вторым моментом меньше 0.05 Гс2, что свидетельствует о доминирующей роли диффузии ионов ${\text{NH}}_{{\text{4}}}^{ + }$ в соединении выше 430 K. Аналогичные виды ионных движений в аммонийной подрешетке наблюдаются во фторидокомлексах циркония и гафния (NH4)6MZr(Hf)4F23 (M = Li–Cs) [16–19], (NH4)3ZrF7 [13], ниобия [29], сурьмы(III) [30–32] и др. [14, 27]. Среди альтернативных вариантов наиболее вероятным механизмом диффузии ионов ${\text{NH}}_{{\text{4}}}^{ + }$ является вакансионный, связанный с прыжками катионов, расположенных в межслоевом пространстве (“каналах”) [26], по образующимся в процессе нагревания образца “собственным” аммонийным вакансиям [3, 24, 25].
Следует отметить, что похожие динамические процессы наблюдались при исследовании ионных движений в [C(NH2)3]2ZrF6 [33]. Второй момент спектров ЯМР 1H практически постоянен в области температур 140–280 K, и небольшое уменьшение (2 Гс2) при 180 K связано с появлением реориентаций NH2-групп. Резкое уменьшение величины S2(H) спектров ЯМР выше 290 K (21 → → 4 Гс2) вызвано поэтапным переходом двух структурно независимых катионов гуанидиния от “жесткой решетки” к реориентациям вокруг осей C3, что следовало из сравнения экспериментальных и расчетных значений вторых моментов для различных моделей реориентаций этих катионов.
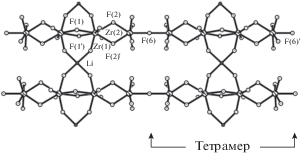
Прежде чем проводить анализ данных ЯМР 19F, целесообразно напомнить строение твердого раствора (NH4)6LiHf2Zr2F23, которое предположительно аналогично строению “материнских” соединений II и III, что следует из идентичности рентгенограмм комплексов I–III [19]. Кроме того, учитывая одинаковый характер динамических процессов в обеих подрешетках этих комплексов при вариациях температуры, разумно предположить, что замена двух атомов циркония на атомы гафния в ромбической структуре (NH4)6LiZr4F23 не окажет заметного влияния на строение (NH4)6LiHf2Zr2F23. Структура (NH4)6LiZr4F23 построена из обособленных бесконечных цепей $[{\text{Z}}{{{\text{r}}}_{{\text{4}}}}{{{\text{F}}}_{{{\text{23}}}}}]_{\infty }^{{7 - }}$ и катионов ${\text{NH}}_{{\text{4}}}^{ + }$ и Li+, расположенных в “каналах” между цепями, образуя мостики F–Li–F и F–NH4–F (рис. 4) [34]. Катионы аммония водородными связями N–H…F завершают объединение структуры в трехмерный каркас. В бесконечных цепях можно выделить тетраядерные фрагменты –[ZrF7–ZrF8–ZrF8–ZrF7]–, внутри которых Zr-полиэдры связаны друг с другом только по общим ребрам, а между собой “тетрамеры” объединены мостиковыми вершинами F(6), F(6)'. Учитывая состав и структуру “тетрамера”, спектр ЯМР 19F этого комплекса для “жесткой решетки” теоретически можно разложить на компоненты, отвечающие концевым атомам фтора в двух полиэдрах, мостиковым атомам F(6) и F(6)' и “реберным” атомам фтора F(2)…F(2)' и F(1)…F(1)'.
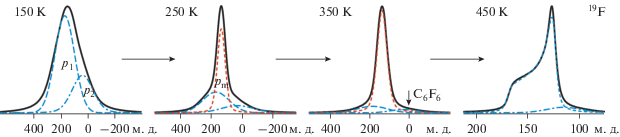
Отсутствие плато на температурной зависимости полуширины спектров ЯМР 19F (NH4)6LiHf2Zr2F23 и ее вид в области температур 150–250 K (рис. 2) свидетельствуют о наличии ионной подвижности во фторидной подрешетке с частотами выше 104 Гц, что наряду с анизотропией хим. сдвига затрудняет проведение корректного разложения спектров ЯМР. Ошибка при разложении спектров ЯМР 19F (NH4)6LiHf2Zr2F23 на компоненты, принадлежащие ориентировочно концевым, “реберным” и мостиковым атомам фтора (рис. 4), доходит до 20% при 150 K. С меньшей ошибкой (до 12%) спектр можно представить двумя компонентами p1 и p2 с отношением интенсивностей 69 : 31 = 2.22 и с хим. сдвигами ~182 и 39 м. д., допустив, что одна из них принадлежит концевым, а другая остальным атомам фтора в “тетрамере” (16 + 7 = 23, 16/7 = 2.22), рис. 4, 5. При этом это разложение спектра ЯМР на компоненты все же условное, поскольку не учитывается влияние анизотропии хим. сдвига на форму спектра.
При повышении температуры от 150 до 350 K происходит сужение спектра ЯМР 19F, изменение его формы, связанное с появлением выше 200 K новой компоненты pm с ХС = 136 ± 5 м. д. (рис. 2, 5), и уменьшение величины S2 (~86 → 15 Гс2). Наблюдаемая трансформация спектров ЯМР 19F связана с активацией локальных движений во фторидной подсистеме (Еа ≈ 0.30 эВ), в результате чего происходит частичное усреднение как анизотропии ХС, так и диполь-дипольных взаимодействий магнитных ядер F–F и F–H, приводящее к сужению спектра, что значительно уменьшает ошибку при разложении спектров выше 200 K (от 3.5–2%). Интенсивность компоненты pm растет до ≈85%, а компонент p1 и p2 падает при увеличении температуры 150 → 350 K, но при этом отношение площадей компонент p1/p2 остается практически неизменным, равным 2.35 ± 0.15. Эти результаты в данном случае косвенно оправдывают выбор предложения представить спектры ЯМР 19F двумя компонентами. Заслуживает внимания тот факт, что положение компоненты pm в спектре ЯМР практически соответствует (с учетом ошибки определения ХС компонент в спектрах ЯМР ниже 250 K) положению центра тяжести низкотемпературного двухкомпонентного спектра ❬δ❭ = = 1/23(16 × 182 + 7 × 39) = 138.5 м. д. Это означает, что выше 150 K наблюдаемый внутримолекулярный обмен между различными ионами фтора из ближнего окружения атомов комплексообразователей приводит к динамическому разупорядочению фторидной подрешетки [24, 29], в результате которого происходит “усреднение” расстояний Zr(Hf)–F, что отражается на форме спектров ЯМР (рис. 4). Тем не менее наличием такого обмена нельзя объяснить происходящую выше 350 K трансформацию относительно симметричного спектра в “односкатную палатку” (рис. 2, 5).
Для установления причины происходящих изменений в спектрах ЯМР 19F можно предложить механизм, рассмотренный ранее для объяснения трансформации спектров ЯМР 19F цепочечных фторидоцирконатов с катионами аммония и таллия [10, 16–19, 35]. Учитывая близость структур соединений (NH4)6LiHf2Zr2F23, (NH4)6LiZr(Hf)4F23 и особенности динамики ионных движений в комплексах M2Zr(Hf)F6 (M = NH4, Tl(I)) и (NH4)6MZr(Hf)4F23 (M = Li–Cs) можно предположить, что в результате анизотропных реориентаций тетрамеров (–[MF7–MF8–MF8–MF7]–, M = = Zr, Hf) вокруг мостиковых атомов F(6) и F(6)' в области температур 200–300 K происходит их “ориентационное” разупорядочение, которое характерно для фторидов циркония и гафния с цепочечной структурой фторидной подрешетки [10, 16–19, 33–36]). Кроме того, при определении структуры (NH4)6LiZr4F23 установлено наличие высоких тепловых колебаний атомов фтора с преимущественной ориентацией эллипсоидов тепловых колебаний в направлениях, перпендикулярных направлению распространения циркониевых цепей, что может служить независимым подтверждением предложенной модели анизотропных реориентаций фторидных группировок [34]. Процесс перехода этих фрагментов к реориентациям в основном заканчивается к 360 K, о чем свидетельствуют форма спектра ЯМР (практически симметричная линия) и уменьшение величины S2 спектров ЯМР 19F до ∼10 Гс2. Таким образом, в области температур 200–350 K наряду с обменом между лигандами во фторидной подрешетке соединения происходит переход исходной цепочечной структуры (NH4)6LiHf2Zr2F23 в разупорядоченное состояние. При этом можно ожидать, что в результате ориентационного разупорядочения ионов NH4 во фторидокомплексах циркония (гафния) будет подавляться влияние водородных связей N–H⋅⋅⋅F, стабилизирующих цепочечную структуру низкотемпературной фазы [36].
Можно отметить, что подобный процесс происходит в [C(NH2)3]2ZrF6, в результате которого переход катионов к реориентациям приводит к ослаблению (разрыву) связей H–F, препятствующих возникновению подвижности димерных анионов [33]. Согласно расчетам второго момента для возможных моделей ионных движений наблюдаемое уменьшение величины S2(F) выше 300 К связано с появлением изотропных реориентаций анионов, в результате которых не исключен переход к самодиффузии ионов фтора, что, по мнению [33], имеет место в K2ZrF6 с изогнутой цепочечной структурой аниона.
Выше 360 K симметричный спектр ЯМР 19F трансформируется в линию с аксиальной анизотропией тензора хим. сдвига (“односкатную палатку” – рис. 2, 5) [10, 25]. Если допустить, учитывая величину S2(F) спектров ЯМР 19F выше 420 K (1.8 ± 0.3 Гс2) и данные по проводимости, что основным видом ионных движений выше 420 K становится диффузия ионов фтора, то в этом случае регистрация сигнала такой формы означает, что усреднения тензора магнитного экранирования на ядрах фтора не происходит. Это возможно в том случае, когда атом (ион) мигрирует по одним и тем же позициям в решетке. Подобный спектр наблюдается, например, во фторидах (NH4)2Zr(Hf)F6 [3, 10], (NH4)6MZr(Hf)4F23 [16–19], Tl2ZrF6 [36] и других соединениях и ТР [37, 38].
Учитывая одинаковое строение фторидокомплексов (NH4)6LiHf4 –xZrxF23 (x = 0–4), логично предположить, что механизм появления диффузии ионов фтора в ТР I аналогичен предложенному ранее для соединений (NH4)2ZrF6 и (NH4)6LiZr4F23 на основании данных ЯМР и РСА [10, 13, 34]. Суть этого механизма состоит в том, что в результате повышения температуры происходит разрыв связей N–H…F и Li–F (из-за реориентаций и диффузии NH4-групп и, возможно, ионов Li), что приводит к понижению жесткости структурных фрагментов $[{\text{H}}{{{\text{f}}}_{{\text{2}}}}{\text{Z}}{{{\text{r}}}_{{\text{2}}}}{{{\text{F}}}_{{{\text{23}}}}}]_{\infty }^{{7 - }}$ и появлению ”проворотов” полиэдров данной группировки относительно друг друга. При этом наряду с конформационными переходами различного рода в полиэдрах возможна прыжковая диффузия ионов F– как по цепи, так и между соседними цепями. В последнем случае ионам фтора, вероятно, принадлежит в спектре ЯМР при 450 K лоренцевая компонента (менее 4%) с шириной ≈2.5 кГц (рис. 5).
Согласно данным ДСК [19], в (NH4)6LiHf2Zr2F23 наблюдается не воспроизводимый при охлаждении (463 → 300 K) и повторном нагреве (300 → → 450 K) эндоэффект с максимумом при 450 K, который отвечает фазовому переходу. Анализ данных ЯМР позволяет предположить, что интенсивные динамические процессы в обеих подрешетках (NH4)6LiHf2Zr2F23 в диапазоне 350–450 K предшествуют ФП типа порядок–беспорядок с образованием метастабильной разупорядоченной β-фазы. Дифрактограммы образцов после цикла нагрев–охлаждение–нагрев (300 → 460 → → 300 → 400 K) почти идентичны, но отличаются от исходного (NH4)6LiZr2Hf2F23. Высокая ионная подвижность в β-фазе сохраняется при ее охлаждении (450 → 300 K), о чем свидетельствует наблюдаемый гистерезис параметров спектров ЯМР (рис. 1–3). В отсутствие процессов разложения вещества [19] данные ЯМР позволяют предположить, что β-фаза представляет собой “замороженную” высокотемпературную фазу, которая остается стабильной некоторое время после охлаждения. Для β-фазы характерно наличие тех же динамических процессов, но их развитие в процессе нагревания (300 → 430 K) происходит при более низких температурах, чем в α-(NH4)6LiHf2Zr2F23. В частности, диффузия ионов ${\text{NH}}_{{\text{4}}}^{ + }$ в α- и β-фазах начинается выше 340 и 290 K, соответственно, и при 370 K все ионы в β-фазе участвуют в диффузии, тогда как в исходном образце их число не превышает 12%.
Образование β-фазы подтверждается и данными ДСК, согласно которым отсутствие эндоэффекта при 450 K в этой фазе “компенсируется” обратимым эндоэффектом при 404 K, более слабым по интенсивности, чем в исходном образце [19]. При этом трансформация спектров ЯМР при многократных циклах нагрев–охлаждение β-фазы 300 → 440 → 300 K остается неизменной и свидетельствует о завершении динамических процессов в обеих подрешетках до 400 K. Время, в течение которого существует β-фаза, определяется длительностью выдержки исходного образца выше температуры ФП. О переходе метастабильной β-фазы в исходную α-модификацию свидетельствуют данные анализа параметров спектров ЯМР обеих фаз и “возвращение” эндоэффекта к 450 K. Похожий процесс наблюдается в [C(NH2)3]2ZrF6 [33]. Регистрация эндоэффекта при 400 K с явным тепловым гистерезисом была связана с фазовым переходом I рода, которому предшествовали реориентации ионов в обеих подрешетках, что отразилось в отсутствии влияния ФП на второй момент спектров ЯМР. В результате полиморфного превращения образуется новая фаза с аномалией на кривой ДТА при 360 K [33].
Анализ характера ионной подвижности в образцах I, II и III показывает, что наиболее низкая температура перехода к диффузии ионов ${\text{NH}}_{{\text{4}}}^{ + }$ (≈340 K) наблюдается в (NH4)6LiHf4F23 [16], тогда как для первых двух образцов этот переход происходит выше 340 и 390 K соответственно. Замещение одного из 4-х ионов гафния ионом циркония в соединении (NH4)6LiHf4F23 приводит к увеличению температуры этого перехода с 340 до 370 K [17]. Следовательно, присутствие в составе соединения ионов гафния благоприятно сказывается на характере динамических процессов в соединении.
2. Анализ данных электрофизических исследований
Исследование электрофизических свойств фторокомплекса (NH4)6LiHf2Zr2F23 позволяет сделать вывод о наличии термоиндуцированных изменений значений проводимости и энергий активации переноса зарядов (рис. 6; табл. 1).
Рис. 6.
Температурные зависимости ионной проводимости соединения (NH4)6LiZr2Hf2F23 и β-фазы (NH4)6LiZr2Hf2F23 при первом нагреве.
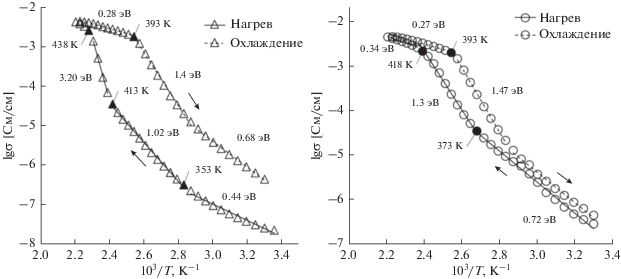
Таблица 1.
Характеристики ионной проводимости и температуры фазовых переходов твердых растворов (NH4)6LiHf2Zr2F23, (NH4)6LiHf3ZrF23, (NH4)6LiHfZr3F23 и соединений (NH4)6LiHf4F23 и (NH4)6LiZr4F23
| Соединение | Еа, эВ | T, K | σ, См/см при T, К | ФП, Т, К |
|---|---|---|---|---|
| (NH4)6LiHf2Zr2F23 нагрев 1 | 0.44 ± 0.02 | 298–348 | 3.0 × 10–8 (303) 1.5 × 10–6 (373) 1.8 × 10–4 (423) 4.5 × 10–3 (453) 3.1 × 10–7 (303) |
450 [19] |
| 1.02 ± 0.02 | 353–413 | |||
| 3.20 ± 0.10 | 418–433 | |||
| 0.28 ± 0.02 | 438–453 | |||
| (NH4)6LiHf2Zr2F23 охлаждение 1 | 0.28 ± 0.01 | 453–393 | ||
| 1.38 ± 0.03 | 393–348 | |||
| 0.68 ± 0.01 | 343–303 | |||
| (NH4)6LiHf2Zr2F23 нагрев 2 | 0.72 ± 0.02 | 303–368 | 2.6 × 10–7 (303) 3.5 × 10–5 (373) 2.6 × 10–3 (423) 4.6 × 10–3 (453) |
404 [19] |
| 1.34 ± 0.03 | 373–418 | |||
| 0.34 ± 0.01 | 423–453 | |||
| (NH4)6LiHf2Zr2F23 охлаждение 2 | 0.27 ± 0.01 | 448–393 | ||
| 1.47 ± 0.03 | 388–353 | |||
| 0.70 ± 0.02 | 348–303 | |||
| (NH4)6LiHf3ZrF23 (IV) нагрев 1 [17] | 1.43 ± 0.01 | 370–410 | 3.2 × 10–3 (423) | 442 |
| 0.20 ± 0.02 | 420–453 | 6.6 × 10–3 (453) | ||
| (NH4)6LiHfZr3F23 (V) нагрев 1 [17] | 1.36 ± 0.01 | 390–415 | 4.3 × 10–3 (423) | 448 |
| 0.39 ± 0.02 | 420–453 | 9.1 × 10–3 (453) | ||
| (NH4)6LiZr4F23 нагрев 1 [16] | 0.87 ± 0.02 | 300–380 | 4.0 × 10–8 (300) | 415 |
| 0.33 ± 0.02 | 380–420 | 4.0 × 10–3 (420) | ||
| (NH4)6LiHf4F23 нагрев 1 [16] | – | 400–420 | 3.8 × 10–3 (420) | 390 |
Как показывает аррениусовская зависимость, построенная в координатах lg σ = f(T–1) для температурного диапазона 298–453 K, характер изменений проводимости в ходе первого нагрева несколько отличается от данных ДСК. Наблюдаемый тепловой эффект на кривой ДСК с максимумом при 450 K связан с фазовым переходом [19], тогда как температура излома на аррениусовской зависимости, при которой соединение (NH4)6LiHf2Zr2F23 переходит в высокопроводящую фазу, оценена в 435 ± 2 K.
Резкое увеличение проводимости (более чем 0.5 См на градус нагрева) происходит при более низких температурах: оно начинается при достижении температуры ≈355 K и наблюдается до 413 K (рис. 6), что хорошо коррелирует с данными ЯМР. Именно в этой области температур происходит разупорядочение аммонийной подрешетки, связанное с переходом ионов ${\text{NH}}_{{\text{4}}}^{ + }$ от изотропных реориентаций к диффузии. В диапазоне температур 413–438 K электропроводность образца растет еще быстрее со скоростью 0.73 См/град (рис. 6). Выше 438 K дальнейший рост проводимости σ носит плавный характер, а энергия активации снижается до 0.28 эВ (табл. 1). Анализ зависимостей lg σ = f(T) показывает, что высокопроводящая фаза (β-фаза) стабилизируется при охлаждении от 453 до 393 K.
Последующее понижение температуры влечет за собой снижение электропроводности и увеличение Ea, повторяя ход кривой нагрева, при этом формируя гистерезис (рис. 6). В исходном образце (NH4)6LiHf2Zr2F23 проводимость при комнатной температуре довольно низкая: 3 × 10–8 См/см. После нагрева образца до 453 K, в результате которого образуется β-фаза, его проводимость увеличивается более чем на пять порядков (4.5 × 10–3 См/см), и после охлаждения соединения до 300 K она снижается до 2.6 × 10–7 См/см, что на порядок выше проводимости исходного образца при тех же условиях. Этот факт подтверждает “замораживание” высокотемпературной фазы при охлаждении образца (450 → 300 K), в которой сохраняется, согласно данным ЯМР, высокая ионная подвижность в обеих подрешетках, что и обеспечивает ее высокую проводимость на начальном этапе измерения σ после охлаждения по сравнению с исходной фазой.
Данные по проводимости (NH4)6LiHf2Zr2F23 после повторного цикла нагрев–охлаждение свидетельствуют о сохранении β-фазы со структурной разупорядоченностью, присущей высокотемпературной фазе и обеспечивающей высокую проводимость [39], что находится в хорошем соответствии с данными ЯМР. Об этом свидетельствует “облегченный” переход в суперионное состояние при 423 K (против 438 K у исходного образца при первом нагреве), а также суженный гистерезис аррениусовской кривой (рис. 6). После повторного цикла нагрев–охлаждение β-фаза (NH4)6LiHf2Zr2F23 характеризуется практически такими же значениями проводимости, что и после первого нагрева:– 4.6 × 10–3 и 2.6 × 10–7 См/см при 453 и 300 K соответственно (табл. 1). При переходе β-фазы по истечении некоторого времени к исходной модификации проводимость становится соизмеримой с проводимостью исходного соединения.
Сравнивая значения ионной проводимости при 453 K для (NH4)6LiHf4 –xZrxF23 (x = 1–3), можно заметить, что более высокая проводимость при первом нагреве наблюдается в образцах, содержащих нечетное количество ионов Zr (табл. 1). Если учесть, что их строение предположительно одинаковое, как и размеры ионов Zr и Hf, более высокую проводимость в ТР V (x = 3) по сравнению с твердыми растворами I и IV (x = 2 и 1) логично связать с количеством в составе образца ионов циркония, поляризуемость которых выше, чем у ионов гафния (2.02 и 1.89 Å3, соответственно [40]). Поскольку в составе ТР V три иона Zr, то при прочих равных условиях этот фактор превалирует, что и обеспечивает, согласно общепринятым критериям [2, 4, 6], более высокую проводимость в этом ТР. Однако этот вывод не объясняет более высокой проводимости в твердом растворе с x = 1 по сравнению с x = 2, что, вероятно, связано с наличием конкуренции между факторами, определяющими проводимость образца. В данном случае этими факторами могут быть температуры ФП (табл. 1), в результате которого образуется высокопроводящая фаза, соотношение между числом ионов циркония и гафния и др. В итоге, среди рассмотренных вариантов оказалось, что порядок наблюдаемых величин проводимости в зависимости от состава ТР сопоставим с их плотностью: 2.43 → 2.67 → 2.58 г/см3, рассчитанной по формуле ρ = M/V, где M – молекулярный вес, V – объем элементарной ячейки. Интуитивно ясно, что плотность твердого раствора связана с относительным свободным объемом, который определяет размер канала проводимости. Чем выше плотность твердого раствора, тем меньше свободный объем и ỳже размер канала проводимости [41], что приводит к понижению проводимости ТР за счет уменьшения числа мигрирующих ионов.
ЗАКЛЮЧЕНИЕ
1. Результаты ЯМР-исследований указывают на общий характер динамики ионов в анионной и катионной подрешетках (NH4)6LiZr(Hf)4F23 и (NH4)6LiHf2Zr2F23, который определяется числом ионов циркония и гафния в составе комплексов. Во фторидокомплексах с общей формулой (NH4)6LiHf4 –xZrxF23 (x = 1–3), которые условно можно считать твердыми растворами замещения, структура которых аналогична структуре “материнского” соединения (NH4)6LiZr4F23 [34], интенсивные динамические процессы в кристаллической решетке, связанные с ориентировочным разупорядочением в обеих подрешетках, предшествуют фазовым переходам, в результате которых образуются высокотемпературные метастабильные β-модификации с высокой ионной (супер-ионной) проводимостью за счет диффузионных движений ионов в обеих подрешетках. Время, в течение которого существует β-фаза с дальнейшим возвратом к исходной модификации, определяется длительностью выдержки исходного образца выше температуры ФП. Меньшая ширина спектров ЯМР 19F для твердых растворов с x = 1, 2, по-видимому, объясняется присутствием в составе ТР ионов гафния, у которых заполнена 4f14-оболочка. Уширение спектра при переходе от соединения (NH4)6LiHf4F23 к твердым растворам с x = 3–1 обусловлено появлением частично ковалентных взаимодействий в связях Zr–F–Zr с участием пустых 4f-орбиталей [36, 42]. Такие же взаимодействия Hf–F–Hf невозможны из-за того, что электронная конфигурация иона Hf4+–4f14 соответствует полностью заполненной 4f-оболочке. Форма спектров ЯМР 19F ТР I на конечном этапе трансформации резонансной линии, имеющая вид односкатной палатки, обусловлена трансляционной диффузией ионов фтора по низкосимметричным позициям и характерна для многих фторидов циркония и гафния с цепочечной структурой комплексного аниона. Необходимым условием перехода всей фторидной подсистемы к диффузии является полная разупорядоченность катионной подрешетки [43]. Данный вывод справедлив для цепочечных комплексов, для островных фторидоцирконатов (гафнатов) он может не соблюдаться. Примером этому является соединение с островной структурой (NH4)3ZrF7, в котором высокая проводимость обусловлена только трансляционной диффузией ионов аммония, а ионы фтора участия в переносе заряда не принимают [13].
2. Можно отметить, что суперионный проводник (NH4)6LiHf2Zr2F23 характеризуется низкой энергией активации переноса заряда, в пределах 0.27–0.31 эВ, а проводимость составляет 4.5 × × 10–3 См/см. Термоиндуцированный переход в суперионное состояние происходит при средних температурах (420 К), а сама высокопроводящая фаза существует в температурном диапазоне 450–400 К. Высокая проводимость наблюдается после ФП, и следовательно, фазовые переходы в (NH4)6LiHf4 –xZrxF23 (x = 0–4) с образованием разупорядоченных β-фаз связаны с достижением суперионного состояния.
Следует отметить, что в легкоплавких соединениях с разупорядоченной структурой одним из факторов, определяющих величину проводимости, является плотность вещества [1, 2, 41]. При рассмотрении условий, влияющих на проводимость, оказалось, что наблюдаемый порядок величин проводимости твердых растворов (NH4)6LiHf4 –xZrxF23 с x = 3, 2, 1 сопоставим с их плотностью. Поскольку плотность твердого раствора влияет на свободный объем вокруг “подвижного” иона, который определяет размер канала проводимости, то интуитивно ясно, что чем больше плотность образца, тем ỳже канал проводимости и, следовательно, тем меньше величина проводимости [41], что и наблюдается в нашем случае. Такая же зависимость наблюдается, например, в иттрий-циркониевых керамических образцах: с увеличением относительной плотности 98.2 → 99.7 (%) проводимость уменьшается 16 → 15.5 См/м [44]. Отметим, что при наличии нескольких факторов, определяющих величину проводимости вещества, предсказать какой из них играет основную роль не всегда удается, но то, что наличие каналов проводимости для миграции мобильных ионов в структуре, предпочтительно построенной как в нашем случае по типу трехмерного каркаса, является одним из основных критериев, формирующих величину проводимости, не вызывает сомнений [45].
Полученные результаты подтверждают сделанные ранее заключения о том, что цепочечное строение фторидной подрешетки в комплексах циркония и гафния, аналогичное строению (NH4)6LiHf4 –xZrxF23 (x = 0–4), является одним из необходимых условий возникновения высокой ионной (суперионной) проводимости у соединений данного класса, ионный транспорт в которых осуществляется миграцией ионов фтора и аммония. Данное предположение открывает возможности для целенаправленного поиска систем, обладающих высокой ионной проводимостью в рядах комплексных фторидов, содержащих внешнесферные одновалентные катионы разной природы.
Список литературы
Иванов-Шиц, А.К., Мурин, И.В. Ионика твердого тела: В 2 т. Том 1. СПб: Изд-во С.-Петерб. ун-та. 2000. 616 с. [Ivanov-Schits, A.K. and Murin, I.V., Solid State Ionics, vol. 1 (in Russian). St. Petersburg: St. Petersburg University Publ., 2000. 616 p.]
Иванов-Шиц, А.К., Мурин, И.В. Ионика твердого тела: В 2 т. Том 2. СПб: Изд-во С.-Петерб. ун-та. 2010. 1000 с. [Ivanov-Schits, A.K. and Murin, I.V., Solid State Ionics, vol. 2 (in Russian). St. Petersburg: St. Petersburg University Publ., 2010. 1000 p.]
Кавун, В.Я., Сергиенко, В.И. Диффузионная подвижность и ионный транспорт в кристаллических и аморфных фторидах элементов IV группы и сурьмы(III). Владивосток: Дальнаука, 2004. 298 с [Kavun, V.Ya. and Sergienko, V.I., Diffusive mobility and ionic transport in crystal and amorphous fluorides of IV groups elements and antimony(III) (in Russian). Vladivostok: Dal’nauka, 2004. 298 p.]
Réau, J.M., Portier, J., Levasseur, A., Villeneuve, G., and Pouchard, M., Characteristic properties of new solid electrolytes, Mat. Res. Bull., 1978, vol. 13, p. 1415.
Трновцова, В., Федоров, П.П., Фурар, И. Фторидные твердые электролиты. Электрохимия. 2009. Т. 45. С. 668. [Trnovcová, V., Fedorov, P.P., and Furar, I., Fluoride solid electrolytes, Russ. J. Electrochem., 2009, vol. 45, p. 630.]
Réau, J.M. and Hagenmuller, P., Fast ionic conductivity of fluorine anions with fluorite- or tysonite-type structures, Rev. Inorg. Chem., 1999, vol. 19, nos. 1–2, p. 45.
Patro, N. and Hariharan, K., Fast fluoride ion conducting materials in solid state ionics:an overview, Solid State Ionics, 2013, vol.239, p. 41.
Hull, S., Superionics: crystal structures and conduction processes, Rep. Prog. Phys., 2004, vol. 67, p. 1233.
Черкасов, Б.И., Москвич, Ю.Н., Суховской, А.А., Давидович, Р.Л. Исследование движений в новом семействе суперионных кристаллов M2ZrF6 и M2HfF6 методом ЯМР 19F. Физика твердого тела. 1988. Т. 30. С. 1652. [Cherkasov, B.I., Moskvich, Yu.N., Sukhovskoi, A.A., and Davidovich, R.L., F-19 NMR – study of internal motions in a new superionic family, M2ZrF6 and M2HfF6, Russ. J. Fiz. Tverd. Tela, 1988, vol. 30, p. 1652.]
Кавун, В.Я., Герасименко, А.В., Сергиенко, В.И. и др. О механизме возникновения суперионной проводимости во фторокомплексах циркония и гафния с катионами аммония, таллия(I) и щелочных металлов. Журн. приклад. химии. 2000. Т. 73. С. 966. [Kavun, V.Ya., Gerasimenko, A.V., Sergienko, V.I., et al. Original of superionic conduction in fluoro complexes of zirconium and hafnium with ammonium, thallium (I), and alkali metal cations, Russ. J. Appl. Chem., 2000. vol. 73, p. 1025.]
Mallikarjunaiah, K.J., Ramesh, K.P., and Damle, R., H-1 and F-19 NMR relaxation time studies in (NH4)2ZrF6 superionic conductor, Appl. Magn. Res., 2009, vol. 35, p. 449.
Avignant, D., Mansouri, I., Chevalier, R., and Cousseins, J.C., Crystal Structure and Fast Ionic Conduction of TIZrF5, J. Solid State Chem., 1981, vol. 38, p.121.
Kavun, V.Ya., Sergienko,V.I., Chernyshov, B.N., Didenko, N.A., Bakeeva, N.G., and Ignateva, L.N., Proton and fluorine-19 NMR study of the internal motion of atomic groups and superionic conductivity in ammonium hexafluorozirconate and -hafnate, Zh. Neorg. Khim. 1991, vol. 36(4), p. 1004.
Furukawa, Y., Sasaki A., and Nakamura, D., Electrical conductivity due to ammonium ion transport in (NH4)3[MF6] (M : Al, Ga, In) and (NH4)2K[AlF6] crystals, Solid State Ionics, 1990, vol. 42, p. 223.
Давидович, Р.Л. Стереохимия комплексных фторидов циркония и гафния, Коорд. химия. 1998. Т. 24. С. 803. [Davidovich, R.L., Stereochemistry of zirconium and hafnium fluoro complexes, Russ. J. Coord. Chem., 1998, vol. 24, p. 751.]
Кавун, В.Я., Сергиенко, В.И., Уваров, Н.Ф., Антохина, Т.Ф. Внутренняя подвижность, фазовые переходы и ионная проводимость в соединениях Na(NH4)6Zr4F23 и Li(NH4)6Zr4F23. Журн. структур. химии. 2002. Т. 43. С. 464. [Kavun, V.Ya., Sergienko, V.I., Uvarov, N.F., and Antokhina, T.F., Internal Mobility, Phase Transition, and Ionic Conduction in Na(NH4)6Zr4F23 and Li(NH4)6Zr4F23, Russ. J. Struct. Chem., 2002, vol. 43, p. 429.]
Kavun, V.Ya., Antokhina, T.F., Savchenko, N.N., Polyantsev, M.M., and Podgorbunskii, A.B., Ion mobility, phase transitions and conductivity in the fluorides (NH4)6LiZr3HfF23 and (NH4)6LiZrHf3F23, J. Solid State Chem., 2019, vol. 270, p. 524.
Кавун, В.Я., Антохина, Т.Ф., Савченко, Н.Н. и др. Термические и транспортные свойства, ионная подвижность и фазовые переходы в соединениях (NH4)6CsZr4F23 и (NH4)6CsHf4F23. Журн. неорган. химии. 2018. Т. 63. С. 83. [Kavun, V.Ya., Antokhina, T.F., Savchenko, N.N., et al., Thermal and Transport Properties, Ion Mobility, and Phase Transitions in Compounds (NH4)6CsZr4F23 and (NH4)6CsHf4F23, Russ. J. Inorg. Chem., 2018, vol. 63, p. 78.]
Кавун, В.Я., Антохина, Т.Ф., Савченко, Н.Н., Полянцев, М.М., Бровкина, О.В. Синтез, ионная подвижность и фазовый переход в соединении (NH4)6LiHf2Zr2F23. Журн. структур. химии. 2018. Т. 59. С. 1888. [Kavun, V.Ya., Antokhina, T.F., Savchenko, N.N., Polyantsev, M.M., and Brovkina, O.V., Synthesis, ion mobility, and phase transition in the (NH4)6LiHf2Zr2F23 compound, Russ. J. Struct. Chem., 2018, vol. 59, p. 1825.]
Kavun, V.Ya., Didenko, N.A., Gerasimenko, A.V., Slobodyuk, A.B., Tkachenko, I.A., Uvarov, N.F., and Sergienko, V.I., Synthesis and Complex Study of Potassium Ammonium Hexafluorozirconates: Ion Mobility, Phase Transitions, and Ionic Conductivity in K2 –n(NH4)nZrF6 Compounds as Probed by NMR, DTA, and Impedance Spectroscopy, Russ. J. Inorg. Chem., 2006, vol. 51, p. 513.
Gerasimenko, A.V., Kavun, V.Ya., Didenko, N.A., Slobodyuk, A.B., Uvarov, N.F., and Sergienko, V.I., Synthesis, Structure, Ion Mobility, Phase Transitions, and Ion Transport in Rubidium Ammonium Hexafluorozirconates, Russ. J. Inorg. Chem., 2007, vol. 52, p. 713.
Sobolev, B.P. and Sorokin, N.I., Nonstoichiometry in Inorganic Fluorides: 2. Ionic Conductivity of Nonstoichiometric M1 –xRxF2 +x and R1 –yMyF3 –y Crystals (M = Ca, Sr, Ba; R Are Rare Earth Elements), Crystallography Reports, 2014, vol. 59, p. 807.
Rakhmatullin, A., Boča, M., Mlynáriková, J., Hadzimová, E., Vasková, Z., Polovov, I.B., and Mičušík, M., Solid state NMR and XPS of ternary fluorido-zirconates of various coordination modes, J. Fluor. Chem., 2018, vol. 208, p. 24.
Габуда, С.П., Лундин, А.Г. Внутренняя подвижность в твердом теле. Новосибирск: Наука, 1986, 176 с. [Gabuda, S.P. and Lundin, A.G., Internal Mobility in Solids (in Russian), Novosibirsk: Nauka, 1986, 176 p.].
Лундин, А.Г., Федин, Э.И. ЯМР-спектроскопия. М.: Наука, 1986, 224 с. [Lundin, A.G. and Fedin, E.I., NMR Spectroscopy (in Russian), M.: Nauka, 1986, 224 p.]
Bukvetskii, B.V., Gerasimenko, A.V., and Davidovich, R.L., Crystalline-structure of NH4ZrF5∙0.75H2O and (NH4)2ZrF6 ammonium fluorozirconates, Koord. Khim., 1991, vol. 17, p. 35.
Watton, A., Reynhardt, E.C., and Petch, H.E., NMR investigation of ammonium ion motions in two ammonium bisulfates, J. Chem. Phys., 1976, vol. 65, p. 4370.
Sasaki, A., Furukava, Y., and Nakamura, D., Ber. Bunsenges, Phys. Chem., 1989, vol. 93, p. 1142.
Kavun, V.Ya., Gabuda, S.P., Kozlova, S.G., et al., Intramolecular mobility and phase transitions in ammonium oxofluoroniobates (NH4)2NbOF5 and (NH4)3NbOF6, a NMR and DFT study, J. Fluor. Chem., 2011, vol. 132, p. 698.
Кавун, В.Я., Уваров, Н.Ф., Земнухова, Л.А., Бровкина, О.В. Внутренняя подвижность, фазовые переходы и ионная проводимость во фтороантимонатах(III) аммония: NH4Sb4F13, NH4Sb3F10, NH4Sb2F7, (NH4)2Sb3F11, (NH4)3Sb4F15 и NH4SbF4.Журн. неорган. химии. 2004. Т. 49. С. 1012. [Kavun, V.Ya., Uvarov, N.F., Zemnukhova, L.A., and Brovkina, O.V., Internal mobility, phase transitions, and ionic conductivity in ammonium fluoroantimonates(III) NH4Sb4F13, NH4Sb3F10, NH4Sb2F7, (NH4)2Sb3F11 (NH4)3Sb4F15 and NH4SbF4, Russ. J. Inorg. Chem., 2004, vol. 49, p. 925.]
Кавун, В.Я., Уваров, Н.Ф., Слободюк, А.Б. и др. Суперионная проводимость в комплексных фторидах сурьмы(III) состава MnSbxFy (M – катионы щелочного металла, аммония и таллия; n = 1–3; x = 1–4). Электрохимия. 2005. Т. 41. С. 560. [Kavun, V.Ya., Uvarov, N.F., Slobodyuk, A.B., et al., Syperionic conduction in complex fluorides of antimony(III) MnSbxFy (M – cations of alkali metal, ammonium, or thallium, n = 1–3; x = 1–4), Russ. J. Electrochem., 2005, vol. 41, p. 488.]
Kavun, V.Ya., Polyantsev, M.M., Zemnukhova, L.A., et al., Ion mobility and phase transitions in heptafluorodiantimonates (III) Cs(1 – x)(NH4)xSb2F7 and K0.4Rb0.6Sb2F7 according to NMR and DSC data, J. Fluor. Chem., 2014, vol. 168, p. 198.
Grotel, M., Kozak, A., and Pajak, Z., 1H and 19F NMR Study of Cation and Anion Motions in Guanidinium Hexafluorozirconate, Naturforsch., 1996, vol. 51a, p. 991.
Герасименко, А.В., Кавун, В.Я., Сергиенко, В.И., Антохина, Т.Ф. Кристаллическая структура, фазовые переходы и динамика ионов в соединении Li(NH4)6Zr4F23. Коорд. химия. 1999. Т. 25. С. 604. [Gerasimenko, A.V., Kavun, V.Ya., Sergienko, V.I., and Antokhina, T.F., Crystal structure, phase transition, and ion dynamics in Li(NH4)6Zr4F23, Russ. J. Coord. Chem., 1999, vol. 25, p. 562.]
Габуда, С.П., Давидович, Р.Л., Козлова, С.Г., Мороз, Н.К. Фазовые переходы и ионная подвижность во фтороцирконатах таллия, Журн. структур. химии. 1996. Т. 37. С. 388. [Gabuda, S.P., Davidovich, R.L., Kozlova, S.G., and Moroz, N.K., Phase transitions, and ionic mobility in thallium fluorozirconates, Russ. J. Structur. Chem., 1996, vol. 37, p. 340.]
Кавун, В.Я., Габуда, С.П., Козлова, С.Г., Давидович, Р.Л. ЯМР 19F, 203, 205Tl и структурные превращения в цепочечных гексафторцирконатах и гексафторгафнатах аммония и таллия. Журн. структур. химии. 1999. Т. 40. С. 664. [Kavun, V.Ya., Gabuda, S.P., Kozlova, S.G., and Davidovich, R.L., 19F and 203, 205Tl NMR and structural transformations in chain ammonium and thallium hexafluorozirconates and hexafluorohafnates, Russ. J. Structur. Chem., 1999, vol. 40, p. 541.]
Бузник, В.М., Москвич, Ю.Н., Соколович, В.В. и др. Исследование анионной подвижности в смешанных фторидах со структурой тисонита. Журн. структур. химии. 1979. Т. 20. С. 622. [Buznik, V.M., Moskvich, Yu,N., Sokolovich, V.V., et al., A study of the anion mobility in mixed fluorides with the tysonite structure, J. Structur. Chem., 1979, vol. 20, p. 529.]
Kavun, V.Ya., Uvarov, N.F., Slobodyuk, A.B., et al., Ion mobility and conductivity in the M0.5 –xPbxBi0.5F2 +x (M = K, Rb) solid solutions with fluorite structure, J. Solid State Chem., 2017, vol. 249, p. 204.
Duvel, A., Heitjans, P., Fedorov, P., et al., Is Geometric Frustration-Induced Disorder a Recipe for High Ionic Conductivity?, J. Am. Chem. Soc., 2017, vol. 139, p. 5842.
Shannon, R.D. and Fischer, R.X., Empirical electronic polarizabilities in oxides, hydroxides, oxyfluorides, and oxychlorides, Phys. Rev. B, 2006, vol. 73, p. 235111.
Уваров, Н.Ф. Композиционные твердые электролиты. Новосибирск: Изд-во СО РАН, 2008. 258 с.
Габуда, С.П., Плетнев, Р.Н. Применение ЯМР в химии твердого тела. Екатеринбург: Изд-во Екатеринбург, 1996. 468 с.
Войт, Е.И., Войт, А.В., Кавун, В.Я., Сергиенко, В.И. Квантово-химическое исследование гексафтороцирконатов калия и аммония. Журн. структур. химии. 2004. Т. 45. С. 644. [Voit, E.I., Voit, A.V., Kavun, V.Ya., and Sergienko, V.I., Quantum-chemical study of potassium and ammonium hexafluorozirconates, J. Structur. Chem., 2004, vol. 45, p. 610.]
Gibson, I.R., Dransfield, G.P., and Irvine, J.T.S., Sinterability of commercial 8 mol% yttria-stabilized zirconia powders and the effect of sintered density on the ionic conductivity, J. Mater. Sci. 1998, vol. 33, p. 4297.
West, A.R., Solid State Chemistry and its applications. M.: Mir, 1988. 336 p.
Дополнительные материалы отсутствуют.