Электрохимия, 2021, T. 57, № 2, стр. 88-95
Инжекция и экстракция атомарного водорода на сплавах систем Cu–Pd и Ag–Pd в щелочной среде
Н. Б. Морозова a, *, Н. Д. Родина a, А. В. Введенский a
a Воронежский государственный университет
394018 Воронеж, Университетская пл., 1, Россия
* E-mail: mnb@chem.vsu.ru
Поступила в редакцию 28.11.2019
После доработки 02.06.2020
Принята к публикации 18.06.2020
Аннотация
Исследовано поведение сплавов систем Cu–Pd и Ag–Pd в реакции катодного выделения водорода в водном растворе 0.1 М KOH. Выявлена роль меди и серебра в процессах внедрения и ионизации атомарного водорода. Предложен механизм данной реакции выделения водорода в водном щелочном растворе на Cu,Pd- и Ag,Pd-сплавах с содержанием соответственно электроотрицательного компонента меди или серебра до 60 ат. %. Установлено, что контролирующей стадией процесса выделения водорода на сплавах палладия в 0.1 М KOH является ионизация атомарного водорода, которая осложнена его диффузией в твердой фазе. Рассчитаны параметры водородопроницаемости для изучаемых систем. Показано, что их максимальное значение достигается на сплаве Ag80Pd. Соответственно сплавы с высоким содержанием палладия наряду с чистым палладием могут быть успешно использованы как эффективные материалы для очистки и хранения атомарного водорода.
ВВЕДЕНИЕ
Электрокатализаторы реакции выделения водорода, проявляющие превосходную активность, достаточно распространены, однако имеется ряд проблем, связанных с их применением в кислой среде. Прежде всего, эксплуатация таких электрокатализаторов ограничивается высокой склонностью к коррозии электродов электролизера, а также загрязнением полученного газообразного водорода кислотными парами. Напротив, производство меньших количеств пара, причем при более низком давлении, является преимуществом щелочных электролитов. Такие системы, к тому же, обладают более высокой стабильностью и в коррозионном плане [1].
В качестве катализаторов для очистки водорода от примесей используют как правило мембраны на основе металлического палладия. Ограничивающим фактором широкого применения таких мембран является их склонность к водородному охрупчиванию, причем как при воздействии высокой концентрации H2, так и после многократных циклов поглощения и десорбции водорода. В процессе поглощения водорода атомы Н неупорядоченно занимают октаэдрические междоузлия в кристаллической решетке палладия [2]. Отмечено [3], что при атомном отношении H/Pd ~ 0.06 доминирующей является α-фаза системы Pd–H, которая представляет собой идеальный разбавленный твердый раствор водорода в палладии [4].
Для снижения эффекта водородного охрупчивания палладий легируют другими металлами, такими как Ag, Cu, Fe, Ni, Pt и Y [5]. Особый интерес, в частности, представляют гомогенные сплавы систем Cu–Pd и Ag–Pd.
Сплав Cu–Pd с избытком Pd характеризуется проницаемостью при поглощении водорода в междоузлиях и устойчивостью к отравлению сульфидами [6]. Показано [7], что максимальная растворимость атомарного водорода в тонких пленках Cu, Pd-сплавов с ГЦК-решеткой уменьшается по мере роста концентрации меди. Сплавы палладия с серебром также обладают высокой селективностью и проницаемостью по отношению к водороду при комнатной температуре, что делает их перспективным материалом для изготовления диффузионных мембран [2]. Сплавы системы Ag–Pd, характеризуемые высоким содержанием Pd, также способны абсорбировать водород [8]. Водород, абсорбированный сплавами Ag–Pd, существует в двух фазах α и β, подобно чистому палладию, при этом сплав Ag77Pd имеет наименьшее несоответствие параметров решетки фаз α и β. Последнее связано с тем, что кристаллическая решетка палладия уже расширена атомами серебра, а потому в меньшей степени подвергается водородному охрупчиванию, в связи с чем механическая прочность диффузионных мембран на основе таких сплавов значительно повышается [9]. Сплавы системы Ag–Pd с XAg ~ ~ 23 мас. % характеризуются максимальным значением проницаемости водорода, прежде всего из-за стимулирующего воздействия серебра на растворимость атомарного водорода [10].
Цель исследования – установление кинетики выделения водорода и исследование водородопроницаемости на палладии и его бинарных сплавах с медью и серебром в щелочной среде, а также выявление роли природы электроотрицательного компонента на водородопроницаемость таких сплавов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве объектов исследования использованы компактные поликристаллические электроды систем Cu–Pd и Ag–Pd с XPd = 15, 30, 40, 50, 60 и 80 ат. %, изготовленные из Pd (99.9 мас. %), Cu (99.99 мас. %) и Ag (99.99 мас. %). Известно [11], что как медь, так и серебро образуют с палладием непрерывные ряды твердых растворов замещения во всем диапазоне концентраций.
Сплавы с палладием готовили прямым сплавлением в предварительно вакуумированной и заполненной аргоном (1.2 атм) индукционной вольфрамовой печи в тиглях из BeO. Сплавы с высоким содержанием палладия (>50 ат. %) нагревали до 1893 К, с меньшим – до 1723 К. Затем тигли охлаждали 40 мин на воздухе до температур 1473 и 1373 К, соответственно, после чего сплавы закаливали в воду.
Химический состав сплавов контролировали рентгеновским спектрометром СПАРК. Все полученные сплавы, согласно диаграммам состояния соответствующих систем, температуре отжига и режиму закалки, представляли мелкокристаллические твердые растворы, что подтверждено металлографически; степень упорядоченности твердых растворов не определяли.
Для изготовления электродов металлы и сплавы механически разрезали, шлифовали и армировали в оправу из эпоксидной смолы. Полученные электроды имели толщину от 3 до 5 мм.
Эксперименты проведены в стеклянной трехэлектродной ячейке с использованием платинового электрода – в качестве вспомогательного, а хлоридсеребряного электрода – в качестве электрода сравнения. Перед проведением поляризационных измерений в 0.1 М KOH (х. ч.) осуществляли деаэрирование растворов путем барботажа аргона (х. ч.) в течение 30 мин. Поверхность электродов предварительно подвергали зачистке суспензией MgO в воде, полировке на натуральной замше, обезжириванию этанолом и промывке дистиллированной водой. В электрохимических измерениях использован потенциостат IPC-Compact с компьютерным управлением. Все потенциалы приведены относительно ст. в. э., а токи отнесены к единице истинной поверхности сплавов, найденной по [12].
С целью удаления с поверхности следовых количеств оксидов, перед получением циклических вольтамперограмм исследуемый электрод выдерживали в растворе при потенциале предпоготовки Епп = –0.60 В в течение 500 с. Вольт-амперные кривые регистрировали в потенциодинамическом режиме при скорости сканирования потенциала v = 5 мВ/с от значения Епп в катодную область, а затем переключали развертку потенциалов в анодную область. Границами i,E-зависимостей являлись предельные токи выделения водорода и кислорода.
При получении вольтамперограмм с разными скоростями сканирования потенциала предварительно осуществляли наводороживание электродов при потенциале Еc = –0.90 В, продолжительность процесса наводороживания tc составляла 3 и 5 c. Скорость сканирования потенциала варьировали в диапазоне 0.5–100 мВ/с. После процедуры наводороживания химический состав, а также микроструктура образцов практически не изменялись.
Для нахождения параметров инжекции и экстракции атомарного водорода использовали метод ступенчатой катодно-анодной хроноамперометрии [13]. Перед получением каждой хроноамперограммы на рабочий электрод, с целью стандартизации его поверхности, в течение 500 с подавали потенциал Eпп.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Установление кинетики выделения водорода проводили методом циклической вольтамперометрии, примеры циклограмм представлены на рис. 1.
Рис. 1.
Циклические вольтамперограммы, полученные на Pd (1), Cu80Pd (2), Ag80Pd (3), Cu50Pd (4) и Ag50Pd (5) в 0.1 М KOH со скоростью сканирования потенциала 5 мВ/с.
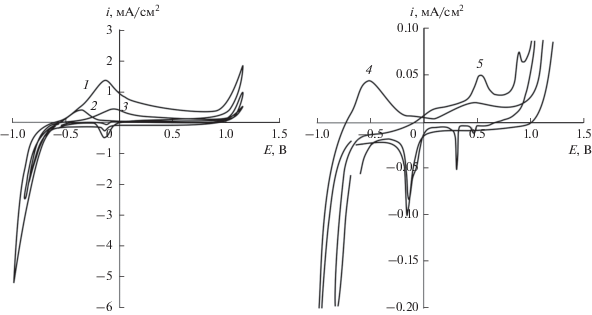
На анодной ветви циклических вольтамперограмм как палладия, так и бинарных сплавов с содержанием XPd ≥ 50 ат. % прослеживается характерный пик тока, который относится к процессу ионизации атомарного водорода в области потенциалов от –0.60 до 0.20 В. Отметим, что пик ионизации водорода для сплавов системы Cu–Pd расположен отрицательнее, чем у сплавов системы Ag–Pd.
По мере увеличения содержания серебра в Ag,Pd-сплавах наблюдается смещение пика ионизации водорода в область более положительных потенциалов, в то время как для Cu,Pd-сплавов данный пик практически не изменяет своего положения. Снижение амплитуды анодного пика на сплавах систем Cu–Pd и Ag–Pd свидетельствует о более высокой скорости ионизации атомарного водорода на чистом палладии. Последнее может быть связано как с затрудненной адсорбцией гидроксид-ионов на поверхности сплавных электродов, так и с образованием оксидных соединений меди и серебра, блокирующих активные участки поверхности и вызывающих анодную пассивацию [14]. Немаловажно, что уже при XPd = 60 ат. % пик ионизации водорода на сплавах выражен значительно слабее, а также наблюдается искажение формы пика, связанное с конкурирующим процессом окисления меди или серебра. Для сплавов с низким содержанием палладия (XPd ≤ 30 ат. %) пик ионизации водорода не выявляется.
При смещении потенциала в область более положительных значений на Pd и сплавах с XPd = = 80 ат. % слабо проявляется область образования оксида палладия в диапазоне от 0.20 до 0.80 В. У сплавов с XPd ≤ 60 ат. % данная область практически исчезает, поскольку окисление электроотрицательного компонента начинает подавлять этот процесс. На катодной ветви вольтамперограмм, полученных как на палладии, так и его гомогенных сплавах, наблюдается катодный пик восстановления оксида PdO, который на Pd зафиксирован при E = –0.22 В [15].
Если у медно-палладиевых электродов с XPd ≤ ≤ 50 ат. % наблюдается один пик окисления меди, расположенный при потенциале около 0.40 В, то серебряно-палладиевые сплавы характеризуются появлением двух анодных пиков − в диапазоне потенциалов от 0.43 до 0.74 В, а также от 0.89 до 0.91 В. Данные пики соответствуют, предположительно, окислению металлического серебра и последующему доокислению Ag2O. Кроме того, на вольтамперограммах сплавов Ag40Pd и Ag15Pd выявлен предпик при 0.52 и 0.61 В, соответственно, предположительно связанный с формированием AgOH [16]. Отметим, что на катодной ветви вольтамперограмм зафиксированы пики, отвечающие лишь восстановлению AgO (~0.50 В) и Ag2O (~0.32 В). Потенциалы катодных и анодных пиков, характерных для сплава Ag15Pd, практически полностью соотносятся с потенциалами аналогичных пиков для чистого серебра [14].
С целью уточнения деталей процесса выделения водорода на сплавах, получены серии вольтамперограмм с разной скоростью сканирования потенциала, а также при времени наводороживания tc = 3 и 5 c. Полученные данные показывают, что на всех исследуемых образцах с увеличением скорости сканирования потенциала происходит как рост пика ионизации $i_{{\text{п}}}^{{\text{а}}},$ так и его смещение в область более положительных значений. Кроме того, на сплавах системы Ag–Pd наблюдается расщепление анодного пика на несколько более мелких, что может указывать на образование различных форм кислородсодержащих частиц [17]. Обработка данных вольтамперометрии всегда проводилась по первому анодному пику, который по потенциалам соответствует процессу ионизации атомарного водорода.
Экспериментальные i,E-кривые как для палладия, так и его гомогенных сплавов перестроены в критериальных координатах $i_{{\text{п}}}^{{\text{а}}}$−v1/2; полученные зависимости хорошо линеаризуются и экстраполируются в начало координат (рис. 2). Не исключено, что процесс ионизации водорода осложнен твердофазной диффузией.
Рис. 2.
Линеаризованные вольтамперограммы в критериальных координатах для Pd, Cu,Pd- и Ag,Pd-сплавов в растворе 0.1 М KOH при tc = 3 с.
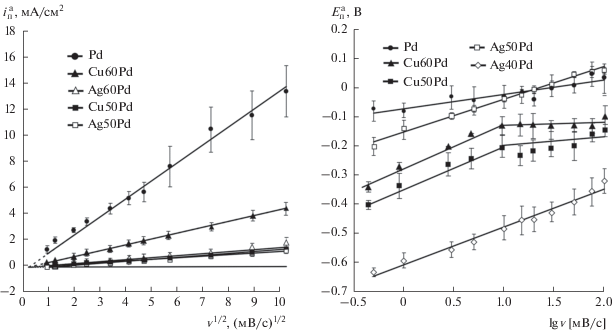
Зависимости потенциала пика ионизации $E_{{\text{п}}}^{{\text{а}}}$ от lg v также являются линейными, причем для всех исследуемых электродов системы Ag–Pd. Это свидетельствует о необратимости электрохимической стадии ионизации атомарного водорода. Для Cu,Pd-сплавов Еп,lg v-зависимости имеют перегиб, а по мере увеличения скорости сканирования потенциала зависимость Еп от lg v вообще исчезает. Значения наклонов ${\text{d}}E_{{\text{п}}}^{{\text{а}}}$/dlg v, найденные для чистого палладия и сплава Ag80Pd, близки и составляют 0.049 и 0.042 В, соответственно, что скорее отвечает одноэлектронному процессу переноса заряда. Величина параметра dEп/dlg v для сплавов с XPd ≤ 60% изменяется в диапазоне 0.091−0.122 В. Вероятно, это свидетельствует о том, что в данном случае кинетика процесса переноса заряда осложнена образованием оксидных форм меди и серебра. Зависимость пика ионизации Еп от скорости сканирования v указывает на необратимый характер электрохимической стадии ${{{\text{H}}}_{{\text{s}}}} \to {{{\text{H}}}^{ + }};$ тогда как перегиб и исчезновение зависимости Еп от v говорит о смене механизма процесса. Речь может идти либо об изменении природы области, в которой локализован массоперенос, либо о смене контроля реакции; более детально этот аспект проблемы не изучался. Отметим, что токи ионизации водорода на сплавах меньше, чем на палладии, поэтому уже сказывается влияние кинетики ионизации водорода на общий ток. Здесь процесс, по-прежнему, контролируется диффузией Н в сплаве.
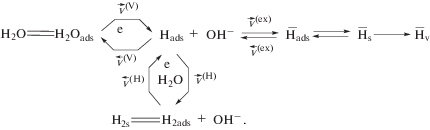
Аналогичные зависимости наблюдаются и в случае, когда период наводороживания tc = 5 c. Здесь также наблюдается линеаризация $i_{{\text{п}}}^{{\text{а}}},{{v}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}$-зависимости с экстраполяцией в начало координат, что в значительной мере подтверждает предложенный в [13] механизм процесса, который для щелочной среды может быть представлен следующим образом:
Здесь индексы V и H в обозначениях скорости реакции соответствуют стадиям Фольмера (Volmer) и Гейровского (Heyrovsky), тогда как стадии обмена и адсорбции обозначены индексами “ex” и “ads” соответственно; ${{{\bar {H}}}_{{\text{s}}}}$ – атом водорода, находящийся в подповерхностном слое металла.Сравнивая результаты, полученные ранее на Cu,Pd- и Ag,Pd-электродах в кислой среде [17], можно заключить, что при смене среды электролита механизм процессов внедрения и ионизации атомарного водорода в целом сохраняется. Осложнения в щелочной среде связаны с оксидообразованием электроотрицательного компонента в сплаве.
Изучение процессов внедрения и экстракции атомарного водорода, а также расчет параметров водородопроницаемости на палладии и его сплавах осуществляли путем получения и обработки двухступенчатых катодно-анодных хроноамперограмм. На i,t-зависимостях (рис. 3) с увеличением времени наводороживания наблюдается линейное уменьшение амплитуд токов как на катодных, так и анодных ветвях хроноамперограмм. Возможно, что указанное явление возникает в результате адсорбции кислородсодержащих частиц, прежде всего OH, затрудняющих ионизацию атомарного водорода с поверхности. В ходе получения серии хроноамперограмм с разным временем наводороживания промежуточная зачистка поверхности электродов не проводилась, что приводило к накоплению адсорбированных частиц и, как следствие, к торможению процессов ионизации и внедрения водорода.
Рис. 3.
Пример двухступенчатой хроноамперограммы, полученной на сплаве Ag80Pd в растворе 0.1 М KOH, при tc = 1–10 c.
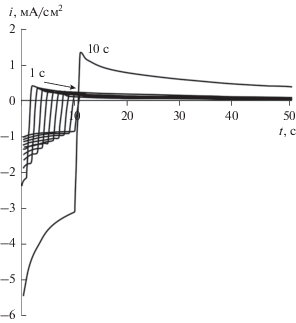
Для подтверждения данного предположения, двухступенчатые катодно-анодные хроноамперограммы получали далее только при tс = 10 с, у которых амплитуды катодного и анодного токов оказались значительно выше, чем для 10 с при последовательной регистрации. С увеличением содержания меди и серебра в сплаве происходит снижение скорости ионизации атомарного водорода, причем как в катодной, так и в анодной областях, что вполне закономерно и согласуется с вольт-амперными зависимостями.
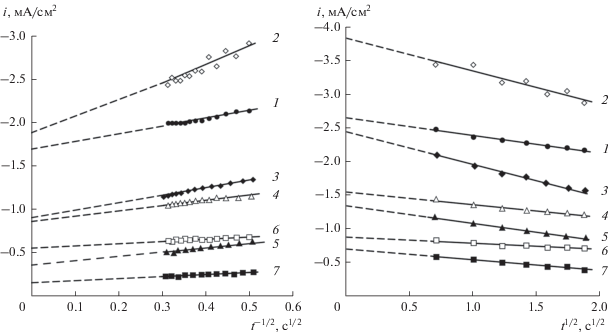
Катодные хроноамперограммы, полученные для времени наводороживания tс = 10 с, спрямляли в координатах iс–$t_{{\text{с}}}^{{{{ - 1} \mathord{\left/ {\vphantom {{ - 1} 2}} \right. \kern-0em} 2}}}$ и iс–$t_{{\text{с}}}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}$ (рис. 4) [18]. Для всех исследуемых систем данные зависимости имеют линейный вид, но не экстраполируются в начало координат. Последнее свидетельствует о том, что регистрируемый катодный ток скорее всего складывается из нескольких составляющих, а именно − тока разряда молекул воды и предельного тока диффузии атомов Н в глубь металлической фазы.
Рис. 4.
Линеаризованные в критериальных координатах [18] катодные хроноамперограммы для Pd (1) и сплавов Ag80Pd (2), Cu80Pd (3), Ag60Pd (4), Cu60Pd (5), Ag50Pd (6) и Cu50Pd (7) при времени наводороживания tс = 10 с.
Используя теоретическую модель, развитую в [18] для электродов полубесконечной толщины, проводили математическую обработку катодных хроноамперограмм с целью получения кинетических и диффузионных параметров. Математическое моделирование позволяет рассчитать следующие параметры: ic(0) и $i_{c}^{\infty }$ – начальный и стационарный катодный ток, соответственно, константы скоростей $\vec {k}$ и $\overset{\lower0.5em\hbox{$\smash{\scriptscriptstyle\leftarrow}$}}{k} $ реакций внедрения и ионизации, а также константу равновесия $K = {{\vec {k}} \mathord{\left/ {\vphantom {{\vec {k}} {\overset{\lower0.5em\hbox{$\smash{\scriptscriptstyle\leftarrow}$}}{k} }}} \right. \kern-0em} {\overset{\lower0.5em\hbox{$\smash{\scriptscriptstyle\leftarrow}$}}{k} }}.$ Параметр, характеризующий твердофазную диффузию – коэффициент водородопроницаемости, является комплексной характеристикой KD = D1/2$\Delta {{c}_{{\bar {H}}}};$ раздельно найти коэффициент диффузии D и изменение концентрации $\Delta c_{{\bar {H}}}^{{}}$ атомарного водорода в сплаве, в рамках используемой модели не представляется возможным. Параметры водородопроницаемости для Pd, Cu–Pd и Ag–Pd сплавов, рассчитанные по катодным спадам тока, представлены в табл. 1.
Таблица 1.
Характеристики процесса инжекции атомарного водорода в палладий, а также в сплавы Cu–Pd (числ.) и Ag–Pd (знам.), полученные в 0.1 М KOH
| XPd, ат. % | $i_{{\text{c}}}^{\infty }$, мА/см2 | ic(0), мА/см2 | KD × 109, моль/(см2 с1/2) | $\vec {k}$ × 108, моль/(см2 с) | $\overset{\lower0.5em\hbox{$\smash{\scriptscriptstyle\leftarrow}$}}{k} $ × 104, см/c | K × 105, моль/см3 |
|---|---|---|---|---|---|---|
| 100 | 2.39 ± 0.32 | 4.95 ± 1.21 | 32.17 ± 10.05 | 3.84 ± 1.21 | 3.82 ± 0.05 | 11.87 ± 4.64 |
| 80 | $\frac{{{\text{0}}{\text{.52}} \pm {\text{0}}{\text{.24}}}}{{{\text{1}}{\text{.91}} \pm {\text{0}}{\text{.15}}}}$ | $\frac{{{\text{1}}{\text{.96}} \pm {\text{0}}{\text{.42}}}}{{{\text{3}}{\text{.65}} \pm {\text{0}}{\text{.12}}}}$ | $\frac{{{\text{20}}{\text{.53}} \pm {\text{5}}{\text{.69}}}}{{{\text{36}}{\text{.19}} \pm {\text{3}}{\text{.67}}}}$ | $\frac{{{\text{2}}{\text{.39}} \pm {\text{0}}{\text{.75}}}}{{{\text{2}}{\text{.99}} \pm {\text{0}}{\text{.47}}}}$ | $\frac{{{\text{3}}{\text{.91}} \pm {\text{1}}{\text{.19}}}}{{{\text{2}}{\text{.65}} \pm {\text{0}}{\text{.30}}}}$ | $\frac{{{\text{6}}{\text{.04}} \pm {\text{1}}{\text{.67}}}}{{{\text{10}}{\text{.40}} \pm {\text{1}}{\text{.41}}}}$ |
| 60 | $\frac{{{\text{0}}{\text{.08}} \pm {\text{0}}{\text{.02}}}}{{{\text{1}}{\text{.17}} \pm {\text{0}}{\text{.35}}}}$ | $\frac{{{\text{1}}{\text{.47}} \pm {\text{0}}{\text{.37}}}}{{{\text{1}}{\text{.36}} \pm {\text{0}}{\text{.31}}}}$ | $\frac{{{\text{11}}{\text{.81}} \pm {\text{2}}{\text{.78}}}}{{{\text{9}}{\text{.31}} \pm {\text{2}}{\text{.40}}}}$ | $\frac{{{\text{1}}{\text{.79}} \pm {\text{0}}{\text{.52}}}}{{{\text{0}}{\text{.76}} \pm 0.22}}$ | $\frac{{{\text{4}}{\text{.74}} \pm {\text{4}}{\text{.18}}}}{{{\text{0}}{\text{.93}} \pm 0.06}}$ | $\frac{{{\text{3}}{\text{.37}} \pm {\text{0}}{\text{.79}}}}{{{\text{2}}{\text{.51}} \pm {\text{0}}{\text{.65}}}}$ |
| 50 | $\frac{{{\text{0}}{\text{.04}} \pm {\text{0}}{\text{.01}}}}{{{\text{0}}{\text{.63}} \pm {\text{0}}{\text{.10}}}}$ | $\frac{{{\text{0}}{\text{.54}} \pm {\text{0}}{\text{.13}}}}{{{\text{0}}{\text{.96}} \pm {\text{0}}{\text{.14}}}}$ | $\frac{{{\text{6}}{\text{.32}} \pm {\text{1}}{\text{.97}}}}{{{\text{7}}{\text{.54}} \pm {\text{1}}{\text{.77}}}}$ | $\frac{{{\text{0}}{\text{.67}} \pm {\text{0}}{\text{.21}}}}{{{\text{0}}{\text{.58}} \pm 0.12}}$ | $\frac{{{\text{3}}{\text{.79}} \pm {\text{0}}{\text{.24}}}}{{{\text{0}}{\text{.26}} \pm 0.03}}$ | $\frac{{{\text{1}}{\text{.77}} \pm {\text{0}}{\text{.55}}}}{{{\text{2}}{\text{.23}} \pm 0.32}}$ |
| 40 | $\frac{{{\text{0}}{\text{.02}} \pm {\text{0}}{\text{.01}}}}{{{\text{0}}{\text{.07}} \pm {\text{0}}{\text{.01}}}}$ | $\frac{{{\text{0}}{\text{.34}} \pm {\text{0}}{\text{.10}}}}{{{\text{0}}{\text{.13}} \pm {\text{0}}{\text{.02}}}}$ | $\frac{{{\text{4}}{\text{.80}} \pm {\text{1}}{\text{.60}}}}{{{\text{0}}{\text{.75}} \pm {\text{0}}{\text{.10}}}}$ | $\frac{{{\text{0}}{\text{.30}} \pm {\text{0}}{\text{.05}}}}{{{\text{0}}{\text{.07}} \pm {\text{0}}{\text{.03}}}}$ | $\frac{{{\text{3}}{\text{.82}} \pm {\text{0}}{\text{.32}}}}{{{\text{0}}{\text{.14}} \pm {\text{0}}{\text{.01}}}}$ | $\frac{{{\text{1}}{\text{.35}} \pm {\text{0}}{\text{.45}}}}{{{\text{0}}{\text{.19}} \pm {\text{0}}{\text{.05}}}}$ |
Исходя из полученных данных, отметим, что значения практически всех экспериментально найденных параметров снижаются с увеличением содержания электроотрицательного компонента в сплаве. Исключение составляет константа водородопроницаемости KD для сплава Ag80Pd, величина которой превышает значение, полученное для чистого палладия. Данное явление, по всей видимости, объясняется максимальной проницаемостью и растворимостью водорода в кристаллической решетке сплава Ag77Pd [2]. В то же время константа скорости процесса экстракции $\overset{\lower0.5em\hbox{$\smash{\scriptscriptstyle\leftarrow}$}}{k} $ в системе Cu–Pd практически не изменяется в пределах ошибки. Аналогичным образом, с привлечением теоретического моделирования [18], проанализированы и анодные спады тока.
Коэффициенты водородопроницаемости, рассчитанные по наклону как линейных участков анодных хроноамперограмм KD(ia), так и хронокулонограмм KD(qa), также имеют максимальное значение для сплава с содержанием палладия 80 ат. % (рис. 5). Следует отметить, что значения коэффициентов водородопроницаемости, рассчитанные по анодным спадам тока, почти на два порядка превышают аналогичные значения, полученные по катодным спадам. Данное различие может быть связано с эффектом дилатации кристаллической решетки сплавов.
Рис. 5.
Зависимость коэффициентов водородной проницаемости от содержания Pd в сплаве, рассчитанные по анодным хроноамперограммам (1), (3) и хронокулонограммам (2), (4).
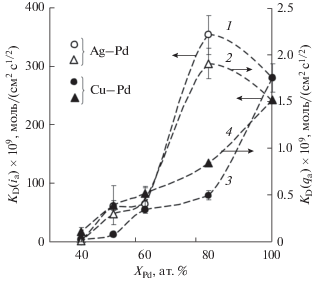
Таким образом, можно заключить, что по мере увеличения концентрации палладия в сплавах системы Cu–Pd зависимость большинства параметров водородопроницаемости монотонно растет. В то же время для сплавов систем Ag–Pd с содержанием XPd = 80 ат. % наблюдается экстремум коэффициента водородопроницаемости, природа которого пока не ясна.
ЗАКЛЮЧЕНИЕ
Исследовано поведение гомогенных сплавов систем Cu–Pd и Ag–Pd в ходе катодной реакции выделения водорода в щелочной среде. Найдено, что по мере введения небольших количеств серебра (<20 ат. %) в кристаллическую решетку палладия наблюдается рост скорости ионизации атомарного водорода, однако при XAg > 20 ат. % происходит подавление этого процесса, предположительно вследствие оксидообразования серебра. Добавка меди в палладий приводит к подавлению ионизации уже во всем интервале составов.
Механизм выделения водорода при переходе от Pd к его гомогенным сплавам с содержанием электроотрицательного компонента (меди или серебра) до 60 ат. % остается неизменным. Контролирующей стадией в кинетике выделения водорода на сплавах палладия в растворе 0.1 М KOH является электрохимическая стадия ионизации атомарного водорода, которая осложнена его диффузией в твердой фазе.
Параметры водородопроницаемости максимальны в сплаве системы Ag–Pd с XAg = 20 ат. %. Лучшими свойствами, с точки зрения водородопроницаемости, обладают сплавы с высоким содержанием палладия. Такие сплавы, по всей видимости, могут быть использованы как эффективные материалы для очистки и хранения атомарного водорода.
Список литературы
Mahmood, N., Yao, Y., Zhang, J.-W., Pan, L., Zhang, X., and Zou, J.-J., Electrocatalysts for Hydrogen Evolution in Alkaline Electrolytes: Mechanisms, Challenges, and Prospective Solutions, Adv. Sci., 2017, vol. 5.
Бугаев, А.Л., Гуда, А.А., Дмитриев, В.П., Ломащенко, К.А., Панкин, И.А., Смоленцев, Н.Ю., Солдатов, М.А., Солдатов, А.В. Динамика наноразмерной атомной и электронной структуры материалов водородной энергетики при реалистичных технологических условиях. Инженерный вестник Дона. 2012. Т. 4. С. 89. [Bugaev, A.L., Guda, A.A., Dmitriev, V.P., Lomashchenko, K.A., Pankin, I.A., Smolencev, N.YU., Soldatov, M.A., and Soldatov, A.V., Dinamika nanorazmernoj atomnoj i elektronnoj struktury materialov vodorodnoj energetiki pri realistichnyh tekhnologicheskih usloviyah, Inzhenernyj vestnik Dona (in Russian), 2012, vol. 4, p. 89.]
Lewis, F.A., The Hydrogen Palladium System, London, Academic Press, 1967, 178 p.
Yun, S. and Ted Oyama, S., Correlations in palladium membranes for hydrogen separation: A review, J. Membr. Sci., 2011, vol. 375, p. 28.
Sharma, R. and Sharma, Ya., Hydrogen permeance studies in ordered ternary Cu–Pd alloys, Int. J. Hydrogen Energy, 2015, vol. 40, p. 14885.
Martin, M.H., Galipaud, J., Tranchot, A., Roué, L., and Guay, D., Measurements of hydrogen solubility in CuxPd100 –x thin films, Electrochim. Acta., 2013, vol. 90, p. 615.
Sharma, B. and Kim, J.-S., Pd/Ag alloy as an application for hydrogen sensing, Int. J. Hydrog. Energy, 2017, vol. 42, p. 25446.
Lukaszewski, M., Klimek, K., and Czerwinski, A., Microscopic, spectroscopic and electrochemical characterization of the surface of Pd–Ag alloys, J. Electroanal. Chem., 2009, vol. 637, p.13.
Amandusson, H., Ekedahl, L.-G., and Dannetun, H., Hydrogen permeation through surface modified Pd and PdAg membranes, J. Membr. Sci., 2001, vol. 193, p.35.
Uemiya, S., Matsuda, T., and Kikuchi, E., Hydrogen permeable palladium–silver alloy membrane supported on porous ceramics, J. Membr. Sci., 1991, vol. 56, p. 315.
Ghosh, G., Kantner, C., and Olson, G. B., Thermodynamic modeling of the Pd–X (X = Ag, Co, Fe, Ni) systems, J. Phase Equilib., 1999, vol. 20, p.295.
Щеблыкина, Г.Е., Бобринская, Е.В., Введенский, А.В. Определение истинной поверхности металлов и сплавов комбинированным электрохимическим. Защита металлов. 1998. Т. 34. С. 11. [Shcheblykina, G.E., Bobrinskaya, E.V., and Vvedenskii, A.V., Determination of real surface area of metals and alloys by a combined electrochemical method, Prot. Met., 1998, vol. 34, p. 6.]
Морозова, Н.Б., Введенский, А.В., Бередина, И.П. Фазограничный обмен и нестационарная диффузия атомарного водорода в сплавах Cu–Pd и Ag–Pd. II. Экспериментальные данные. Физикохимия поверхности и защита материалов. 2015. Т. 51. С. 40. [Morozova, N.B., Vvedensky, A.V., and Beredina, I.P., Phase boundary exchange and nonstationary diffusion of atomic hydrogen in Cu–Pd and Ag–Pd alloys. II. Experimental data, Prot. Metals and Phys. Chem. Surf., 2015, vol. 51, p. 72.]
Лесных, Н.Н., Тутукина, Н.М., Маршаков, И.К. Влияние сульфат- и нитрат-ионов на пассивацию и активацию серебра в щелочном растворе. Физикохимия поверхности и защита материалов. 2008. Т. 44. С. 472. [Lesnykh, N.N., Tutukina, N.M., and Marshakov, I.K., The effect of sulfate and nitrate ions on the passivation and activation of silver in alkaline solutions, Prot. Metals and Phys. Chem. Surf., 2008, vol. 44, p. 437.]
Salvarezza, R.C., Montemayor, M.C., Fatas, E., and Arvia, A.J., Electrochemical study of hydrogen absorption in polycrystalline palladium, J. Electroanal. Chem., 1991, vol. 313, p. 291.
Kunze, J., Strehblow, H.-H., and Staikov, G., In situ STM study of the initial stages of electrochemical oxide formation at the Ag (111)/0.1 M NaOH (aq) interface, Electrochem. Comm., 2004, vol. 6, p. 132.
Бобринская, Е.В., Введенский, А.В., Кращенко, Т.Г. Адсорбция кислорода и электрокатализ на золоте в щелочной среде: состояние проблемы. Конденсир. среды и межфазные границы. 2014. Т. 16. С. 381. [Bobrinskaya, E.V., Vvedenskii, A.V., and Krashchenko, T.G., Oxygen adsorption and electrocatalysis on gold in alkaline medium: state of the problem, Kondensirovannye sredy i mezhfaznye granicy., 2014, vol. 16, p. 381 (in Russian).]
Морозова, Н.Б., Введенский, А.В., Бередина, И.П. Фазограничный обмен и нестационарная диффузия атомарного водорода в сплавах Cu–Pd и Ag–Pd. I. Анализ модели. Физикохимия поверхности и защита материалов. 2014. Т. 50. С. 573. [Morozova, N.B., Vvedenskii, A.V., and Beredina, I.P., The phase-boundary exchange and the non-steady-state diffusion of atomic hydrogen in Cu–Pd and Ag–Pd alloys. Part I. Analysis of the model, Prot. Metals and Phys. Chem. Surf., 2014, vol. 50, p. 699.]
Дополнительные материалы отсутствуют.