Электрохимия, 2021, T. 57, № 5, стр. 283-300
Теоретическое и экспериментальное исследование предельного диффузионного тока в системах с модифицированными перфторированными сульфокатионитовыми мембранами
Н. А. Кононенко a, О. А. Демина a, Н. В. Лоза a, *, С. В. Долгополов b, С. В. Тимофеев c
a Кубанский государственный университет
350040 Краснодар, ул. Ставропольская, 149, Россия
b Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Ленинский просп., 31, Россия
c ОАО “Пластполимер”
195197 Санкт-Петербург, Полюстровский просп., 32, Россия
* E-mail: nata_loza@mail.ru
Поступила в редакцию 08.07.2020
После доработки 23.10.2020
Принята к публикации 24.11.2020
Аннотация
Выполнена теоретическая оценка величины предельного диффузионного тока в электромембранной системе по уточненному уравнению Пирса с использованием различных модельных подходов для расчета числа переноса противоиона в мембране и дифференциального коэффициента ее диффузионной проницаемости. Для этого использованы экспериментальные данные по удельной электропроводности, диффузионной и электроосмотической проницаемости, а также кажущимся числам переноса противоионов в перфторированных сульфокатионитовых мембранах МФ-4СК с различной удельной влагоемкостью в широкой области концентраций раствора хлорида натрия. Проведен анализ особенностей применения разных подходов и моделей к оценке параметров мембраны, необходимых для расчета электродиффузионных характеристик и величины предельного диффузионного тока. Показана возможность адекватной теоретической оценки величины предельного диффузионного тока для ионообменных мембран, модифицированных допантами органической и неорганической природы, что позволяет на основании сравнительно простых измерений транспортных характеристик модифицированных ионообменных мембран предсказать эффективность их использования в электромембранных процессах.
ВВЕДЕНИЕ
Электромембранные технологии получения, выделения и концентрирования ценных компонентов из растворов, очистки природных, сточных и технических вод различного назначения позволяют решить такие проблемы, как возврат ценных веществ в производство и создание замкнутых технологический циклов. Величина предельного диффузионного тока в электромембранной системе является ключевой характеристикой, определяющей результативность применения мембран в электродиализе, поскольку позволяет найти оптимальные условия проведения процесса с максимальной эффективностью и минимальными энергозатратами. Использование ионообменных мембран не только для обессоливания, но и для концентрирования растворов электролитов, а также в процессах хлорно-щелочного электролиза требует оценки предельного диффузионного тока в широком диапазоне концентраций растворов электролитов [1–5]. Получить информацию об этом параметре можно из поляризационной кривой, измеренной методом мембранной вольтамперометрии [6–8]. Однако не всегда удается реализовать возможность экспериментального определения величины предельного диффузионного тока, особенно в широком интервале концентраций растворов электролитов. Анализ литературы показывает, что диапазон концентраций, в которых измеряются вольт-амперные кривые, составляет от 5 × 10–4 до 5 × 10–1 М, при этом наиболее часто используются концентрации от 2 × 10–2 до 1 × 10–1 М [9–19]. Поэтому необходимо иметь способ адекватной теоретической оценки этой величины в электромембранной системе. Это особенно важно в случае модифицированных ионообменных мембран, поскольку позволяет предсказать степень влияния модификатора на эффективность использования этих образцов в электромембранных процессах.
Несмотря на большой интерес к исследованию поляризационного поведения ионообменных мембран [20–23], в том числе и модифицированных компонентами органической и неорганической природы, вопрос о возможности теоретической оценки параметров вольт-амперной кривой с учетом не только внешних, но и внутренних факторов детально не изучен. Большинство работ посвящено исследованию явлений, протекающих в сверпредельных токовых режимах, при этом наиболее изучено влияние состояния поверхности мембран на развитие сопряженных эффектов концентрационной поляризации и толщину диффузионного слоя [24–30]. В то же время роль электротранспортных характеристик мембран, а также особенностей их структуры до сих пор не выявлена. Согласно формуле Пирса, при расчете предельного тока из внутренних факторов учитывается только число переноса противоионов, характеризующее селективность мембраны. В работе Гнусина Н.П. и сотр. [31] было убедительно показано, что диффузионная проницаемость структурно-неоднородных ионообменных мембран также влияет на величину предельного тока.
Целью данной работы является исследование возможности применения различных модельных подходов для расчета электродиффузионных характеристик ионообменных мембран и адекватной теоретической оценки величины предельного диффузионного тока.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Для расчета плотности предельного тока (ilim) можно использовать уточненное уравнение Пирса [31], учитывающее не только концентрацию раствора (C), коэффициент диффузии электролита (D), толщину диффузионного слоя (δ) и число переноса противоиона в мембране $\left( {t_{i}^{*}} \right)$ и в растворе (ti), но и проницаемость (P*) и толщину мембраны (l):
(1)
${{i}_{{\lim }}} = \frac{{DCF}}{{\left( {t_{i}^{*} - {{t}_{i}}} \right)\delta }} + \frac{{P{\text{*}}FC}}{{\left( {t_{i}^{*} - {{t}_{i}}} \right)l}}.$Необходимые для расчета величины ilim значения ti и D можно взять из справочников. Значения электромиграционного, или истинного числа переноса противоионов в мембране $t_{i}^{*}$ и дифференциального коэффициента диффузионной проницаемости P*, которые невозможно измерить экспериментально, можно рассчитать различными способами.
Расчет истинного числа переноса противоионов в катионообменной мембране $t_{ + }^{*}$ можно выполнить тремя способами: по уравнению Скачарда, с использованием параметров расширенной трехпроводной модели и на основании электродиффузионных коэффициентов противо- и коионов. Для расчета по уравнению Скачарда [32]
необходимо располагать экспериментально полученными концентрационными зависимостями кажущихся чисел переноса противоионов (t+app) и чисел переноса воды (tw). В уравнении (2) Mw – молярная масса воды, 18 г/моль; m± – средняя моляльность раствора.Другую возможность оценить селективность мембраны дает расширенная трехпроводная модель проводимости ионообменных материалов. В рамках этой модели можно рассчитать доли тока, протекающего через различные структурные фрагменты набухшей мембраны: последовательно через гель и раствор, только через гель и только через раствор (параметры a, b и c, соответственно) [33, 34]. Поскольку перенос коионов, снижающий селективность мембраны, может осуществляться только по каналу, заполненному равновесным раствором (модельный параметр с), рассчитать электромиграционное число переноса противоионов можно по уравнению [35]:
где ${{K}_{{\text{m}}}} = \frac{{{{\kappa }_{{\text{m}}}}}}{\kappa }$ – электропроводность мембраны, измеренная на переменном токе (κm), нормированная на электропроводность раствора (κ) при данной концентрации; t– – число переноса коиона в растворе. Для расчета истинного числа переноса этим способом необходимо экспериментально получить только одну зависимость κm от концентрации равновесного раствора (С).Третий способ расчета истинного числа переноса противоионов в катионообменной мембране связан с использованием электродиффузионных коэффициентов противо- $L_{ + }^{*}(C)$ и коионов $L_{ - }^{*}(C),$ зависящих от концентрации раствора:
Электродиффузионные коэффициенты рассчитываются по формулам [36]:
(5)
$L_{ + }^{*}(C) = \frac{{\kappa _{{\text{m}}}^{{\text{d}}}(C)}}{{2{{F}^{2}}}}\left[ {1 + \sqrt {1 - \frac{{2P{\text{*}}(C)C{{F}^{2}}}}{{RT\kappa _{{\text{m}}}^{{\text{d}}}(C){{\pi }_{ \pm }}}}} } \right],$(6)
$L_{ - }^{*}(C) = \frac{{\kappa _{{\text{m}}}^{{\text{d}}}(C)}}{{2{{F}^{2}}}}\left[ {1 - \sqrt {1 - \frac{{2P{\text{*}}(C)C{{F}^{2}}}}{{RT\kappa _{{\text{m}}}^{{\text{d}}}(C){{\pi }_{ \pm }}}}} } \right],$В уравнении (7) ${{\gamma }_{ \pm }}$ – средний коэффициент активности электролита. Для расчета истинного числа переноса этим способом необходимо располагать экспериментально полученными концентрационными зависимостями удельной электропроводности на переменном токе и интегрального коэффициента диффузионной проницаемости мембраны.
Электропроводность мембраны на постоянном токе $\kappa _{{\text{m}}}^{{\text{d}}}$ рассчитывается по формуле [37]:
где f2 – объемная доля раствора в набухшей мембране; t+ – число переноса противоиона в растворе.Расчет дифференциального коэффициента диффузионной проницаемости можно осуществить двумя способами [38]. Первый способ основан на использовании уравнения связи между интегральным (Рm) и дифференциальным (P*) коэффициентами диффузионной проницаемости:
где $\beta = \frac{{\lg j}}{{\lg C}}$ – угловой наклон диффузионного потока (j) от концентрации диффундирующего в воду раствора в билогарифмических координатах. В этом случае необходимо располагать экспериментально измеренной концентрационной зависимостью диффузионного потока, из которой находится параметр β и рассчитывается величина интегрального коэффициента диффузионной проницаемости: где l – толщина мембраны; C – концентрация диффундирующего в воду раствора электролита.Другой способ заключается в расчете величины $P{\text{*}}$ в рамках двухфазной модели проводимости структурно-неоднородной мембраны по уравнению [39]:
(11)
$P* = {{\left[ {{{f}_{{\text{1}}}}{{{\left( {GC} \right)}}^{{{\alpha }}}} + {{f}_{2}}{{D}^{{{\alpha }}}}} \right]}^{{{1 \mathord{\left/ {\vphantom {1 {{\alpha }}}} \right. \kern-0em} {{\alpha }}}}}},$Для использования этого уравнения необходимо располагать набором транспортно-структурных параметров мембраны: f1 (или f2), α и G, которые для ряда ионообменных мембран имеются в литературе [40–42]. В набор транспортно-структурных параметров мембраны входит также электропроводность гелевой фазы мембраны ${{\kappa }_{{{\text{iso}}}}},$ что открывает возможность рассчитать и концентрационную зависимость удельной электропроводности мембраны по уравнению:
(12)
${{\kappa }_{{\text{m}}}} = {{\left[ {{{f}_{1}}\kappa _{{{\text{iso}}}}^{{{\alpha }}} + {{f}_{2}}{{\kappa }^{{{\alpha }}}}} \right]}^{{{1 \mathord{\left/ {\vphantom {1 {{\alpha }}}} \right. \kern-0em} {{\alpha }}}}}},$Уравнение (13) вытекает из уравнения (12) в случае α → 0 [7, 43]. Далее полученные значения κm можно обработать в рамках расширенной трехпроводной модели и оценить селективность мембраны по уравнению (3).
Зная набор транспортно-структурных параметров, можно оценить также и селективность мембраны по уравнению (4), рассчитав электродиффузионные коэффициенты противо- $L_{ + }^{*}(C)$ и коионов $L_{ - }^{*}(C)$ по формулам (5) и (6), при этом для расчета величин $P{\text{*}}$ и $\kappa _{{\text{m}}}^{{\text{d}}}$ использовать уравнения (11), (12) и (8).
Комбинация различных подходов для расчета величин $t_{ + }^{*}$ и P* представлена на рис. 1. Вариант 1 предполагает расчет обеих величин P* и $t_{ + }^{*}$ в рамках двухфазной модели проводимости с использованием транспортно-структурных параметров мембраны. В отличие от этого в варианте 2 значения $t_{ + }^{*}$ рассчитываются с помощью электродиффузионных коэффициентов, найденных с использованием значений электропроводности, определенной экспериментально. В варианте 3 расчет обеих величин P* и $t_{ + }^{*}$ проводится на основании экспериментальных данных по концентрационным зависимостям удельной электропроводности и диффузионной проницаемости. Вариант 4 позволяет рассчитать величину предельного тока с использованием значений P* и ${{\kappa }_{{\text{m}}}},$ найденных в рамках двухфазной модели проводимости, а $t_{ + }^{*}$ – в рамках трехпроводной модели. Вариант 5 отличается от предыдущего использованием для расчета предельного тока значений P*, найденных из экспериментальных данных. В варианте 6, наоборот, значения P* рассчитываются в рамках двухфазной модели проводимости, а для расчета $t_{ + }^{*}$ в рамках трехпроводной модели используются экспериментально определенные значения ${{\kappa }_{{\text{m}}}}.$ Вариант 7 позволяет рассчитать величину предельного тока с использованием значений P* и ${{\kappa }_{{\text{m}}}},$ найденных из экспериментальных данных, а $t_{ + }^{*}$ – в рамках трехпроводной модели. В вариантах 8 и 9 величина $t_{ + }^{*}$ рассчитывается по уравнению Скачарда с использованием экспериментально полученных концентрационных зависимостей электроосмотической проницаемости мембраны и ее потенциометрических чисел переноса, а величина P* рассчитывается в рамках двухфазной модели проводимости (вариант 8) или из экспериментальных данных (вариант 9). В данной работе использовались все описанные способы теоретической оценки величин $t_{ + }^{*}$ и P*, необходимых для расчета величины предельного тока по уравнению (1).
Рис. 1.
Схема расчета плотности предельного тока с использованием различных модельных подходов для оценки истинного числа переноса противоионов в мембране и дифференциального коэффициента ее диффузионной проницаемости (номера, указанные на рисунке, соответствуют вариантам расчета, описанным в тексте).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Объектами исследования являлись перфторированные сульфокатионитовые мембраны МФ‑4СК с близкими значениями обменной емкости в сухом состоянии (Q), но разным влагосодержанием (W, ${{{{{\text{г}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}} \mathord{\left/ {\vphantom {{{{{\text{г}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}} {{{{\text{г}}}_{{{\text{сух}}}}}}}} \right. \kern-0em} {{{{\text{г}}}_{{{\text{сух}}}}}}}$) и, как следствие, различной удельной влагоемкостью, представляющей собой усредненное количество молей воды, приходящееся на 1 моль ионогенных групп (n, моль H2O/моль). Выбор данных образцов обусловлен тем, что влагосодержание мембраны оказывает существенное влияние на ее электротранспортные свойства. Мембраны с различным влагосодержанием получали в результате обработки исходного образца МФ-4СК-1 органическим растворителем, смешивающимся с водой, при температуре выше температуры стеклования иономера. Для указанного образца температура стеклования составляла 110°С. В качестве растворителя использовали этиленгликоль. Величина влагосодержания мембраны регулировалась временем ее обработки – от 10 с до 3 мин. Растворитель удаляли нагреванием мембран в деионизованной воде при 100°С, при этом воду трижды заменяли на свежую порцию. Физико-химические характеристики исследованных мембран представлены в табл. 1. В этой же таблице приведены характеристики образца МФ‑4СК-4, который использовался для экспериментальной проверки теоретических расчетов величины ilim.
Таблица 1.
Физико-химические характеристики мембран МФ-4СК в 0.1 М растворе NaCl
| Образец | l, мкм | Q, ммоль/гсух | W, ${{{{{\text{г}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}} \mathord{\left/ {\vphantom {{{{{\text{г}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}} {{{{\text{г}}}_{{{\text{сух}}}}}}}} \right. \kern-0em} {{{{\text{г}}}_{{{\text{сух}}}}}}}$ | n, моль H2O/моль |
|---|---|---|---|---|
| МФ-4СК-1 | 210 ± 5 | 0.78 | 0.159 | 11.3 |
| МФ-4СК-2 | 230 ± 3 | 0.78 | 0.284 | 20.2 |
| МФ-4СК-3 | 270 ± 8 | 0.78 | 0.512 | 36.5 |
| МФ-4СК-4 | 310 ± 4 | 0.71 | 0.254 | 19.9 |
Проверка возможности теоретической оценки предельного тока выполнена также для образцов МФ-4СК, модифицированных допантами органической и неорганической природы (табл. 2). В качестве органических веществ использовались поливинилбутираль (ПБ), который является гидрогелем и способен удерживать воду в структуре мембраны, а также сульфированный полисульфон (СПС), который является ионообменником (Q = 2.00 ммоль/гсух). Изготовление мембран осуществлялось методом полива с использованием 10% по весу раствора сополимера Ф-4СК в диметилформамиде и 5% по весу растворов СПС и ПБ в воде [44]. Совмещение полимеров осуществляли путем перемешивания соответствующих растворов при комнатной температуре в течение 30 мин. После этого полученный раствор фильтровали в вакууме через капроновый фильтр, наливали на стекло с ограничивающей рамкой и помещали в термостат для удаления растворителя. Количество введенных модифицирующих добавок составляло 5% от веса мембранного полимера.
Таблица 2.
Объекты исследования
| Перфторированная мембрана МФ-4СК | 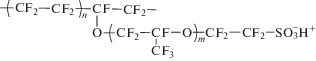 |
| Модифицирующие добавки | |
| Поливинилбутираль |  |
| Сульфированный полисульфон |  |
| Кислый фосфат циркония | Zr(HPO4)2 |
В качестве минерального допанта использовался неорганический ионообменник – кислый фосфат циркония (КФЦ). Гибридные мембраны, модифицированные КФЦ, готовились аналогичным способом. На первой стадии осуществлялось совмещение водного раствора хлорокиси циркония ZrOCl2.8H2O с раствором перфторсульфокислоты Ф-4СК. После получения пленки ее помещали в раствор фосфорной кислоты для осаждения кислого фосфата циркония Zr(HPO4)2. В исследованном образце количество введенной добавки КФЦ составляло 18% от веса мембранного полимера.
Мембрана МФ-4СК, модифицированная КФЦ, была также получена на основе экструзионной мембраны. Для этого мембрана МФ-4СК в Н+-форме выдерживалась в водном растворе этанола, а затем в растворе ZrOCl2.8H2O, после чего помещалась в раствор фосфорной кислоты для осаждения КФЦ. Все образцы получены в ОАО “Пластполимер” специально для применения в твердотельных топливных элементах и мембранных электролизерах. В табл. 3 представлены физико-химические характеристики исходных и модифицированных перфторированных мембран. Значения обменной емкости образцов МФ-4СК/ПБ и МФ‑4СК/СПС были рассчитаны, исходя из состава мембраны; обменная емкость образцов МФ‑4СК/КФЦ была определена экспериментально путем титрования выделившихся Н+-ионов при реакции нейтрализации щелочью.
Таблица 3.
Физико-химические характеристики исходных и модифицированных перфторированных мембран
| № | Мембрана | l, мкм | Q, ммоль/гсух | W, ${{{{{\text{г}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}} \mathord{\left/ {\vphantom {{{{{\text{г}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}} {{{{\text{г}}}_{{{\text{сух}}}}}}}} \right. \kern-0em} {{{{\text{г}}}_{{{\text{сух}}}}}}}$ | n, моль H2O/моль |
|---|---|---|---|---|---|
| Поливные мембраны | |||||
| 1 | МФ-4СК | 62 ± 3 | 0.98 | 0.311 | 17.6 |
| 2 | МФ-4СК/ПБ | 55 ± 3 | 0.93 | 0.360 | 21.5 |
| 3 | МФ-4СК/СПС | 65 ± 5 | 1.03 | 0.330 | 17.8 |
| 4 | МФ-4СК/КФЦ | 61 ± 2 | 2.84 | 0.348 | 6.8 |
| Экструзионные мембраны | |||||
| 5 | МФ-4СК | 85 ± 5 | 0.93 | 0.260 | 15.5 |
| 6 | МФ-4СК/КФЦ | 105 ± 5 | 1.20 | 0.314 | 9.0 |
Для экспериментальной проверки теоретических расчетов величины ilim выполнено измерение вольт-амперных характеристик (ВАХ) мембран МФ-4СК в диапазоне концентраций растворов хлорида натрия 0.01–0.1 М. Измерение ВАХ осуществлялось в четырехкамерной ячейке [45] с двумя поляризующими платиновыми электродами, с помощью которых на систему подавался ток с постоянной скоростью развертки 1 × 10–4 А/с. Регистрация мембранного потенциала проводилась в режиме реального времени с частотой дискретизации 1 раз в секунду с помощью измерительных хлоридсеребряных электродов, подведенных к поверхности ионообменной мембраны и подключенных к потенциостату-гaльванoстату Autolab PGSTAT302N. Постоянная скорость циркуляции раствора в ячейке 14 мл/мин обеспечивалась многоканальным перистальтическим насосом. Величина предельного тока определялась методом касательных в программе Microsoft Excel.
Для нахождения параметров расширенной трехпроводной модели была определена удельная электропроводность ионообменных мембран в широкой области концентраций раствора хлорида натрия от 0.05 до 3 М. Удельная электропроводность мембран (κm, См/м) рассчитывалась на основании измерения активной части импеданса мембраны ртутно-контактным методом. Интегральный коэффициент диффузионной проницаемости Pm определялся в двухкамерной ячейке при диффузии растворов хлорида натрия различной концентрации через мембрану в воду по методике, подробно описанной в [40]. Кажущиеся числа переноса ионов в мембранах определялись потенциометрическим методом в двухкамерной ячейке в условиях циркуляции раствора, концентрация которого по обе стороны мембраны отличалась в 2 раза. Измерение мембранного потенциала осуществлялось с помощью хлоридсеребряных электродов. Электроосмотическая проницаемость мембран, необходимая для расчета истинных чисел переноса противоионов в мембранах по уравнению Скачарда, определялась объемным методом в двухкамерной ячейке с поляризующими обратимыми хлоридсеребряными электродами и горизонтально расположенными измерительными капиллярами [26]. Погрешность экспериментального определения электротранспортных характеристик мембран не превышала 5%.
Для расчетов использовались характеристики раствора хлорида натрия, приведенные в справочной литературе: табличные значения удельной электропроводности [46, 47], коэффициентов диффузии, средних коэффициентов активности [47, 48], а также чисел переноса ионов [47] в широком диапазоне концентраций раствора NaCl. В случае отсутствия значения характеристики при некоторой концентрации эта величина определялась на основании полинома, описывающего концентрационную зависимость этого свойства. При расчете коэффициентов активности и поправочного коэффициента ${{\pi }_{ \pm }},$ учитывающего неидеальность раствора, приведенные в справочной литературе моляльные концентрации пересчитывались в молярные с учетом плотности раствора хлорида натрия при 20°С [46].
РЕЗУЛЬТАТЫ РАСЧЕТА ЭЛЕКТРОДИФФУЗИОННЫХ ХАРАКТЕРИСТИК И ВЕЛИЧИНЫ ПРЕДЕЛЬНОГО ТОКА ДЛЯ ПЕРФТОРИРОВАННЫХ МЕМБРАН С РАЗЛИЧНОЙ ВЛАГОЕМКОСТЬЮ
Для оценки диапазона концентраций раствора NaCl, в котором возможна корректная оценка величин $t_{ + }^{*}$ и P* каждым из приведенных на рис. 1 вариантом расчета, использованы экспериментальные данные по концентрационным зависимостям удельной электропроводности, диффузионной проницаемости, чисел переноса противоионов и воды в перфторированных мембранах МФ-4СК с различной влагоемкостью в широком интервале концентраций раствора NaCl. На рис. 2а–2г сплошными линиями, соединяющими точки, показаны экспериментальные данные, а пунктирными – результаты расчета. Расчет концентрационных зависимостей электропроводности мембран (рис. 2а) проводился по уравнению (13), дифференциального коэффициента диффузионной проницаемости (рис. 2б) – по уравнению (11), истинных чисел переноса ионов (рис. 2в) – по уравнению Скачарда (2) с использованием экспериментальных данных по числам переноса воды (рис. 2г).
Рис. 2.
Концентрационные зависимости удельной электропроводности (а), интегрального коэффициента диффузионной проницаемости (б), чисел переноса противоионов (в) и воды (г) для перфторированных мембран с различной удельной влагоемкостью: 1 – МФ‑4СК-1; 2 – МФ-4СК-2; 3 – МФ-4СК-3 в растворах NaCl. Экспериментальные данные обозначены точками, соединенными сплошными линиями. Результаты расчетов показаны пунктирными линиями.

Транспортно-структурные параметры мембран, необходимые для расчета P*, κm и t* с использованием вариантов расчета 1–9 и найденные из концентрационной зависимости удельной электропроводности и диффузионной проницаемости, представлены в табл. 4.
Таблица 4.
Транспортно-структурные параметры мембран МФ-4СК с различной удельной влагоемкостью
| Мембрана | κiso, См/м | ${{f}_{2}}$ | α | G × 1015, м5/(моль с) | $\beta $ | $c$ |
|---|---|---|---|---|---|---|
| МФ-4СК-1 | 0.635 | 0.12 | 0.293 | 1.50 | 1.40 | 0.006 |
| МФ-4СК-2 | 0.933 | 0.13 | 0.283 | 8.38 | 1.51 | 0.003 |
| МФ-4СК-3 | 1.310 | 0.20 | 0.361 | 61.20 | 1.43 | 0.026 |
В расчетах величины ilim различными вариантами значение δ составляло 2.5 × 10–4 м, которое было найдено из формулы Пирса, при этом использовалась величина ilim, определенная из экспериментально измеренной вольт-амперной кривой.
Сопоставление результатов теоретических расчетов величин удельной электропроводности и интегрального коэффициента диффузионной проницаемости с их экспериментальными значениями позволило выявить диапазон концентраций раствора NaCl, в котором возможна корректная оценка величин $t_{ + }^{*}$ и P* каждым из приведенных на рис. 1 вариантом расчета. Так, вариант 1 с использованием двухфазной модели проводимости может быть реализован только в области концентраций, которой ограничено применение этой модели, то есть до величины, соответствующей максимальному значению удельной электропроводности на ее концентрационной зависимости, как это было показано в работе [49]. Это 0.5 М для мембраны МФ-4СК-3 и 1 М для остальных мембран с меньшей удельной влагоемкостью. Рассчитать ilim в наибольшем диапазоне концентраций удается с использованием вариантов расчета 7 и 9 (табл. 5).
Таблица 5.
Значения плотности предельного тока, рассчитанные как среднее из всех использованных вариантов, и результаты статистической обработки полученных данных
| C, М | ilim, А/м2 | Номера реализованных вариантов расчета | ∆, % | ||||||
|---|---|---|---|---|---|---|---|---|---|
| МФ-4СК-1 | МФ-4СК-2 | МФ-4СК-3 | МФ-4СК-1 | МФ-4СК-2 | МФ-4СК-3 | МФ-4СК-1 | МФ-4СК-2 | МФ-4СК-3 | |
| 0.05 | 48.09 | 48.13 | 49.68 | 1–9 | 1–9 | 1–9 | 0.2 | 0.1 | 0.2 |
| 0.1 | 93.99 | 94.06 | 98.22 | 1–9 | 1–9 | 1–9 | 0.3 | 0.1 | 0.5 |
| 0.5 | 470.52 | 471.13 | 536.85 | 1–9 | 1–9 | 1–9 | 0.8 | 0.9 | 3.9 |
| 1.0 | 971.72 | 979.1 | 1201.56 | 1–9 | 1–9 | 3, 5, 7, 9 | 1.8 | 2.9 | 2.8 |
| 1.5 | 1574.68 | 1524.78 | 2163.49 | 7, 9 | 7, 9 | 3, 5, 7, 9 | 7.4 | 11.5 | 0.6 |
| 2.0 | 2267.34 | 2137.71 | 2452.73 | 7, 9 | 7, 9 | 5, 7, 9 | 10.7 | 15.7 | 4.4 |
| 2.5 | 3146.68 | 2905.9 | 3291.16 | 7, 9 | 7, 9 | 7, 9 | 17.7 | 24.0 | 10.3 |
| 3.0 | 4072.77 | 3660.14 | 4218.29 | 7, 9 | 7, 9 | 7, 9 | 20.4 | 28.4 | 13.6 |
Статистический анализ полученных значений предельной плотности тока выполнен с использованием встроенных функций Microsoft Excel. В табл. 5 представлены средние значения ilim из величин, рассчитанных различными способами. Если усреднялись 3 и более значений, то далее определись величины стандартного отклонения и доверительный интервал Стьюдента при вероятности 0.95. Величина погрешности (∆) в этом случае рассчитывалась как отношение величины доверительного интервала к среднему значению. В случаях оценки величины предельной плотности тока в концентрированных растворах, когда использовалось 2 варианта расчета, величина ∆ определялась по формуле:
(14)
$\Delta = \frac{{\left| {i_{{\lim }}^{m} - i_{{\lim }}^{n}} \right|}}{{{{{\bar {i}}}_{{\lim }}}}} \times 100\% ,$Как видно из табл. 5, диапазон концентраций раствора NaCl, в котором возможна оценка величины ilim с погрешностью, не превышающей 10%, зависит от влагоемкости мембраны: для образцов МФ-4СК-1 и МФ-4СК-2 он ограничен 1.5 М, а для более влагоемкого образца МФ‑4СК-3 – до 2.5 М. Однако, если для расчета использовать только экспериментальные данные по концентрационным зависимостям кажущихся чисел переноса ионов, чисел переноса воды и диффузионной проницаемости (варианты 7, 9), то теоретическая оценка величины ilim, может быть корректно выполнена во всем исследованном диапазоне концентраций.
В табл. 6 представлены результаты расчета P* и $t_{ + }^{*}$ различными способами для мембран с различной влагоемкостью в 0.05 М растворе NaCl. В этой же таблице приведены усредненные результаты расчета величины ilim по формуле (1), выполненные каждым из 9 вариантов согласно схеме на рис. 1, а также значения ilim, найденные из экспериментально измеренных вольт-амперных кривых для перфторированных мембран, имеющих близкие электротранспортные характеристики.
Таблица 6.
Транспортные характеристики мембран МФ-4СК в 0.05 М растворе NaCl
| Образец | $t_{ + }^{*}$ | P* × 1012, м2/с | ilim, А/м2 | ||||
|---|---|---|---|---|---|---|---|
| (2) | (3) | уравнение (4) | (9) | (11) | среднее из 9 вариантов расчета | эксперимент | |
| МФ-4СК-1 | 1.000 | 0.998 | 0.999 | 3.22 | 3.43 | 48.09 ± 0.09 | – |
| МФ-4СК-2 | 1.000 | 0.999 | 0.999 | 6.97 | 6.68 | 48.13 ± 0.03 | – |
| МФ-4СК-3 | 0.991 | 0.992 | 0.996 | 40.00 | 46.71 | 49.68 ± 0.12 | – |
| МФ-4СК-4 | – | – | – | – | – | – | 50.9 ± 1.7 |
Анализ результатов, представленных в табл. 6, показывает, что в разбавленных растворах электролитов рассчитанная величина предельного тока практически не зависит от электротранспортных характеристик мембраны и совпадает с величиной ilim, найденной из эксперимента.
Значения ilim, рассчитанные в широком диапазоне концентраций раствора NaCl для мембран MФ-4СK с разной удельной влагоемкостью, показаны на рис. 3. Для расчета применялся вариант 7 (рис. 1), предполагающий использование значений P* и ${{\kappa }_{{\text{m}}}},$ найденных из экспериментальных данных, а $t_{i}^{*}$ – в рамках трехпроводной модели. Кроме того, на рис. 3 представлены значения плотности предельного тока, найденные из экспериментально измеренных вольт-амперных кривых для образца МФ-4СК-4 с близким к образцу МФ-4СК-2 влагосодержанием (табл. 1). Диапазон измерения экспериментальной зависимости ограничен техническими возможностями приборов и не превышает 0.1 М для данных условий эксперимента. Как видно из рисунка, в диапазоне концентраций от 0.01 до 0.1 М между экспериментально полученной и теоретически рассчитанной зависимостями наблюдается хорошее согласие. При этом увеличение удельной влагоемкости мембраны в 2 раза не оказывает существенного влияния на значение ilim. Однако увеличение этой характеристики в 3 раза уже приводит к значительному возрастанию величины ilim (рис. 3, кривая 3). Можно предположить, что в области концентрированных растворов вклад второго слагаемого в уравнении (1) в величину ilim становится более существенным. Этот член (i2) в уравнении (1) фактически учитывает вклад обратной диффузии электролита и может быть оценен по формуле:
(15)
${{\frac{{P{\text{*}}FC}}{{l\left( {t_{i}^{*} - {{t}_{i}}} \right)}}} \mathord{\left/ {\vphantom {{\frac{{P{\text{*}}FC}}{{l\left( {t_{i}^{*} - {{t}_{i}}} \right)}}} {{{i}_{{\lim }}}}}} \right. \kern-0em} {{{i}_{{\lim }}}}} = \frac{{{{i}_{2}}}}{{{{i}_{{\lim }}}}} \times 100\% .$Рис. 3.
Концентрационные зависимости предельной плотности тока, рассчитанной теоретически вариантом 7 (сплошные линии) (а) и найденной из экспериментально измеренных вольт-амперных кривых (точки) (б): 1 – МФ-4СК-1; 2 – МФ-4СК-2; 3 – МФ-4СК-3; 4 – МФ-4СК-4 (экспериментальные данные).

Как видно из рис. 4, в случае наиболее влагоемкой мембраны этот вклад достигает 8%. Анализ полученных концентрационных зависимостей показывает, что вклад второго члена в (1) увеличивается с ростом концентрации раствора до 1.5 М, после чего достигает постоянного значения, поскольку тот же характер имеет концентрационная зависимость коэффициента диффузионной проницаемости (рис. 2б).
Рис. 4.
Вклад обратной диффузии электролита в величину предельного тока как функция концентрации раствора NaCl для мембран с различной удельной влагоемкостью: 1 – МФ-4СК-1; 2 – МФ-4СК-2; 3 – МФ-4СК-3.

Таким образом, показано, что уточненное уравнение Пирса позволяет правильно вычислять значение предельного диффузионного тока в широком диапазоне концентраций раствора электролита. Использование этого уравнения является обязательным в случае образцов с удельной влагоемкостью более 20 моль Н2О/моль функциональных групп, поскольку обратной диффузией раствора электролита нельзя пренебрегать.
РЕЗУЛЬТАТЫ РАСЧЕТА ЭЛЕКТРОДИФФУЗИОННЫХ ХАРАКТЕРИСТИК И ВЕЛИЧИНЫ ПРЕДЕЛЬНОГО ТОКА ДЛЯ МОДИФИЦИРОВАННЫХ ПЕРФТОРИРОВАННЫХ МЕМБРАН
Описанный для мембран с различной удельной влагоемкостью подход к оценке величины предельного тока был использован для расчета этой характеристики в перфторированных мембранах, модифицированных поливинилбутиралем, сульфированным полисульфоном и кислым фосфатом циркония. С этой целью для перечисленных образцов были экспериментально определены их электропроводность и диффузионная проницаемость в растворах NaCl различной концентрации. Как видно из рис. 5а, ведение органических модификаторов приводит к уменьшению удельной электропроводности во всей области исследуемых концентраций, при этом более существенный эффект наблюдается для мембраны, модифицированной поливинилбутиралем.
Рис. 5.
Зависимость удельной электропроводности (а, в) и дифференциального коэффициента диффузионной проницаемости (б, г) исходных и модифицированных мембран от концентрации раствора NaCl. Номер у кривой соответствует номеру образца в табл. 3. Точки, соединенные сплошными линиями – экспериментальные данные, пунктирные линии – результат расчета по уравнению (11) (б, г) и уравнению (13) (а, в).

Как видно из рис. 5, введение модифицирующих добавок КФЦ приводит к возрастанию удельной электропроводности перфторированных мембран независимо от способа их изготовления во всем исследованном диапазоне концентраций равновесных растворов хлорида натрия (рис. 5а, 5в). Возможной причиной этого является более высокая обменная емкость образцов с КФЦ по сравнению со всеми остальными мембранами. Однако на величину диффузионной проницаемости модифицирование КФЦ влияет по-разному, что связано со способом введения модификатора в матрицу перфторированной мембраны. Так коэффициент диффузионной проницаемости образца, полученного методом полива, ниже в 1.5 раза по сравнению с исходной мембраной (рис. 5б), в то время как модифицирование экструзионной мембраны КФЦ приводит к увеличению коэффициента диффузионной проницаемости во всем диапазоне исследуемых концентраций приблизительно в 6 раз (рис. 5г). В случае экструзионной мембраны прекурсор КФЦ вводился в готовую пленку, которая предварительно выдерживалась в этаноле для расширения структуры мембраны [50, 51] и увеличения количества введенного модификатора. Происходящее при этом расширение транспортных каналов даже после формирования в мембране частиц КФЦ облегчает диффузию электролита. В поливных мембранах распределение неорганической фазы в полимере более однородное, так как совмещение компонентов осуществлялось в растворах, прекурсор добавляли в раствор перфторсульфокислоты, после чего пленку отливали. Полученные результаты качественно согласуются с данными авторов [52], которые для объяснения наблюдаемых эффектов использовали модель, в соответствии с которой включения модифицирующих добавок в кластерах мембраны играют роль препятствий при диффузии электролита.
Полученные экспериментальные данные по концентрационным зависимостям удельной электропроводности и диффузионной проницаемости модифицированных мембран были использованы для расчета транспортно-структурных параметров (f2, κiso, α, G и β), с помощью которых рассчитывались электродиффузионные характеристики мембран (P* и $t_{ + }^{*}$), необходимые для оценки предельного диффузионного тока. Расчет электродиффузионных характеристик проводился с применением варианта 3 (рис. 1). Значения найденных модельных параметров и электродиффузионных характеристик приведены в табл. 7.
Таблица 7.
Модельные параметры и электродиффузионные характеристики модифицированных мембран
| Образец | f2 | κiso, См/м | α | G × 1015, м5/(моль с) | β | P*× 1012, м2/с | t* |
|---|---|---|---|---|---|---|---|
| Поливные мембраны | |||||||
| МФ-4СК | 0.16 | 0.686 | 0.16 | 90.8 | 1.70 | 18.6 | 0.997 |
| МФ-4СК/ПБ | 0.05 | 0.379 | 0.44 | 37.1 | 1.62 | 6.7 | 0.998 |
| МФ-4СК/СПС | 0.01 | 0.540 | 0.68 | 42.8 | 1.60 | 6.2 | 0.999 |
| МФ-4СК/КФЦ | 0.11 | 0.897 | 0.19 | 85.0 | 1.70 | 12.9 | 0.998 |
| Экструзионные мембраны | |||||||
| МФ-4СК | 0.05 | 0.428 | 0.37 | 32.8 | 1.69 | 25.8 | 0.996 |
| МФ-4СК/КФЦ | 0.06 | 0.660 | 0.55 | 252 | 1.66 | 156.7 | 0.975 |
Рассчитанные по уравнению (1) значения ilim и, по формуле (15), вклад обратной диффузии электролита в величину предельного тока (i2/ilim) представлены в табл. 8. Анализ полученных результатов показал, что для мембран, изготовленных методом полива, различия в величине ilim составляют 3–4% независимо от природы модификатора. Практически одинаковые значения ilim для этих образцов связаны с их высокой селективностью и относительно низкой диффузионной проницаемостью, в результате чего вклад обратной диффузии электролита в величину предельного тока не превышает 5%. Однако, согласно выполненным расчетам, величина ilim для экструзионной мембраны, модифицированной КФЦ, должна увеличиться на 14% из-за существенного увеличения диффузионной проницаемости этого образца.
Таблица 8.
Плотность предельного тока для мембран в 0.05 М растворе NaCl и вклад обратной диффузии электролита в его величину
| № | Мембрана | ilim, А/м2 | i2, А/м2 | $\frac{{{{i}_{2}}}}{{{{i}_{{\lim }}}}},\,\,\% $ | |
|---|---|---|---|---|---|
| эксперимент | расчет | ||||
| Поливные мембраны | |||||
| 1 | МФ-4СК | 43.7 ± 1.4 | 50.52 | 2.44 | 4.8 |
| 2 | МФ-4СК/ПБ | 44.1 ± 1.4 | 48.97 | 0.99 | 2.0 |
| 3 | МФ-4СК/СПС | 44.0 ± 0.5 | 48.68 | 0.76 | 1.6 |
| 4 | МФ-4СК/КФЦ | 50.3 ± 1.2 | 49.68 | 1.72 | 3.5 |
| Экструзионные мембраны | |||||
| 5 | МФ-4СК | 47.6 ± 1.9 | 50.59 | 2.48 | 4.9 |
| 7 | МФ-4СК/КФЦ | 52.0 ± 1.2 | 57.71 | 7.82 | 13.5 |
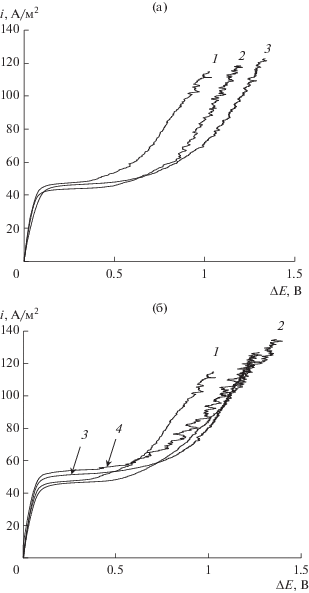
Для экспериментальной проверки адекватности теоретического расчета величины ilim для модифицированных мембран были измерены их вольт-амперные характеристики в 0.05 М растворе NaCl (рис. 6). Как видно из рисунка, для всех образцов исходных и модифицированных мембран наклон омического участка поляризационной кривой примерно одинаков, так как вклад мембраны в общее сопротивление электромембранной системы существенно меньше, чем прилегающих диффузионных слоев раствора. Найденные из полученных ВАХ значения плотности предельного тока представлены в табл. 8. Из таблицы видно, что мембраны, изготовленные методом полива, имеют близкие значения ilim, а величина ilim для экструзионной мембраны, модифицированной КФЦ, увеличивается на 9%, что согласуется с результатами теоретического расчета. Обнаруженное экспериментально увеличение ilim для образца поливной мембраны с КФЦ свидетельствует о необходимости дальнейшего развития подходов к теоретической оценке предельного диффузионного тока в системах с модифицированными мембранами и учета дополнительных факторов, обусловленных влиянием модификатора.
ЗАКЛЮЧЕНИЕ
Проведен анализ особенностей применения различных модельных подходов к оценке электродиффузионных характеристик мембран, необходимых для расчета предельного диффузионного тока: двухфазной модели структурно-неоднородной мембраны и трехпроводной модели проводимости ионообменного материала. Расчет плотности предельного диффузионного тока выполнен по уточненному уравнению Пирса, учитывающему селективность мембраны и вклад обратной диффузии электролита. Необходимые для расчета предельного тока числа переноса противоиона в мембране и дифференциальный коэффициента ее диффузионной проницаемости определены на основании экспериментальных данных по концентрационным зависимостям удельной электропроводности, диффузионной проницаемости, чисел переноса противоионов и воды в широком интервале концентраций раствора хлорида натрия. На примере перфторированных мембран МФ-4СК с различной удельной влагоемкостью выявлен диапазон концентраций раствора NaCl, в котором возможен теоретический расчет электродиффузионных характеристик мембран. Показано, что область концентраций, в которой возможно корректно оценить плотность предельного тока, зависит от используемого модельного подхода и удельной влагоемкости мембраны. Использование уточненного уравнения Пирса является обязательным в случае образцов с удельной влагоемкостью более 20 моль Н2О/моль функциональных групп, поскольку обратной диффузией раствора электролита в этом случае пренебрегать нельзя.
Сравнение результатов расчета плотности предельного диффузионного тока с его величиной, найденной из экспериментально измеренных вольт-амперных кривых, показало возможность адекватной теоретической оценки этого параметра для перфторированных мембран МФ-4СК, модифицированных допантами органической и неорганической природы. Это позволяет на основании сравнительно простых измерений транспортных характеристик модифицированных ионообменных мембран предсказать степень влияния модификатора не только на транспортные свойства, но и величину предельного тока в заданных условиях, а следовательно, прогнозировать эффективность использования данных модификаций мембран в электромембранных процессах при решении конкретных практических задач.
Список литературы
Galama, A.H., Saakes, M., Bruning, H., Rijnaarts, H.H.M., and Post, J.W., Seawater predesalination with electrodialysis, Desalination, 2014, vol. 342, p. 61.
Moon, S.-H. and Yun, S.-H., Process integration of electrodialysis for a cleaner environment, Current Opinion in Chemical Engineering, 2014, vol. 4, p. 25.
Ярославцев, А.Б., Никоненко, В.В. Ионообменные мембранные материалы: свойства, модификация и практическое применение. Рос. нанотехнологии. 2009. Т. 4. № 3–4. С. 44. [Yaroslavtsev, A.B. and Nikonenko, V.V., Ion-exchange membrane materials: Properties, modification, and practical application, Nanotechnologies in Russia, 2009, vol. 4, p. 137.]
Заболоцкий, В.И., Протасов, К.В., Шарафан, М.В. Исследование процесса электродиализного концентрирования хлорида натрия с гибридными органо-неорганическими ионообменными мембранами. Электрохимия. 2010. Т. 46. С. 1044. [Zabolotskii, V.I., Protasov, K.V., and Sharafan, M.V., Sodium chloride concentration by electrodialysis with hybrid organic-inorganic ion-exchange membranes: an investigation of the process, Russ. J. Electrochem., 2010, vol. 46, p. 979.]
Протасов, К.В., Шкирская, С.А., Березина, Н.П., Заболоцкий, В.И. Применение композитных сульфокатионитовых мембран, модифицированных полианилином, для электродиализного концентрирования солевых растворов. Электрохимия. 2010. Т. 46. С. 1209. [Protasov, K.V., Shkirskaya, S.A., Berezina, N.P., and Zabolotskii, V.I., Сomposite sulfonated cation-exchange membranes modified with polyaniline and applied to salt solution concentration by electrodialysis, Russ. J. Electrochem., 2010, vol. 46, p. 1131.]
Мембраны и мембранные технологии, Отв. ред. Ярославцев, А.Б., М.: Научный мир, 2013. 612 с. [Membranes and membranes technologies (in Russian), edited by Yaroslavtsev, A.B., M.: Nauchnyi mir, 2013. 612 p.]
Заболоцкий, В.И., Никоненко, В.В. Перенос ионов в мембранах, М.: Наука, 1996. С. 392. [Zabolotskii, V.I. and Nikonenko, V.V., Ion transport in membranes (in Russian), M.: Nauka, 1996. 392 p.]
Melnikov, S., Loza, S., Sharafan, M., and Zabolotskiy V., Electrodialysis treatment of secondary steam condensate obtained during production of ammonium nitrate. Technical and economic analysis, Sep. Pur. Tech., 2016, vol. 157, p. 179.
Martí-Calatayud, M.C., García-Gabaldón, M., and Pérez-Herranz, V., Effect of the equilibria of multivalent metal sulfates on the transport through cation-exchange membranes at different current regimes, J. Membr. Sci., 2013, vol. 443, p. 1.
Zerdoumi, R., Oulmi, K., and Benslimane, S., Electrochemical characterization of the CMX cation exchange membrane in buffered solutions: Effect on concentration polarization and counterions transport properties, Desalination, 2014, vol. 340, p. 42.
Елисеева, Т.В., Харина, А.Ю. Особенности вольтамперных и транспортных характеристик анионообменных мембран при электродиализе растворов, содержащих алкилароматическую аминокислоту и минеральную соль. Электрохимия. 2015. Т. 51. С. 74. [Eliseeva, T.V. and Kharina, A.Y., Voltammetric and transport characteristics of anion-exchange membranes during electrodialysis of solutions containing alkylaromatic amino acid and a mineral salt, Russ. J. Electrochem., 2015, vol. 51, p. 63.]
Ul Afsar, N., Ge, X., Zhao, Z., Hussain, A., He, Y., Ge, L., and Xu, T., Zwitterion membranes for selective cation separation via electrodialysis, Sep. Pur. Tech., 2021, vol. 254, p. 117619.
Ahmad, M., Yaroshchuk, A., and Bruening, M.L., Moderate pH changes alter the fluxes, selectivities and limiting currents in ion transport through polyelectrolyte multilayers deposited on membranes, J. Membr. Sci., 2020, vol. 616, p. 118570.
Benvenuti, T., García-Gabaldón, M., Ortega, E.M., Rodrigues, M.A.S., Bernardes, A.M., Pérez-Herranz, V., and Zoppas-Ferreira, J., Influence of the co-ions on the transport of sulfate through anion exchange membranes, J. Membr. Sci., 2017, vol. 542, p. 320.
Li, J., Yuan, S., Wang, J., Zhu, J., Shen, J., and Van der Bruggen, B., Mussel-inspired modification of ion exchange membrane for monovalent separation, J. Membr. Sci., 2018, vol. 553, p. 139.
Mikhaylin, S. and Bazinet, L., Fouling on ion-exchange membranes: Classification, characterization and strategies of prevention and control, Adv. Colloid and Interface Sci., 2016, vol. 229, p. 34.
Gallya, C., García-Gabaldón, M., Ortega, E.M., Bernardes, A.M., and Pérez-Herranz, V., Chronopotentiometric study of the transport of phosphoric acid anions through an anion-exchange membrane under different pH values, Sep. Pur. Tech., 2020, vol. 238, 116421.
Hao, L., Wang, C., Chen, Q., Yu, X., Liao, J., Shen, J., and Gao, C., A facile approach to fabricate composite anion exchange membranes with enhanced ionic conductivity and dimensional stability for electrodialysis, Sep. Pur. Tech., 2019, vol. 227, p. 115725.
Le, X.T., Concentration polarization and conductance of cation exchange membranes in sulfuric acid and alkaline sulfate media, J. Membr. Sci., 2012, vol. 397–398, p. 66.
Филиппов, А.Н. Асимметрия вольт-амперной характеристики: бислойная модель модифицированной ионообменной мембраны. Коллоид. журн. 2016. Т. 78. № 3. С. 386. [Filippov, A.N., Asymmetry of current–voltage characteristics: a bilayer model of a modified ion-exchange membrane, Colloid J., 2016, vol. 78, p. 397.]
Филиппов, А.Н. Асимметрия вольт-амперной характеристики ионообменных мембран: модель линейной по толщине мембраны плотности зарядов фиксированных групп. Электрохимия. 2017. Т. 53. С. 292. [Filippov, A.N., Asymmetry of current–voltage characteristics of ion-exchange membranes: Model of charge density of fixed groups linear by membrane thickness, Russ. J. Electrochem., 2017, vol. 53, p. 257.]
Шапошник, В.А. Васильева, В.И., Кессоре, К. Интерферометрический метод измерения предельной плотности тока диффузии на ионообменных мембранах. Электрохимия. 1991. Т. 27. С. 891. [Shaposhnik, V.A., Vasileva, V.I., and Quessore, C., Interferometric determination of the limiting diffusion currents at ion-exchange membranes, Soviet electrochem., 1991, vol. 27, p. 784.]
Шапошник, В.А., Васильева, В.И., Григорчук, О.В., Явления переноса в ионообменных мембранах, М.: Изд-во МФТИ, 2001. 200 с. [Shaposhnik, V.A., Vasileva, V.I., and Grigorchuk, O.V., Transport phenomena in ion exchange membranes (in Russian), M.: MFTI, 2001. 200 p.]
Chamoulaud, G. and Belanger, D., Modification of ion-exchange membrane used for separation of protons and metallic cations and characterization of the membrane by current-voltage curves, J. Colloid. Interface Sci., 2005, vol. 281, p.179.
Ibanez, R., Stamatialis, D.F., and Wessling, M., Role of membrane surface in concentration polarization at cation exchange membranes, J. Membr. Sci., 2004, vol. 239, p. 119.
Письменская, Н.Д., Мареев, С.А., Похидня, Е.В., Ларше, К., Даммак, Л., Никоненко, В.В. Влияние модификации поверхности гетерогенной анионообменной мембраны на интенсивность электроконвекции у ее поверхности. Электрохимия. 2019. Т. 55. С. 1471. [Pismenskaya, N.D., Mareev, S.A., Pokhidnya, E.V., Larchet, C., Dammak, L., and Nikonenko, V.V., Effect of surface modification of heterogeneous anion-exchange membranes on the intensity of electroconvection at their surfaces, Russ. J. Electrochem., 2019, vol. 55, p. 1203.]
Никоненко, В.В., Мареев, С.А., Письменская, Н.Д., Узденова, А.М., Коваленко, А.В., Уртенов, М.Х., Пурсели, Ж. Эффект электроконвекции и его использование в электродиализе [обзор]. Электрохимия. 2017. Т. 53. С. 1266. [Nikonenko, V.V., Mareev, S.A., Pis’menskaya, N.D., Kovalenko, A.V., Urtenov, M.K., Uzdenova, A.M., and Pourcelly, G., Effect of electroconvection and its use in intensifying the mass transfer in electrodialysis (review), Russ. J. Electrochem., 2017, vol. 53, p. 1122.]
Akberova, E.M. and Vasil’eva, V.I., Effect of the resin content in cation-exchange membranes on development of electroconvection, Electrochem. Commun., 2020, vol. 111, p. 106659.
Balster, J., Yildirim, M.H., Stamatialis, D.F., Ibanez, R., Lammertink, R.G.H., Jordan, V., and Wessling, M., Morphology and microtopology of cation-exchange polymers and the origin of the overlimiting current, J. Phys. Chem. B, 2007, vol. 111, p. 2152.
Лоза, Н.В., Долгополов, С.В., Кононенко, Н.А., Андреева, М.А., Коршикова, Ю.С. Влияние поверхностного модифицирования перфторированных мембран полианилином на их поляризационное поведение. Электрохимия. 2015. Т. 51. С. 615. [Loza, N.V., Dolgopolov, S.V., Kononenko, N.A., Andreeva, M.A., and Korshikova, Y.S., Effect of surface modification of perfluorinated membranes with polyaniline on their polarization behavior, Russ. J. Electrochem., 2015, vol. 51, p. 538.]
Гнусин, Н.П., Кононенко, Н.А., Паршиков, С.Б. Электродиффузия через неоднородную ионообменную мембрану с прилегающими диффузионными слоями. Электрохимия. 1994. Т. 30. С. 35. [Gnusin, N.P., Kononenko, N.A., and Parshikov, S.B., Electrodiffusion through an inhomogeneous ion-exchange membrane with adjacent diffusion layers, Russ. J. Electrochem., 1994, vol. 30, p. 28.]
Физика электролитов, под ред. Д. Хладика, М.: Мир, 1978. 556 с. [Physics of electrolytes (in Russian), edited by Hladik, J., Moscow: Mir, 1978. 556 p.]
Демина, О.А., Кононенко, Н.А., Фалина, И.В. Новый подход к характеризации ионообменных мембран с помощью набора модельных параметров. Мембраны и мембранные технологии. 2014. Т. 4. № 2. С. 83. [Demina, O.A., Kononenko, N.A., and Falina, I.V., New approach to the characterization of ion-exchange membranes using a set of model parameters, Petroleum Chem., 2014, vol. 54, p. 515.]
Демина, О.А., Фалина, И.В. Расчет модельных параметров ионообменных материалов в рамках расширенной трехпроводной модели, Свидетельство о государственной регистрации программы для ЭВМ 2014662877 (Россия). 2014. [Demina, O.A. and Falina, I.V., Calculation of extended three-wire model parameters of ion-exchange materials, Certificate RF of state registration of the computer programs № 2014662877 (Russia), 2014.]
Демина, О.А., Шкирская, С.А., Кононенко, Н.А., Назырова, Е.В. Оценка селективности композитных ионообменных мембран с использованием расширенной трехпроводной модели проводимости. Электрохимия. 2016. Т. 52. С. 339. [Demina, O.A., Shkirskaya, S.A., Kononenko, N.A., and Nazyrova, E.V., Assessing the selectivity of composite ion-exchange membranes within the framework of the extended three-wire model of conduction, Russ. J. Electrochem., 2016, vol. 52, p. 291.]
Гнусин, Н.П., Паршиков, С.Б., Демина, О.А. Решение задачи электродиффузионного переноса через ионообменную мембрану при произвольной концентрации внешнего раствора. Электрохимия. 1998. Т. 34. С. 1316. [Gnusin, N.P., Parshikov, S.B., and Demina, O.A., Solution of the problem of electrodiffusion transport across an ion-exchange membrane at an arbitrary concentration of the external solution, Russ. J. Electrochem., vol. 34, p. 1185.]
Гнусин, Н.П., Демина, О.А., Мешечков, А.И., Турьян, И.Я. Электропроводность ионообменных мембран, измеренная на постоянном и переменном токах. Электрохимия. 1985. Т. 21. С. 1525. [Gnusin, N.P., Demina, O.A., Meshechkov, A.I., and Tur’yan, I.Ya., Ion-exchange membrane conductance measured with AC and DC, Soviet electrochem., 1985, vol. 21, p. 1439.]
Демина, О.А., Кононенко, Н.А., Фалина, И.В., Демин, А.В. Теоретическая оценка дифференциальных коэффициентов диффузионной проницаемости ионообменных мембран. Коллоид. журн. 2017. Т. 79. № 3. С. 259. [Demina, O.A., Kononenko, N.A., Falina, I.V., and Demin, A.V., Theoretical estimation of differential coefficients of ion-exchange membrane diffusion permeability, Colloid J., 2017, vol. 79, no. 3, p. 317.]
Гнусин, Н.П., Березина, Н.П., Шудренко, А.А., Ивина, О.П. Диффузия электролита через ионообменные мембраны. Журн. физ. химии. 1994. Т. 68. С. 565. [Gnusin, N.P., Berezina, N.P., Shudrenko, А.А., and Ivina, O.P., Electrolyte diffusion across ion-exchange membranes, Russ.J. Phys.Chem. A., 1994, vol. 68, p. 565.]
Berezina, N.P., Kononenko, N.A., Dyomina, O.A., and Gnusin, N.P., Characterization of ion-exchange membrane materials: Properties vs structure, Advances in Colloid and Interface Science, 2008, vol. 139, nos. 1–2, p. 3.
Gnusin, N.P., Berezina, N.P., Kononenko, N.A., and Dyomina, O.A., Transport structural parameters to characterize ion exchange membranes, J. Membr. Sci., 2004, vol. 243, no. 1–2, p. 301.
Березина, Н.П., Кононенко, Н.А., Демина, О.А., Гнусин, Н.П. Применение модельного подхода для описания физико-химических свойств ионообменных мембран. Высокомолек. соед. Серия А. 2004. Т. 46. № 6. С. 1071. [Berezina, N.P., Kononenko, N.A., Demina, O.A., and Gnusin, N.P., Model approach for describing the properties of ion-exchange membranes, Polymer Sci. Series A, 2004, vol. 46, p. 672.]
Zabolotsky, V.I. and Nikonenko, V.V., Effect of structural membrane inhomogeneity on transport properties, J. Membr. Sci., 1993, vol. 79, p. 181.
Тимофеев, С.В., Кононенко, Н.А., Боброва, Л.П., Березина, Н.П., Лютикова, Е.К., Долгополов, С.В. Электрохимические и диффузионные характеристики модифицированных перфторированных мембран МФ-4СК. Fluorine Notes. 2011. Т. 76. С. 7. [Timofeev, S.V., Kononenko, N.A., Bobrova, L.P., Berezina, N.P., Luticova, E.K., and Dolgopolov, S.B., Electrochemical and diffusion characteristics of modified perfluorinated membranes MF-4SK, Fluorine notes, 2011, vol. 76, p. 7.]
Лоза, Н.В., Кононенко, Н.А., Шкирская, С.А., Березина, Н.П. Поляризационные характеристики ионообменных мембран МФ-4СК в зависимости от метода их модифицирования. Электрохимия. 2006. Т. 42. С. 907. [Loza, N.V., Kononenko, N.A., Shkirskaya, S.A., and Berezina, N.P., Effect of modification of ion-exchange membrane MF-4SK on its polarization characteristics, Russ. J. Electrochem., 2006, vol. 42. p. 815.]
Справочник химика. Том 3, под ред. Грива, З.И., Коц, В.А., Пиастро, В.Д., Томарченко, С.Л., Л.: Химия. 1964. 1008 с. [Chemist,s Handbook, vol. 3 (in Russian), edited by Griva, Z.I., Koc, V.A., Piastro, V.D., and Tomarchenko, S.L., Leningrad: Kchimiya, 1964. 1008 p.]
Справочник по электрохимии, под ред. Сухотина, А.М., Л.: Химия, 1981. 488 с. [Electrochemistry Handbook (in Russian), edited by Suhotin, A.M., Leningrad: Kchimiya, 1981. 488 p.]
Робинсон, Р., Стокс, Р. Растворы электролитов, М.: Изд-во иностр. лит., 1963. 647 с. [Robinson, R.A. and Stokes R.H., Electrolyte solutions, London: Butterworths Sci. Publ., 1959. 559 p.]
Демина, О.А., Фалина, И.В., Кононенко, Н.А. Теоретическая оценка электропроводности ионообменных мембран с учетом пространственной ориентации проводящих фаз. Электрохимия. 2016. Т. 52. С. 347. [Demina, O.A., Falina, I.V., and Kononenko, N.A., Theoretical estimation of conductivity of ion-exchange membranes taking into account to spatial orientation of conducting phases, Russ. J. Electrochem., 2016, vol. 52, p. 299.]
Berezina, N.P., Timofeev, S.V., and Kononenko, N.A., Effect of conditioning techniques of perfluorinated sulphocationic membranes on their hydrophylic and electrotransport properties, J. Membr. Sci., 2002, vol. 209, p. 509.
Kononenko, N.A., Fomenko, M.A., and Volfkovich, Y.M., Structure of perfluorinated membranes investigated by method of standard contact porosimetry, Advances in Colloid and Interface Science, 2015, vol. 222, p. 425.
Шалимов, А.С., Перепелкина, А.И., Стенина, И.А., Ребров, А.И., Ярославцев, А.Б. Транспортные свойства мембран МФ-4СК, модифицированных гидратированным фосфатом циркония, Журн. неорган. химии. 2009. Т. 54. № 3. С. 403. [Shalimov, A.S., Perepelkina, A.I., Stenina, I.A., Rebrov, A.I., and Yaroslavtsev, A.B., Ion transport in MF-4SK membranes modified with hydrous zirconium hydrogen phosphate, Russ. J. Inorganic Chem., 2009, vol. 54, p. 356.]
Дополнительные материалы отсутствуют.