Электрохимия, 2021, T. 57, № 6, стр. 331-343
Многокомпонентные платиносодержащие электрокатализаторы в реакциях восстановления кислорода и окисления метанола
В. С. Меньщиков a, *, С. В. Беленов a, И. Н. Новомлинский a, А. Ю. Никулин a, В. Е. Гутерман a
a Южный федеральный университет, химический факультет
Ростов-на-Дону, Россия
* E-mail: men.vlad@mail.ru
Поступила в редакцию 07.10.2020
После доработки 02.12.2020
Принята к публикации 08.01.2021
Аннотация
Методом жидкофазного синтеза получены катализаторы, содержащие платиновые и биметаллические PtCu-наночастицы, нанесенные на углеродный и композитный SnO2/C-носители. Исследованы состав и структура синтезированных материалов, их каталитическая активность в реакциях электровосстановления кислорода и электроокисления метанола, а также коррозионная стабильность. Установлено, что легирование платины атомами меди и использование композиционного носителя SnO2/C улучшает характеристики катализаторов по сравнению с Pt/C в обеих исследуемых реакциях. При этом существенное значение имеют условия, в частности значение или диапазон значений потенциалов, при которых оценивается активность катализаторов. Многокомпонентный PtCu/(SnO2/C)-катализатор проявляет наиболее высокие активность в реакции электровосстановления метанола и толерантность к промежуточным продуктам его окисления.
ВВЕДЕНИЕ
Прямые метанольные топливные элементы (МТЭ) привлекают все больше внимания как альтернативный источник энергии. Малые выбросы [1], простота хранения и транспортировки топлива [2], небольшой размер и высокая плотность тока [3] делают их перспективными для использования в портативных электронных устройствах [4‒6]. Широкой коммерциализации МТЭ мешает ряд факторов: высокая стоимость электрокатализаторов, во многом обусловленная использованием драгоценных металлов, и низкая долговечность в условиях эксплуатации (деградация мембраны, отравление поверхности Pt промежуточными продуктами окисления метанола, кроссовер метанола в катодную область и обусловленное этим изменение потенциала катода) [7, 8]. Реакция электроокисления метанола (РОМ) включает стадии его адсорбции, дегидрирования и последующего образования интермедиатов, таких как HCOOH, HCOH, COадс и др. [9]. Прочная адсорбция CO значительно снижает активность Pt-катализатора за счет блокировки активных центров. Ключевым моментом в обеспечении быстрого протекания РОМ является использование электрохимически активного и стабильного анодного катализатора. На сегодняшний день наиболее широко изучены PtRu/C- электрокатализаторы, получившие широкое прикладное применение. Более высокую активность PtRu/C-материалов в реакциях электроокисления органических соединений по сравнению с Pt/C связывают с бифункциональным механизмом катализа: на кластерах рутения гораздо легче, чем на платине, адсорбируются группы OH, которые облегчают окисление молекул СО, адсорбированных на соседних кластерах платины [10–12]. Последующее более подробное изучение механизма окисления метанола на PtRu-катализаторах показало, что наряду с бифункциональным механизмом катализа позитивный вклад может вносить и эффект электронного взаимодействия металлов [13, 14]. В последние годы многие исследователи работали над получением новых платино-металлических катализаторов, изменяя состав твердого раствора и архитектуру наночастиц. При этом решали задачи совершенствования как анодных, так и катодных катализаторов, электровосстановлению кислорода на которых мешает кроссовер метанола. Были изучены твердые растворы PtCu [15, 16], PtRu [17], PtSn [18], а также синтезированы материалы, содержащие наночастицы со структурой “оболочка–ядро”, где поверхность образована атомами каталитически активного металла (Pt, Pd), а ядро состоит из атомов недрагоценного металла, промотирующего активность платины [19–22].
Другой подход к созданию катализаторов, активных в РОМ и реакции электровосстановления кислорода (РВК), заключается в использовании некоторых оксидных материалов, например CeO2 [23, 24], TiO2 [24], SnO2 [25], в качестве носителей для наночастиц платины. Повышение каталитической активности в этом случае достигается за счет позитивных эффектов электронного взаимодействия носителя с наночастицами платины [26, 27]. Так, например, в работах [28–31] отмечается, что Pt/TiО2-катализаторы проявляют более высокую активность в РВК по сравнению с Pt/C, поскольку для них не характерны коррозия носителя и последующий отрыв наночастиц Pt. Широкое применение оксидных носителей для производства электрокатализаторов ограничивает их низкая электронная проводимость. Поэтому для увеличения электропроводности зачастую используют их композиты с высокодисперсной углеродной сажей. Особый интерес представляют наноструктурные композиты, в которых оксидный компонент содержится в виде наночастиц, нанесенных на поверхность микрочастиц углеродного носителя и находящихся в контакте с наночастицами платины [31–33]. В работах [27, 34–37] было показано, что Pt-катализаторы на углеродном носителе, в составе которого имеется диоксид олова, проявляют большую активность в реакциях электроокисления метанола и этанола, чем аналогичные катализаторы без добавления оксида металла. Авторы [27] отмечают, что наночастицы Pt соприкасаются одновременно с частицами SnO2 и углеродом, образуя уникальные наноструктуры Pt/SnO2/C с тройным контактом.
Мы уже отмечали, что кроссовер метанола через полимерную мембрану в катодную область приводит к отравлению поверхности Pt промежуточными продуктами окисления метанола [9] и значительному уменьшению электрохимической активности катализатора в РВК. В связи с этим к катодным катализаторам в МТЭ предъявляют ряд дополнительных требований: они должны сочетать активность в РВК и РОМ с высокой толерантностью к продуктам неполного окисления метанола, устойчивостью к деградации при высоких потенциалах, соответствующих работе кислородного электрода. Результаты проведенных нами ранее исследований и некоторые литературные данные свидетельствуют о том, что замена наночастиц Pt на PtCu [38, 39, 52] так же, как и нанесение наночастиц Pt на некоторые композиционные носители MOx/C [23–25, 40], повышают активность катализаторов в РВК и РОМ. Возникают вопросы, можно ли соединить в одном катализаторе позитивное влияние двух факторов – легирования платины d-металлом и нанесения на поверхность углерода наночастиц SnO2, контактирующих с металлическим наночастицами? В каком качестве – анодного или катодного катализатора модифицированный материал будет иметь явные преимущества по сравнению с Pt/C и, возможно, PtRu/C?
Целью настоящего исследования было получение многокомпонентного PtCu/(SnO2/C)-катализатора, содержащего биметаллические наночастицы, нанесенные на поверхность наноструктурного SnO2/C-носителя, и сравнение его поведения в РВК и РОМ с поведением PtCu/C- и Pt/(SnO2/C)-электрокатализаторов, близких по содержанию платины, а в определенных условиях – и с коммерческим PtRu/C-электрокатализатором. Для снижения влияния дополнительных факторов, обусловленных методическими особенностями формирования на электроде пористых каталитических слоев, в перечень исследуемых материалов также был включен коммерческий Pt/C-катализатор.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
На композитный носитель SnO2/C, содержащий наночастицы олова на поверхности частиц углеродного носителя Vulcan XC72, полученный по методике [40, 41], осаждали наночастицы Pt. Для этого к 0.2 г порошка SnO2/C (30 мас. % SnO2) добавляли 20 мл этиленгликоля и 25.6 мл 0.01 М водного раствора H2PtCl6. Полученную суспензию гомогенизировали ультразвуком, затем при постоянном перемешивании последовательно добавляли 1 мл 37% НСОН и 1 М раствор NaOH в смеси вода-этиленгликоль (1 : 1) до достижения рН 11. Суспензию в течение 2 ч выдерживали при 90°С. После 30 мин самопроизвольного остывания полученный Pt/(SnO2/C)-катализатор отделяли фильтрованием. Нанесение биметаллических PtCu-наночастиц на углеродный и композитный носители с расчетным атомным соотношением Pt : Cu – 1 : 1 проводили в одну стадию посредством совместного восстановления прекурсоров платины и меди в водно-этиленгликолевой суспензии при pH 9–10 избытком свежеприготовленного 1 M раствора NaBH4. Расчетная массовая доля металлов в полученных материалах составляла 20 мас. % Pt и 9 мас. % Cu.
Соотношение металлов Pt : Cu в биметаллических катализаторах определяли методом рентгенофлуоресцентного анализа (РФлА) на спектрометре с полным внешним отражением рентгеновского излучения РФС-001 (НИИ физики ЮФУ, Россия). Массовую долю металлов в полученных материалах определяли методом термогравиметрии (ТГА), окисляя катализаторы при 800°С. При расчете учитывали фактическое соотношение компонентов, определенное методом РФлА, считая, что в твердом остатке могут содержаться Pt, CuO, SnO2.
Фазовый состав катализаторов определяли методом порошковой рентгенографии на дифрактометре ARL X’TRA (CuKα), проводя измерения в диапазоне углов 2θ от 15° до 55°, с шагом 0.02° и скоростью регистрации 2°/мин. Средний размер кристаллитов вычисляли по формуле Шеррера [42]: D = Kλ/(FWHMcosθ), где K = 0.98 – постоянная Шеррера, λ – длина волны монохроматического излучения в Å, FWHM – полная ширина пика на половине высоты (в радианах), D – средний размер кристаллитов, нм, θ – угол отражения в радианах.
Электрохимические измерения проводили в трехэлектродной ячейке на вращающемся дисковом электроде, используя потенциостат VersaStat 3 (AMETEK Scientific Instruments, США). Для этого на торце дискового электрода формировали каталитический слой. К навеске материала 0.006 г добавляли 900 мкл изопропилового спирта и 100 мкл 0.5% водной эмульсии полимера Nafion®. Полученную суспензию диспергировали в ультразвуке в течение 15 мин. Затем при постоянном перемешивании с помощью микродозатора отбирали аликвоту объемом 6 мкл и наносили на торец электрода. Полученную каплю сушили при комнатной температуре со скоростью вращения электрода 700 об/мин.
Стандартизацию каталитического слоя проводили методом циклической вольтамперометрии, проводя 100 циклов развертки потенциала со скоростью 200 мВ/с в 0.1 М HClO4, насыщенным Ar. Затем проводили измерение площади электрохимически активной поверхности (ЭХАП) по количеству электричества, затраченного на электрохимическую адсорбцию/десорбцию атомарного водорода. Для этого регистрировали две циклических вольтамперограммы (ЦВА) в аналогичном диапазоне потенциалов, но со скоростью развертки потенциала 20 мВ/с. Определение значения ЭХАП также проводили по окислению монослоя хемосорбированного CO. Для этого раствор электролита продували CO в течение 20 мин, выдерживая постоянный потенциал 0.1 В. Затем продували аргоном в течение 40 мин и регистрировали две ЦВА, по которым и проводили расчет. Активность катализаторов в реакции электровосстановления кислорода измеряли в 0.1 М HClO4 растворе, насыщенном кислородом в течение 1 ч, на вращающемся дисковом электроде. Линейные вольтамперограммы регистрировали при скоростях вращения дискового электрода 400, 900, 1600 и 2500 об/мин и скорости развертки потенциала 20 мВ/с. Для оценки активности катализаторов в реакции электроокисления метанола, проводили регистрацию ЦВА в 0.1 М растворе HClO4 + 0.5 М CH3OH. Толерантность к промежуточным продуктам окисления метанола определяли с помощью хронопотенциограмм в том же электролите при потенциалах 0.60 и 0.87 В.
Ресурсные испытания катализаторов в мембранно-электродных блоках – лучший способ оценки их стабильности [43, 44]. Однако такие исследования достаточно трудоемки. Во многих публикациях отмечается возможность проведения предварительной экспресс-оценки стабильности катализаторов с использованием различных режимов стресс-тестирования в электрохимической ячейке [45–50]. В настоящей работе для оценки стабильности синтезированных катализаторов проводили 1000 вольтамперометрических циклов в диапазоне потенциалов 0.6–1.4 В в 0.1 М растворе HClO4, в атмосфере аргона. Через каждые 200 циклов измеряли ЭХАП, как это описано ранее. Подобный режим стресс-теста был успешно опробован нами в [51]. Степень деградации (СД) катализаторов оценивали по формуле:
Структурные характеристики и электрохимическое поведение синтезированных катализаторов сравнивали со структурой/поведением коммерческого Pt/C-катализатора HiSPEC3000 (Johnson Matthey), содержащего 20 мас. % Pt. Далее он обозначен как JM20. В некоторых случаях, когда электрохимическое поведение синтезированных нами материалов изучали в метанольных растворах при относительно низких потенциалах, в качестве образца сравнения был исследован также коммерческий PtRu/C-электрокатализатор (Pt–Ru – 1 : 1, 40 мас. % Pt, 20 мас. % Ru, Alfa Aesar). Дело в том, что использование PtRu/C-катализатора целесообразно только на аноде МТЭ, т.е. при относительно небольших потенциалах [9–11, 13].
Все значения потенциалов в работе приведены относительно потенциала обратимого водородного электрода (ОВЭ), в качестве электрода сравнения использовали насыщенный хлоридсеребряный электрод, в качестве противоэлектрода – платиновую проволоку.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На порошковых дифрактограммах PtCu/C-, PtCu/(SnO2/C)-, Pt/(SnO2/C)- и Pt/C-материалов присутствуют отражения, соответствующие фазам платины, углерода (2θ ~ 25°) и диоксида олова (рис. 1), что подтверждает эффективное осаждение металлической компоненты как на углеродный, так и на композитный носитель. Уширение максимумов обусловлено малым размером наночастиц. При этом для платиномедных материалов максимумы отражений металлической фазы сдвинуты в область больших углов по сравнению с фазой платины. Рассчитанная величина параметра кристаллической решетки для биметаллических наночастиц меньше, чем для поликристаллической платины. Такой результат обусловлен присутствием атомов меди в их составе. Средний размер кристаллитов, рассчитанный по формуле Шеррера, составил 1.8 нм для наночастиц платины в Pt/(SnO2/C) и около 2.6 нм для PtCu-наночастиц (табл. 1). Средний размер кристаллитов платины в коммерческом Pt/C-катализаторе – 2.4 нм. Отметим, что на рентгенограммах биметаллических катализаторов отсутствуют отражения, соответствующие фазам оксидов меди, что не исключает возможность присутствия их небольших количеств в рентгеноаморфном состоянии.
Рис. 1.
Рентгеновские дифрактограммы исследуемых катализаторов: 1 – PtCu/C, 2 – Pt/C, 3 – PtCu/(SnO2/C), 4 – Pt/(SnO2/C).

Таблица 1.
Состав и структурные характеристики полученных катализаторов и коммерческого Pt/C-материала JM20
| Образец | Состав металлической фазы (РФлА) | Массовая доля Pt, % | Средний размер кристаллитов (РФА), нм | Параметр кристаллической решетки a, Å | |
|---|---|---|---|---|---|
| исходный | после активации | ||||
| Pt/C | Pt | Pt | 20.0 ± 0.2 | 2.4 ± 0.2 | 3.94 |
| PtCu/C | Pt1Cu0.7 | Pt1Cu0.3 | 19.5 ± 0.2 | 2.8 ± 0.3 | 3.82 |
| PtCu/(SnO2/С) | Pt1Cu0.7 | Pt1Cu0.3 | 20.0 ± 0.2 | 2.5 ± 0.2 | 3.81 |
| Pt/(SnO2/C) | Pt | Pt | 19.0 ± 0.2 | 1.8 ± 0.2 | 3.94 |
По результатам гравиметрии все полученные материалы содержат от 19 до 20% Pt. Оба платиномедных катализатора характеризуются атомным соотношением Pt : Cu – 1 : 0.7 (табл. 1). Такое соотношение металлов несколько отличается от соотношения взятых для синтеза прекурсоров, что может быть обусловлено неполным восстановлением и/или потерей небольшого количества меди в процессе синтеза, как это отмечалось в [52].
В процессе стандартизации катализаторов происходит очистка и развитие поверхности металлических наночастиц. Известно, что на ЦВА платиномедных материалов могут наблюдаться пики анодного растворения меди из собственной фазы и/или твердого раствора в диапазонах потенциалов 0.25–0.45 и 0.7–0.8 В, соответственно [53, 54]. Для PtCu/C- и PtCu/(SnO2/C)-катализаторов подобных максимумов не наблюдалось. Однако, по данным РФлА, после электрохимической стандартизации содержание меди в этих катализаторах уменьшается (табл. 1), что обусловлено селективным растворением атомов легирующего компонента из наночастиц и, возможно, химическим растворением оксидов меди. Для того, чтобы исключить влияние перешедших в раствор ионов Cu2+ на поведение исследуемого электрода, после завершения стандартизации проводили замену электролита и его повторное насыщение аргоном в течение 20 мин.
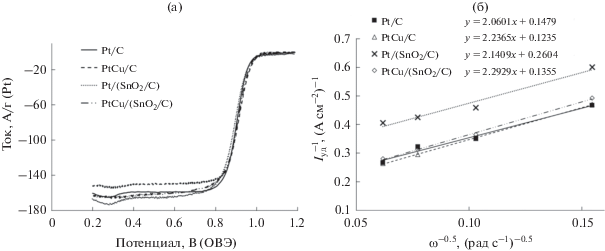
По количеству электричества, затраченному на адсорбцию/десорбцию атомарного водорода при регистрации циклических вольтамперограмм, были рассчитаны значения ЭХАП катализаторов (рис. 2а, табл. 2). Полученные значения хорошо коррелируют с величинами ЭХАП, рассчитанными по окислению монослоя хемосорбированного CO (рис. 2б, табл. 2). По окислению монослоя СО также была рассчитана ЭХАП PtRu/C-катализатора, которая составила 68 м2/г (PtRu)11.
Рис. 2.
(а) Циклические вольтамперограммы стандартизированных электрокатализаторов в атмосфере аргона; (б) после пропускания СО. Электролит 0.1 М раствор HClO4 в атмосфере аргона.

Таблица 2.
Параметры, характеризующие электрохимическое поведение катализаторов в РВК*
| Образец | ЭХАП Hад/дес, м2/г (Pt) | ЭХАП COад, м2/г (Pt) | Кинетические токи, Iк (E = 0.90 В) | n, e | E1/2, В (1600 об/мин) | |
|---|---|---|---|---|---|---|
| А/г (Pt) | А/м2 (Pt) | |||||
| Pt/C | 78 ± 8 | 78 ± 8 | 182 ± 9 | 2.3 ± 0.1 | 3.8 | 0.91 |
| PtCu/C | 39 ± 4 | 38 ± 4 | 225 ± 11 | 5.8 ± 0.1 | 4.0 | 0.91 |
| Pt/(SnO2/C) | 73 ± 7 | 70 ± 7 | 125 ± 6 | 1.7 ± 0.1 | 4.1 | 0.92 |
| PtCu/(SnO2/C) | 37 ± 4 | 32 ± 3 | 206 ± 10 | 6.0 ± 0.1 | 4.0 | 0.92 |
* Отметим, что значения ЭХАП и кинетических токов РВК, измеренные для катализаторов в рамках настоящего исследования, несколько отличаются от таковых, приведенных нами ранее [52, 53] для близких по составу катализаторов. Причиной является изменение настроек потенциостата при работе в условиях линейной развертки потенциала. Линейная развертка потенциала на самом деле представляет совокупность маленьких ступеней. Ранее потенциостат измерял силу тока на начальном этапе каждой микроступеньки. При выполнении настоящего исследования настройки прибора изменены: измерение отклика (силы тока) происходит в конце каждой ступеньки. Это привело, в частности, к снижению токов на ЦВА и снижению расчетных значений ЭХАП для одних и тех же катализаторов.
В результате установлено, что в ряду катализаторов Pt/C > Pt/(SnO2/C) $ \gg $ PtCu/C ≥ PtCu/(SnO2/C) происходит снижение значений ЭХАП от 78 до 32–37 м2/г (Pt). Наибольшие значения ЭХАП Pt/C- и Pt/(SnO2/C)-катализаторов в целом согласуются с малым размером кристаллитов платины в данных материалах (табл. 1), хотя наблюдаемая разница в размерах кристаллитов не должна приводить к столь существенным различиям в ЭХАП. Возможно, существенное уменьшение значений ЭХАП при переходе от платиновых к платиномедным катализаторам PtCu/C и PtCu/(SnO2/C) связано с большей степенью агломерации PtCu-наночастиц [55]. Отметим, что на катализаторах, содержащих SnO2, окисление СО начинается при меньших потенциалах, максимум тока окисления СО на ЦВА также смещен в сторону меньших потенциалов (рис. 2б). При этом на вольтамперограмме PtCu/(SnO2/C)-катализатора даже наблюдается двойной пик окисления CO с максимумами в области 0.4 и 0.7 В (рис. 2б). Наличие двух пиков окисления СО может быть обусловлено разными причинами: неоднородностью состава или размерного распределения металлических наночастиц, их агломерацией, особенностями поведения PtCu-наночастиц, находящихся в контакте с частицами SnO2, или особенностями адсорбции СО на различных гранях наночастиц [56–60]. Учитывая определенное сходство в поведении двух катализаторов, содержащих наночастицы SnO2, по отношению к окислению СО (рис. 2б), можно связать обнаруженные эффекты именно с присутствием диоксида олова.
Для оценки активности катализаторов в реакции электровосстановления кислорода применяли метод вольтамперометрии с линейной разверткой потенциала (рис. 3а). В качестве дескриптора каталитической активности использовали значения кинетического тока при потенциале 0.90 В, нормированного на массу платины или ЭХАП катализатора (табл. 2). Значение кинетических токов и количества электронов были рассчитаны по уравнению Коутецкого–Левича (рис. 3б). Видно, что при нормировании кинетического тока на массу платины Pt/(SnO2/C)-катализатор демонстрирует наименьшую активность РВК, а при нормировании на величину ЭХАП активность Pt/(SnO2/C)- и Pt/C-катализаторов близка. Несмотря на меньшие значения ЭХАП платиномедных катализаторов, они продемонстрировали большую активность в РВК в расчете как на массу платины, так и на величину ЭХАП, по сравнению с Pt/(SnO2/C) и коммерческим Pt/C-катализатором (табл. 2). Для всех исследованных электродов характерно протекание РВК по 4х-электронному механизму (табл. 2).
Рис. 3.
(а) Вольтамперограммы электровосстановления кислорода на разных катализаторах при скорости вращения дискового электрода 1600 об/мин; (б) зависимости в координатах 1/Iуд–1/ω0.5 при E = 0.90 В, построенные по результатам вольтамперометрии. Электролит 0.1 М раствор HClO4, насыщенный O2 при атмосферном давлении.
Поведение катализаторов в РОМ было исследовано методами циклической вольтамперометрии (рис. 4а) и хроноамперометрии (рис. 4б, 4в). Для РОМ форма ЦВА исследуемых катализаторов характеризуется двумя ярко выраженными пиками окисления при прямом и обратном ходе развертки потенциала. В рамках вольтамперометрического исследования в качестве показателей активности катализаторов в РОМ обычно используют удельные значения максимальных токов на прямом ходе развертки потенциала ЦВА [60, 61], величину потенциала начала окисления метанола [61] и количество электричества ${{Q}_{{{\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{OH}}}}}$ (табл. 3), затраченное на электроокисление метанола при прямом ходе развертки потенциала ЦВА [38]. Судя по значениям тока в максимуме и ${{Q}_{{{\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{OH}}}}},$ удельная активность катализаторов в РОМ возрастает в ряду Pt/C < Pt/(SnO2/C) $ \ll $ PtCu/C ≤ ≤ PtCu/(SnO2/C) (рис. 4).
Рис. 4.
(а) Циклические вольтамперограммы прямого хода при электроокислении метанола. Скорость развертки потенциала 20 мВ/с; (б), (в) хроноамперограммы электроокисления метанола при потенциалах 0.87 и 0.60 B, соответственно. Электролит 0.1 М раствор HClO4. Атмосфера аргона.

Таблица 3.
Параметры, характеризующие электрохимическое поведение полученных катализаторов в РОМ
| Образец | Результаты циклической вольтамперометрии | Начальные и конечные токи на хроноамперограмме, А/м2 (Pt) | |||||
|---|---|---|---|---|---|---|---|
| Imax, А/м2 (Pt) | потенциал начала окисления метанола, Eнач, В | количество электричества, затраченное на окисление метанола, ${{Q}_{{{\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{OH}}}}},$ Кл/м2 (Pt) | |||||
| при Е = 0.87 В | при Е = 0.60 В | ||||||
| I0 | I1800 | I0 | I1800 | ||||
| Pt/C | 4.5 ± 0.2 | 0.61 | 56 ± 3 | 4.1 ± 0.2 | 1.7 ± 0.1 | 0.6 ± 0.1 | 0.3 ± 0.1 |
| PtCu/C | 15.2 ± 0.7 | 0.60 | 224 ± 11 | 9.8 ± 0.5 | 2.0 ± 0.1 | 1.2 ± 0.1 | 0.4 ± 0.1 |
| Pt/(SnO2/C) | 7.4 ± 0.3 | 0.61 | 95 ± 5 | 6.3 ± 0.3 | 3.0 ± 0.1 | 1.0 ± 0.1 | 0.7 ± 0.1 |
| PtCu/(SnO2/C) | 14.4 ± 0.7 | 0.59 | 234 ± 12 | 10.0 ± 0.5 | 3.0 ± 0.1 | 1.7 ± 0.1 | 0.9 ± 0.1 |
| PtRu/C | – | – | – | – | – | 1.3 ± 0.1 | 0.6 ± 0.1 |
Сложнее обстоит вопрос, связанный со сравнительной оценкой активности катализаторов в РОМ и толерантности к промежуточным продуктам окисления метанола, проведенной по результатам хроноамперометрии (рис. 4б, 4в). При потенциале 0.87 В, близком к потенциалу катода МТЭ, наибольшее значение удельного тока в начальный момент времени продемонстрировали медьсодержащие катализаторы, однако спад тока окисления метанола на этих электродах происходил быстрее, чем на Pt/C и Pt/(SnO2/C) (рис. 4б). Более высокая чувствительность PtCu/C- и PtCu/(SnO2/C)-катализаторов к промежуточным продуктам окисления метанола может быть обусловлена в том числе и более высокой концентрацией интермедиатов в приэлектродном слое. В то же время спад тока на PtCu/(SnO2/C)-катализаторе происходит медленнее, чем на PtCu/C. Более медленный спад тока, характерный для Pt/C- и Pt/(SnO2/C)-электродов, наблюдается при заметно более высокой скорости окисления метанола на Pt/(SnO2/C) по сравнению с Pt/C. Таким образом присутствие наночастиц SnO2 на поверхности Pt/(SnO2/C)- и PtCu/(SnO2/C)-катализаторов повышает их толерантность к промежуточным продуктам окисления метанола при высоких потенциалах.
Хроноамперограммы окисления метанола при потенциале 0.60 В (рис. 4в) измеряли также и на коммерческом PtRu/C-катализаторе, поскольку именно платинорутениевые катализаторы известны высокой активностью и толерантностью к окислению метанола на аноде МТЭ. Оказалось, что в этих условиях наиболее высокие значения анодного тока зафиксированы на PtRu/C- и PtCu/(SnO2/C)-катализаторах. Pt/(SnO2/C)-катализатор продемонстрировал среднюю скорость окисления метанола и высокую стабильность тока во времени. Значительно ниже оказались значения силы тока на Pt/C- и PtCu/C-катализаторах.
По всей видимости, позитивное влияние легирующего металла (меди), проявляющееся при высоких потенциалах, и оксидной компоненты катализатора (SnO2) на скорость электроокисления метанола обусловлено различными механизмами. При высоких потенциалах в начальный момент времени, когда количество молекул СО (наиболее устойчивого промежуточного продукта электроокисления метанола), адсорбированных на активной поверхности катализаторов, невелико, наибольшее влияние на процесс окисления CH3OH оказывает добавка меди. С течением времени количество адсорбированных молекул СО увеличивается, что приводит к блокировке активной поверхности платины и снижению скорости электроокисления. Наличие наночастиц SnO2, контактирующих с наночастицами Pt или PtCu, способствует реализации бифункционального механизма катализа при окислении СО в широком диапазоне потенциалов, что обусловливает более высокую толерантность катализатора. Подобный механизм влияния наночастиц SnO2 подтверждается также смещением потенциала начала окисления СО в область меньших значений на соответствующих вольтамперограммах (рис. 2б). В условиях окисления метанола при потенциале 0.60 В многокомпонентный PtCu/(SnO2/C)-катализатор практически не уступает коммерческому PtRu/C-катализатору (рис. 4б, табл. 3).
В целом, платиномедные катализаторы продемонстрировали высокую активность в РВК и в РОМ при высоких потенциалах, а катализаторы, содержащие наночастицы диоксида олова, проявили более высокие активность в РОМ при низких потенциалах и толерантность к промежуточным продуктам окисления метанола в широком диапазоне потенциалов. По-видимому, опираясь на результаты циклической вольтамперометрии, можно говорить об интегральной активности катализаторов в РОМ, сравнивая при этом максимальные токи и количество электричества, затраченное на окисление метанола в широком диапазоне потенциалов. Вывод об активности разных катализаторов в потенциостатических условиях зависит от значения потенциала (узкого диапазона потенциалов), при котором производится их сравнение.
При проведении стресс-тестирования в растворе, не содержащем метанола, для Pt/C и Pt/(SnO2/C) характерно быстрое снижение ЭХАП по сравнению с PtCu/C- и PtCu/(SnO2/C)-катализаторами: для платиновых катализаторов степень деградации составляет около 75%, в то время как для биметаллических – около 25–30% (рис. 5). Таким образом, по увеличению стабильности в условиях “жесткого” режима стресс-тестирования исследуемые катализаторы располагаются в ряд Pt/C ≤ Pt/(SnO2/C) $ \ll $ PtCu/(SnO2/C) ≤ ≤ PtCu/C. Следует отметить, что в течение первых 100 циклов для биметаллических катализаторов наблюдается рост ЭХАП, а затем – ее уменьшение. Полученные данные свидетельствуют о более высокой коррозионной стабильности биметаллических катализаторов, что хорошо согласуется с полученными нами ранее результатами и результатами других авторов [50–52]. Нельзя исключить, что большая стабильность PtCu-катализаторов обусловлена не только составом, но и большим размером наночастиц, обусловливающим меньшую величину ЭХАП этих материалов. Наличие соответствующих корреляций было продемонстрировано в [44]. Судя по результатам циклической вольтамперометрии, после завершения стресс-теста катализаторы PtCu/C и PtCu/(SnO2/C) по-прежнему характеризуются значительно более высокой интегральной каталитической активностью в РОМ по сравнению с платиновыми катализаторами (табл. 4).
Рис. 5.
Зависимость степени деградации катализаторов от числа циклов в ходе вольтамперометрического стресс-тестирования электродов в диапазоне потенциалов 0.6–1.4 В.
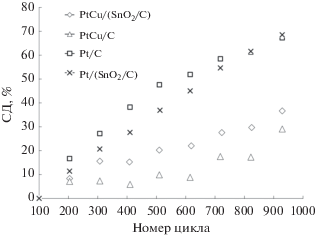
Таблица 4.
Параметры, характеризующие электрохимическое поведение катализаторов в РОМ до и после стресс-тестирования
| Материал | ЭХАП, м2/г (Pt) | ${{Q}_{{{\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{OH}}}}},$ Кл/м2 (Pt) | ||
|---|---|---|---|---|
| 100-й цикл | 1000-й цикл | до стресс-теста | после стресс-теста | |
| Pt/C | 70 ± 7 | 28 ± 3 | 56 ± 3 | 32 ± 2 |
| PtCu/C | 43 ± 4 | 28 ± 3 | 224 ± 11 | 192 ± 10 |
| Pt/(SnO2/C) | 70 ± 7 | 22 ± 2 | 95 ± 5 | 86 ± 4 |
| PtCu/(SnO2/C) | 45 ± 5 | 25 ± 3 | 234 ± 11 | 182 ± 9 |
ЗАКЛЮЧЕНИЕ
Методом жидкофазного боргидридного синтеза получены платиносодержащие электрокатализаторы, в которых Pt- или PtCu-наночастицы нанесены на поверхность углеродного или наноструктурированного композиционного носителя SnO2/C. Композиционный носитель представляет собой углеродный материал, на поверхность которого нанесены наночастицы SnO2. Массовая доля Pt в катализаторах составляет около 20%, размер металлических наночастиц (кристаллитов) увеличивается в ряду Pt/(SnO2/C) < Pt/C ≈ ≈ PtCu/(SnO2/C) < PtCu/C от 1.8 до 2.8 нм. ЭХАП катализаторов существенно уменьшается при переходе от платиновых (70–78 м2/г (Pt)) катализаторов к платиномедным (32–39 м2/г (Pt)).
Методом циклической вольтамперометрии установлено, что биметаллические катализаторы PtCu/C и PtCu/(SnO2/C) проявляют более высокую активность в РВК, а также более высокую коррозионную стабильность в вольтамперометрических стресс-тестах (1000-кратное циклирование потенциала в диапазоне 0.6–1.4 В) по сравнению с платиновыми аналогами – Pt/C и Pt/(SnO2/C).
Оценка, сделанная на основании сравнения максимальных токов и значений количества электричества, затраченного на окисление метанола, также позволяет сделать заключение о более высокой активности биметаллических катализаторов в РОМ. В то же время поведение катализаторов в потенциостатических условиях во многом зависит от значения потенциала, при котором производится измерение, и свидетельствует о важной роли наночастиц диоксида олова, закрепленных на поверхности частиц углерода. При потенциале 0.87 В платиномедный и платиновый катализаторы на основе композиционного носителя SnO2/C проявляют более высокую толерантность по сравнению с аналогами, не содержащими диоксида олова. Окисление метанола при потенциале 0.60 В протекает более активно на катализаторах, содержащих SnO2/C, причем PtCu/(SnO2/C)-материал демонстрирует удельную активность и толерантность, практически не уступающие коммерческому PtRu/C-катализатору.
Положительное влияние меди на активность платины может быть обусловлено уменьшением величины параметра кристаллической решетки твердого раствора и понижением энергии d-орбиталей атомов платины, приводящим к облегчению диссоциативной адсорбции молекул кислорода на поверхности наночастиц. Наличие на поверхности углеродного носителя наночастиц SnO2, часть которых находится в контакте с металлическими наночастицами, повышает толерантность как платиномедного, так и платинового катализатора к промежуточным продуктам окисления метанола, предположительно – к СО.
На наш взгляд, поиск эффективных многокомпонентных платиносодержащих катализаторов электровосстановления кислорода и электроокисления метанола должен быть продолжен. При этом важно добиться повышения площади электрохимически активной поверхности таких материалов, что позволит существенно повысить их масс-активность.
Список литературы
Wee, J.-H., A feasibility study on direct methanol fuel cells for laptop computers based on a cost comparison with lithium-ion batteries, J. Power Sources, 2007, vol. 173, p. 424.
Brouzgou, A., Podias, A., and Tsiakaras P., PEMFCs and AEMFCs directly fed with ethanol: a current status comparative review, J. Appl. Electrochem., 2013, vol. 43, p. 119.
Burhan, H., Cellat, K., Yilmaz, G., and Sen, F., Chapter 3 – Direct methanol fuel cells (DMFCs), Direct Liquid Fuel Cells: Fundamentals, Advances and Future, 2021. p. 71.
Тарасевич, М.Р., Кузов, А.В. Топливные элементы прямого окисления спиртов. Альтернат. энергетика и экология. 2010. № 7(87). С. 86. [Tarasevich, M.R. and Kuzov, A.V., Direct alcohol fuel cells, Al’ternat. Energetika i Ekologiya (in Russian), 2010, no. 7(87), p. 86.]
Meital, G., Menkin, S., and Peled, E., High power direct methanol fuel cell for mobility and portable applications, Int. J. Hydrogen Energy, 2019, vol. 44, p. 3138.
Pinto, A.M.F.R., Oliveira, V.S., and Falcao, D.S.C., Direct Alcohol Fuel Cells for Portable Applications: Fundamentals, Engineering and Advances 1st Edition, 2018. p. 287.
Kaur, B., Srivastava, R., and Satpati, B., Highly efficient CeO2 decorated nano-ZSM-5 catalyst for electrochemical oxidation of methanol, ACS Catal., 2016, vol. 6, p. 2654.
Liu, Y., Li, D., Stamenkovic, V.R., Soled, S., Henao, J.D., and Sun, S., Synthesis of Pt3Sn alloy nanoparticles and their catalysis for electro-oxidation of CO and methanol, ACS Catal., 2011, vol. 1, p. 1719.
Hamnett, A., Mechanism and electrocatalysis in the direct methanol fuel cell, Cat. Today, 1997, vol. 38, p. 445.
Watanabe, M. and Motoo, S., Electrocatalysis by adatoms. Part II. Enhancement of the oxidation of methanol on platinum by ruthenium ad-atoms, J. Electroanalyt. Chem., 1975, vol. 60, p. 267.
Gasteiger, H.A., Markovic, N., Ross, P.N., and Cairns, E.J., Methanol electrooxidation on well-characterized Pt–Ru alloys, J. Phys. Chem., 1993, vol. 97, p. 12029.
Markovic, N., Gasteiger, H.A., Ross, P.N., Jiang, X., Villegas, I., and Weaver, M.J., Electro-oxidation mechanisms of methanol and formic acid on Pt–Ru alloy surfaces, Electrochim. Acta, 1995, vol. 40, p. 91.
Tong, Y.Y., Kim, H.S., Babu, P.K., Waszczuk, P., Wieckowski, A., and Oldfield, E., An NMR investigation of CO tolerance in a Pt/Ru fuel cell catalyst, J. Am. Chem. Soc., 2002, vol. 124, p. 468.
Pinheiro, A.L.N., Zei, M.S., and Ertl, G., Electro-oxidation of carbon-monoxide and methanol on bare and Pt-modified Ru (1010) electrodes, PhysChem – ChemPhys., 2005, vol. 7, p. 1300.
Yang, H., Dai, L., Xu, D., Fang, J., and Zou, S., Electrooxidation of methanol and formic acid on PtCu nanoparticles, Electrochim. Acta, 2010, vol. 55, p. 8000.
Li, X., Zhou, Y., Du, Y., Xu, J., Wang, W., Chen, Z., and Cao, J., PtCu nanoframes as ultra-high performance electrocatalysts for methanol oxidation, Int. J. Hydrogen Energy, 2019, vol. 44, p. 18050.
Santasalo-Aarnio, A., Borghei, M., Anoshkin, I.V., Nasibulin, A.G., Kauppinen, E.I., Ruiz, V., and Kallio, T., Durability of different carbon nanomaterial supports with PtRu catalyst in a direct methanol fuel cell, Int. J. Hydrogen Energy, 2012, vol. 37, p. 3415.
Çögenli, M.S. and Yurtcan, A.B., Catalytic activity, stability and impedance behavior of PtRu/C, PtPd/C and PtSn/C bimetallic catalysts toward methanol and formic acid oxidation. Int. J. Hydrogen Energy, 2018, vol. 43, p. 10698.
Stamenković, V., Schmidt, T.J., Ross, P.N., and Marković, N.M., Surface segregation effects in electrocatalysis: kinetics of oxygen reduction reaction on polycrystalline Pt3Ni alloy surfaces, J. Electroanalyt. Chem., 2003, vol. 554–555, p. 191.
Guofeng, W., van Hove, M.A., Ross, P.N., and Baskes, M.I., Quantitative prediction of surface segregation in bimetallic Pt–M alloy nanoparticles (M = Ni, Re, Mo), Prog. Surf. Science, 2005, vol. 79, p. 28.
Noel, K. and Xin, W., Pt-shell–Au-core/C electrocatalyst with a controlled shell thickness and improved Pt utilization for fuel cell reactions, Electrochem. Commun., 2008, vol. 10, p. 12.
Hua, L.M. and Shan, D.J., Kinetics of oxygen reduction reaction on Co rich core–Pt rich shell/C electrocatalysts, J. Power Sources, 2009, vol. 188, p. 353.
Chen, L-N., Hou, K.-P., Liu, Y.-S., Qi, Z., Zheng, Q., Lu, Y.-H., Chen, J.-Y., Chen, J.-L., Pao, C.-W., Wang, S.-B., Li, Y.-B., Xie, S.-H., Liu, F.-D., Prendergast, D., Klebanoff, L.E., Stavila, V., Allendorf, M.D., Guo, J., Zheng, L-S., Su, J., and Somorjai, G.A., Efficient Hydrogen Production from Methanol Using a Single-Site Pt1/CeO2 Catalyst, J. Amer. Chem. Soc., 2019, vol. 141, p. 17995.
Papavasiliou, J., Paxinou, A., Słowik, G., Neophytides, S., and Avgouropoulos, G., Steam Reforming of Methanol over Nanostructured Pt/TiO2 and Pt/CeO2 Catalysts for Fuel Cell Applications, Catalysts, 2018, vol. 8, p. 544.
Kuriganova, A., Chernysheva, D., Faddeev, N., Leontyev, I., Smirnova, N., and Dobrovolskii, Y., PAC Synthesis and Comparison of Catalysts for Direct Ethanol Fuel Cells, Processes, 2020, vol. 8, p. 712.
Zhang, K., Feng, C., He, B., Dong, H., Dai, W., Lu, H., and Zhang, X., An advanced electrocatalyst of Pt decorated SnO2/C nanofibers for oxygen reduction reaction, J. Electroanal. Chem., 2016, vol. 781, p. 198.
Zhang, N., Zhang, S., Du, C., Wang, Z., Shao, Y., Kong, F., Lin, Y., and Yin, G., Pt/Tin Oxide/Carbon Nanocomposites as Promising Oxygen Reduction Electrocatalyst with Improved Stability and Activity, Electrochim. Acta, 2014, vol. 117, p. 413.
Huang, S.-Y., Ganesan, P., and Popov, B.N., Titania supported platinum catalyst with high electrocatalytic activity and stability for polymer electrolyte membrane fuel cell, Appl. Catal. B: Environmental, 2011, vol. 102, p. 74.
Akalework, N.G., Pan, C.-J., Su, W.-N., Rick, J., Tsai, M.-C., Lee, J.-F., Lin, J.-M., Tsai, L.-D., and Hwang, B.-J., Ultrathin TiO2-coated MWCNTs with excellent conductivity and SMSI nature as Pt catalyst support for oxygen reduction reaction in PEMFCs, J. Mater. Chem., 2012, vol. 22, p. 20977.
Esfahani, R.A.M., Videla, A.H.M., Vankova, S., and Specchia, S., Stable and methanol tolerant Pt/TiOx–C electrocatalysts for the oxygen reduction reaction, Int. J. Hydrogen Energy, 2015, vol. 40, p. 14529.
Ando, F., Tanabe, T., Gunji, T., Tsuda, T., Kaneko, S., Takeda, T., Ohsaka, T., and Matsumoto, F., Improvement of ORR Activity and Durability of Pt Electrocatalyst Nanoparticles Anchored on TiO2/Cup-Stacked Carbon Nanotube in Acidic Aqueous Media, Electrochim. Acta, 2017, vol. 232, p. 404.
Kuriganova, A.B., Leontyev, I.N., Alexandrin, A.S., Maslova, O.A., Rakhmatullin, A.I., and Smirnova, N.V., Electrochemically synthesized Pt/TiO2-C catalysts for direct methanol fuel cell applications, Mendeleev Communications, 2017, vol. 27, p. 67.
Wang, J., Xu, M., Zhao, J., Fang, H., Huang, Q., Xiao, W., Li, T., and Wang, D., Anchoring ultrafine Pt electrocatalysts on TiO2–C via photochemical strategy to enhance the stability and efficiency for oxygen reduction reaction, Appl. Catal. B: Environmental, 2018, vol. 237, p. 228.
De Oliveira, M.B., Profeti, L.P.R., and Olivi, P., Electrooxidation of methanol on PtMyOx (M = Sn, Mo, Os or W) electrodes, Electrochem. Communications, 2005, vol. 7, p. 703.
Rousseau, S., Coutanceau, C., Lamy, C., and Léger, J.-M., Direct ethanol fuel cell (DEFC): Electrical performances and reaction products distribution under operating conditions with different platinum-based anodes, J. Power Sources, 2006, vol. 158, p. 18.
Cui, X., Cui, F., He, Q., Guo, L., Ruan, M., and Shi, J., Graphitized mesoporous carbon supported Pt–SnO2 nanoparticles as a catalyst for methanol oxidation, Fuel, 2010, vol. 89, p. 372.
Wang, X., Hu, X., Huang, J., Zhang, W., Ji, W., Hui, Y., and Yao, X., Electrospinning synthesis of porous carbon fiber supported Pt–SnO2 anode catalyst for direct ethanol fuel cell, Solid State Science, 2019, vol. 94, p. 64.
Menshchikov, V.S., Alekseenko, A.A., Guterman, V.E., Nechitailov, A., Glebova, N.B., Tomasov, A.A., Spiridonova, O.A., Belenov, S.V., Zelenina, N.K., and Safronenko, O.I., Effective Platinum–Copper Catalysts for Methanol Oxidation and Oxygen Reduction in Proton-Exchange Membrane Fuel Cell, Nanomaterials, 2020, vol. 10, p. 742.
Guterman, V.E., Lastovina, T.A., Belenov, S.V., Tabachkova, N.Yu., Vlasenko, V.G., Khodos, I.I., and Balakshina, E.N., PtM/C (M = Ni, Cu, or Ag) electrocatalysts: effects of alloying components on morphology and electrochemically active surface areas, J. Solid State Electrochem., 2013, vol. 18, p. 1307.
Новомлинский, И.Н., Гутерман, В.Е., Даниленко, М.В., Волочаев, В.А. Платиновые электрокатализаторы, нанесенные на композиционный оксидно-углеродный носитель. Электрохимия. 2019. Т. 55. С. 885. [Novomlinskiy, I.N., Guterman, V.E., Danilenko, M.V., and Volochaev, V.A., Platinum Electrocatalysts Deposited Onto Composite Carbon Black – Metal Oxide Support, Russ. J. Electrochem., 2019, vol. 55, p. 690.]
Гутерман, В.Е., Новомлинский, И.Н., Скибина, Л.М., Мауэр, Д.К. Способ получения наноструктурного материала оксида олова на углеродном носителе, Пат. 2656914 (Россия). 2017. [Guterman, V.E., Novomlinskij, I.N., Skibina, L.M., and Mauer, D.K., Method for obtaining nanostructural material of tin oxide on basis of carbon, Pat. 2656914 (Russia), 2017.]
Langford, J.I. and Wilson, A.J.C., Scherrer after Sixty Years: A Survey and Some New Results in the Determination of Crystallite Size, J. Applied Crystallography, 1978, vol. 11, p. 102.
Borup, R., Meyers, J., Pivovar, B., Kim, Yu.S., Mukundan, R., Garland, N., Myers, D., Wilson, M., Garzon, F., and Wood, D., More scientific aspects of polymer electrolyte fuel cell durability and degradation, Chem. Rev., 2007, vol. 107, p. 3904.
Pavlov, V.I., Gerasimova, E.V., Zolotukhina, E.V., Dobrovolsky, Y.A., Don, G.M., and Yaroslavtsev, A.B., Degradation of Pt/C electrocatalysts having different morphology in low-temperature PEM fuel cells, Nanotech. in Russ., 2016, vol. 11, p. 743.
Zhang, Y., Chen, S., Wang, Y., Ding, W., Wu, R., Li, L., Qi, X., and Wei, Z., Study of the degradation mechanisms of carbon-supported platinum fuel cells catalyst via different accelerated stress test, J. Power Sources, 2015, vol. 273, p. 62.
Ohma, A., Shinohara, K., Iiyama, A., Yoshida, T., and Daimaru, A., Fuel cells by FCCJ membrane, catalyst, MEA WG membrane and catalyst performance targets for automotive, ECS Trans., 2011, vol. 41, p. 775.
Capelo, A., Esteves, M.A., Sa, A.I., Silva, R.A., Cangueiro, L., Almeida, A., Vilar, R., and Rangel, C.M., Stability and durability under potential cycling of Pt/C catalyst with new surface-functionalized carbon support, Int. J. Hydrogen Energy, 2016, vol. 41, p. 12962.
Hasche, F., Oezaslan, M., and Strasser, P., Activity, stability, and degradation mechanisms of dealloyed PtCu3 and PtCo3 nanoparticle fuel cell catalysts, Chem-CatChem., 2011, vol. 3, p. 1805.
Park, Yu.-Ch., Kakinuma, K., Uchida, M., Uchida, H., and Watanabe, M., Deleterious effects of interim cyclic voltammetry on Pt/carbon black catalyst degradation during start-up/shutdown cycling evaluation, Electrochim. Acta, 2014, vol. 123, p. 84.
Riese, A., Banham, D., Ye, S., and Sun, X., Accelerated stress testing by rotating disk electrode for carbon corrosion in fuel cell catalyst supports, J. Electrochem. Soc., 2015, vol. 162, p. F783.
Могучих, Е.А., Алексеенко, А.А., Гутерман, В.Е., Новиковский, Н.М., Табачкова, Н.Ю., Меньщиков, В.С. Влияние состава и структуры PtCu/C электрокатализаторов на их стабильность при различных условиях стресс-тестирования // Электрохимия. 2018. Т. 54. С. 976. [Moguchikh, E.A., Alekseenko, A.A., Guterman, V.E., Novikovsky, N.M., Tabachkova, N.Yu., and Menshchikov, V.S., Effect of the composition and structure of Pt(Cu)/C electrocatalysts on their stability under different stress test conditions, Russ. J. Electrochem., 2018, vol. 54, p. 979.]
Alekseenko, A.A., Moguchikh, E.A., Safronenko, O.I., and Guterman, V.E., Durability of de-alloyed PtCu/C electrocatalysts, Int. J. Hydrogen Energy, 2018, vol. 43, p. 22885.
Oezaslan, M. and Strasser, P., Activity of dealloyed PtCo and PtCu nanoparticle electrocatalyst for oxygen reduction reaction in polymer electrolyte membrane fuel cell, J. Power Sources, 2011, vol. 196, p. 5240.
Oezaslan, M., Hasche, F., and Strasser, P., PtCu3, PtCu and Pt3Cu Alloy Nanoparticle Electrocatalysts for Oxygen Reduction Reaction in Alkaline and Acidic Media, J. Electrochem. Soc., 2012, vol. 159, p. 444.
Guterman, V.E., Belenov, S.V., Alekseenko, A.A., Rui, Lin, Tabachkova, N.Yu., and Safronenko, O.I., Activity and Stability of Pt/C and Pt–Cu/C Electrocatalysts, Electrocatalysis, 2018, vol. 9, p. 550.
Van der Vliet, Dr. D.F., Wang, D.F., Li, C., Paulikas, D., Greeley, A.P., Rankin, J.R.B., Strmcnik, D., Tripkovic, D., Markovic, N.M., and Stamenkovic, V.R., Unique Electrochemical Adsorption Properties of Pt-Skin Surfaces, Angewandte Chemie Intern. Edition, 2012, vol. 51, p. 3139.
Rudi, S., Cui, C., Gan, L., and Strasser, P., Comparative Study of the Electrocatalytically Active Surface Areas (ECSAs) of Pt Alloy Nanoparticles Evaluated by Hupd and CO-stripping voltammetry, Electrocatalysis, 2014, vol. 5, p. 408.
Ghavidel, Z.M.R., Monteverde Videla, A.H.A., Specchia, S., and Easton, E.B., The relationship between the structure and ethanol oxidation activity of Pt–Cu/C alloy catalysts, Electrochim. Acta, 2017, vol. 230, p. 58.
Maillard, F., Schreier, S., Hanzlik, M., Savinova, E.R., Weinkauf, S., and Stimming, U., Influence of particle agglomeration on the catalytic activity of carbon-supported Pt nanoparticles in CO monolayer oxidation, Phys. Chem. Chemical Physics, 2005, vol. 7, p. 385.
Liu, C., Zhang, L., Sun, L., Wang, W., and Chen, Z., Enhanced electrocatalytic activity of PtCu bimetallic nanoparticles on CeO2/carbon nanotubes for methanol electro-oxidation, Int. J. Hydrogen Energy, 2020, vol. 45, p. 8558.
Wang, X., Wang, W., Qi, Z., Zhao, C., Ji, H., and Zhang, Z., Fabrication, microstructure and electrocatalytic property of novel nanoporous palladium composites, J. Alloys and Compounds, 2010, vol. 508, p. 463.
Дополнительные материалы отсутствуют.


