Электрохимия, 2021, T. 57, № 7, стр. 408-423
Электроактивные композиты на основе интеркаляционных соединений лития и материалов с высокими проводящими свойствами: способы получения и электрохимические характеристики
А. В. Иванищев a, *, И. А. Иванищева a, С. Ч. Нам b, Дж. Мун c
a Институт химии, ФГБОУ ВО “Саратовский национальный исследовательский государственный университет
им. Н.Г. Чернышевского”
410012 Саратов, ул. Астраханская, 83, Россия
b Исследовательский институт индустриальных наук и технологий, POSCO Глобальный исследовательский центр, Сонгдогвахак-ро
21985 Инчхон, 100, Ёнсу-гу, Республика Корея
c Департамент энергии и химической инженерии, Инчхонский национальный университет
22012 Инчхон, Академи-ро, 119, Ёнсу-гу, Республика Корея
* E-mail: ivanischevav@inbox.ru
Поступила в редакцию 12.08.2020
После доработки 11.10.2020
Принята к публикации 14.02.2021
Аннотация
Многие интеркаляционные соединения лития, успешно применяемые в качестве материалов литий-ионного аккумулятора (ЛИА), используются не в индивидуальном состоянии, а в составе специально организованных композитов, содержащих также вспомогательные компоненты, распределенные по поверхности частиц интеркаляционного материала, а также в межчастичном пространстве. Применяемые вещества-модификаторы оказывают влияние на такие характеристики интеркаляционных материалов как емкость, ее обратимость и сохраняемость в ходе длительного циклирования в режиме заряда–разряда, а также при варьировании тока и диапазона потенциалов электрода. В настоящей работе подробно рассмотрено поведение модифицирующего агента в составе электроактивного композита, который относится к классу соединений, известных в литературе как MAX-фазы. Они имеют общую формулу Mn+ 1AXn, где M – переходный металл, A – элемент III–VI групп Периодической системы, а X – C или N. Температура, необходимая для синтеза соединения Ti3SiC2 (TSC), близка к 1500°C. Ее удалось снизить с помощью предварительной механохимической обработки смеси реагентов. Механизм действия модификацирующей добавки TSC рассмотрен в сравнении с другими подобными моделями, предложенными в литературе. Сравнение характеристик композитных материалов с различным содержанием TSC и различными типами модифицируемых интеркаляционных соединений (субстратов) показало положительное влияние модификатора как на кинетику электродных процессов, так и на скорость деградации емкостных характеристик материалов.
ВВЕДЕНИЕ
Значимость автономной энергетики в настоящее время возрастает в связи с быстрым развитием портативных электронных устройств, электромобилей и накопителей для распределенных энергетических систем. Для расширения диапазона режимов работы источников энергии с точки зрения мощности и энергоемкости могут использоваться комбинации различных устройств накопления энергии, таких как аккумулятор, топливный элемент и суперконденсатор. В то же время, каждое из устройств и используемые в них электрохимические системы занимают довольно узкую нишу в соответствии со своими характеристиками, которые можно разделить на три большие группы: топливные элементы, конденсаторные системы и аккумуляторы. Топливные элементы имеют высокую удельную энергию, но невысокую мощность; конденсаторные системы, наоборот, имеют высокую мощность, но небольшую энергоемкость; аккумуляторам присущи промежуточные значения мощности и удельной энергии. Развитие всех этих направлений происходит параллельно и, в основном, независимо друг от друга. Среди электрохимических систем, применяемых в аккумуляторах, выделяется литий-ионная система (литий-ионный аккумулятор, ЛИА), которая значительно опережает другие системы как по характеристикам, так и по степени развития. При конструировании автономных источников электропитания в зависимости от потребностей питаемого технического устройства возможно комбинирование различных типов источников путем включения их в общую электрическую схему, коммутирующую их взаимодействие. Такой способ заметно снижает удельные характеристики системы в целом. Привлекательным решением проблемы могла бы стать взаимная интеграция различных электрохимических систем на уровне электродных композитов или даже активных материалов электродов.
Первым шагом в направлении разработки таких интегрированных систем является создание единой классификации электродных материалов, принадлежащих к разным классам. Одну из первых попыток такой классификации можно встретить в работе [1]. Авторы предлагают искать общие черты у наиболее близких по составу и характеристикам конденсаторных и аккумуляторных систем. Данный подход предполагает разделение энергозапасающих материалов на компоненты электрических двойнослойных конденсаторов (EDLС) и суперконденсаторов (ионистор, supercapacitor). В них механизм накопления энергии осуществляется по-разному. Если в первой группе накопление заряда происходит в ходе адсорбции электролитных ионов на поверхности электродного материала в отсутствие какого-либо переноса заряда, то вторая группа материалов характеризуется протеканием фарадеевских процессов, связанных с переносом заряда через границу раздела фаз. Вклад этих процессов обычно обозначают как “псевдоемкость”, подразумевая под истинной емкостью ее электрическую составляющую (электростатическая энергия, обусловленная пространственным разделением заряда на границе электродный материал/электролит). Фарадеевские процессы при этом обусловлены окислительно-восстановительными реакциями, хемосорбцией и интеркаляцией в приповерхностные слои. В отдельную группу можно выделить литий-ионные конденсаторы (LIC, гибридные конденсаторы). В них реализуется как электростатический механизм накопления энергии, так и электрохимический (посредством интеркаляции литиевых ионов), причем доли электростатической и электрохимической емкости сильно варьируются в различных материалах. Конструктивно такой источник тока содержит композитные электроды из углеродных материалов с внедренными или осажденными псевдоемкостными фазами, такими как оксиды металла или проводящие полимеры, а также угдеродные электроды, где катодом является активированный уголь, а анодом допированный ионами лития с целью понижения электродного потенциала углеграфитовый материал. Далее к этим материалам также добавились материалы ассиметричных гибридных конденсаторов, в которых положительный электрод состоит из оксида металла (некомпозитный), а отрицательный – активированный уголь, являющийся EDLC-материалом. В дальнейшем такая классификация и терминология в литературе стала размываться, что обусловило попытки некоторых авторов внести уточнения. Так, в работе [2] уточнено различие между псевдоемкостными электродными материалами и материалами электродов ЛИА: последние представляют собой редокс-системы с достаточно однородной по энергии поверхностью электроактивного вещества, тогда как в материалах первой группы процесс обратимой электрохимической реакции протекает на участках поверхности электродного материала с неоднородным энергетическим ландшафтом, что приводит к более сглаженному электрохимическому отклику в условиях наложения тока или потенциала. Высокая степень кристалличности интеркаляционных материалов создает энергетически равноценную электродную поверхность, в то время как высокоразвитая поверхность аморфных материалов образована большим количеством структурных дефектов, что сглаживает форму фарадеевского отклика. С недавних пор [3] стало распространяться употребление термина “суперконденсатор” в отношении многих оксидных (помимо уже используемых для этих целей RuO2 и MnO2), нитридных и карбидных материалов, отмечая таким образом значительный вклад псевдоемкостных процессов в классическое конденсаторное поведение электродов на их основе.
Таким образом, анализ многообразия свойств различных электроактивных материалов позволяет найти общность физической основы процессов в этих материалах и выстроить общую классификацию материалов. Однако, не следует рассматривать такую классификацию как некий новый физический принцип или закономерность, например новый механизм тех или иных процессов в материале. Механизмы и закономерности являются объективными явлениями и не зависят от отнесения их к той или иной категории. Подобная классификация уместна, в основном, в отношении функциональных свойств материалов. В то же время, в литературе можно наблюдать и такое довольно странное явление, когда при изучении электродного материала, руководствуясь некоторыми его функциональными свойствами, относят такой материал, например, к конденсаторным системам, и далее автоматически приписывают ему все остальные свойства данного класса материалов. Пример такого подхода изложен в работе [4], где материалу Ti3SiC2, который отличается высокими показателями электронной проводимости, приписываются также и высокие ионопроводящие и ионоаккумулирующие свойства по отношению к ионам лития. Выводы авторов базируются, в основном, на электрохимических откликах материала, полученных в растворах литиевых солей. Однако, предположения о механизме электрохимического поведения базируются лишь на аналогии формы электрохимических характеристик с другими известными материалами и остаются недостаточно обоснованными.
Следует отметить также и подход продуктивного использования данной классификации – при разработке электродных композитов. Электрод современного ЛИА представляет собой сложный многокомпонентный композит, компоненты которого могут выполнять разнообразные функции: аккумулирования ионов, их транспорта, а также транспорта электронов к точкам, в которых происходит электрохимическая реакция. Однако, каждый компонент может быть полифункциональным, например: электропроводная добавка может также являться материалом с конденсаторными свойствами. Такие неосновные функции компонентов композита, на которые указывают некоторые авторы [2], могут быть целенаправленно использованы при разработке электродного материала. Кратко охарактеризуем конкретные способы создания композитов с TSC в качестве электропроводного компонента.
Соединения группы фосфатов лития и переходных металлов обладают прочной кристаллической структурой, состоящей из ${\text{PO}}_{4}^{{3 - }}$-групп и октаэдров MO6 (M – ион переходного металла) [5, 6]. Способность сопротивляться объемным изменениям структуры в ходе обратимого внедрения ионов лития делает эти материалы одними из наиболее востребованных в качестве катодных материалов ЛИА. Им присущи такие преимущества, как высокая термическая и химическая стабильность, выдающаяся безопасность при работе, а также высокие удельные характеристики, позволяющие на равных конкурировать с высокоэнергоемкими слоистыми оксидами лития и переходных металлов. В фосфатной группе материалов одним из наиболее энергоемких является фосфат ванадия–лития (Li3V2(PO4)3, LVP). В наших предыдущих работах были подробно исследованы характеристики этого материала [7–11]. Превосходная способность электрода к скоростному заряду и разряду обеспечивается созданием углеродного покрытия частиц материала, обладающего высокими кинетическими характеристиками.
Относительно низкая электронная проводимость LVP ≈ 10–7 Ом–1 см–1 на фоне не столь низкого коэффициента диффузии 10–11 см2 с–1 для одного из трех ионов лития, по данным [12], приводит к существенному недобору циклируемой емкости в сравнении с теоретически возможной. В литературе предлагаются различные способы преодоления этой проблемы: путем легирования катионами в высоких степенях окисления [13‒16], создания электропроводного углеродного покрытия частиц [17], уменьшения размера частиц [18], формирования своеобразной морфологии и текстуры [19]. В нашей работе был реализован подход к послойному формированию электроактивного композита на основе LVP. На начальном этапе на частицах LVP формировалось углеродное покрытие, которое положительно зарекомендовало себя в случае материалов с низкими проводящими свойствами [20–24]. Особенность реализованного нами подхода заключается в следующем этапе – нанесении модифицирующего слоя Ti3SiC2 (TSC) поверх углеродного покрытия частиц активного материала. Впервые эта фаза была получена Jeitschko и Nowotny в 1967 г. [25]. Продолжительное время интерес к этому соединению проявлялся в связи с высокими электро- и теплопроводностью (по этим показателям TSC превосходит титан), окислительной и термической стойкостью, а также механическими свойствами: прочностью на сжатие и модулем Юнга в сочетании с невысокой твердостью. В середине 1990-х годов Barsoum и El-Raghy синтезировали относительно фазово-чистые образцы Ti3SiC2 и предложили название для целого класса подобных соединений “фаза Mn+ 1AXn” или просто MAX-фаза, где М – переходный металл, A – элемент III–VI групп Периодической системы, а X – C и/или N [26]. Различие между представителями этого класса соединений состоит в количестве слоев атомов переходного металла М, которые разделяют слои атомов А [27, 28]. Наиболее значимым свойством MAX-фаз для использования в литий-ионных технологиях является их высокая электронная проводимость (~104 Ом–1 см–1) [29], и эти материалы положительно зарекомендовали себя в качестве модификатора LiFePO4 [30]. Кроме того, порошок Ti3SiC2 обладает более высокой насыпной плотностью (4.52 г см–3) в сравнении с углеродными материалами, что делает его более предпочтительным для высокоэнергоемких литий-ионных аккумуляторов, применяемых, например, в электромобилях [31]. Также это позволило снизить сопротивление переносу заряда и повысить скорость зарядно-разрядного процесса для модифицированного TSC электродного материала на основе LiFePO4 [30]. Авторы объяснили улучшение электрохимического поведения электрода формированием в межчастичном пространстве электропроводной сети, обеспечивающей подвод электронов к поверхностям раздела интеркаляционной и электропроводной фаз, а также соединение электропроводных плоскостей между собой. Условно авторы обозначили эту сеть термином “поверхность–точка”. Этот подход был затем развит в работе [32], где при низких температурах были получены весьма привлекательные электрохимические характеристики. Емкость была в высокой степени стабильна при температуре –20°C. Вероятно, хорошие электрохимические характеристики модифицированных композитов Ti3SiC2 связаны с проводящими “мостиками”, образованными высоко диспергированным Ti3SiC2.
Поскольку низкая проводимость является общей проблемой для фосфатных материалов, в настоящей работе в качестве субстрата в TSC-модифицированных материалах были взяты LiFePO4 (LFP/C) и LVP/C. Следует заметить, что публикации, посвященные TSC-модификации электродных материалов, немногочисленны, в качестве примера можно упомянуть работы [33, 34]. Авторы [33] на основании анализа данных HRTEM пришли к выводу, что кристаллиты TSC и аморфный углерод образуют единую сеть в межчастичном пространстве и на поверхности частиц LVP. Была предложена схема функционирования такого композитного материала, которую авторы [33] назвали моделью двухэтажного автобуса. В рамках этой модели обосновывались причины ускорения электронного и ионного транспорта в композитном электродном материале на основе интеркаляционного соединения и TSC. На основании сведений о кристаллической и зонной структуре TSC [35] авторы [33] сочли возможным одновременный перенос ионов Li и электронов внутри наноламинированной структуры TSC. В подтверждение своего предположения авторы приводили данные спектроскопии комбинационного рассеяния (Raman), которые указывали на присутствие LiF внутри частицы TSC после циклирования. Однако других данных, говорящих в пользу переноса ионов Li в структуре TSC в литературе обнаружить не удается. Напротив, имеются сведения о больших расчетных значениях энергии активации для миграции ионов H+ в структуре Ti3SiC2 [36], которые имеют значительно меньший радиус в сравнении с ионами Li+. На сегодняшний день механизм повышения характеристик фосфатных электродных материалов при их модифицировании с использованием TSC остается предметом дискуссии.
Основательные работы по синтезу MAX-соединений и детальному исследованию их разнообразных характеристик были выполнены в научных центрах Швеции [37, 38]. Авторы протестировали разнообразные способы синтеза с использованием различных исходных компонентов. TSC обычно получают путем смешения исходных компонентов в форме порошков с последующим высокотемпературным отжигом. По этой причине в большинстве случаев приходится использовать сверхстехиометрическое количество кремния в исходной смеси, чтобы компенсировать его убыль в результате испарения при температуре выше 1500°C. Если вкратце перечислить, то Ti3SiC2 может быть получен из исходных компонентов следующими способами: в ходе термообработки, сопряженной с прессованием [26], самораспространяющегося высокотемпературного синтеза (СВС) [39], химического осаждения из паровой фазы [40] и различных твердотельных реакций в системе Ti–Si–C [41–45]. В качестве еще одного распространенного подхода можно упомянуть карботермическое вакуумное восстановление смеси оксидов титана и кремния [46]. В качестве примера получения фазовочистого TSC можно упомянуть [47].
Предложенный нами способ получения требует относительно низкотемпературного отжига, благодаря реализации подхода, описанного в работе [48]. Этот подход позволил понизить температуру синтеза с 1500 до 1150°C за счет добавления порошка Al в реакционную смесь. Дисперсный Al в реакционной смеси промотирует образование TSC, поскольку быстро расплавляется и контактирует с поверхностью частиц других реагентов, при этом препятствуя их возможному окислению примесями в атмосфере печи, в результате ускоряется образование промежуточной фазы Ti5Si3, и далее – целевого продукта TSC. Авторы [49] также отметили положительный эффект от присутствия дисперсного Al в смеси исходных реагентов. В отсутствие дисперсного Al в смеси исходных реагентов основной фазой продукта был TiC. Интенсивность пиков рентгеновской дифрактограммы Ti3SiC2, TiSi2 и Ti5Si3 была довольно низкой, что свидетельствовало о низком содержании этих компонентов в продукте синтеза. С увеличением содержания дисперсного Al интенсивность пиков TiSi2 и Ti5Si3 на дифрактограмме уменьшалась, а пиков Ti3SiC2 – наоборот, увеличивалась. В результате оптимизации состава реакционной смеси удалось получить продукт с содержанием 99 мас. % индивидуального компонента Ti3SiC2, при этом содержание дисперсного Al составляло 0.1–0.2 мас. % [50]. Авторы предполагают в расплаве Al ускоренную взаимную диффузию Ti, Si и TiC, которая способствует синтезу продукта Ti3SiC2.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для синтеза электродного материала на основе Li3V2(PO4)3 использовались следующие прекурсоры: карбонат лития (Li2CO3 > 99%, ОАО “Завод редких металлов”, Российская Федерация), одноосновный фосфат аммония (NH4H2PO4 > 99%, “Реахим”, Российская Федерация), оксид ванадия (V) (V2O5 > 99%, “Химреактивснаб”, Россия). Их смешивали в соотношении, соответствующем элементному составу: Li : V : P = 3 : 2 : 3. Затем к смеси добавляли 23.5 мас. % сажи для восстановления V+5 и формирования электропроводной матрицы композита. Далее реакционную смесь подвергали механохимической обработке в шаровой планетарной мельнице АГО-2 (Новиц, Российская Федерация, 560 об/мин, 20 мин, среда – ацетон) при комнатной температуре. Термическую обработку проводили в трубчатой печи (поток аргона, скорость нагрева 10°С/мин) по двухстадийной схеме: 4 ч при 350°С, затем 8 ч при 800°С. В результате был получен композиционный материал Li3V2(PO4)3/C, состоящий из частиц Li3V2(PO4)3, диспергированных в углеродной матрице. Ti3SiC2 был получен твердотельным синтезом при 1150°C в присутствии дисперсного Al. В качестве исходных реагентов использовались порошки Ti, TiC, Si. По данным литературы [49], TiC обнаруживается в реакционной смеси в процессе обработки в высокоэнергетической шаровой мельнице, поэтому данный реагент выступал в качестве одного из исходных веществ для синтеза. Кроме того, использование в качестве исходного вещества стехиометрического соединения углерода и титана предпочтительно, поскольку уменьшает вероятность отклонения от стехиометрии углерода в конечном продукте и снижает в нем количество примесей. Исходные вещества смешивалось в стехиометрических количествах, для компенсации испарения брался 5% избыток Si. Синтезированный порошок TSC подвергался обработке в высокоэнергетической шаровой мельнице в течение 1 ч при 560 об/мин для обновления поверхности частиц Ti3SiC2 с целью интенсификации взаимодействия модифицирующей добавки с поверхностью модифицируемого материала LVP/C или LFP/C. Сразу после завершения измельчения суспензию TSC по каплям добавляли к суспензии субстрата в ацетоне. Ацетон выпаривали при постоянном перемешивании, а затем смесь сушили в атмосферном сушильном шкафу при 100°C в течение ночи. Содержание фазы Ti3SiC2 в базовом образце электродного материала составляло 5 мас. % (использовались и другие содержания TSC при исследовании его влияния на характеристики электрода).
Активная масса электродов приготавливалась смешением 90 мас. % TSC-модифицированного Li3V2(PO4)3/C или LiFePO4/C, 5 мас. % ацетиленовой сажи и 5 мас. % связующего PVdF. Электролитом являлся 1 М раствор LiPF6 в смеси этиленкарбонат : диметилкарбонат (1 : 1 по объему). Электродную суспензию наносили на алюминиевую фольгу с использованием аппликатора “Doctor Blade”. Электрохимические измерения проводились в герметичных ячейках из нержавеющей стали. Испытания в режиме гальваностатического заряда–разряда выполнялись с использованием зарядно-разрядных модулей Neware/BTS10V10mA (Neware Technology Limited, Китай). Электродные потенциалы здесь и далее приведены относительно Li/Li+-электрода в том же растворе. Все приведенные в настоящей работе удельные характеристики рассчитаны на полную массу электродного композита (включает Ti3SiC2, углерод, Li3V2(PO4)3 или LiFePO4). Многоканальный потенциостат-гальваностат Elins/P-20X8 (Elins, Российская Федерация) применялся для проведения измерений методом циклической вольтамперометрии (ЦВА). Все электрохимические измерения проводились при 30°C. Токи заряда и разряда для электродных материалов на основе Li3V2(PO4)3 рассчитывались, исходя из соответствия 1 С удельному току 197 мА г–1, для LiFePO4 – удельному току 170 мА г–1.
Рентгенодифракционный анализ образцов был выполнен на дифрактометре PANalytical Empyrean с использованием кобальтового излучения с длиной волны CoKα λ = 1.790307 Å. Данные о морфологии материалов, распределении частиц по размерам и локальном элементном составе с использованием метода EDAX были исследованы с помощью сканирующей электронной микроскопии (SEM) на микроскопе JEOL JSM-6490LV с W-катодом при ускоряющем напряжении 20 кВ.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Структурные и морфологические характеристики электроактивных композитов
На основании данных рентгенодифракционного анализа фазового состава продукта синтеза TSC, а также состава смеси исходных реагентов, была составлена схема синтетического процесса, включающая два основных этапа [47]:
(1)
$5{\text{Ti}} + 3{\text{Si}} = {\text{T}}{{{\text{i}}}_{{\text{5}}}}{\text{S}}{{{\text{i}}}_{{\text{3}}}}{\kern 1pt} ,$(2)
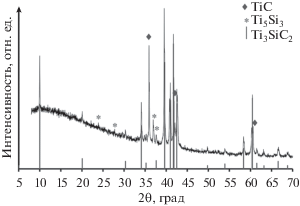
${\text{T}}{{{\text{i}}}_{{\text{5}}}}{\text{S}}{{{\text{i}}}_{{\text{3}}}} + 10{\text{TiC}} + 2{\text{Si}} = 5{\text{T}}{{{\text{i}}}_{{\text{3}}}}{\text{Si}}{{{\text{C}}}_{2}}{\kern 1pt} .$Содержание целевой фазы Ti3SiC2 в конечном продукте синтеза было около 50 мас. %. В качестве примесей обнаруживались TiC (около 30 мас. %) и Ti5Si3 (около 20 мас. %), что свидетельствовало о неполном протекании твердофазной реакции синтеза (рис. 1). Несмотря на то, что температура отжига (1150°C) была существенно ниже температуры плавления Si (1415°C), скорость его испарения в ходе отжига и вывода из зоны твердофазной реакции была значительной, поэтому 5% избытка Si оказалось недостаточно для компенсации его убыли из-за испарения, что привело к невысокому выходу целевого продукта. Однако, это не могло стать помехой к использованию TSC-содержащего продукта в качестве поверхностного модификатора электродных материалов, поскольку обнаруженные примеси сами по себе могут использоваться в качестве поверхностного модификатора в силу достаточно высоких электропроводящих свойств и химической стабильности в агрессивных средах.
Рис. 1.
Рентгеновская дифрактограмма синтезированного образца Ti3SiC2. На графике отмечены рефлексы присутствующих в образце кристаллических фаз.
TSC-содержащий продукт перед использованием в качестве поверхностного модификатора подвергался измельчению для уменьшения размера частиц и достижения узкого распределения частиц по размерам. Кроме того, по данным работы [51], механохимическая обработка (МО) удаляет поверхностные пленки, обновляя поверхность частиц, что способствует их более активному взаимодействию с поверхностью частиц модифицируемого электродного материала. Процедура МО при получении исследуемых материалов применялась дважды. В начале МО использовалась для обработки смеси исходных реагентов для синтеза TSC с целью активации реагентов и снижения температуры термообработки [49]. На следующем этапе МО применялась в отношении смесей TSC с модифицируемым электродным материалом (LVP/C или LFP/C), диспергированных в среде ацетона, что способствовало однородному распределению частиц TSC в межчастичном пространстве LVP/C или LFP/C. Процедура проводилась по схеме “мокрый по мокрому” для предотвращения агрегации и агломерации частиц материалов. Запечатленные на рис. 2a полидисперсные частицы TSC варьируются в размерах от нескольких десятых до нескольких мкм и собраны в довольно рыхлые скопления, тогда как субстрат LVP/C представляет собой довольно крупные и плотные образования – агломераты (рис. 2б). Какой-либо предварительной механохимической обработки исходного порошкового композитного материала LVP/C не проводилось с целью сохранения целостности углеродного покрытия частиц. Таким образом, нанесение слоя TSC на поверхность частиц композитного материала LVP/C позволило создать “послойную” структуру частиц композита LVP/C/TSC (рис. 2в).
Рис. 2.
SEM микрофотографии образцов: (а) – Ti3SiC2, (б) – LVP/C, (в) – Ti3SiC2-модифицированного LVP/C.

Для убедительного подтверждения присутствия частиц TSC на поверхности LVP была проведена серия экспериментов по сравнительному элементному анализу с использованием метода EDAX немодифицированных образцов LVP/C и образцов LVP/C/TSC с нанесенным на поверхность частиц TSC-покрытием. Во втором случае мы обнаружили присутствие элементов, составляющих ожидаемые фазы – LVP, C и TSC в соответствующих количественных соотношениях (табл. 1).
Таблица 1.
EDAX данные по локальному элементному составу TSC-модифицированного LVP/C-электродного материала
| Элемент (спектральная линия) | Содержание, атом. % | Погрешность определения, атом. % |
|---|---|---|
| C (K) | 11.50 | ±0.12 |
| O (K) | 56.12 | ±0.66 |
| Al (K) | 0.04 | ±0.01 |
| Si (K) | 0.53 | ±0.03 |
| P (K) | 16.63 | ±0.12 |
| Ti (K) | 1.68 | ±0.04 |
| V (K) | 13.50 | ±0.10 |
Отклонение от стехиометрии упомянутых компонентов обусловлено погрешностью метода EDAX и относительно небольшим количеством модифицирующей фазы TSC (5 мас. %). Внутренние ограничения элементного анализа методом EDAX обусловлены тем, что границы области анализируемого образца, активированного электронным пучком, захватывают не только часть площади поверхности, но и распространяются вглубь образца. Таким образом, анализируемый сигнал от образца отражает усредненный состав всех веществ, которые находятся в активированном объеме.
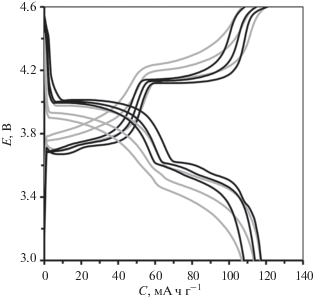
Предположение о возможном допировании LVP-элементами, содержащимися в TSC, не находит подтверждения в работе [33], где авторы исследовали композит LVP/C/TSC с использованием метода XPS. Авторы показали, что значения энергии связи атомов в соединении TSC в модифицированных образцах электродного материала соответствуют таковым в чистом TSC, а энергия связи иона V3+ в модифицированном материале на основе LVP соответствует таковой в чистом LVP [52, 53], что явно свидетельствует об отсутствии взаимодействия между атомами поверхностного модификатора (TSC) и субстрата (LVP). Более того, если бы возможность допирования все же существовала, процедура термообработки способствовала бы этому процессу. Сравнение электрохимического поведения образцов, прошедших и не прошедших термообработку, показало отсутствие различий в уровне емкости, однако термообработанные образцы показали более высокую поляризацию и сглаженные кривые (рис. 3). Трансформация кривых может свидетельствовать о влиянии термообработки на состояние самого LVP, например о возникновении небольших изменений в структуре: концентрации дефектов, состоянии поверхности частиц и т.д. Далее в работе, чтобы исключить влияние на свойства электродного материала различных неучтенных факторов, к термообработке модифицированных образцов не прибегали.
Рис. 3.
Зарядно-разрядные характеристики 5-го, 20‑го и 40-го циклов при токе 1 C образцов TSC-модифицированного LVP/C-электродного материала, прошедших (серые линии) и не прошедших (черные линии) термообработку после поверхностной TSC-модификации.
Гальваностатические зарядно-разрядные испытания с последовательно меняющимся током были выполнены для электродов на основе материалов LVP/C/TSC и LVP/C (рис. 4). На первых четырех циклах ток последовательно увеличивался в следующем порядке: 0.1–0.2–0.5–1 C, последующие 100 циклов проводились при токе 1 С. На первых циклах (рис. 4, вставка) заметных различий в электрохимическом поведении образцов не наблюдалось. Заметное различие в поведении образцов проявилось при испытании на стабильность емкости в условиях многократно повторяющихся циклов заряда–разряда при токе 1 С: стартуя от значения 117 мА ч г–1, емкость образца LVP/C приняла значение 53 мА ч г–1, в то время как емкость модифицированного TSC образца LVP/C/TSC стала 100 мА ч г–1.
Рис. 4.
Зависимости разрядной емкости от номера цикла при гальваностатическом циклировании образцов немодифицированного (пустые маркеры) и TSC-модифицированного (закрашенные маркеры) LVP/C-электродного материала: первые 3 цикла при последовательно меняющемся токе 0.1–0.2–0.5 C, 4-й и все последующие циклы при токе 1 C. На вставке – зависимость емкости от тока циклирования для первых 4 циклов.

Среднее значения коэффициента диффузии ионов лития в материале Li3V2(PO4)3, по данным [54], составляет 10–10 см2 с–1. Ускоренная относительно других катодных материалов кинетика транспорта ионов лития обеспечивает растущую токовую нагрузку. В нашей предыдущей работе [9] было показано, что электроды на основе LVP/C способны к очень быстрому заряду–разряду (током выше 300 C). Способность выдерживать высокие токи циклирования для поверхностно модифицированных или немодифицированных образцов LVP/C во многом зависит от особенностей синтеза, состава углеродного проводящего компонента и конкретного способа изготовления композитного электрода. В данной работе применялась идентичная процедура изготовления электродов на основе обоих типов материалов (LVP/C и LVP/C/TSC), при этом данные исследований показали приблизительно равный уровень емкости при токе менее 1 C (рис. 4). В других работах различие в емкости модифицированных и немодифицированных образцов наблюдалось уже при токе 0.5 С [34], а величина разрядной емкости двух типов образцов зависела от величины тока, начиная уже с 0.1 С [33].
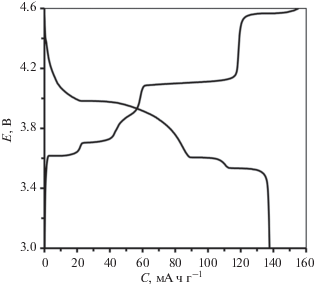
В настоящей работе предлагается алгоритм оценки одного из важнейших транспортных параметров – коэффициента диффузии ионов лития в твердом теле D путем сравнения зависимостей емкости от тока циклирования модифицированных и немодифицированных образцов интеркалируемого литием электродного материала. Этот параметр характеризует кинетику переноса ионов Li в структуре твердого тела и позволяет сравнивать различные электродные материалы. Их можно условно разделить на две группы: материалы с так называемым поведением твердого раствора (с гомогенным состоянием в широком диапазоне концентраций ионов лития) и материалы с выраженным двуфазным поведением (с гомогенным состоянием в узком диапазоне концентрации ионов лития, за пределами которого система становится гетерогенной). Несмотря на серию областей фазовых переходов, которые происходят в ходе заряда или разряда LVP и отражаются в форме плато на зарядно-разрядных кривых (рис. 5), этот материал скорее относится к первой группе, и для анализа электрохимического отклика электрода можно использовать модель полубесконечной диффузии [9]. Следовательно, диффузионная длина L (глубина проникновения ионов Li в частицу электродного материала) и τ – постоянная времени линейной диффузии связаны известным соотношением:
где D – коэффициент диффузии.Рис. 5.
Типичная форма зарядной и разрядной кривых TSC-модифицированного LVP/C-электродного материала при токе 0.1 C.
При условии, что в ходе одного периода заряда или разряда теоретическая емкость электрода не достигалась, можно допустить, что фронт диффузии ионов Li внутри каждой частицы не достигал внутренней границы диффузионного слоя, поэтому можно принять, что в любой момент времени t < τ сохранялись условия полубесконечной диффузии. Как было упомянуто выше, различие между электродами на основе TSC-модифицированных и немодифицированных материалов возникало при величине тока, превышающей определенный предел, выраженный в единицах C. Если предположить, что слой TSC не участвует в транспорте ионов Li, то эффект от его присутствия заключается в увеличении электронной проводимости объема электрода. При низких токах заряда–разряда (медленном продвижении диффузионного фронта вглубь частицы электродного материала) наблюдался одинаковый уровень емкости электродов обоих типов. Это означает, что проводимость обоих образцов избыточна для данной скорости зарядного или разрядного процесса (скорости продвижения диффузионного фронта). Как известно, общая проводимость включает электронную и ионную составляющие. При условии, что в обоих образцах содержится один и тот же тип интеркаляционного электродного материала, одинаковые емкости обоих электродов свидетельствуют об одинаковом эффективном значении коэффициента диффузии D ионов Li. При условии, что TSC не взаимодействует с материалом субстрата и не допирует его, он не влияет на значение D для материала LVP/C/TSC. Очевидно, что практический уровень емкости обоих типов электродов зависит от электронной составляющей проводимости частицы LVP при протекании тока в ходе зарядного или разрядного процесса. Проводящая добавка (ацетиленовая сажа) в объеме электрода обеспечивает перенос электронов от металлической подложки (токоотвода) и распределение электронов между частицами активного материала. Слой углеродного покрытия, покрывающий поверхность частиц LVP, обеспечивает подвод электронов к точкам на поверхности частиц материала. Пока ток через электрод относительно низкий, углеродный проводящий компонент справляется с подводом электронов на уровне, необходимом для движения ионов Li в структуре LVP, поэтому реализуемая электродом емкость определяется диффузионным процессом. Однако, начиная с определенного значения тока, проводимость углеродного компонента дальше не способна поддерживать возросший ток заряда или разряда, поэтому характеристики электрода будут ограничиваться скоростью подвода электронов к частице LVP. Дальнейшее увеличение токовой нагрузки приводит к разнице в уровнях емкости электродов на основе LVP/C и LVP/C/TSC. Для последнего электропроводный компонент, содержащий TSC, продолжает поддерживать высокую скорость переноса электронов. Для первого электрода с меньшей электронной проводимостью скорость переноса электронов оказывается недостаточно высокой, что приводит к снижению циклируемой емкости. Первое значение тока, при котором зависимости емкости от тока заряда или разряда для двух типов электродов начинают расходиться, соответствует моменту смены лимитирующей стадии электродного процесса с диффузионной на стадию подвода электронов. Эти характеристики можно использовать для определения коэффициента диффузии в материале.
Глубина продвижения фронта диффузии ионов Li вглубь частицы в каждом периоде заряда или разряда коррелирует с практической удельной емкостью электрода (Cactual) и может быть рассчитана, исходя из размера частиц, и выражена в процентах от максимально достижимой на практике емкости материала Cmax, которая обычно реализуется при минимальной токовой нагрузке в условиях полубесконечной линейной диффузии. Таким образом, среднюю глубину проникновения диффузионного фронта L можно рассчитать с использованием уравнения (4):
где d – размер частиц, определенный по данным SEM или кривой распределения частиц по размерам. Cmax на практике не достигает Ctheor, поскольку способ изготовления электрода неидеален, что приводит к изоляции некоторого количества электродного материала. Поскольку в реальном токообразующем процессе участвует только активная часть материала, в знаменателе используется именно максимальная практическая емкость. Для расчета D выбирается точка на оси тока, в которой зависимости емкости электродов на основе LVP/C и LVP/C/TSC начинают расходиться. Координаты этой точки Cactual и соответствующее значение i используются для определения переходного времени τ, которое соответствует длительности соответствующего зарядного или разрядного полуцикла:(5)
$\tau = 3600\frac{{{{C}_{{{\text{actual}}}}}{{C}_{{{\text{theoretical}}}}}}}{{i{{C}_{{{\text{max}}}}}}}.$Емкость и ток должны быть выражены в соответствующих единицах, например мА ч г–1 и мА г–1. Комбинируя уравнения (4) и (5), получаем выражение для коэффициента диффузии D:
(6)
$D = \frac{{i{{C}_{{{\text{actual}}}}}{{d}^{2}}}}{{3600{{C}_{{{\text{max}}}}}{{C}_{{{\text{theoretical}}}}}}}~.$Данные ряда публикаций по значениям емкости, тока заряда–разряда и размера частиц собраны в табл. 2 вместе с рассчитанными значениями D. Следует, однако, отметить, что в некоторых случаях представленных в литературе данных было недостаточно для оценки D (такие значения выделены курсивом), поскольку представленные в публикациях зависимости стартовали уже с довольно высоких значений тока, когда уже наблюдалось различие между модифицированными и немодифицированными образцами. Это снижает надежность значений D, определенных из этих данных. Следует ожидать, что найденные по данным различных публикаций значения D для одной и той же температуры должны быть близки друг к другу, поскольку в эксперименте участвовал один и тот же электродный материал – Li3V2(PO4)3.
Естественно ожидать уменьшение D с понижением температуры (табл. 2): эта тенденция подтверждается данными в строках 2 и 3 таблицы, хотя строка 1 выпадает из указанной закономерности. Также несколько выпадают из данного тренда и наши собственные данные (строка 4 табл. 2). Все это можно объяснить неоднородностью экспериментальных условий, в которых были получены представленные данные. Поэтому корректно сравнивать результаты в пределах одной работы (строки 2 и 3 табл. 2). Поскольку значение коэффициента диффузии испытывает влияние различных экспериментальных факторов, надежным можно считать лишь порядок его величины. Для представленных в табл. 2 условий можно ожидать колебание D в пределах одного порядка, совпадение которого у значений D, найденных в различных работах, можно считать подтверждением нашего предположения, что присутствие Ti3SiC2 в качестве поверхностного модификатора частиц Li3V2(PO4)3 влияет только на электронную составляющую проводимости, не затрагивая ионную.
Таблица 2.
Оценка значений D по литературным данным
| Электродный материал, публикация | Cactual/Cmax | d, 10–4, см | L, 10–4, см | τ, с | D, см2 с–1 |
|---|---|---|---|---|---|
| LVP/C/TSC (5 wt %) [33], 25°C | 1 (170/170) | 3.2 | 3.2 | 36 000 | 2.8 × 10–12 |
| LVP/C/TSC (4 wt %) [34], 0°C | 0.9 (130/140) | 2.4 | 2.2 | 6480 | 7.5 × 10–12 |
| LVP/C/TSC (4 wt %) [34], –20°C | 1 (120/120) | 2.4 | 2.4 | 18 000 | 3.3 × 10–12 |
| Данная работа, 30°C | 0.8 (120/150) | 1.5 | 1.2 | 2880 | 5.0 × 10–12 |
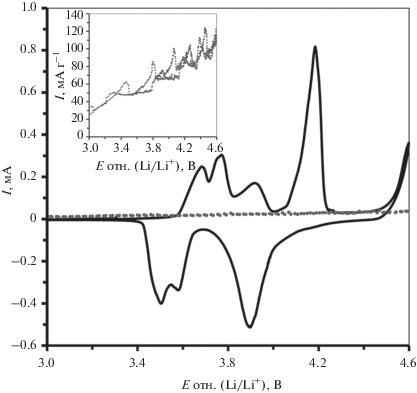
Для подтверждения отсутствия электрохимической активности Ti3SiC2 были выполнены измерения методом циклической вольтамперометрии (рис. 6). ЦВА-кривые электродов на основе LVP/C/TSC и TSC (композит с ацетиленовой сажей и связующим) при низкой скорости развертки потенциала измеряли в диапазоне потенциалов 3.0–4.6 В. Линия на вставке в рис. 6 соответствует отклику фазы Ti3SiC2: на ЦВА-кривой не обнаруживается область активного внедрения лития, а очень низкий ток, медленно увеличивающийся с ростом потенциала, был обусловлен побочными процессами, связанными с окислением электролита. С учетом содержания TSC в LVP/C/TSC-электроде, на рис. 6 представлена прерывистая линия, отражающая вклад тока, создаваемого TSC в общий отклик электрода (сплошная линия). Как видно, отклик всего LVP/C/TSC-электрода намного сильнее отклика содержащегося в нем TSC. Можно с определенностью сказать, что вклад Ti3SiC2 в общий электродный фарадеевский процесс незначителен, из чего следует, что данная фаза не участвует в интеркаляционном переносе и накоплении ионов лития в рассматриваемом диапазоне потенциалов электрода.
Рис. 6.
Циклические вольтамперограммы при скорости линейной развертки потенциала 0.05 мВ с–1 для композитных электродов на основе TSC (на вставке) и TSC-модифицированного LVP/C; прерывистая линия на рисунке отражает вклад содержащегося в электроде TSC в результирующий отклик тока (масса LVP/C/TSC в электроде 6.75 мг, содержание TSC 5 мас. %).
Поверхностная TSC-модификация LVP/C оказывает существенное положительное влияние на стабильность циклирования электродов на основе такого материала. Сравнительные исследования показали, что в идентичных условиях электрод на основе LVP/C сохранял к 100-му циклу лишь приблизительно половину начальной разрядной емкости, в то время как электрод на основе LVP/C/TSC-материала сохранял емкость около 85% от первоначального уровня (рис. 7). Мы полностью разделяем мнение авторов [29], что в композитном электродном материале TSC создает эффективную проводящую сеть из-за дисперсности и наноламинированной структуры частиц TSC в LVP/C/TSC. Одной из задач настоящей работы было выяснение характера влияния TSC на электрохимические характеристики модифицированных им электродных материалов. Рассмотрим работу электрода в гальваностатическом режиме, который предполагает постоянный поток ионов Li через границу электрод/электролит. Скорость распространения тока из поверхностного слоя в объем частицы зависит от внутренних свойств материала, таких как ионная диффузия и электронная проводимость. Обладающие высокой электронной проводимостью частицы TSC в составе композитного материала LVP/C/TSC создают на поверхности частиц LVP множество участков, насыщенных электронами и способных принимать ионы лития, которые в дальнейшем будут распределяться в объеме частиц LVP. Чем больше совокупная поверхность, к которой обеспечен подвод электронов, тем более однородным становится распределение ионного тока по этой поверхности. В этих условиях снижается доля “перегруженных” повышенным потоком ионов Li, либо избыточно поляризованных участков поверхности, что положительно влияет на стабильность структуры Li3V2(PO4)3, а следовательно, повышается стабильность зарядно-разрядных характеристик электрода в ходе многократно повторяющихся циклов. Такой механизм снижению скорости деградации емкости LVP/C/TSC-электродов в сравнении с LVP/C-электродами выглядит более закономерным, чем возможная изоляция поверхности LVP от непосредственного контакта с электролитом, который обусловливает нежелательные химические взаимодействия и деградацию структуры материала. Обычно в литературе именно изоляцией поверхности электродного материала и приданием ей защитных свойств объясняют положительное влияние поверхностной модификации на стабильность при циклировании [55]. В некоторых случаях (например, LiCoPO4) роль поверхностной химии в деградации емкости очень существенна, и взаимодействие электрода с электролитом приводит к прогрессирующему снижению характеристик из-за разрыва связей P–O в группировках PO4 на поверхности материала [56]. Хотя в основном фосфатные материалы устойчивы к различным типам электролитов, и для Li3V2(PO4)3, в частности, не происходит интенсивного растворения ванадия, тогда как в случае других катодных материалов (например, из класса слоистых оксидов лития и переходных металлов) растворение переходного металла является одним из наиболее негативных факторов [57]. Дополнительную защитную функцию в нашем случае несет углеродный компонент, распределенный по поверхности материала.
Рис. 7.
Зависимости остаточной емкости (% от начального уровня) от номера цикла при гальваностатическом циклировании образцов немодифицированного (пустые маркеры) и TSC-модифицированного (закрашенные маркеры) LVP/C-электродного материала при токе 1 C.

Данные нашего эксперимента для образцов с различным содержанием TSC в композитном материале подтверждают предложенный механизм действия поверхностного модификатора: чем больше его содержание, тем меньше повреждающее воздействие на структуру основного интеркаляционного материала (рис. 8а). Данные на рис. 8a свидетельствуют, что TSC является балластным компонентом электрода, и его количество коррелирует с начальным уровнем разрядной емкости: увеличение содержания балластного компонента ведет к снижению емкости. Так, для образца с 10% TSC относительно образца с 5% TSC наблюдалось снижение разрядной емкости на 5%.
Рис. 8.
Зависимости емкости и остаточной емкости (на вставке, в % от начального уровня) от номера цикла: (а) для TSC-модифицированного LVP/C-электродного материала с различным содержанием TSC (5 мас. % – черная линия, 10 мас. % – серая линия); (б) для немодифицированного (пустые маркеры) и TSC-модифицированного (закрашенные маркеры) LFP/C-электродного материала при токе 1 C.
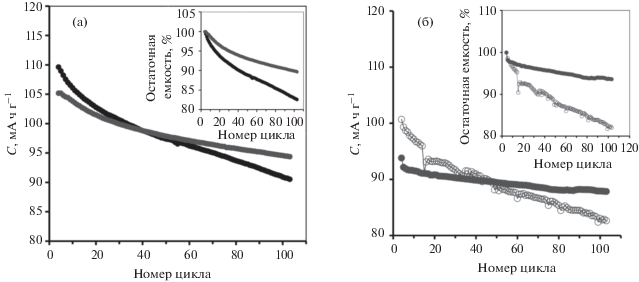
Эффект от присутствия TSC в композитном электродном материале схож с влиянием на электрохимическое поведение углеродных электропроводных добавок, однако есть и особенности, обусловленные исключительно высокими электропроводящими свойствами. В то же время, имеются противоречивые сведения о влиянии TSC на транспорт ионов Li [33]. С одной стороны, обсуждается, что агломерация частиц TSC влияет на перенос иона Li между электролитом и активным материалом, т.е. частицы TSC изолируют поверхность активного материала. Для обоснования возможности движения ионов Li между слоями Ti и Si в структуре TSC была предложена модель двухэтажного автобуса. При наличии у Ti3SiC2 литий-ионной проводимости, увеличение содержания TSC в композитном электродном материале должно приводить к монотонному изменению коэффициента диффузии ионов Li. Фактически, наблюдалась зависимость D от содержания TSC с экстремумом, положение которого зависит от температуры [33, 34]. Авторы объяснили данный факт тем, что агрегация частиц Ti3SiC2 блокирует диффузию ионов лития при большой извилистости путей диффузии в электродном материале, что создает немонотонную форму кривой зависимости D от содержания TSC [30]. Вызывает сомнение, чтобы увеличение содержания TSC на 1% приводило к заметной агломерации и ухудшению электрохимических характеристик, поскольку электрохимический отклик композитного электрода не столь чувствителен к изменению содержания электропроводного компонента [33]. Мы исходим из того, что данные [30] следует интерпретировать иначе: положительный эффект поверхностной модификации электродного материала с использованием TSC следует связывать только с повышением электронной проводимостью и ускорением стадии переноса заряда, что способствовало увеличению скорости электрохимического процесса. Следовательно, TSC является балластным компонентом, создающим электронопроводящую матрицу, которая обеспечивает необходимый поток электронов для поддержания пропорционального потока ионов за счет протекания окислительно-восстановительного превращения иона переходного металла. Предложенный нами механизм действия поверхностного модификатора подтверждается результатом расчета [36], который на примере атомов H показывает, что для их миграции в структуре Ti3SiC2 требуется преодолеть значительный активационный барьер, хотя радиус ионов H существенно меньше радиуса иона лития [58].
При разработке электродных материалов всегда возникает выбор между уровнем емкости и скоростью ее деградации при циклировании. Такой выбор возникает и при TSC-модификации электродного материала LiFePO4 (рис. 8б). Модифицированный электрод отличается большей стабильностью характеристик при циклировании. Высокие электрохимические характеристики модифицированного TSC катодного материала оливинового типа определены как при комнатной температуре [30], так и при пониженной температуре [32]. Характеристики циклирования наших электродов на основе модифицированных электродных материалов более высокие, чем представленные в работе [30], однако уровень емкости ниже, что объясняется меньшим содержанием активного интеркаляционного материала в композите. Электронная проводимость LiFePO4 превосходит ионную проводимость [59], что определяет его электрохимические характеристики. И ожидалось, что стабильное циклическое поведение будет достигнуто за счет модификации поверхности Ti3SiC2, что значительно повысит его электронную проводимость. Действительно, для TSC-модифицированного LFP была получена низкая скорость деградации емкости – менее 1 мА ч г–1 за цикл. Тот факт, что одно соединение для модификации поверхности (фаза Ti3SiC2) действует сходным образом для разных типов модифицируемых материалов (LVP/C и LFP/C), подтверждает неспецифический характер действия данного поверхностного модификатора и позволяет рассматривать TSC как универсальный компонент различных композитных электродных материалов. Известное для катодных материалов явление постепенного растворения переходного металла в электролите присуще LiFePO4 в крайне малой степени [60]. Таким образом, электродный материал на основе LiFePO4 не требует поверхностного покрытия, которое защищает материал от нежелательного взаимодействия с электролитом, однако и в случае LFP наблюдалось улучшение электрохимического поведения при модификации TSC композитного электродного материала, который связан с повышением электронной проводимости и, как результат стабилизации состояния структуры электродного материала при многократно повторяющихся циклах заряда–разряда в соответствии с описанным выше механизмом. В результате, фаза Ti3SiC2 снижает скорость деградации емкости электрода в процессе длительного циклирования.
Еще одним обстоятельством, которое планировалось прояснить в рамках настоящей работы, было выделение вклада основной примеси в составе материала TSC–TiC в электрохимическое поведение LVP/C/TSC-материала. Наши испытания показали, что, не смотря на более высокую начальную емкость электрода на основе LVP/C, модифицированного фазово-чистым TiC, скорость снижения его емкости от цикла к циклу была столь же высокой, как и у немодифицированного LVP/C-электрода. Однако, приблизительно после 40-го цикла емкость электрода на основе LVP/C/TSC-материала начала превосходить емкость электрода на основе модифицированного фазово-чистым TiC LVP/C-материала (рис. 9).
Рис. 9.
Зависимости разрядной емкости от номера цикла для немодифицированного (пустые черные маркеры), TSC-модифицированного (закрашенные маркеры) и TiC-модифицированного (пустые серые маркеры) LVP/C-электродного материала при токе 1 C.

Таким образом, можно заключить, что высоко электропроводная твердая фаза, диспергированная на поверхности частиц интеркаляционного электродного материала с низкой электронной проводимостью, снижает скорость деградации емкости модифицируемого электродного материала при циклировании. Причем, этот эффект коррелирует с величиной электронной проводимости модификатора: Ti3SiC2 имеет на порядок более высокую электронную проводимость, чем TiC, в результате чего TSC-модифицированный электродный материал показывает большую стабильность емкости при циклировании в сравнении с TiC-модифицированным электродным материалом. Иными словами, электронная проводимость модифицированной поверхности электродного материала с низкой электронной проводимостью является ключевым фактором электрохимической стабильности такого материала при циклировании.
ЗАКЛЮЧЕНИЕ
В настоящей работе были подробно рассмотрены способы поверхностного модифицирования интеркаляционных электродных материалов с низкой электронной проводимостью твердыми соединениями-модификаторами, имеющими высокую электронную проводимость, на примере известного соединения-модификатора Ti3SiC2, принадлежащего к группе так называемых MAX-фаз, а также двух модифицируемых интеркаляционных материалов Li3V2(PO4)3 и LiFePO4. Представлены результаты оптимизации процесса синтеза соединения-модификатора TSC с целью приведения температуры синтеза к умеренному значению (ниже температуры испарения Si) и достижения при этом высокого содержания в продукте синтеза целевой фазы Ti3SiC2. Разработан способ поверхностной модификации электродного материала по ступенчатой схеме с высокой степенью однородности распределения частиц TSC по поверхности электродного материала на примере композита LVP/C. В результате на поверхности фосфатных электродных материалов создавалась сеть эффективного подвода электронов. Анализ данных эксперимента по гальваностатическому циклированию электродов на основе композитного электродного материала LVP/C/TSC с различным содержанием поверхностного модификатора TSC в сопоставлении с литературными данными показал, что высокая электронная проводимость модифицированной поверхности является ключевым параметром, определяющим стабильность электрохимических характеристик при длительном циклировании. Было показано также, что фаза TSC является электрохимически неактивным, в смысле накопления ионов Li, балластным компонентом, который также непосредственно не участвует в переносе ионов Li, однако опосредованно, за счет повышения электронной проводимости поверхности электродного композита и интенсификации подвода электронов к частицам интеркаляционного материала, увеличивает скорость транспортных процессов в материале, что отражается на величине эффективного коэффициента диффузии ионов Li. Было установлено отсутствие влияния протекторного действия слоя Ti3SiC2 на поверхности частиц электродного материала от нежелательных взаимодействий с компонентами электролита на стабильность характеристик модифицированных электродов при циклировании, а снижение скорости деградации емкости материала обусловлено более равномерным распределением тока по его поверхности. В результате наблюдалась стабилизация структуры модифицируемого электродного материала при циклировании. Установленные закономерности влияния поверхностной TSC-модификации могут быть использованы при оптимизации структуры других электродных материалов с низкой электронной проводимостью.
Список литературы
Conway, B.E., Transition from “Supercapacitor” to “Battery” Behavior in Electrochemical Energy Storage, J. Electrochem. Soc., 1991, vol. 138, p. 1539.
Eftekhari, A., Low voltage anode materials for lithium-ion batteries, Energy Storage Mater., 2017, vol. 7, p. 157.
Simon, P., Gogotsi, Y., and Dunn, B., Where Do Batteries End and Supercapacitors Begin? Science, 2014, vol. 343, p. 1210.
Xu, J., Zhao, M.-Q., Wang, Y., Yao, W., Chen, C., Anasori, B., Sarycheva, A., Ren, C.E., Mathis, T., Gomes, L., Zhenghua, L., and Gogotsi, Y., Demonstration of Li-Ion Capacity of MAX Phases, ACS Energy Lett., 2016, vol. 1, p. 1094.
Huang, H., Yin, S.-C., Kerr, T., Taylor, N., and Nazar, L.F., Nanostructured Composites: A High Capacity, Fast Rate Li3V2(PO4)3/Carbon Cathode for Rechargeable Lithium Batteries, Adv. Mater., 2002, vol. 14, p. 1525.
Gaubicher, J., Wurm, C., Goward, G., Masquelier, C., and Nazar, L., Rhombohedral Form of Li3V2(PO4)3 as a Cathode in Li-Ion Batteries, Chem. Mater., 2000, vol. 12, p. 3240.
Ivanishchev, A.V., Churikov, A.V., and Ushakov, A.V., Lithium transport processes in electrodes on the basis of Li3V2(PO4)3 by constant current chronopotentiometry, cyclic voltammetry and pulse chronoamperometry, Electrochim. Acta, 2014, vol. 122, p. 187.
Ivanishchev, A.V., Churikov, A.V., Ivanishcheva, I.A., and Ushakov, A.V., Lithium diffusion in Li3V2(PO4)3-based electrodes: a joint analysis of electrochemical impedance, cyclic voltammetry, pulse chronoamperometry, and chronopotentiometry data, Ionics, 2016, vol. 22, p. 483.
Ivanishchev, A.V., Ushakov, A.V., Ivanishcheva, I.A., Churikov, A.V., Mironov, A.V., Fedotov, S.S., Khasanova, N.R., and Antipov, E.V., Structural and electrochemical study of fast Li diffusion in Li3V2(PO4)3-based electrode material, Electrochim. Acta, 2017, vol. 230, p. 479.
Babbar, P., Ivanishchev, A., Churikov, A., and Dixit, A., Electrochemical behavior of carbonic precursor with Na3V2(PO4)3 nanostructured material in hybrid battery system, Ionics, 2017, vol. 23, p. 3067.
Ushakov, A.V., Makhov, S.V., Gridina, N.A., Ivani-shchev, A.V., and Gamayunova, I.M., Rechargeable lithium-ion system based on lithium-vanadium(III) phosphate and lithium titanate and the peculiarity of it functioning, Monatsh. Chem., 2019, vol. 150, p. 499.
Sun, C., Rajasekhara, S., Dong, Y., and Goodenough, J.B., Hydrothermal Synthesis and Electrochemical Properties of Li3V2(PO4)3/C-Based Composites for Lithium-Ion Batteries, ACS Appl. Mater. Inter., 2011, vol. 3, p. 3772.
Chen, Y., Zhao, Y., An, X., Liu, J., Dong, Y., and Chen, L., Preparation and electrochemical performance studies on Cr-doped Li3V2(PO4)3 as cathode materials for lithium-ion batteries, Electrochim. Acta, 2009, vol. 54, p. 5844.
Yao, J., Wei, S., Zhang, P., Shen, C., Aguey-Zinsou, K.-F., and Wang, L., Synthesis and properties of Li3V2-xCex(PO4)3/C cathode materials for Li-ion batteries, J. Alloy. Compd., 2012, vol. 532, p. 49.
Yuan, W., Yan, J., Tang, Z., Sha, O., Wang, J., Mao, W., and Ma, L., Mo-doped Li3V2(PO4)3/C cathode material with high rate capability and long term cyclic stability, Electrochim. Acta, 2012, vol. 72, p. 138.
Bini, M., Ferrari, S., Capsoni, D., and Massarotti, V., Mn influence on the electrochemical behaviour of Li3V2(PO4)3 cathode material, Electrochim. Acta, 2011, vol. 56, p. 2648.
Ren, M.M., Zhou, Z., Gao, X.P., Peng, W.X., and Wei, J.P., Core–Shell Li3V2(PO4)3@C Composites as Cathode Materials for Lithium-Ion Batteries, J. Phys. Chem. C, 2008, vol. 112, p. 5689.
Pan, A., Liu, J., Zhang, J.-G., Xu, W., Cao, G., Nie, Z., Arey, B.W., and Liang, S., Nano-structured Li3V2(PO4)3/carbon composite for high-rate lithium-ion batteries, Electrochem. Commun., 2010, vol. 12, p. 1674.
Teng, F., Hu, Z.-H., Ma, X.-H., Zhang, L.-C., Ding, C.-X., Yu, Y., and Chen, C.-H., Hydrothermal synthesis of plate-like carbon-coated Li3V2(PO4)3 and its low temperature performance for high power lithium-ion batteries, Electrochim. Acta, 2013, vol. 91, p. 43.
Eftekhari, A., LiFePO4/C nanocomposites for lithium-ion batteries, J. Power Sources, 2017, vol. 343, p. 395.
Konarova, M. and Taniguchi, I., Synthesis of carbon-coated LiFePO4 nanoparticles with high rate performance in lithium secondary batteries, J. Power Sources, 2010, vol. 195, p. 3661.
Chong, J., Xun, S., Song, X., Ridgway, P., Liu, G., and Battaglia, V.S., Towards the understanding of coatings on rate performance of LiFePO4, J. Power Sources, 2012, vol. 200, p. 67.
Kam, K.C., Gustafsson, T., and Thomas, J.O., Synthesis and electrochemical properties of nanostructured Li2FeSiO4/C cathode material for Li-ion batteries, Solid State Ionics, 2011, vol. 192, p. 356.
Fujita, Y., Iwase, H., Shida, K., Liao, J., Fukui, T., and Matsuda, M., Synthesis of high-performance Li2FeSiO4/C composite powder by spray-freezing/freeze-drying a solution with two carbon sources, J. Power Sources, 2017, vol. 361, p. 115.
Jeitschko, W. and Nowotny, H., Die Kristallstruktur von Ti3SiC2 – ein neuer Komplexcarbid-Typ, Monatsh. Chem., 1967, vol. 98, p. 329.
Barsoum, M.W. and El-Raghy, T., Synthesis and Characterization of a Remarkable Ceramic: Ti3SiC2, J. Am. Ceram. Soc., 1996, vol. 79, p. 1953.
Barsoum, M.W. and El-Raghy, T., The MAX Phases: Unique New Carbide and Nitride Materials: Ternary ceramics turn out to be surprisingly soft and machinable, yet also heat-tolerant, strong and lightweight, Am. Sci., 2001, vol. 89, p. 334.
Högberg, H., Hultman, L., Emmerlich, J., Joelsson, T., Eklund, P., Molina-Aldareguia, J.M., Palmquist, J.-P., Wilhelmsson, O., and Jansson, U., Growth and characterization of MAX-phase thin films, Surf. Coat. Tech., 2005, vol. 193, p. 6.
Sun, Z.M., Progress in research and development on MAX phases: a family of layered ternary compounds, Int. Mater. Rev., 2011, vol. 56, p. 143.
An, J., Liu, C., Guo, R., Li, Y., and Xu, W., Ti3SiC2 Modified LiFePO4/C Cathode Materials with Improved Electrochemical Performance, J. Electrochem. Soc., 2012, vol. 159, p. A2038.
Pampuch, R., Lis, J., Stobierski, L., and Tymkiewicz, M., Solid combustion synthesis of Ti3SiC2, J. Eur. Ceram. Soc., 1989, vol. 5, p. 283.
Cai, G., Guo, R., Liu, L., Yang, Y., Zhang, C., Wu, C., Guo, W., and Jiang, H., Enhanced low temperature electrochemical performances of LiFePO4/C by surface modification with Ti3SiC2, J. Power Sources, 2015, vol. 288, p. 136.
Wu, C., Guo, R., Cai, G., Zhang, C., Yang, Y., Guo, W., Liu, Z., Wan, Y., and Jiang, H., Ti3SiC2 modified Li3V2(PO4)3/C cathode materials with simultaneous improvement of electronic and ionic conductivities for lithium ion batteries, J. Power Sources, 2016, vol. 306, p. 779.
Sun, D., Wu, C., Guo, R., Liu, Z., Xie, D., Zheng, M., Wang, B., Peng, J., and Jiang, H., Enhanced low temperature electrochemical properties of Li3V2(PO4)3/C modified by a mixed conductive network of Ti3SiC2 and C, Ceram. Int., 2017, vol. 43, p. 2791.
Medvedeva, N.I., Enyashin, A.N., and Ivanovskii, A.L., Modeling of the electronic structure, chemical bonding, and properties of ternary silicon carbide Ti3SiC2, J. Struct. Chem., 2011, vol. 52, p. 785.
Xu, Y.-G., Ou, X.-D., and Rong, X.-M., Vacancy trapping behaviors of hydrogen in Ti3SiC2: A first-principles study, Mater. Lett., 2014, vol. 116, p. 322.
Eklund, P., Beckers, M., Jansson, U., Högberg, H., and Hultman, L., The Mn + 1AXn phases: Materials science and thin-film processing, Thin Solid Films, 2010, vol. 518, p. 1851.
Kero, I., Tegman, R., and Antti, M.-L., Effect of the amounts of silicon on the in situ synthesis of Ti3SiC2 based composites made from TiC/Si powder mixtures, Ceram. Int., 2010, vol. 36, p. 375.
Grigoryan, A.E., Rogachev, A.S., Sychev, A.E., and Levashov, E.A., SHS and formation of structure in composite materials in three-component Ti–Si–C, Ti‒Si–N, and Ti–B–N systems, Refract. Ind. Ceram., 1999, vol. 40, p. 484.
Goto, T. and Hirai, T., Chemically vapor deposited Ti3SiC2, Mater. Res. Bull., 1987, vol. 22, p. 1195.
Zhimei, S., Yi, Z., and Yanchun, Z., Synthesis of Ti3SiC2 powders by a solid-liquid reaction process, Scripta Mater., 1999, vol. 41, p. 61.
Sun, Z. and Zhou, Y., Fluctuation synthesis and characterization of Ti3SiC2 powders, Mater. Res. Innov., 1999, vol. 2, p. 227.
Arunajatesan, S. and Carim, A.H., Synthesis of Titanium Silicon Carbide, J. Am. Ceram. Soc., 1995, vol. 78, p. 667.
Kellerman, D.G., Gorshkov, V.S., Blinovskov, Ya.N., Grigorov, I.G., Perelyaev, V.A., and Shveikin, V.A., Synthesis and properties of the ternary phase Ti3SiC2, Inorg. Mater., 1997, vol. 33, p. 271.
Yang, S., Sun, Z.M., and Hashimoto, H., Reaction in Ti3SiC2 powder synthesis from a Ti–Si–TiC powder mixture, J. Alloy. Compd., 2004, vol. 368, p. 312.
Goldin, B.A., Istomin, P.V., and Ryabkov, Yu.I., Reduction solid-state synthesis of titanium silicide carbide, Ti3SiC2, Inorg. Mater., 1997, vol. 33, p. 577.
Istomin, P.V., Nadutkin, A.V., Ryabkov, Yu.I., and Goldin, B.A., Preparation of Ti3SiC2, Inorg. Mater., 2006, vol. 42, p. 250.
Zou, Y., Sun, Z.M., Tada, S., and Hashimoto, H., Effect of Al addition on low-temperature synthesis of Ti3SiC2 powder, J. Alloy. Compd., 2008, vol. 461, p. 579.
Liang, B., Han, X., Zou, Q., Zhao, Y., and Wang, M., TiC/Ti3SiC2 composite prepared by mechanical alloying, Int. J. Refract. Met. H., 2009, vol. 27, p. 664.
Cui, Y.R., Xu, Y.H., Xu, S.C., Li, X.M., and Yang, J., Synthesis of High Purity Ti3SiC2 Powder by Vacuum Sintering, Mater. Sci. Forum., 2009, vols. 620–622, p. 331.
Аввакумов, Е.Г. Механические методы активации химических процессов. Новосибирск: Наука, 1989. 306 с. [Avvakumov, E.G., Mechanical activation methods of chemical processes (in Russian), Novosibirsk: Nauka, 1989. 306 p.]
Chen, Y., Zhang, D., Bian, X., Bie, X., Wang, C., Du, F., Jang, M., Chen, G., and Wei, Y., Characterizations of the electrode/electrolyte interfacial properties of carbon coated Li3V2(PO4)3 cathode material in LiPF6 based electrolyte, Electrochim. Acta, 2012, vol. 79, p. 95.
Zhang, S., Wu, Q., Deng, C., Liu, F.L., Zhang, M., Meng, F.L., and Gao, H., Synthesis and characterization of Ti–Mn and Ti–Fe codoped Li3V2(PO4)3 as cathode material for lithium-ion batteries, J. Power Sources, 2012, vol. 218, p. 56.
Yin, S.-C., Grondey, H., Strobel, P., Anne, M., and Nazar, L.F., Electrochemical Property: Structure Relationships in Monoclinic Li3 – yV2(PO4)3, J. Am. Chem. Soc., 2003, vol. 125, p. 10402.
Zhang, L.-L., Liang, G., Peng, G., Zou, F., Huang, Y.-H., Croft, M.C., and Ignatov, A., Significantly Improved Electrochemical Performance in Li3V2(PO4)3/C Promoted by SiO2 Coating for Lithium-Ion Batteries, J. Phys. Chem. C, 2012, vol. 116, p. 12401.
Markevich, E., Sharabi, R., Gottlieb, H., Borgel, V., Fridman, K., Salitra, G., Aurbach, D., Semrau, G., Schmidt, M.A., Schall, N., and Bruenig, C., Reasons for capacity fading of LiCoPO4 cathodes in LiPF6 containing electrolyte solutions, Electrochem. Commun., 2012, vol. 15, p. 22.
Markovsky, B., Rodkin, A., Cohen, Y.S., Palchik, O., Levi, E., Aurbach, D., Kim, H.-J., and Schmidt, M., The study of capacity fading processes of Li-ion batteries: major factors that play a role, J. Power Sources, 2003, vol. 119-121, p. 504.
Ahrens, L.H., The use of ionization potentials Part 1. Ionic radii of the elements, Geochim. Cosmochim. Ac., 1952, vol. 2, p. 155.
Svitan’ko, A., Scopets, V., Novikova, S., and Yaroslavtsev, A., The effect of composite formation with oxides on the ion conductivity of NASICON-Type LiTi2(PO4)3 and olivine-type LiFePO4, Solid State Ionics, 2015, vol. 271, p. 42.
Iltchev, N., Chen, Y., Okada, S., and Yamaki, J.-I., LiFePO4 storage at room and elevated temperatures, J. Power Sources, 2003, vols. 119–121, p. 749.
Дополнительные материалы отсутствуют.


