Электрохимия, 2021, T. 57, № 7, стр. 402-407
Влияние температуры на характеристики литий-ионных и натрий-ионных аккумуляторов
Т. Л. Кулова a, *, А. М. Скундин a, **
a Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
Москва, Россия
* E-mail: tkulova@mail.ru
** E-mail: askundin@mail.ru
Поступила в редакцию 24.07.2020
После доработки 03.10.2020
Принята к публикации 14.02.2021
Аннотация
С позиций теории пористых электродов с дважды распределенными параметрами рассмотрено влияние температуры на емкость отдельных электродов и аккумуляторов в целом.
Важнейшей характеристикой любого, в том числе литий-ионного и натрий-ионного, аккумулятора является температурный диапазон его работоспособности. В большинстве случаев рассматривают диапазон температур от –50 до +50°C, выход за пределы этого диапазона представляет собой специальный случай.
Скорости токообразующих и побочных процессов в литий-ионных аккумуляторах зависят от температуры, и эта зависимость в общем виде носит активационный характер и, следовательно, представляет собой непрерывную функцию. Возможны случаи пороговых зависимостей характеристик аккумуляторов от температуры (при фазовых переходах, структурной перестройке и т.п.), в этих случаях температурные зависимости могут быть описаны разрывными функциями. Изменение скоростей отдельных стадий токообразующего процесса с температурой приводит к изменению поляризации: при снижении температуры поляризация возрастает, таким образом, при прочих равных условиях возрастает зарядное и снижается разрядное напряжение аккумулятора. В то же время, снижение температуры, как правило, приводит к уменьшению разрядной и зарядной емкости, и точная природа этого явления не очевидна.
Действительно, разрядная емкость определяется выбранным значением конечного напряжения, и в зависимости от конкретного вида разрядной кривой изменение разрядной емкости, вызванное изменением поляризации с изменением температуры, имеет разный характер. Это положение наглядно видно из рис. 1, где приведены примеры разрядных кривых с резким спадом напряжения в конце разряда (рис. 1а) и с плавным снижением напряжения по мере разряда (рис. 1б). Как видно, в первом случае разрядная емкость Q почти не зависит от температуры, и главное – не зависит от выбранного значения конечного напряжения, а во втором случае резко уменьшается при снижении температуры и сильно зависит от произвольно выбранного значения конечного напряжения. Аналогичные соображения применимы и к зарядной емкости.
Рис. 1.
Изменение разрядной емкости с температурой для аккумуляторов с разрядной кривой с резким спадом напряжения в конце разряда (а) и для аккумуляторов с плавным снижением напряжения (б). Температуры t1 < t2 < t3 < t4.

Токообразующие процессы в аккумуляторе многостадийны, и скорости разных стадий по-разному зависят от температуры, поэтому итоговая зависимость положения разрядной или зарядной кривой от температуры может быть довольно сложной. На рис. 2 приведены примеры зависимости разрядной емкости разных литий-ионных аккумуляторов от температуры, построенные по литературным данным. С учетом активационной природы основных процессов, протекающих в аккумуляторе, эти зависимости приведены в координатах “логарифм емкости–обратная абсолютная температура”.
Рис. 2.
Температурная зависимость разрядной емкости аккумуляторов: (а) аккумулятор системы смешанный литированный оксид никеля–графит по данным [1]; (б) аккумуляторы системы NMC–графит с разными электролитами по данным [2]; (в) аккумуляторы системы LiMn2O4–графит с разными гель-полимерными электролитами по данным [3]; (г) аккумулятор с полимерным электролитом по данным [4]; (д) лабораторные макеты аккумуляторов систем LiMn2O4–Li4Ti5O12 (1), LiFePO4–графит (2), NCA–графит (3), LiFePO4–Li4Ti5O12 (4) по данным [5]; (е) лабораторный макет аккумулятора системы NCA–графит по данным [6].

Следует обратить внимание на то, что в разных литературных источниках использовано разное представление зависимости емкости от температуры. В одних случаях (как на рис. 2б и 2г) емкость выражена в абсолютных единицах (Q, мА ч/г). В других случаях используются относительные величины, как отношение емкости при данной температуре к емкости того же электрода при комнатной температуре (q). Характер температурной зависимости передается одинаково, как в координатах lg Q от 1/Т, так и в координатах lg q от 1/Т.
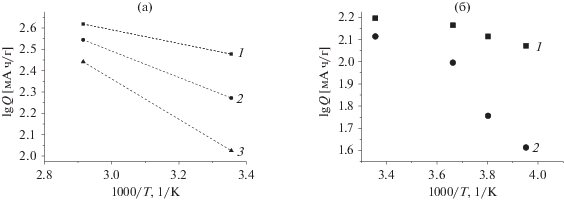
В некоторых случаях на кривых рис. 2 можно выделить по два участка, близких к линейным: высокотемпературный участок с меньшим наклоном dlg Q/d(1/T) и низкотемпературный участок с большим наклоном (например, рис. 2а, 2в, 2г). В других случаях наблюдается плавное увеличение наклона dlg Q/d(1/T) по мере снижения температуры (например, рис. 2б, 2е). Естественно, что зависимость емкости отдельных электродов от температуры выражается, в общем, так же. Примеры температурной зависимости емкости отдельных электродов приведены на рис. 3.
Рис. 3.
Температурная зависимость разрядной емкости отдельных электродов. (а) Электроды из углеродных материалов: (1) терморасширенный графит (по данным [7]), (2) кокс (по данным [8]), (3) графит (по данным [9]); (б) электроды из Li4Ti5O12: (1) по данным [9]), (2) по данным [10]), (3) по данным [11]); (в – электроды из NMC (по данным [12]); (г) электроды из LiFePO4 (по данным [13] пустые значки, по данным [14] залитые значки).

В работе [7] при исследовании влияния температуры на интеркаляцию лития в терморасширенный графит предполагалось, что кинетика этого процесса определяется только диффузией лития в фазе графита. В гальваностатических условиях при относительно невысоких плотностях тока литий внедряется во всю глубину частиц графита. При увеличении плотности тока толщина диффузионного слоя к моменту достижения нулевого потенциала (т.е., когда время гальваностатического опыта равно переходному времени τ) становится меньше размера частиц графита, и разрядная емкость оказывается меньше предельной. Переходное время в условиях плоской полубесконечной диффузии определяется выражением
(1)
$\tau = {{\pi {{n}^{2}}{{F}^{2}}D{{c}^{2}}} \mathord{\left/ {\vphantom {{\pi {{n}^{2}}{{F}^{2}}D{{c}^{2}}} {4{{i}^{2}}}}} \right. \kern-0em} {4{{i}^{2}}}},$В гальваностатических условиях разрядная емкость пропорциональна переходному времени, и следовательно, пропорциональна коэффициенту диффузии лития. Очевидно, что в этих условиях температурная зависимость разрядной емкости совпадает с температурной зависимостью коэффициента диффузии. Действительно, данные из работы [7] в диапазоне температур от –40 до ‒15°C хорошо линеаризуются в координатах lg Q, 1/T, а при температурах от 0 до 37°С емкость практически не зависит от температуры (рис. 3а, значки 1). Наклон линейного участка в этом случае составляет 3.45 К, что формально соответствует энергии активации около 66 кДж/моль; это значение явно превышает энергию активации диффузии. Такое завышение наклона линейного участка было объяснено в работе [7] тем обстоятельством, что исследуемые электроды представляют собой пористые объекты с относительно широким распределением частиц по размерам. С понижением температуры уменьшается коэффициент диффузии, уменьшается толщина диффузионного слоя и все большее количество частиц литируются не на всю глубину. Таким образом, температурная зависимость емкости оказывается более крутой, чем для гомодисперсного электрода, что соответствует большей кажущейся энергии активации.
Объяснение природы температурной зависимости емкости интеркаляционных электродов, приведенное в [7], следует рассматривать как весьма приближенное. Геометрия диффузии в субмикронных частицах графита далека от линейной полубесконечной. Но главное, весь электрод следует рассматривать как систему с дважды распределенными параметрами: 1) как пористый объект, заполненный электролитом, интенсивность процесса в котором затухает по глубине активного слоя, 2) как объект, состоящий из отдельных частиц, интенсивность диффузии в которых изменяется по глубине каждой частицы. В [7] принималось во внимание только второе распределение параметров.
Из теории жидкостных пористых электродов следует, что неравномерность распределения процесса по глубине пористого электрода определяется соотношением константы скорости электродной реакции (k) и коэффициента диффузии ионов в жидком электролите, заполняющем поры электрода (D), или между константой скорости электродной реакции и удельной проводимостью электролита (κ) [15, 16]. Глубина проникновения процесса определяется так называемыми характерной диффузионной (Ld) и характерной омической длиной (Lo), которые выражаются следующими формулами:
(2)
${{L}_{{\text{d}}}} = \sqrt {{{nFD} \mathord{\left/ {\vphantom {{nFD} {\sigma k}}} \right. \kern-0em} {\sigma k}}} ,$(3)
${{L}_{{\text{o}}}} = \sqrt {{{nF\kappa } \mathord{\left/ {\vphantom {{nF\kappa } {\sigma k}}} \right. \kern-0em} {\sigma k}}} ,$(4)
$D = {{D}_{0}}\exp \left( {{{ - {{W}_{D}}} \mathord{\left/ {\vphantom {{ - {{W}_{D}}} {RT}}} \right. \kern-0em} {RT}}} \right),$(5)
$\kappa = {{\kappa }_{0}}\exp \left( {{{ - {{W}_{\kappa }}} \mathord{\left/ {\vphantom {{ - {{W}_{\kappa }}} {RT}}} \right. \kern-0em} {RT}}} \right),$(6)
$k = {{k}_{0}}\exp \left( {{{ - {{W}_{k}}} \mathord{\left/ {\vphantom {{ - {{W}_{k}}} {RT}}} \right. \kern-0em} {RT}}} \right).$Если считать, что реализуемая емкость пропорциональна характерной длине, то после простых преобразований получаем
(7)
$\lg Q = a - {{\left( {{{W}_{D}} - {{W}_{k}}} \right)} \mathord{\left/ {\vphantom {{\left( {{{W}_{D}} - {{W}_{k}}} \right)} {4.6RT}}} \right. \kern-0em} {4.6RT}}{\kern 1pt} ,$(8)
$\lg Q = a - {{\left( {{{W}_{\kappa }} - {{W}_{k}}} \right)} \mathord{\left/ {\vphantom {{\left( {{{W}_{\kappa }} - {{W}_{k}}} \right)} {4.6RT}}} \right. \kern-0em} {4.6RT}}{\kern 1pt} .$Логично предположить, что высокотемпературные участки зависимостей на рис. 2 и 3 относятся именно к эффекту распределения параметров по толщине пористого электрода. Так, для электродов из титаната лития (рис. 3б) наклон высокотемпературного участка соответствует формальному значению энергии активации 2.8 кДж/моль по данным [10] и [11], а наклоны низкотемпературных участков соответствуют значениям 27 кДж/моль по данным [9], 25 кДж/моль по данным [10] и 32 кДж/моль по данным [11].
Энергия активации проводимости жидких электролитов литий-ионных и натрий-ионных аккумуляторов имеет порядок 20–30 кДж/моль. Например, для 1 М растворов LiPF6 в смесях этиленкарбоната с диэтилкарбонатом (3 : 7) и этиленкарбоната с диметилкарбонатом и диэтилкарбонатом (1 : 1 : 1) энергия активации проводимости составляет 22 кДж/моль [17]. Для 1 M LiPF6 в смеси этиленкарбоната с пропиленкарбонатом и этилметилкарбонатом (2 : 2 : 6) энергия активации проводимости составляет 20.5 кДж/моль [6]. Для 1.15 М LiPF6 в смеси этиленкарбоната, диметилкарбоната и метилэтилкарбоната (1 : 1 : 1) энергия активации проводимости составляет 21.8 кДж/моль [18]. Энергия активации коэффициента жидкостной диффузии (фигурирующего в уравнениях (2) и (4)) должна иметь тот же порядок, поскольку, согласно соотношению Нернста–Эйнштейна, коэффициент диффузии пропорционален абсолютной скорости иона. Оценить энергию активации константы скорости электродной реакции чрезвычайно трудно, хотя бы потому, что величина k в том смысле, в каком она используется в уравнениях (2) и (3), включает в себя затруднения прохождения заряда через пассивную пленку на поверхности электрода, граничащей с электролитом. Так или иначе, в принципе, разности WD – Wk и ${{W}_{\kappa }}$ – Wk могут быть как положительными, так и отрицательными, т.е. наклон зависимостей dlgQ/d(1/T) теоретически может иметь любой знак. Во всех примерах, приведенных на рис. 2 и 3, этот наклон отрицателен. Пример системы с положительным значением наклона dlg Q/d(1/T) приведен в [19], где исследована кинетика деградации (спада емкости по мере циклирования) литий-ионных аккумуляторов при разных температурах. Предложенная в [19] интерпретация такого необычного эффекта отличается от излагаемого в настоящей работе.
Изложенное выше соображение о том, что зависящее от замедленности твердофазной диффузии уменьшение емкости при снижении температуры проявляется тем слабее, чем меньше размер частиц активного материала, иллюстрируется данными из работы [8], показанными на рис. 4.
Рис. 4.
Температурная зависимость емкости электрода из более мелких (1) и более крупных (2) частиц кокса (по данным [8]).

Как видно из уравнения (1), глубина проникновения диффузионного процесса сильно уменьшается с ростом плотности тока. С учетом широкого распределения частиц активного материала по размерам, в соответствии с соображениями, высказанными в работе [7], рост тока должен приводить к увеличению наклона dlg Q/d(1/T), что и наблюдается на практике. На рис. 5а приведены данные об интеркаляционной емкости электродов из твердого углерода по внедрению натрия при температурах 25 и 70°С и разных токовых нагрузках, а на рис. 5б – аналогичные данные о внедрении лития в электроды из титаната лития.
Список литературы
Zhang, S.S., Xu, K., and Jow, T.R., The low temperature performance of Li-ion batteries, J. Power Sources, 2003, vol. 115, p. 137.
Shi, P., Fang, F., Luo, D., Yang, L., and Hiranoc, S., A Safe Electrolyte Based on Propylene Carbonate and Non-Flammable Hydrofluoroether for High-Performance Lithium Ion Batteries, J. Electrochem. Soc., 2017, vol. 164, p. A1991.
Smart, M.C., Ratnakumar, B.V., Behar, A., Whitcanack, L.D., Yu, J.-S., and Alamgir, M., Gel polymer electrolyte lithium-ion cells with improved low temperature performance, J. Power Sources, 2007, vol. 165, p. 535.
Aris, A.M. and Shabani, B., An experimental study of a lithium ion cell operation at low temperature conditions, Energy Procedia, 2017, vol. 110, p. 128.
Singer, J.P. and Birke, K.P., Kinetic study of low temperature capacity fading in Li-ion cells, J. Energy Storage, 2017, vol. 13, p. 129.
Li, Q., Jiao, S., Luo, L., Ding, M.S., Zheng, J., Cartmell, S.S., Wang, C.-M., Xu, K., Zhang, J.-G., and Xu, W., Wide-Temperature Electrolytes for Lithium-Ion Batteries, ACS Appl. Mater. Interfaces, 2017, vol. 9, p. 18826.
Кулова, Т.Л. Влияние температуры на обратимые и необратимые процессы при интеркаляции лития в графит. Электрохимия. 2004. Т. 40. С. 1221. [Kulova, T.L., Effect of Temperature on Reversible and Irreversible Processes during Lithium Intercalation in Graphite, Russ. J. Electrochem., 2004, vol. 40, p. 1052.]
Huang, C.-K., Sakamoto, J.S., Wolfenstine, J., and Surampudia, S., The Limits of Low-Temperature Performance of Li-Ion Cells, J. Electrochem. Soc., 2000, vol. 147, p. 2893.
Zhu, G., Wen, K., Lv, W., Zhou, X., Liang, Y., Yang, F., Chen, Z., Zou, M., Li, J., Zhang, Y., and He, W., Materials insights into low-temperature performances of lithium-ion batteries, J. Power Sources, 2015, vol. 300, p. 29.
Кузьмина, А.А., Кулова, Т.Л., Тусеева, Е.К., Чиркова, Е.В. Особенности работы электродов литий-ионного аккумулятора при пониженных температурах. Электрохимия. 2020. Т. 56. С. 994. [Kuz’mina, A.A., Kulova, T.L., Tusseeva, E.K., and Chirkova, E.V., Features of electrodes of lithium-ion batteries at lower temperatures, Russ. J. Electrochem., 2020, vol. 56, p. 899.]
Тусеева, Е.К., Кулова, Т.Л., Скундин, А.М. Влияние температуры на поведение электродов из титаната лития. Электрохимия. 2018. Т. 54. С. 1135. [Tusseeva, E.K., Kulova, T.L., and Skundin, A.M., Temperature Effect on the Behavior of a Lithium Titanate Electrode, Russ. J. Electrochem., 2018, vol. 54, p. 1186.]
Yoon, S.J., Myung, S.T., and Sun, Y.K., Low Temperature Electrochemical Properties of Li[NixCoyMn1 – x – y]O2 Cathode Materials for Lithium-Ion Batteries, J. Electrochem. Soc., 2014, vol. 161, p. A1514.
Тусеева, Е.К., Кулова, Т.Л., Скундин, А.М., Галеева, А.К., Курбатов, А.П. Влияние температуры на поведение электродов из феррофосфата лития. Электрохимия. 2019. Т. 55. С. 329. [Tusseeva, E.K., Kulova, T.L., Skundin, A.M., Galeeva, A.K., and Kurbatov, A.P., Temperature Effects on the Behavior of Lithium Iron Phosphate Electrodes, Russ. J. Electrochem., 2019, vol. 55, p. 194.]
Rui, X.H., Jin, Y., Feng, X.Y., Zhang, LC., and Chen, C.H., A comparative study on the low-temperature performance of LiFePO4/C and Li3V2(PO4)3/C cathodes for lithium-ion batteries, J. Power Sources, 2011, vol. 196, p. 2109.
Фрумкин, А.Н. О распределении коррозионного процесса по длине трубки. Журн. физ. хим. 1949. Т. 23. С. 1477. [Frumkin, A.N., On corrosion process distribution along tube, Zh. Phys. Chem. 1949, vol. 23, p. 1477 (in Russian).]
Багоцкий, В.С., Скундин, А.М, Химические источники тока. М.: Энергоиздат, 1981. 360 с. [Bagotzky, V.S. and Skundin, A.M., Chemical Power Sources. 1980. London; New-York; Sydney: Academic Press, 385 p.]
Smart, M.C., Ratnakumar, B.V., and Surampudi, S., Electrolytes for Low-Temperature Lithium Batteries Based on Ternary Mixtures of Aliphatic Carbonates, J. Electrochem. Soc., 1999, vol. 146, p. 486.
Кулова, Т.Л., Тарнопольский, В.А., Скундин, А.М. Импеданс литий-ионных аккумуляторов. Электрохимия. 2009. Т. 45. С. 42. [Kulova, T.L., Tarno-pol’skii, V.A., and Skundin, A.M., The Impedance of Lithium-ion Batteries, Russ. J. Electrochem., 2009, vol. 45, p. 38.]
Waldmann, T., Wilka, M., Kasper, M., Fleischhammer, M., and Wohlfahrt-Mehrens, M., Temperature dependent ageing mechanisms in Lithium-ion batteries—A Post-Mortem study, J. Power Sources, 2014, vol. 262, p. 129.
Ponrouch, A. and Palacín, M.R., On the high and low temperature performances of Na-ion battery materials: Hard carbon as a case study, Electrochem. Comm., 2015, vol. 54, p. 51.
Дополнительные материалы отсутствуют.