Электрохимия, 2021, T. 57, № 8, стр. 485-491
Исследование наноструктурированных углеродных войлочных материалов в качестве электродов ванадиевых проточных аккумуляторных батарей
В. А. Комаров a, *, А. Н. Воропай b, **, М. Н. Ильина a, Т. В. Горячева a
a Государственный университет “Дубна”
Дубна, Россия
b ЗАО “МПОТК “Технокомплект”
Дубна, Россия
* E-mail: svarogber2013@gmail.com
** E-mail: voropay@techno-com.ru
Поступила в редакцию 10.10.2020
После доработки 20.11.2020
Принята к публикации 28.12.2020
Аннотация
Проточные ванадиевые аккумуляторные батареи набирают большую популярность в мире и уже опережают свинцовые аккумуляторы по величине установленной мощности, но сильно отстают от литий-ионных батарей. Большое распространение данных систем сдерживает в том числе и низкая удельная мощность, ввиду того, что электрокаталитическая активность электродных материалов по отношению к ионам ванадия низкая, поэтому поляризационное сопротивление при высоких плотностях тока является значительным. В данной работе исследуется метод модификации войлочных электродов для снижения удельного сопротивления ячейки проточного аккумулятора. Модификация проводится методом термического каталитического разложения пропан/бутана на поверхности углеродного волокна. Показано, что нанесение нитевидных наноструктур снижает удельное поверхностное сопротивление ячейки проточного аккумулятора с 11 до 3.9 Ом см2.
ВВЕДЕНИЕ
Проточные ванадиевые редокс-аккумуляторы в современном мире приобретают все большую популярность как накопители для альтернативной энергетики [1]. Как показывают авторы работы [2], перспективным, на сегодняшний день, является направление по снижению стоимости стеков проточной батареи, так как они составляют значительную мощность системы. Есть два пути снижения стоимости стеков – это снижение материалоемкости и повышение характеристик стека. На стоимость и производительность стеков влияют три составляющих: протон проводящая мембрана, пористые войлочные электроды и биполярные пластины. Особое внимание следует уделить электродам, поскольку они поддерживают кинетику электрохимической реакции и определяют перенапряжение. Следовательно, энергоэффективность всей системы зависит от параметров электрода. В дополнение к этому, структура электродов определяет характеристики потока и проницаемости, которые влияют на гидросопротивление электрода и степень его гидродинамических потерь [3, 4].
Основным сырьем для производства электродов проточных ванадиевых батарей является углеродный войлок на основе полианилинового волокна. Такие электроды обеспечивают необходимую кинетику протекания электрохимической реакции за счет наличия на поверхности различных кислородных групп [5]. Причем, как показывают работы [6, 7], кинетика протекания реакции для ионов ванадия зависит от концентрации фенольных групп на поверхности электрода, и в большей степени эта зависимость проявляется в реакции на отрицательном электроде, где протекает реакция воcстановления V3+ до V2+ при заряде и окисления V2+ до V3+ при разряде. Для положительного электрода стадия переноса кислорода является лимитирующей, как показано в работе [8], что делает данный процесс менее зависимым от концентрации активных центров, чем реакция на отрицательном электроде. Тем не менее, графитовый войлок должен быть подвергнут обработке поверхности, прежде чем он может быть использован в качестве электродов, чтобы улучшить его электрохимические характеристики [9].
Модификация углеродного войлока проводится разными исследователями для повышения его электрокаталитической активности. Эффективным способом достижения этого является введение электрокатализатора на поверхность графита. Электрохимическая активность окислительно-восстановительных пар ванадия может быть облегчена электроосаждением катализаторов на основе благородных металлов, таких как Pt, Pd, Au и Ir, что показано в статье [10]. Однако высокая стоимость и низкая механическая стабильность катализаторов из благородных металлов остаются проблемными. Усовершенствованные катализаторы с более низкой стоимостью и высокой каталитической активностью изучались некоторыми исследователями, например [11] продемонстрировали, что угольный бумажный электрод, покрытый WO3/SAC, улучшает электрохимические характеристики по сравнению с стандартными свойствами аккумулятора. Другие исследователи [12] сообщили, что модификации углеродного войлочного электрода Mn3O4 обеспечивают эффективную работу ванадиевых батарей.
Функционализация углеродных материалов может проводиться с использованием химического или термического окисления. На поверхности электродов могут быть сформированы различные функциональные группы (карбонил [13], карбоксил [14] и гидроксил [14]) и различные азотные группы. В данных работах было показано, что это приводит к улучшению электрохимических свойств углерода.
Исследователи [15] продемонстрировали, что, выращивая нанопроволоки TiO2 на поверхности графитового войлока с помощью гидротермального метода, с последующим азотированием до TiN, получаются значения КПД по энергии около 70% при высоком токе с плотностью до 150 мА/см2, что свидетельствует о высокой электрокаталитической активности электродов. Параллельно другие авторы статей сообщали о значительной роли, которую играют связи C–N во взаимодействии с ионами ванадия [16, 17].
Но на сегодняшний день проблемой всех электродных материалов для проточных ванадиевых батарей, сформированных на основе металлических катализаторов [18], является временная стабильность, так как коррозия катализаторов протекает быстрее, чем коррозия углерода, а также существует проблема адгезии катализаторов на поверхности электрода. Все это заставляет исследователей и инженеров искать другие пути для модификации электродов. Авторы настоящей работы считают, что наиболее перспективным направлением является выращивание на поверхности углеродного электрода различных наноструктур, преимущественно нанонитей, которые переплетаясь в процессе роста, создают неразрушимый каркас вокруг углеродного волокна.
В настоящей работе мы исследуем, как наличие нанонитей на поверхности углеродного войлока влияет на его электрохимические характеристики, чтобы продемонстрировать перспективность данного метода модификации поверхности электродов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы
В качестве электродного материала использовался углеродный войлок GFD 4.6 EA (SGL Carbon, Германия). Этот же материал использовался и для формирования наноструктурированного композитного электрода.
Модификация углеродного войлока
До осаждения наночастиц никеля и после синтеза углеродных нановолокон (УНВ) образцы обрабатывали на установке низкотемпературной плазмы Atto B (Diener electronic GmbH + Co. KG, Германия) в плазме сухого воздуха при постоянном давлении 225 тoрр, частоте 40 кГц и интенсивности 100%. Время обработки 30 мин. Таким образом получен войлок, модифицированный углеродными наноструктурами (GFD 4.6 EA/NF). Съемка образцов проводилась методом сканирующей электронной микроскопии на микроскопе SUPRA 40-30-87 при ускоряющем напряжении 10 кВ.
Осаждение наночастиц никеля
На данном этапе на углеродный войлок осаждались наночастицы никеля методом электрохимического осаждения. Осаждение проводилось в водном электролите Уотса [19] следующего состава: 1.46 М NiSO4, 0.47 М NiCl2, 0.21 M NaCl, 0.13 M NaF и 0.53 M H3BO3. Осаждение проводилось при температуре 40°С в течение 50 с. Осаждение проводилось в 3-электродной ячейке. В качестве вспомогательного электрода использовали платиновый электрод, в качестве электрода сравнения насыщенный хлоридсеребряный электрод, а рабочим электродом служило углеродное волокно GFD 4.6 EA. Осаждение проводилось в гальваностатическом режиме при плотности тока 5 мкА/см2 (плотность тока рассчитана на площадь войлочного электрода).
После осаждения никелевого катализатора образцы промывали от остатков электролита и сушили в вакууме при температуре 120°С в течение 48 ч.
Синтез углеродных нановолокон
Далее, образцы помещались в трубчатую печь STF 15 (Carbolite Gero) и нагревались до температуры 750°С в атмосфере аргона при давлении 60–70 тoрр. После выдерживались при данной температуре в атмосфере аргон/водорода (9 : 1 соответственно) в течение 30 мин при давлении 60–70 тoрр. Далее в камеру подавалась смесь пропан/бутана (чистота 99.8%) при давлении 190–210 тoрр в течение 60 мин [20].
Электрохимические исследования
Электрохимические исследования проводились в 2-электродной проточной ячейке в гальваностатическом режиме при плотности тока от 25 до 100 мА/см2. Использовался электролит состава: 0.8 М VOSO4 и 0.4 М V2(SO4)3 в 3 М растворе серной кислоты. Площадь электродов 6.25 см2, в качестве электродов использовался углеродный войлок GFD 4.6 EA или GFD 4.6 EA/NF, в качестве мембраны использовался Nafion 117. Углеродный войлок при сборке сжимался до толщины 4 мм. Скорость прокачки электролита составляла 1.1 л/ч. Исследование проводилось в гальваностатическом режиме при токах заряда разряда от 25 до 100 мА/см2.
Расчет удельного поверхностного сопротивления ячейки (ASR) проводился из значений энергии заряда и энергии разряда системы, так как для практического применения важным параметром является энергоэффективность системы. Энергия заряда тратится на изменение валентности ионов ванадия и на тепло согласно уравнению (1), другими потерями мы пренебрегаем. При разряде, энергия, которая была запасена в виде химической связи расходуется на создание электрического тока и на тепло, как представлено в уравнении (2). Мы делаем допущение, что саморазряда электролита в баках нет. Сопротивление в данном случае – это сопротивление ячейки, и оно связано с ASR формулой (3). Вычитая из уравнения (1) уравнение (2) и учитывая (3), получаем уравнение (4), по которому и рассчитывается ASR. При этом мы полагаем, что сопротивление при заряде и разряде одинаковое. Рабочее напряжение рассчитывается по формуле (5), с учетом того, что падение напряжения на ячейке также связано с сопротивлением ячейки. КПД по напряжению, заряду и энергии рассчитывались аналогично статье [21, 22]. Среднее рабочее напряжение (или средняя ЭДС элемента) рассчитывалось по уравнению (5) с учетом того, что падение напряжения на ячейке также связано и с внутренним сопротивлением ячейки. Поэтому в уравнении присутствует дополнительное слагаемое, зависящее от сопротивления ячейки. Это позволяет сравнить средние рабочие напряжения двух ячеек, имеющих различное внутреннее сопротивление.
Где E0 – энергия, которая идет на изменение валентности ионов ванадия; R – среднее сопротивление ячейки; ASR – удельное поверхностное сопротивление (area specific resistivity) [Ом см2], ЕCh и ЕDch – энергия заряда и разряда соответственно, tCh и tDch – время заряда и разряда соответственно, I – ток заряда и разряда, S – площадь электрода, U – среднее рабочее напряжение.РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На рис. 1 представлены СЭМ-изображения углеродного войлока на различных этапах получения образцов. Видно, что исходное углеродное волокно имеет на своей поверхности большое количество сторонних элементов (рис. 1а), которые могут оказывать отрицательный эффект на работу данного войлока в качестве электродного материала, а также данные элементы могут загрязнять электролит. После плазменной обработки поверхность волокна становится чистой (рис. 1б), что важно для нанесения на поверхность катализатора.
Рис. 1.
СЭМ-изображения углеродного войлока на различных этапах: а – исходный войлок; б – войлок после плазменной обработки и перед нанесением катализатора; в – войлок с нанесенным катализатором; г – углеродный войлок, модифицированный углеродными наноструктурами.

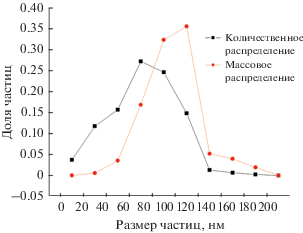
Катализатор (наночастицы никеля) формируется на поверхности редкими индивидуальными (практически без образования агломератов) частицами со средним массовым и средним количественным размером 82 и 72 нм соответственно. Кривая распределения частиц по размерам и массовое распределение частиц представлено на рис. 2. Основная масса частиц находится в интервале от 60 до 130 нм, а размер частиц в интервале от 30 до 110 нм.
Несмотря на редкое расположение частиц никеля, углеродные наноструктуры формируются на поверхности углеродного войлока в виде густых переплетенных нитей (рис. 1г). Прирост массы при этом составляет лишь 4.5%, что определяется взвешиванием сухих образцов до и после формирования углеродных наноструктур.
На рис. 3 представлены заряд-разрядные кривые углеродного войлока исходного GFD 4.6 EA и модифицированного GFD 4.6 EA/NF. Видно, что модифицированный углеродный войлок способен работать значительно дольше при том же объеме электролита, то есть позволяет достичь лучшую утилизацию ванадия, как в абсолютном отношении (выше энергоемкость и заряд), так и в относительном (выше КПД по энергии). Значение КПД энергетического и кулоновского представлено в табл. 1.
Рис. 3.
Заряд-разрядные кривые углеродного войлока исходного GFD 4.6 EA и модифицированного GFD 4.6 EA/NF при плотности тока 25 мА/см2.
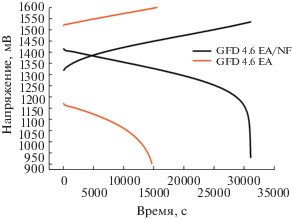
Таблица 1.
Характеристики ячейки при плотности тока 25 мА/см2
| Характеристика | Значение для GFD 4.6 EA | Значение для GFD 4.6 EA/NF |
|---|---|---|
| ASR, Ом см2 | 11.0 | 3.9 |
| Рабочее напряжение, мВ | 1355 | 1408 |
| КПД по заряду, % | 94.6 | 95.9 |
| КПД по напряжению, % | 69.3 | 90.4 |
| КПД по энергии, % | 65.6 | 86.7 |
Видно из табл. 1, что после модификации произошло не только снижение удельного поверхностного сопротивления, но и небольшое повышение рабочего напряжения, что может быть связано с изменением состава поверхности углеродного войлока при обработке его в плазме [23] сухого воздуха. Повышение энергетического КПД связано не только с увеличением удельной поверхности, но также с появлением на поверхности большого числа функциональных групп, в том числе и азотных [24, 25]. Более высокий КПД по напряжению у GFD 4.6 EA/NF по сравнению с образцом GFD 4.6 EA свидетельствует об усилении переноса электронов в результате снижения перенапряжений, что также может быть связано с увеличением поверхности и увеличением концентрации активных центров для взаимодействия ионов ванадия с поверхностью электрода.
На рис. 4 представлены значения основных параметров ячейки на основе войлока GFD 4.6 EA/NF при различной плотности тока, нормированные на значения соответствующего параметра при плотности тока 25 мА/см2. Видно, что кулоновский КПД повышается с увеличением плотности тока, что связано, видимо, с сокращением времени заряда/разряда и, как следствие, со снижением негативного эффекта от кроссовера электролита [26] через мембрану при работе ячейки [27].
Рис. 4.
Значения основных параметров ячейки на основе войлока GFD 4.6 EA/NF при различной плотности тока.
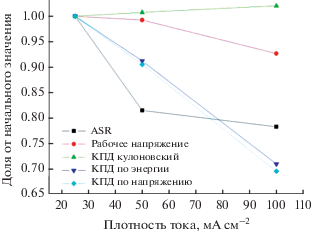
Снижение КПД по напряжению (рис. 4) с ростом плотности тока для образца GFD 4.6 EA/NF объясняется увеличением омических потерь [28], с этим же связано и снижение КПД по энергии.
ASR при повышении плотности тока снижается (рис. 4), как продемонстрировано в работе [29], где снижение сопротивления связано со снижением сопротивления в низкочастотной области спектра. Это может объясняться различным соотношением концентраций V3+/V2+ и ${{{\text{V}}{{{\text{О}}}^{{{\text{2}} + }}}} \mathord{\left/ {\vphantom {{{\text{V}}{{{\text{О}}}^{{{\text{2}} + }}}} {{\text{VО}}_{2}^{ + }}}} \right. \kern-0em} {{\text{VО}}_{2}^{ + }}},$ ввиду того, что при высоких плотностях тока снижается состояние заряда электролита. Этот эффект также наблюдался в работе [30], где видно, что повышение состояния заряда электролита приводит к повышению перенапряжения.
ЗАКЛЮЧЕНИЕ
Таким образом показано, что полученные в результате работы наноструктурированные композитные электроды снижают сопротивление ячейки проточного аккумулятора с 11 до 3.9 Ом см2. Это приводит к повышению КПД по энергии с 65.6 до 86.7% для исходного и модифицированного электрода соответственно.
Показано, что нанесение наноструктур на поверхность электрода позволяет снизить потери при переносе электронов от ионов ванадия к поверхности проводника, что проявляется в снижении величины перенапряжений на электроде в процессе работы.
Список литературы
Nguyen, T. and Savinell, R.F., Flow Batteries, Electrochem. Soc. Interface, 2010, vol. 19, p. 54. https://doi.org/10.1149/2.F06103if
Lüth, T., König, S., Suriyah, M., and Leibfried, T., Passive components limit the cost reduction of conventionally designed vanadium redox flow batteries, Energy Procedia, 2018, vol. 155, p. 379. https://doi.org/10.1016/j.egypro.2018.11.040
Wu, X., Xu, H., Lu, H., Zhao, H., Fu, H., Shen, H., Xu, H., and Dong, H., PbO2-modified graphite felt as the positive electrode for an all-vanadium redox flow battery, J. Power Sources, 2014, vol. 250, p. 274. https://doi.org/10.1016/j.jpowsour.2013.11.021
Bevilacqua, N., Eifert, L., Banerjee, R., Köble, K., Faragó, T., Zuber, M., Bazylak, A., and Zeis, R., Visualization of electrolyte flow in vanadium redox flow batteries using synchrotron X-ray radiography and tomography – Impact of electrolyte species and electrode compression, J. Power Sources, 2019, vol. 439, p. 227071. https://doi.org/10.1016/j.jpowsour.2019.227071
Eifert, L., Banerjee, R., Jusys, Z., and Zeis, R., Characterization of Carbon Felt Electrodes for Vanadium Redox Flow Batteries: Impact of Treatment Methods, J. Electrochem, Soc., 2018, vol. 165, p. A2577. https://doi.org/10.1149/2.0531811jes
Kim, K.J., Park, M.-S., Kim, Y.-J., Kim, J.H., Dou, S.X. and Skyllas-Kazacos, M., A technology review of electrodes and reaction mechanisms in vanadium redox flowbatteries, J. Mater. Chem. A, 2015, vol. 3, p. 16913. https://doi.org/10.1039/C5TA02613J
Yue, L., Li, W.S., Sun, F.Q., Zhao, L.Z., and Xing, L.D., Highly hydroxylated carbon fibres as electrode materials of all-vanadium redox flow battery, Carbon, 2010, vol. 48, p. 3079. https://doi.org/10.1016/j.carbon.2010.04.044
Sun, B. and Skyllas-Kazacos, M., Chemical modification of graphite electrode materials for vanadium redox flow battery application – part II. Acid treatments, Electrochim. Acta, 1992, vol. 37, p. 2459. https://doi.org/10.1016/0013-4686(92)87084-D
Wu, Y. and Holze, R., Electrocatalysis at Electrodes for Vanadium Redox Flow Batteries, Batteries, 2018, vol. 4, p. 47. https://doi.org/10.3390/batteries4030047
Wang, W.H. and Wang, X.D., Investigation of Ir-modifed carbon felt as the positive electrode of an all-vanadium redox flow battery, Electrochim. Acta, 2007, vol. 52, p. 6755. https://doi.org/10.1016/j.electacta.2007.04.121
Yao, C., Zhang, H., Liu, T., Li, X., and Liu, Z., Carbon paper coated with supported tungsten trioxide as novel electrode for all-vanadium flow battery, J. Power Sources, 2012, vol. 218, p. 455. https://doi.org/10.1016/j.jpowsour.2012.06.072
Kim, K.J., Park, M.S., Kim, J.H., Hwang, U., Lee, N.J., Jeong, G., and Kim, Y.J., Novel catalytic effects of Mn3O4 for all vanadium redox flow batteries, Chem.Commun., 2012, vol. 48, p. 5455. https://doi.org/10.1039/C2CC31433A
Sun, B. and Skyllas-Kazacos, M., Modification of graphite electrode materials for vanadium redox flow battery application–I. Thermal treatment, Electrochim. Acta, 1992, vol. 37, p. 1253. https://doi.org/10.1016/0013-4686(92)85064-R
Han, P., Wang, H., Liu, Z., Chen, X., Ma, W., Yao, J., Zhu, Y., and Cui, G., Graphene oxide nanoplatelets as excellent electrochemical active materials for VO2+/ and V2+/V3+ redox couples for a vanadium redox flow battery, Carbon, 2011, vol. 49, p. 693. https://doi.org/10.1016/j.carbon.2010.10.022
Vazquez-Galv, J., Flox, C., Jervis, J.R., Jorge, A.B., Shearing, P.R., and Morante, J.R., High-power nitrided TiO2 carbon felt as the negative electrode for all-vanadium redox flow batteries, Carbon, 2019, vol. 148, p. 91. https://doi.org/10.1016/j.carbon.2019.01.067
Huang, R.-H., Sun, C.-H., Tseng, T.-m., Chao, W.-k., Hsueh, K.-L., and Shieu, F.-S., Investigation of active electrodes modified with platinum/multiwalled carbon nanotube for vanadium redox flow battery, J. Electrochem. Soc., 2012, vol. 159 p. A1579. https://doi.org/10.1149/2.003210jes
Jin, J., Fu, X., Liu, Q., Liu, Y., Wei, Z., Niu, K., and Zhang, J., Identifying the Active Site in Nitrogen-Doped Graphene for the VO2+/VO2+ Redox Reaction, ACS Nano, 2013, vol. 7(6), p. 4764. https://doi.org/10.1021/nn3046709
Wang, S., Zhao, X., Cochell, T., and Manthiram, A., Nitrogen-doped carbon nanotube/graphite felts as advanced electrode materials for vanadium redox flow batteries, J. Phys. Chem., 2012, vol. 3, p. 2164. https://doi.org/10.1021/jz3008744
Golovin, Yu.I., Golovin, D.Yu., Shuklinov, A.V., Stolyarov, R.A., and Vasyukov, V.M., Electrodeposition of nickel nanoparticles onto multiwalled carbon nanotubes, Technical Physics Letters, 2011, vol. 37(3), p. 253. https://doi.org/10.1134/s1063785011030217
Temirgaliyeva, T.S., Nazhipkyzy, M., Nurgain, A., Mansurov, Z.A., and Bakenov, Z.B., Synthesis of carbon nanotubes on a shungite substrate and their use for lithium–sulfur batteries, J. Engineering Phys. and Thermophys., 2018, vol. 91, p. 1295. https://doi.org/10.1007/s10891-018-1861-5
Opar, D.O., Nankya, R., Lee, J., and Jung, H., Three-dimensional mesoporous graphene-modified carbon felt for high-performance vanadium redox flow batteries, Electrochim. Acta, 2019, vol. 330, p. 135276. https://doi.org/10.1016/j.electacta.2019.135276
Davies, T. and Tummino, J., High-Performance Vanadium Redox Flow Batteries with Graphite Felt Electrodes, J. Carbon Research, 2018, vol. 4, p. 8. https://doi.org/10.3390/c4010008
Chen, J.-Z., Liao, W.-Y., Hsieh, W.-Y., Hsu, C.-C., and Chen, Y.-S., All-vanadium redox flow batteries with graphite felt electrodes treated by atmospheric pressure plasma jets, J. Power Sources, 2015, vol. 274, p. 894. https://doi.org/10.1016/j.jpowsour.2014.10.097
Shao, Y., Wang, X., Engelhard, M., Wang, C., Dai, S., Liu, J., Yang, Z., and Lin, Y., Nitrogen-doped mesoporous carbon for energy storage in vanadium redox flow batteries, J. Power Sources, 2010, vol. 195, p. 4375. https://doi.org/10.1016/j.jpowsour.2010.01.015
Sun, J., Zeng, L., Jiang, H.R., Chao, C.Y.H., and Zhao, T.S., Formation of electrodes by self-assembling porous carbon fibers into bundles for vanadium redox flow batteries, J. Power Sources, 2018, vol. 405, p. 106. https://doi.org/10.1016/j.jpowsour.2018.10.035
Oh, K., Moazzam, M., Gwak, G., and Ju, H., Water crossover phenomena in all-vanadium redox flow batteries, Electrochim. Acta, 2008, vol. 53. https://doi.org/10.1016/j.electacta.2018.11.151
Wei, X., Nie, Z., Luo, Q., Li, B., Chen, B., Simmons, K., Sprenkle, V., and Wang, W., Nanoporous polytetrafluoroethylene/silica composite separator as a highperformance all-vanadium redox flow battery membrane, Adv. Energy Mater, 2013, vol. 3, p. 1215. https://doi.org/10.1002/aenm.201201112
Wang, Q., Qu, Z.G., Jiang, Z.Y., and Yang, W.W., Experimental study on the performance of a vanadium redox flow battery with non-uniformly compressed carbon felt electrode, Appl. Energy, 2018, vol. 213, p. 293. https://doi.org/10.1016/j.apenergy.2018.01.047
Chen, J.-Y., Hsieh, C.-L., Hsu, N.-Y., Chou, Y.-S., and Chen, Y.-S., Determining the Limiting Current Density of Vanadium Redox Flow Batteries, Energies, 2014, vol. 7, p. 5863. https://doi.org/10.3390/en7095863
Satola, B., Komsiyska, L., and Wittstock, G., Bulk Aging of Graphite-Polypropylene Current Collectors Induced by Electrochemical Cycling in the Positive Electrolyte of Vanadium Redox Flow Batteries, J. Electrochem. Soc., 2017, vol. 164, p. A2566. https://doi.org/10.1149/2.1261712jes
Дополнительные материалы отсутствуют.