Электрохимия, 2022, T. 58, № 10, стр. 688-696
Смесь фосфорно-ванадиево-молибденовых гетерополикислот как перспективный катодный редокс-медиатор гибридного водородно-воздушного топливного элемента
Л. З. Абунаева a, *, Е. А. Рубан b, М. А. Мячина a, П. А. Локтионов a, b, Д. Э. Вераксо a, А. А. Пустовалова a, М. М. Петров a, Д. В. Конев b, **, Н. Н. Гаврилова a, А. Е. Антипов a
a Российский химико-технологический университет им. Д.И. Менделеева
Москва, Россия
b Институт проблем химической физики РАН
Черноголовка, Россия
* E-mail: abunaeva_lily@mail.ru
** E-mail: dkfrvzh@gmail.com
Поступила в редакцию 01.02.2022
После доработки 04.04.2022
Принята к публикации 07.04.2022
- EDN: ZKNEKN
- DOI: 10.31857/S0424857022100036
Аннотация
Водородно-воздушный топливный элемент (ТЭ) – это один из самых перспективных видов химических источников тока с широким кругом применений. Однако для проведения целевой реакции с катодной стороны ТЭ требуется использование дорогостоящих катализаторов платиновой группы, что значительно повышает стоимость установки. Один из способов обойти эти ограничения – это применение молекул редокс-медиаторов, которые могут электрохимически восстанавливаться без значительных перенапряжений на поверхности катодов без каталитических слоев, а потом химически окисляться кислородом в объеме отдельного реактора. В данной работе была синтезирована смесь фосфорно-ванадиево-молибденовых гетерополикислот и оценены перспективы ее использования в качестве редокс-медиатора с катодной стороны водородно-воздушного топливного элемента. Редокс-поведение смеси было систематически исследовано путем анализа циклических вольтамперограмм, полученных при различных рН и скоростях развертки потенциала. Далее смесь была испытана в качестве католита разрядной ячейки гибридного источника тока, сочетающего принципы H2/O2 топливного элемента и ванадиевой проточной редокс-батареи. Разрядная мощность такой ячейки при температурах 25 и 50°C составила 30.3 и 34.9 мВт/см2 соответственно. Кроме того, была оценена возможность регенерации редокс-медиатора кислородом. Максимальный ток регенерации достигал 0.7 А. Совокупность полученных данных показывает перспективность использования синтезированной смеси в качестве редокс-медиатора гибридного ТЭ.
ВВЕДЕНИЕ
Полиоксометаллаты (ПОМ) это класс неорганических соединений, представляющих собой полианионы сложной геометрии, включающие в себя атомы переходных металлов [1]. Многообразие структур, а также широкие возможности модификации позволяют подбирать и получать соединения с требуемыми свойствами.
Гидролиз анионов некоторых металлов (например, молибдена, вольфрама, ванадия) в высших степенях окисления приводит к образованию многоядерных анионов (конденсированными ПОМ), называемых изополианионами. Структура соединений представлена тетраэдрами и октаэдрами, расположенными таким образом, что изополианион теряет способность гидролизоваться. Однако внутри трехмерной структуры остаются пустоты, в которые возможно включение посторонних атомов с образованием гетерополианионов. Соотношение числа ионов металла полианиона и ионов гетерополиатомов, а также их взаимное расположение определяют конкретные виды структур ПОМ. В настоящее время к отдельно выделенным относятся структуры Кеггина [XM12O40]3–, структуры Доусона (производные от структур Кеггина) [X2M18O62]6–, структуры Андерсона [X(OH)6M6O18]3–, где Х – гетероатом, М – включенный атом, называемый аддентом, О – кислород [1, 2]. Соединения перечисленных типов представляют большой интерес из-за их высокой растворимости (в том числе в органических растворителях), термической стабильности, большой вариативности состава, а также особенностей окислительно-восстановительных свойств.
Особенным вниманием пользуются соединения со структурой Кеггина и их производные в силу их высокой устойчивости, обусловленной особенностями геометрии, защищающей гетероатом от внешнего воздействия. Высокоорганизованная система представляет собой соединение четырех фрагментов [M3O10], связанных между собой гетероатомом, занимающим центральное положение. В роли гетероатома может выступать порядка 50 элементов [1]. Свойства гетероатома влияют на взаимное расположение фрагментов системы за счет влияния на характеристики связи М–О. Соединения со структурой Кеггина демонстрируют высокую кислотность по Бренстеду, хорошие каталитические и сокаталитические свойства [2]. Благодаря этому возможно их применение в топливных элементах.
Существует множество работ, посвященных изучению ПОМ типа Кеггина в роли модифицирующих добавок для каталитических покрытий катодов ТЭ [3–6]. ПОМ типа Кеггина склоны к необратимой адсорбции на поверхности углеродных материалов и металлов [7]. Поэтому модифицирование электродов на основе углеродных материалов производится различными методами, включающими сложные технологии нанесения наночастиц и создания композитов, что позволяет добиться не только уменьшения загрузки драгоценных металлов, но и увеличения каталитической активности электродных материалов, а следовательно, и удельной мощности топливных элементов. Например, введение H5PV2Mo10O4 в катализатор Pt/C с образованием композитного электрода приводит к увеличению удельной мощности топливного элемента в десятки раз [4].
Кроме этого ряд работ посвящен изучению модификации катионообменных мембран [8–12]. Введение гетерополикислот в структуру материала позволяет значительно улучшить его химическую стабильность при рабочих температурах ТЭ, повысить протонную проводимость, а также поддерживать влагосодержание в мембране.
Наконец благодаря структуре ПОМ, обеспечивающей высокую скорость редокс-реакций, их можно применять в качестве жидких химически-регенерируемых медиаторов кислородной реакции в водородно-воздушном топливном элементе [13]. В отличие от примеров выше, где ПОМ используются как сокатализаторы непосредственно на поверхности электрода, здесь они в жидкой фазе обеспечивают преобразование прямой каталитической реакции восстановления кислорода на катоде в опосредованную: на поверхности катода происходит гетерогенная реакция восстановления ПОМ, а в объеме раствора – гомогенная реакция обратного окисления ПОМ кислородом. Такой подход позволяет отказаться от дорогостоящего катализатора, значительно снижая стоимость установки и разрывая зависимость ее характеристик от состояния каталитического слоя. По этим причинам подход считается перспективным, несмотря на сопутствующие усложнения в конструкции топливного элемента и фактическое преобразование его в гибридный источник тока, сочетающий в своей конструкции принципы топливного элемента и проточной редокс-батареи [14].
Существует ряд требований к потенциальному редокс-медиатору: высокая растворимость, стабильность в широком диапазоне рН, химическая стабильность различных редокс-форм, большая скорость реакции регенерации, а также доступность. Формулирование четких требований к составу соединения затруднены их большим разнообразием и малым числом исследований в данном направлении.
Известно об исследовании ванадий-замещенных фосфорно-молибденовых гетерополикислот состава H3 +n+ 2mPMo12 –n – m${\text{V}}_{n}^{{\text{V}}}{\text{V}}_{m}^{{{\text{IV}}}}$O40, 1 ≤ n ≤ 4 и 0 ≤ m ≤ 4 (ФМ-ПОМ). В работе [15] было изучено электрохимическое поведение коммерческих H3PMo12O40, H5PV2Mo10O40, H6PV3Mo9O40 при разных температурах и показано, что наибольшие перспективы в качестве католита гибридного топливного элемента проявляет H6PV3Mo9O40. В работе [16] была синтезирована смесь, содержащая H3PV3Mo9O40, H7PV4Mo8O40 и свободный V+5, которая была испытана в качестве католита редокс-медиаторного H2/О2 топливного элемента при температуре 80°С. Была охарактеризована скорость процесса регенерации, а также изучено влияние средней степени окисления ванадия в составе ПОМ на мощностные характеристики ТЭ.
Данная работа посвящена систематическому исследованию свойств редокс-медиатора гибридного топливного элемента на основе ФМ-ПОМ, которым ранее не было уделено должное внимание. Проведена серия синтезов, полученные соединения охарактеризованы методами циклической вольтамперометрии (ЦВА) при различных рН, что позволяет оценить обратимость протекающих редокс-реакций. Также представлены результаты испытаний в опытном топливном элементе гибридного типа с жидким катодным и газовым анодным контурами при повышенной и комнатной температурах, оценен ток регенерации и удельная мощность. Дополнительные исследования, проведенные при комнатной температуре, позволяют более реалистично оценить возможность использования редокс-медиаторов на основе ПОМ в гибридных устройствах.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез католита
Синтез 0.3 М ФМ-ПОМ проводился в соответствии с патентом [17]. В трехгорлую колбу 250 мл, оборудованную магнитной мешалкой, термометром и обратным холодильником, поочередно при перемешивании загружалась ортофосфорная кислота (H3РO4, “ч.”, Химмед, массовая концентрация 85%), пентаоксид ванадия (V2O5, 99.6%, Sigma-Aldrich) и тридистиллированная вода. В полученную суспензию одной навеской вводилась молибденовая пудра (Мо, “ч.”, Химмед), затем смесь нагревалась до кипения (100°С) и выдерживалась в течение часа до приобретения темно-синего цвета. Затем система охлаждалась до 80°С и при поддержании данной температуры через герметично подсоединенную трубку в течение 8 ч осуществлялся барботаж газообразным кислородом при перемешивании. Барботаж проводили до перехода соединения в полностью окисленную форму, который диагностировали по изменению цвета до насыщенного оранжево-желтого. После завершения барботажа и остывания продукт отфильтровывался на стеклянном фильтре и разбавлялся в мерной колбе до заданной концентрации путем доведения до метки тридистилированной водой. Контроль концентрации проводился путем сравнения измеренной плотности с калибровочной кривой из литературных источников [16]. Плотность полученного образца составила 1.365 г/см3 при 20°C. В соответствии с исходной методикой концентрации 0.3 М соответствует плотность раствора 1.369 г/см3 при 20°C. В результате синтеза получен продукт состава H7PV4Mo8O40, содержащий примесь свободных ${\text{VO}}_{2}^{ + }$-ионов, не включенных в состав ПОМ.
Исследование физико-химических свойств католита
Исследование электрохимических свойств методом ЦВА проводилось в стеклянной треэлектродной ячейке при комнатной температуре (25°С) в экранированной от внешних электромагнитных полей клетке Фарадея. В качестве рабочего электрода использовался стеклоуглерод (диск, диаметр 3 мм), вспомогательный электрод выполнен из платины, электрод сравнения Ag/AgCl (3.5 M KCl). Измерение проводилось в инертной среде с использованием линии Шленка в нескольких фоновых электролитах: серной кислоте (0.1 М, приготовление из серной кислоты, H2SO4, “х. ч.”, СигмаТек, массовая концентрация 95%), ортофосфорной кислоте (0.1 М), универсальной буферной смеси (pH 1.81–4.35) [18]. Концентрация ПОМ во всех измерения составила 1 ммоль/л, диапазон напряжений 0.2–0.8 В, скорости развертки от 25 до 1000 мВ/с.
Испытания гибридного топливного элемента
Мембранно-электродный блок для испытания синтезированного католита включал мембрану Nafion 211 с активной площадью 4 см2. Катодная сторона представлена электродом из 3 листов углеродной бумаги Sigracet 39AA (активная площадь 4 см2) и токосъемной пластины из графита (3 мм). Анодная сторона представлена комбинированным электродом, включающим 1 лист бумаги Freudenberg H24C8 с нанесенным катализатором Pt/C (1 мг Pt/см2) и 2 листа Sigracet 39AA, и токосъемными пластинами из уплотненной графитовой фольги (1 мм). В ячейке реализовано проточное поле типа серпантин. Принцип изготовления и сборки аналогичен методике, представленной в [19].
Электровосстановление раствора ПОМ проводилось в гальваностатическом режиме. На катод подавался раствор, предварительно нагретый до 80°С (скорость подачи 100 мл/мин). На анод непрерывно подавался увлажненный водород (5 л/ч). В процессе нагревания регистрировались величины напряжения разомкнутой цепи (НРЦ) ячейки.
Регенерация осуществлялась химически за счет воздействия газообразного кислорода. Для этого проводилось электровосстановление католита при 25°С, при 0.4 В вплоть до снижения тока до стационарного значения, после которого раствор нагревался до 80°С и барботировался газообразным кислородом при непрерывной циркуляции через катодный полуэлемент. Параллельно производилась непрерывная регистрация НРЦ ячейки.
Поляризационные кривые регистрировались при помощи линейной развертки напряжения от НРЦ до 5 мВ со скоростью развертки 20 мВ/с при непрерывной подаче электроактивных сред.
Во всех экспериментах использовался потенциостат-гальваностат Autolab 302N FRA (Metrohm, Нидерланды).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Анализ ЦВА
На рис. 1 приведены циклические вольтамперограммы для синтезированного ФМ-ПОМ, полученные при различных значениях рН в интервале от 0.7 до 4.35.
Рис. 1.
Циклические вольтамперограммы ФМ-ПОМ в универсальной буферной смеси с рН 1.81 (1), рН 2.56 (2), рН 2.39 (3), рН 4.35 (4), 0.1 М H3PO4 (5), 0.1 М H2SO4 (6). Скорость развертки 50 мВ/с. Номер цикла в каждом измерении – 2.
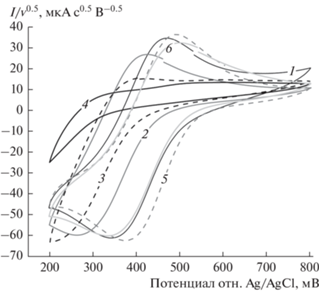
Большинство полученных зависимостей (кривые 1, 2, 6, 5) имеют схожий вид. Так, на кривой 1 наблюдается пара хорошо разрешенных редокс-пиков: пик восстановления расположен в области 340 мВ, а пик окисления – 450 мВ. Формальный потенциал данной пары редокс-пиков E1/2 = = 395 мВ отн. Ag/AgCl-электрода сравнения, что в пересчете на шкалу стандартного водородного электрода (СВЭ) дает E1/2 = 600 мВ. Эта пара пиков соответствует редокс-превращению V+4/V+5 атомов ванадия в составе молекул ФМ-ПОМ, протекающего в соответствии с уравнением:
(1)
$\begin{gathered} {{\left( {{\text{XV}}_{m}^{{ + 5}}{{{\text{M}}}_{{12 - m}}}{{{\text{O}}}_{{40}}}} \right)}^{{n - }}} + y{\text{e}} + y{{{\text{H}}}^{ + }} \to \\ \to {{\left( {{{{\text{H}}}_{y}}{\text{XV}}_{{m - y}}^{{ + 5}}{\text{V}}_{y}^{{ + 4}}{{{\text{M}}}_{{12 - m}}}{{{\text{O}}}_{{40}}}} \right)}^{{n - }}}. \\ \end{gathered} $Формальный потенциал этой пары значительно смещен относительно стандартного потенциала редокс-пары V+4/V+5 из-за пониженного pH исследуемого раствора (для кривой 1 – это 1.81), а также того факта, что электроактивные атомы ванадия включены в сложную структуру молекулы ПОМ. Аналогичное смещение наблюдалось, например. и для 0.1 M H6PV3Mo9O40 [15]. Также необходимо отметить, что величина пика восстановления для кривой 1 примерно в два раза превышает пик окисления. Это может свидетельствовать о том, что исследуемая реакция протекает по механизму, сочетающему электрохимическую и химическую стадии (EC-механизм), т.е. молекула ПОМ, содержащая окисленную форму ванадия V+5 вступает не только в фарадеевскую реакцию восстановления, но и в постороннюю реакцию окисления.
Как видно из рис. 1, с повышением рН ЦВА зависимости претерпевают изменения: редокс-пики смещаются в катодную область. При этом зависимость формального потенциала редокс-перехода ФМ-ПОМ от величины рН в исследованном диапазоне носит линейный характер, и с уменьшением рН на единицу величина E1/2 в среднем уменьшается на 44 мВ, что хорошо сочетается с уравнением (1), в соответствии с которым в каждую редокс-реакцию вовлечено одновременно x электронов и x протонов H+.
Наконец, с увеличением рН наблюдается не только смещение редокс-пиков, но с преодолением определенного предела по значениям – еще и изменение характера зависимости. Так, на кривой 3 (рН 3.29) уже не разрешается пик восстановления и практически неразличим пик окисления, а на кривой 4 (рН 4.35) уже полностью отсутствуют какие-либо редокс-пики. Это может объясняться не только смещением положения пиков с изменением рН, но еще и химической деградацией молекул ФМ-ПОМ или же потерей ими редокс-свойств.
Также важно отметить, что для всех исследованных значений рН расстояние между редокс-пиками превышает 100 мВ (наименьшая величина наблюдается для линии 1–110 мВ). Это говорит о том, что в исследованном диапазоне рН ФМ‑ПОМ не показывает обратимого редокс-отклика. Для того чтобы более подробно изучить редокс-поведение синтезированного соединения и оценить перспективы его использования в качестве редокс-медиатора, была проведена серия измерений ЦВА при различных скоростях сканирования в интервале значений от 25 до 100 мВ/с. Результаты измерений для рН 0.7, 1.89, 2.36 приведены на рис 2.
Рис. 2.
Циклические вольтамперограммы ФМ-ПОМ в универсальной буферной смеси с рН 0.7 (а) 1.89 (б) 2.36 (в) при скоростях развертки 25 (1), (2), 100 (3), 250 (4), 500 (5), 1000 мВ/с (6). Номер цикла в каждом измерении – 2.

Видно, что на качественном уровне кривые претерпевают аналогичные изменения с увеличением скорости сканирования ν в независимости от величины рН. При возрастании ν увеличивается расстояние между редокс-пиками, что обусловлено прежде всего заметным смещением пика восстановления в катодную область, а также уже менее заметным смещением пика окисления в анодную сторону. При этом форма редокс-пиков остается практически неизменной за исключением того, что с увеличением скорости развертки постепенно уменьшается величина силы тока, отнормированная на v0.5.
На рис. 3 приведены данные о положении редокс-пиков в зависимости от логарифма скорости развертки lg v, полученные при обработке кривых с рис. 2. Характер зависимости потенциала пика восстановления от lg v практически не меняется с повышением рН (см., точки со сплошным заполнением на рис. 3). При малых скоростях развертки (25, 50 и 100 мВ/с) зависимость Ered(lg v) носит линейный характер с угловым коэффициентом около 25–40 мВ/декаду, что соответствует механизму реакции ECirr, где E – электрохимическая стадия реакция, Cirr – необратимая химическая стадия реакции. Это сочетается с упомянутой выше асимметрией в интенсивности редокс-пиков (см. рис. 1). При увеличении скорости развертки линейный вид зависимости Ered(lg v) сохраняется, но угловой коэффициент постепенно увеличивается до величины около 60‒80 мВ/декаду, что в свою очередь уже говорит о переходе от ECirr-механизма к Eirr-механизму, т.е. проявляется собственная необратимость реакции окисления/восстановления ФМ-ПОМ, которая выше предсказывалась на основании большого расстояния между редокс-пиками на ЦВА-зависимостях. Аналогичное поведение наблюдается и для зависимости Eox(lg v) при pH 0.7. C повышением же рН ее характер несколько меняется – все так же сохраняется линейный вид зависимости, но ее угловой коэффициент значительно уменьшается, а также не наблюдается столь заметного перехода между режимами ECirr и Eirr с повышением скорости развертки. Причины такого поведения требуют дополнительных исследований.
Рис. 3.
Зависимость потенциалов пиков окисления и восстановления от логарифма скорости развертки. Значения рН обозначены: квадрат – 0.7; круг – 1.89; треугольник – 2.36. Закрашенные фигуры соответствуют пикам восстановления, численно обозначена величина наклона.

Таким образом, по результатам систематического изучения электрохимических свойств ФМ‑ПОМ с помощью метода ЦВА при варьировании рН и скорости развертки было показано, что редокс-поведение синтезированного материала определяется парой V+4/V+5. Однако, наблюдаются существенные отличия от случая истинных растворов ванадийсодержащих солей. Во-первых, электрохимическое поведение сильно зависит от pH – так, при повышении pH формальный потенциал ФМ-ПОМ смещается в катодную область. Во-вторых, есть свидетельства, что форма ФМ-ПОМ, имеющая в составе V+4, вступает в постороннюю химическую реакцию. Наконец, в-третьих, протекание редокс-реакций с электроактивными атомами ванадия, заключенными внутрь объёмных молекул ФМ-ПОМ, связано с кинетическими ограничениями. Эти аспекты необходимо учитывать при использовании ФМ-ПОМ в качестве редокс-медиатора с катодной стороны H2/O2 топливного элемента.
Результаты испытаний гибридного топливного элемента
Электровосстановление раствора ПОМ проводилось в гальваностатическом режиме при токе I = 12.5 мА/см2. Первоначально была получена эталонная зависимость НРЦ ячейки МЭБ с ФМ-ПОМ от величины θ (рис. 4) – оценочной средней степени окисления ФМ-ПОМ (см. уравнение (2); величина θ, равная 0, соответствует полностью восстановленному ПОМ, в котором ванадий имеет степень окисления +4, а 1 – полностью окисленному ФМ-ПОМ).
Рис. 4.
Зависимость НРЦ ячейки МЭБ гибридного ТЭ, использующего раствор ФМ-ПОМ, от величины θ, полученная на основании результатов гальваностатического электровосстановления ФМ-ПОМ при плотности тока 12.5 мА/см2 и температуре католита 80°C.
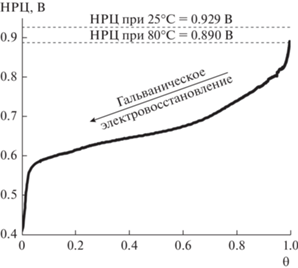
Данная зависимость была получена на основании напряжения ячейки МЭБ (с учетом омического перенапряжения) в процессе гальваностатического электровосстановления ФМ-ПОМ при температуре католита 80°C. Форма полученной зависимости НРЦ от θ диктуется уравнением Нернста. При нагреве ФМ-ПОМ с 25 до 80°C НРЦ ячейки МЭБ снижается с 929 до 890 мВ. Вероятнее всего, это связано в тем, что часть свободных, т.е. изначально присутствующих в смеси и не включенных в состав фосфорно-ванадиево-молибденовых ПОМ, ${\text{VO}}_{2}^{ + }$-ионов выпадает в осадок [20]. По величине общего полученного заряда при электровосстановлении 0.3 M раствора ФМ‑ПОМ содержание ванадия составило 0.54 М или 1.8 атомов V на молекулу ФМ-ПОМ. Сравнение величин полученного заряда и формы поляризационных кривых гальваностатического электровосстановления ФМ-ПОМ при 25 и 80°C позволило оценить концентрацию свободных (не связанных с ФМ-ПОМ) ${\text{VO}}_{2}^{ + }$-ионов, которая составила 11 мМ.
(2)
$\theta = {Q \mathord{\left/ {\vphantom {Q {{{Q}_{{{\text{tot}}}}}}}} \right. \kern-0em} {{{Q}_{{{\text{tot}}}}}}},$Также были проведены испытания по химической регенерации полностью восстановленного ФМ-ПОМ кислородом при температуре католита 80°C. На рис. 5 приведена зависимость НРЦ ячейки ТЭ, в положительном полуэлементе которой непрерывно циркулировал ФМ-ПОМ-католит, который химически окисляли кислородом при температуре до 80°C.
Рис. 5.
Зависимость НРЦ ячейки МЭБ гибридного ТЭ, использующего раствор ФМ-ПОМ, и оцененной величины θ ФМ-ПОМ от времени эксперимента, полученные в процессе химической регенерации ФМ-ПОМ газообразным кислородом при температуре 80°C; на врезке изображена зависимость оцененного тока регенерации от величины θ.

Для оценки величины θ по НРЦ ячейки МЭБ с ФМ-ПОМ в процессе химической регенерации (рис. 5) была использована зависимость, представленная на рис. 4. На полученной зависимости θ от времени видно 3 характерных участка: 1) резкое увеличение НРЦ при t < 0.25 ч – в начальный момент времени концентрация восстановленной формы ФМ-ПОМ максимальна, что соответствует наибольшей скорости химической реакции окисления ФМ кислородом; 2) при t = 0.25–1.8 ч концентрация реагентов химической реакции постепенно снижается, как следствие скорость окисления ПОМ снижается; 3) после 1.8 ч химическая реакция практически прекращается. В результате после окисления ФМ-ПОМ при непрерывной подаче кислорода в течение 1.8 ч при 80°C удалось достичь величины θ ≈ 0.9, т.е. полного обратного окисления атомов V+4 в составе ПОМ до V+5 достичь не получится.
Полученные выше данные были использованы для оценки зависимости величины тока регенерации (см. уравнение (3)) от θ (см. врезку на рис. 5). Так как ток регенерации показывает фактически, какой разрядный ток можно поддерживать в системе, так чтобы химическая реакция обеспечивала неизменность степени окисления ПОМ, в совокупности с данными о разрядных характеристиках гибридного ТЭ описанная выше зависимость может быть использована для выбора режима функционирования ТЭ, который обеспечит заданную мощность разряда. В нашей работе максимальный ток регенерации составил 0.7 А, в то время как в работе [16] величина тока регенерации ПОМ состава 0.3 M H3PV3Mo9O40 достигала 12 А. Величина тока регенерации определяется параметрами конкретного реактора регенерации (например, его объемом). Нормировка тока может быть полезна для анализа характеристик в пределах исследования одной системы, однако прямое сравнение полученных характеристик с литературными данными нецелесообразно в силу различия реакторов. Стоит лишь отметить, что ток регенерации, полученный в данной работе, в дальнейшем можно повысить за счет оптимизации конструкции реактора регенерации.
На рис. 6 приведены поляризационные кривые ячейки МЭБ гибридного ТЭ, использующего ФМ-ПОМ при θ ≈ 1.
Рис. 6.
Вольт-амперные (кривые 1 и 2) и ватт-амперные (3 и 4) характеристики ячейки МЭБ гибридного ТЭ, использующего раствор ФМ-ПОМ, измеренные линейной разверткой потенциала от НРЦ до 5 мВ при скорости развертки 20 мВ/с; температура католита 25°C (кривые 1 и 3) и 50°C (кривые 2 и 4).
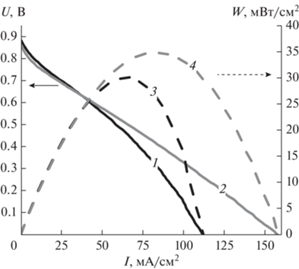
Перед измерением кривой 1 была измерена серия линейных разверток потенциала до тех пор, пока последняя и предыдущая поляризационные кривые не совпадут. Существенное отличие первых измеренных поляризационных кривых с кривой 1 связано с наличием свободных ${\text{VO}}_{2}^{ + }$-ионов – в результате НРЦ ячейки при 25°C снизилась с 929 до 889 мВ. На обеих вольт-амперных кривых заметен участок активационных потерь – при плотности тока <10 мА/см2. На поляризационной кривой для 25°C уже при плотности тока >50 мА/см2, несмотря на высокую скорость циркуляции электролита (100 мл/мин), наблюдается участок диффузионного контроля разрядных характеристик. Этот эффект можно связать с тем, что католит на основе ФМ-ПОМ представляет собой коллоидную систему; для сравнения, в случае полностью ванадиевой ПРБ при скорости циркуляции электролитов более 50 мл/мин такого эффекта не наблюдается при плотностях тока порядка единиц А/см2 [19]. При увеличении температуры до 50°C собственное сопротивление ячейки МЭБ снизилось, что привело к уменьшению угла наклона линейного участка поляризационной кривой. Также повышение температуры привело к уменьшению диффузионных потерь, что видно из характерного изменения вида поляризационных кривых при больших плотностях тока (для 50°C зависимость имеет почти линейный вид, в то время как при температуре 25°C наблюдается явное отклонение от линейного вида). Такое поведение может объясняться уменьшением вязкости католита. В результате максимальная удельная мощность при 25 и 50°C составила 30.3 мВт/см2 (при 65 мА/см2) и 34.9 мВт/см2 (при 85 мА/см2), что сопоставимо по величине с характеристиками, полученными в работе [15].
Максимальная величина тока регенерации ФМ-ПОМ кислородом составила 0.7 А. Для повышения тока регенерации и, следовательно, плотности тока разряда гибридного ТЭ необходимо провести работы по оптимизации реактора регенерации.
Максимальная удельная мощность при 25 и 50°C составила 30.3 и 34.9 мВт/см2 соответственно. Достижение большей производительности гибридного ТЭ требует выбора компромиссного значения плотности тока разряда, поскольку увеличение плотности тока разряда приводит к снижению величины θ и, следовательно, снижению удельной мощности ТЭ.
Вероятнее всего, высокая вязкость католита при комнатной температуре служит основным источником потерь удельной мощности гибридного ТЭ.
ЗАКЛЮЧЕНИЕ
В работе была синтезирована смесь фосфорно-ванадиево-молибденовых гетерополикислот состава H3 +nPMo12 –nVnO40 со средним значением n = 1.8 и проведена серия измерений для оценки перспектив использования данного состава (ФМ ПОМ) в качестве редокс-медиатора, функционирующего с катодной стороны гибридного H2/O2 топливного элемента.
На основании анализа циклических вольтамперограмм, полученных при различных значениях рН и скоростях развертки потенциала, было показано что электрохимическое поведение ФМ ПОМ определяется редокс-парой V+4/V+5, а механизм редокс-реакции меняется с ECirr при малых скоростях развертки на Eirr при больших скоростях развертки. Также было показано, что редокс-поведение ФМ ПОМ значительно зависит от величины pH: формальный потенциал реакции смещается в катодную сторону с повышением pH, что может негативно влиять на работоспособность редокс-медиатора.
Далее ФМ-ПОМ был испытан в гибридной разрядной ячейке, сочетающей в своей конструкции принципы ванадиевой проточной редокс-батареи и H2/O2 топливного элемента. Показано, что удельная разрядная мощность такого элемента достигает 30.3 и 34.9 мВт/см2 при температуре 25 и 50°C соответственно. Также получена зависимость величины тока регенерации, характеризующего скорость химической реакции окисления ФМ ПОМ кислородом, от оценочной средней степени окисления ФМ-ПОМ. Показано, что максимальный ток регенерации наблюдается для полностью восстановленного ФМ-ПОМ и составляет 0.7 А (при регенерации редокс-медиатора в той же самой разрядной ячейке).
Совокупность полученных данных указывает на то, что синтезированный ФМ ПОМ может быть применен в качестве редокс-медиатора гибридного топливного элемента. Однако, конструкция данного устройства требует доработки и оптимизации с учетом установленных закономерностей: прежде всего необходимо учитывать ограничения по pH, оптимизировать реактор регенерации, а также выбрать оптимальную степень окисления ФМ-ПОМ, величина которой определяет баланс между током регенерации и величиной разрядного тока.
Список литературы
Pope, M.T., Molybdenum Oxygen Chemistry: Oxides, Oxo Complexes, and Polyoxoanions, Progr. Inorg. Chem., 1991, vol. 39, p. 181.
Khan, M.I. and Zubieta, J., Oxovanadium and Oxomolybdenum Clusters and Solids Incorporating Oxygen-Donor Ligands, Progr. Inorg. Chem., 1995, vol. 43, p. 1.
Dehghani Sanij, F., Balakrishnan, P., Su, H., Khotseng, L., and Xu, Q., Fabrication of polyoxometalate-modified palladium–nickel/reduced graphene oxide alloy catalysts for enhanced oxygen reduction reaction activity, RSC Adv, 2021, vol. 11, p. 39118.
Cui, Z., Xing, W., Liu, C., Tian, D., and Zhang, H., Synthesis and characterization of H5PMo10V2O40 deposited Pt/C nanocatalysts for methanol electrooxidation, J. Power Sources, 2010, vol. 195, p.1619.
Renzi, M., et al., Activation of bimetallic PtFe nanoparticles with zeolite-type cesium salts of vanadium-substituted polyoxometallates toward electroreduction of oxygen at low Pt loadings for fuel cells, J. Solid State Electrochem., 2021, vol. 26, p. 3.
Feng, L., Lv, Q., Sun, X., Yao, S., Liu, C., and Xing, W., Enhanced activity of molybdovanadophosphoric acid modified Pt electrode for the electrooxidation of methanol, J. Electroanal. Chem., 2012, vol. 664, p. 14.
Izumi, Y. and Urabe, K., Catalysis of heteropoly acids entrapped in activated carbon, Chem. Lett., 1981, vol. 10, no. 5, p. 663.
Zhang, B., Cao, Y., Li, Z., Wu, H., Yin, Y., Cao, L., He, X., and Jiang, Z., Proton exchange nanohybrid membranes with high phosphotungstic acid loading within metal-organic frameworks for PEMFC applications, Electrochim. Acta, 2017, vol. 240, p. 186.
Amirinejad, M., Madaeni, S.S., Lee, K.S., Ko, U., Rafiee, E., and Lee, J.S., Sulfonated poly(arylene ether)/heteropolyacids nanocomposite membranes for proton exchange membrane fuel cells, Electrochim. Acta, 2012, vol. 62, p. 227.
Tang, H., Pan, M., Lu, S., Lu, J., and Jiang, S.P., One-step synthesized HPW/meso-silica inorganic proton exchange membranes for fuel cells, Chem. Commun. (Camb), 2010, vol. 46, p. 4351.
Malers, J.L., Sweikart, M-A., Horan, J.L., Turner, J.A., and Herring, A.M., Studies of heteropoly acid/polyvinylidenedifluoride–hexafluoroproylene composite membranes and implication for the use of heteropoly acids as the proton conducting component in a fuel cell membrane, J. Power Sources, 2007, vol. 172, p. 83.
Qian, W., Shang, Y., Wang, S., Xie, X., and Mao, Z., Phosphoric acid doped composite membranes from poly (2,5-benzimidazole) (ABPBI) and CsxH3– xPW12O40/CeO2 for the high temperature PEMFC, Int. J. Hydrog. Energy, 2013, vol. 38, p. 11053.
Yang, L., et al., The Intrinsic Charge Carrier Behaviors and Applications of Polyoxometalate Clusters Based Materials, Adv. Mater., 2021, vol. 33, p. 1.
Петров, М.М., Модестов, А.Д., Конев, Д.В., Антипов, А.Е., Локтионов, П.А., Пичугов, Р.Д., Карташова, Н.В., Глазков, А.Т., Абунаева, Л.З., Андреев, В.Н., Воротынцев, М.А. Проточные редокс-батареи: место в современной структуре электроэнергетики и сравнительные характеристики основных типов. Успехи химии. 2021. Т. 90(6). С. 677. [Petrov, M.M., Modestov, A.D., Konev, D.V., Antipov, A.E., Loktionov, P.A., Pichugov, R.D., Kartashova, N.V., Glazkov, A.T., Abunaeva, L.Z., Andreev, V.N., and Vorotyntsev, M.A., Redox flow batteries: role in modern electric power industry and comparative characteristics of the main types, Russ. Chem. Rev., 2021, vol. 90, no. 6, p. 677.]
Matsui, T., Morikawa, E., Nakada, S., Okanishi, T., Muroyama, H., Hirao, Y., Takahashi, T., and Eguchi, K., Polymer Electrolyte Fuel Cells Employing Heteropolyacids as Redox Mediators for Oxygen Reduction Reactions: Pt-Free Cathode Systems, ACS Appl. Mater. Interfaces, 2016, vol. 8, p. 18119.
Gunn, N.L.O., Ward, D.B., Menelaou, C., Herbert, M.A., and Davies, T.J., Investigation of a chemically regenerative redox cathode polymer electrolyte fuel cell using a phosphomolybdovanadate polyoxoanion catholyte, J. Power Sources, 2017, vol. 348, p. 107.
Martin, N. and Herbert, M., Synthesis of polyoxometalates, patent WO 2015/097459, 2014.
Лурье, Ю.Ю., Справочник по аналитической химии, М.: Химия, 1974. 456 с.
Pichugov, R.D., et al., Electrolyte Flow Field Variation: A Cell for Testing and Optimization of Membrane Electrode Assembly for Vanadium Redox Flow Batteries, Chempluschem, 2020, vol. 85, p. 1919.
Skyllas-Kazacos, M., Cao, L., Kazacos, M., Kausar, N., and Mousa, A., Vanadium Electrolyte Studies for the Vanadium Redox Battery—A Review, ChemSusChem, 2016, vol. 9, p. 1521.
Дополнительные материалы отсутствуют.


