Электрохимия, 2022, T. 58, № 10, стр. 676-687
Синтез и сравнительное исследование электрохимических характеристик твердых электролитов CsAg4Br2.5I2.5 и RbAg4I5
О. Г. Резницких a, Т. В. Ярославцева a, *, А. А. Глухов b, Н. А. Попов a, Н. В. Урусова a, Н. Г. Букун b, Ю. А. Добровольский b, О. В. Бушкова a, b, **
a Институт химии твердого тела УрО РАН
Екатеринбург, Россия
b Институт проблем химической физики РАН
Черноголовка, Россия
* E-mail: tanya_yaroslavtseva@mail.ru
** E-mail: ovbushkova@rambler.ru
Поступила в редакцию 15.02.2022
После доработки 15.04.2022
Принята к публикации 19.04.2022
- EDN: ZFFTUV
- DOI: 10.31857/S0424857022100103
Аннотация
Предложена новая методика твердофазного синтеза суперионного проводника CsAg4Br2.5I2.5, облегчающая получение однофазного продукта. Методом дифференциальной сканирующей калориметрии исследовано термическое поведение CsAg4Br2.5I2.5 в интервале температур от –160 до +190°С и подтверждено отсутствие полиморфных превращений; единственный фазовый переход I рода наблюдается вблизи 177°С и отвечает инконгруэнтному плавлению твердого электролита. Показано, что из порошка CsAg4Br2.5I2.5 может быть получена плотная керамика путем прессования при комнатной температуре; определено оптимальное значение давления прессования. Исследования электротранспортных характеристик CsAg4Br2.5I2.5 включали в себя измерения ионной проводимости четырехзондовым методом в интервале –60…+120°C и оценку электронной составляющей проводимости методом Хэбба–Вагнера. Показано, что вклад электронного переноса пренебрежимо мал (~10–9 См см–1), а ионная проводимость близка к таковой для широко известного суперионного проводника RbAg4I5 и характеризуется низкой энергией активации (10.3 кДж моль–1). Потенциал окисления, определенный методом пошаговой поляризации, составляет 0.78 В, что заметно выше, чем у RbAg4I5. Отсутствие фазовых переходов первого рода при температурах ниже температуры плавления в сочетании с высокой ионной проводимостью делает соединение CsAg4Br2.5I2.5 более привлекательным для низкотемпературных применений, а повышенная электрохимическая устойчивость – для использования в химических источниках тока по сравнению с RbAg4I5.
ВВЕДЕНИЕ
Создание и совершенствование новых твердотельных технических устройств и приборов, электрохимических по принципу действия и самых разнообразных по назначению, входит в число важнейших направлений развития современной техники [1–4]. Это могут быть сенсоры для контроля параметров технологичесих процессов и окружающей среды, кулонометры, нелинейные элементы, компактные и энергоэффективные ионные источники для аэрокосмического применения и ионно-лучевых технологий, химические источники тока – первичные и вторичные ХИТ, суперконденсаторы и т.д. [1–4]. К преимуществам полностью твердотельных технических устройств относятся широкий интервал рабочих температур, устойчивость к механическим нагрузкам, продолжительный срок службы, пожаро- и взрывобезопасность [1]. Ключевым компонентом таких приборов и устройств являются твердые электролиты с суперионной проводимостью, которые могут применяться в виде керамики или тонких пленок.
Соединения CsAg4Br3 –хI2 +х (0 ≤ x ≤ 1), впервые полученные и исследованные в работах Личковой и Деспотули с соавторами [1, 5–9], представляют большой интерес как суперионные проводники с очень высокой проводимостью по катионам Ag+, близкой к проводимости α-модификации широко известного твердого электролита RbAg4I5, и при этом предположительно обладающие более высокой термодинамической устойчивостью [1, 5–8, 10, 11]. Как и α-RbAg4I5, соединения CsAg4Br3 –xI2 +x принадлежат семейству MAg4I5 [12] и обладают кубической решеткой, относящейся к пространственной группе P4132. Однако в отличие от RbAg4I5, многокомпонентные твердые растворы CsAg4Br3 –хI2 +х трудно получить в виде однофазного продукта. Это существенно осложняет исследования их физико-химических свойств и практическое применение. Так, приведенные в недавних работах группой авторов из КНР в соавторстве с Толстогузовым [10, 11] структурные и транспортные характеристики относятся к неоднофазным образцам CsAg4Br3 –хI2 +х (0 ≤ x ≤ 1), полученным из трехкомпонентных смесей CsI, β‑AgI и AgBr методом механохимического синтеза без последующего отжига. Единственное исключение в работе [11] составляет электролит состава CsAg4Br2.5I2.5 (x = 0.5), однако и его однофазность вызывает сомнения, так как не подтверждена термическим анализом, более чувствительным к следовым количествам примесных фаз, чем рентгеновская дифрактометрия. Кроме того, механохимический синтез без последующего отжига с высокой вероятностью привел к получению продукта с неравновесной дефектной структурой, что не могло не отразиться на свойствах. Личкова и Деспотули с соавторами использовали для синтеза твердых растворов CsAg4Br3 –хI2 +х (0 ≤ x ≤ 1) метод направленной кристаллизации из расплава [5–8]. Суть метода заключается в сплавлении смеси бромидов и иодидов цезия и серебра при молярном соотношении суммарных количеств солей серебра и цезия 4 : 1 с использованием стеклянной или кварцевой ампулы; процесс проводят в вакууме или в инертной атмосфере. Затем расплав кристаллизуют при комнатной температуре, размалывают, прессуют таблетки и отжигают при температуре ниже температуры плавления получаемых соединений [8]. Плавлением смеси достигается высокая гомогенность расплава, а при отжиге происходит реакция твердофазного синтеза твердых электролитов. Однако это довольно трудоемкий способ с плохо воспроизводимыми из-за инконгруэнтного характера плавления твердых растворов CsAg4Br3 –xI2 +x результатами. Гомогенизация частично закристаллизованного, а частично застеклованного расплава требует значительных механических усилий. Кроме того, недостатком такого способа синтеза является сложность его масштабирования для получения больших количеств твердого электролита. Кроме направленной кристаллизации расплава, в работе [6] упоминается также твердофазный синтез CsAg4Br3 –xI2 +x. Хотя его условия не детализированы, вполне понятно, что для получения однофазного продукта из трехкомпонентной шихты, состоящей из галогенидов цезия и серебра, требуются длительные отжиги с многократной гомогенизацией.
В данной работе предложена новая методика твердофазного синтеза суперионного проводника CsAg4Br2.5I2.5, значительно облегчающая получение однофазного продукта и пригодная к масштабированию. Состав исследуемого твердого раствора, отвечающий х = 0.5, выбран на основании литературных данных как наиболее изученный и обладающий, по данным работ [7, 8], максимальной ионной проводимостью в ряду твердых растворов CsAg4Br3 –хI2 +х. Однофазность синтезированного твердого электролита CsAg4Br2.5I2.5 подтверждали методами рентгеновской дифракции и термического анализа. Измеренные электротранспортные характеристики, электрохимическая устойчивость и другие физико-химические свойства CsAg4Br2.5I2.5 сопоставлены с данными для RbAg4I5, полученного путем твердофазного синтеза.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы
Твердый электролит CsAg4Br2.5I2.5 получали методом твердофазного синтеза из стехиометрической смеси CsI (99.9% (по примесям металлов), ЛАНХИТ, Россия) и предварительно синтезированного твердого раствора AgBr0.625I0.375. Исходными веществами для синтеза AgBr0.625I0.375 методом совместного осаждения с последующим отжигом при 110°С, описанным в работе [13], служили KBr (99.0%, Уральский завод химической продукции, Россия), KI (99.5%, Уральский завод химической продукции, Россия) и AgNO3 (99.9%, СИБПРОЕКТ-ДрагМет, Россия). Для приготовления растворов реагентов использовали бидистиллированную воду. Полноту удаления воды из синтезированного AgBr0.625I0.375 контролировали методом синхронного термического анализа. Синтез твердого электролита CsAg4Br2.5I2.5 вели в расчете на получение 50 г материала. Смесь реагентов помещали в вакуумируемый реактор; температура отжигов составляла 155–170°С.
Твердый электролит RbAg4I5 был получен методом твердофазного синтеза из смеси взятых в стехиометрическом соотношени RbI (чистота 99.99% (по примесям металлов), ЛАНХИТ, Россия) и предварительно синтезированного путем ионного обмена AgI, Методика синтеза и последующей сушки AgI приведена в [14]; исходными веществами служили KI и AgNO3. Синтез твердого электролита RbAg4I5 вели в вакуумируемом реакторе при 210°С в расчете на получение 50 г вещества.
Все описанные выше операции, а также хранение полученных продуктов и подготовку образцов для исследований выполняли при красном освещении во избежание деградации светочувствительных соединений серебра. Готовые партии CsAg4Br2.5I2.5 и RbAg4I5 хранили в защищенном от света контейнере в перчаточном боксе Unilab Pro (MBraun, Германия) в атмосфере сухого аргона (содержание воды <0.1 ppm).
Методы
Фазовый состав полученных продуктов определяли при комнатной температуре методом рентгеновской дифракции с помощью дифрактометра XRD7000 (Shimadzu, Япония) (CuKαизлучение, 2θ = 5°–80°, шаг 0.03°). Для идентификации фаз использовали базу порошковых стандартов PDF2 (ICDD, США, Release 2016). Параметры кристаллической структуры продуктов определяли методом полнопрофильного анализа Ритвельда с использованием программы Fullprof [15]. Для подтверждения однофазности синтезированных твердых электролитов, а также для исследования их термического поведения применяли дифференциальную сканирующую калориметрию (ДСК) с использованием прибора DSC 214 Polyma (NETZSCH, Германия). Навеску порошка массой от 16 до 40 мг помещали в одноразовый тигель Concavus, обеспечивающий высокую воспроизводимость измерений, и герметично запечатывали холодной сваркой. Измерительная камера прибора продувалась сухим азотом со скоростью 40 мл/мин. Измерения проводили в интервале температур от –160 до +190оС (CsAg4Br2.5I2.5) и 260°С (RbAg4I5) при скоростях нагрева и охлаждения 10°С/мин. Температуры фазовых переходов первого рода (ФП I) определяли из кривых нагрева, принимая за температуру ФП I начало эндотермического эффекта, в соответствии с общепринятой практикой [16]. Синхронный термический анализ образцов выполняли для контроля полноты удаления воды из предварительно синтезированных исходных реагентов AgBr0.625I0.375 и AgI с помощью термоанализатора STA 449 F3 Jupiter (NETZSCH, Германия) в интервале температур 30–350°С на воздухе в режиме нагрева со скоростью 10°C/мин. Пикнометрическую плотность продуктов синтеза определяли с помощью гелиевого пикнометра Accu Pyc II 1340 (Micromeritics, США) с использованием измерительной камеры объемом 1 см3; погрешность измерения не превышала 0.03%. Морфологию и микроструктуру полученных порошков твердых электролитов исследовали методом сканирующей электронной микроскопии (СЭМ) с помощью электронного микроскопа JSM 6390 LA (JEOL Ltd., Япония) с увеличением от 500 до 10000.
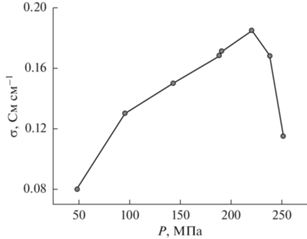
Ионную проводимость твердых электролитов σi измеряли четырехэлектродным методом [17, 18]. Для этого использовали ячейку собственной конструкции, схема которой изображена на рис. 1. Порошки электролитов засыпали в ячейку и затем прессовали при следующих давлениях: 120 МПа для RbAg4I5 и 220 МПа для CsAg4I2.5Br2.5. Величина оптимального давления прессования, обеспечивающего максимальную ионную проводимость прессованной керамики RbAg4I5, известна из литературы [17]. Оптимальное давление прессования для CsAg4I2.5Br2.5 было определено в настоящей работе из зависимости, представленной на рис. 2. В результате прессования получали керамический образец электролита в виде столбика высотой ~1.5 см и диаметром 0.4 см. К нему с двух сторон припрессовывали порошок серебра ПС-3 (99.0%, НПП Дельта-пасты, Россия) для формирования обратимых по Ag+ токовых электродов. Потенциальными электродами служили точечные контакты из металлического серебра на боковой поверхности столбика электролита, полученные следующим образом. Два латунных винта малого диаметра вкручивали в корпус ячейки, как показано на рис. 1. Между этими винтами и столбиком электролита сначала засыпали тонкий слой исследуемого электролита, а затем тонкий слой порошка серебра во избежание нежелательных эффектов переосаждения. Расстояние между двумя потенциальными электродами составляло 0.55 см, а между потенциальными и токовыми электродами – не менее 0.2 см. Такая конструкция ячейки позволила пропускать между торцевыми электродами постоянный ионный ток, одновременно измеряя падение напряжения между потенциальными электродами и избегая при этом влияния поляризационных эффектов, возникающих на границе серебро/твердый электролит.
Рис. 1.
Схема четырехэлектродной ячейки: 1 – капролоновый корпус; 2, 3 – титановые пуансоны, служащие токоподводами токовых электродов; 4, 5 – латунные винты, служащие токоподводами потенциальных электродов; 6 – столбик электролита; 7 – припрессованный к торцам электролита порошок серебра (обратимые токовые электроды); 8 – прослойки электролита; 9 – припрессованный порошок серебра (потенциальные электроды).

Рис. 2.
Зависимость ионной проводимости керамического образца CsAg4I2.5Br2.5 от давления прессования.
Измерения ионной проводимости четырехэлектродным методом проводили с помощью потенциостата-гальваностата P40-X (Элинс, Россия) в гальваностатическом режиме, задавая ток I между электродами 1 и 2 (рис. 1) и измеряя разность потенциалов U между потенциальными электродами 4 и 5. Варьируя заданное значение тока в диапазоне 1–10 мА, строили вольт-амперную характеристику (ВАХ) ячейки, которая во всех случаях была прямой линией. Величину сопротивления электролита R определяли путем аппроксимации полученной прямой согласно закону Ома. Проводимость электролита вычисляли по формуле:
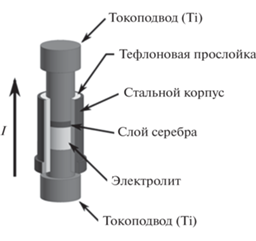
где l – расстояние между потенциальными электродами, S – площадь сечения керамического образца электролита. Измерения ионной проводимости RbAg4I5 вели в интервале –50…+100°С; для CsAg4I2.5Br2.5 использовали несколько более широкий диапазон температур –60…+120°С. Температуру задавали с помощью термостата/криостата Huber CC-805 (точность ±0.1°С); шаг по температуре составлял от 10 до 25°С. Перед каждым измерением ячейку термостатировали до тех пор, пока не устанавливалось постоянное сопротивление электролита.Величину потенциала окисления Eox и парциальную электронную проводимость σel твердых электролитов CsAg4Br2.5I2.5 и RbAg4I5 определяли при комнатной температуре из ВАХ, построенных с использованием описанной в [18] пошаговой потенциостатической методики на основе метода Хэбба–Вагнера. Сущность методики заключается в пошаговой поляризации несимметричной двухконтактной ячейки (–) обратимый электрод|электролит|блокирующий электрод (+) постоянной разностью потенциалов и измерении зависимости тока от времени до достижения стационарного состояния, которому отвечает стационарный ток Iss. Схема измерительной ячейки приведена на рис. 3. Как и при измерении ионной проводимости, порошок исследуемого твердого электролита запрессовывали непосредственно в ячейке, получая в итоге керамической образец в виде диска высотой ~0.1 см и диаметром 0.5 см внутри фторопластовой трубки, вложенной в стальной корпус (рис. 3). Инертным электродом служил титановый пуансон двухэлектродной ячейки, а обратимым – припрессованный к образцу электролита порошок серебра; он же служил электродом сравнения (рис. 3). Значения приложенной к ячейке разности потенциалов задавали в диапазоне от 0 до 950 мВ (отн. Ag0/Ag+) с шагом 50 мВ. Измеренные таким образом значения Iss представляли на графике как функцию приложенной к ячейке разности потенциалов, получая таким образом вольт-амперную характеристику. Измерения вели с использованием потенциостата-гальваностата P40-X (Элинс, Россия).
Рис. 3.
Схема несимметричной двухэлектродной электрохимической ячейки, использованной для измерения вольтамперных характеристик твердых электролитов по методу Хебба–Вагнера (ток пропускают в направлении от инертного электрода к обратимому).
Все ячейки для измерения ионной и электронной проводимости твердых электролитов собирали в сухом аргоновом боксе при красном освещении и затем помещали в герметичные стеклянные контейнеры для проведения измерений.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Синтез твердых электролитов
Твердофазный синтез соединения CsAg4Br2.5I2.5 проводили согласно [19]. В качестве исходной шихты использовали двухкомпонентную смесь CsI + 4 AgBr0.625I0.375. Применение твердого раствора AgBr0.625I0.375, где галогениды уже смешаны на молекулярном уровне, вместо механической смеси двух простых галогенидов серебра, способствовало лучшему распределению компонентов и более быстрому достижению однофазности при минимальном количестве стадий отжига. Кроме того, избавление от части эвтектик тройной системы CsI–AgI–AgBr позволило вести синтез при более высокой температуре.
Согласно фазовой диаграмме системы AgI–AgBr, приведенной в работе [13], на основе каждого индивидуального галогенида серебра образуется ограниченный ряд твердых растворов. (Фрагмент фазовой диаграммы этой системы приведен на рис. 4.) Твердый раствор на основе бромида серебра имеет более широкую область гомогенности (до 48 мол. %) AgI при 128°С, чем твердый раствор на основе AgI (до 11 мол. %) AgBr в тех же условиях [13]. При комнатной температуре обе эти области характеризуются еще меньшей протяженностью, хотя их границы в работе [13] очерчены лишь приблизительно. Отсутствие непрерывного ряда твердых растворов в системе AgI–AgBr сужает применимость использованной в данной работе методики твердофазного синтеза CsAg4Br3 –xI2 +x. Согласно нашим оценкам, она может быть полезна лишь в интервале составов 0 ≤ x ≤ 0.63. Выбранный для исследования в данной работе твердый раствор CsAg4Br2.5I2.5 (где x = = 0.5) укладывается в эти пределы.
Рис. 4.
Фрагмент субсолидусной области фазовой диаграммы системы AgI–AgBr, построенный по данным работы [13].

Твердый электролит RbAg4I5 получали путем обычного твердофазного синтеза из стехиометрической смеси RbI и AgI. Предварительный самостоятельный синтез AgI и строгое соблюдение условия изоляции от света позволили исключить частичное разложение крайне светочувствительного AgI на металлическое серебро и молекулярный иод. Это условие представляется крайне важным для получения соединений CsAg4Br2.5I2.5 и RbAg4I5 высокой степени чистоты и измерения их электрохимических характеристик, так как неконтролируемая частичная деградация исходных материалов способна существенно исказить результаты измерений электронной составляющей проводимости твердых электролитов.
Фазовый состав, морфология и физико-химические свойства
Дифрактограммы CsAg4Br2.5I2.5 и RbAg4I5, полученных путем твердофазного синтеза, приведены на рис. 5 и 6, соответственно. Как видно из рисунков, в обоих случаях все наблюдаемые рефлексы соответствуют основной фазе. Рассчитанные параметры кристаллической структуры твердых электролитов приведены в табл. 1, где для сравнения представлены также литературные данные. Можно видеть, что полученные нами величины очень хорошо согласуются с результатами работ [6, 12]. Несколько завышенные структурные параметры, полученные авторами [11], по-видимому, следует отнести к высокой дефектности структуры электролита CsAg4Br2.5I2.5, полученного механохимическим синтезом без последующего отжига.
Рис. 5.
Экспериментальная (точки) и расчетная (линия) рентгенограммы твердого электролита CsAg4Br2.5I2.5. Штрихи – угловые положения Брэгговских рефлексов. Внизу – разность между расчетом и экспериментом.

Рис. 6.
Экспериментальная (точки) и расчетная (линия) рентгенограммы твердого электролита RbAg4I5. Штрихи – угловые положения Брэгговских рефлексов. Внизу – разность между расчетом и экспериментом.
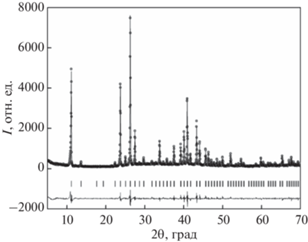
Таблица 1.
Параметры элементарной ячейки и плотность твердых электролитов
При синтезе твердых растворов CsAg4Br3 –xI2 +x нельзя сделать заключение об однофазности полученного продукта только на основании данных рентгеновской дифракции, так как невозможно исключить присутствие аморфных примесных фаз в системе CsI–AgI–AgBr, очень склонной к стеклообразованию [5, 7]. Поэтому дополнительным контролем однофазности служили результаты дифференциального термического анализа, представленные на рис. 7. Как видно из рисунка, на кривой ДСК твердого электролита CsAg4Br2.5I2.5 нет никаких термических эффектов от –160°С вплоть до температуры его инконгруэнтного плавления 177°С, что надежно подтверждает, как однофазность синтезированного образца, так и основанные на измерениях проводимости в низкотемпературной области заключения авторов [6] об отсутствии полиморфных переходов у твердого электролита этого состава.
На кривой ДСК твердого электролита RbAg4I5 в низкотемпературной области (ниже –60°С) наблюдаются два четко выраженных эндотермических эффекта (рис. 7), которые воспроизводятся как в режиме охлаждения, так и при последующих повторных измерениях в режимах нагрев–охлаждение. Они относятся к хорошо известным низкотемпературным фазовым переходам I рода, обусловленным перестройками кристаллической структуры RbAg4I5 с переходом от α- к плохопроводящим β- и γ-модификациям [1, 20–22]. При более высоких температурах имеет место единственный эндотермический эффект с температурой начала около 236°С, который отвечает плавлению с разложением фазы RbAg4I5. Таким образом, и в этом случае результаты термического анализа подтверждают однофазность синтезированного твердого электролита.
Термохимические свойства твердых электролитов CsAg4Br2.5I2.5 и RbAg4I5 суммированы в табл. 2. Полученные в данной работе значения температур фазовых переходов близки к литературным. Теплоты плавления CsAg4Br2.5I2.5 и RbAg4I5 очень близки между собой. Для RbAg4I5 полученная величина неплохо согласуется с данными работы [24]; для CsAg4Br2.5I2.5 такие сведения в литературе отсутствуют. Температуры полиморфных переходов RbAg4I5 в пределах погрешности измерений совпадают с литературными, а их теплоты имеют тот же порядок величины. По-видимому, полученные в настоящей работе значения ΔHФП I можно считать более точными благодаря использованию современного высокочувствительного оборудования.
Из сопоставления термохимических свойств двух твердых электролитов очевидно, что для низкотемпературных применений (например, в космической технике) CsAg4Br2.5I2.5 более предпочтителен благодаря отсутствию полиморфных переходов. В то же время, RbAg4I5 несколько более устойчив к нагреванию, так как обладает более высокой температурой плавления (разница составляет ~60°С).
Пикнометрическая плотность твердого электролита CsAg4Br2.5I2.5 составила 5.46 г см–3, что очень близко к расчетному значению этой величины (табл. 1). Твердый электролит RbAg4I5 характеризуется несколько меньшей величиной пикнометрической плотности 5.39 г см–3, которая также очень близка к расчетной (табл. 1).
Морфологию порошков твердых электролитов характеризуют электронные микрофотографии, представленные на рис. 8. Как видно из рис. 8, отдельные частицы твердых электролитов имеют весьма сходную форму, однако размер гранул CsAg4Br2.5I2.5 заметно меньше, чем RbAg4I5. По-видимому, замещение части ионов иода на бром делает кристаллиты более хрупкими, что облегчает их измельчение при перетирании в ступке.
Рис. 8.
Электронные микрофотографии порошков RbAg4I5 (а, б) и CsAg4Br2.5I2.5 (в, г) при различных увеличениях.

Очень важным для практического использования достоинством твердого электролита RbAg4I5 является высокая пластичность его кристаллов. Это позволяет не только получать высокоплотную (близкую к 100%) оптически прозрачную керамику путем обычного прессования при комнатной температуре и небольшом давлении, но и с легкостью изготавливать композиционную электродную массу с надежным контактом на межфазной границе. На рис. 9 представлена микрофотография поперечного скола таблетки RbAg4I5 с припрессованными распределенными электродами из порошков Ag и RbAg4I5, которая иллюстрирует монолитность полученного трехслойного изделия.
Рис. 9.
Электронная микрофотография поперечного скола таблетки RbAg4I5 (однородная масса в центре) с припрессованными распределенными электродами из порошка Ag и электролита (сверху и снизу).

Пластичность твердых электролитов семейства CsAg4Br3 –хI2 +х в литературе не охарактеризована. Согласно полученным нами данным, изготовление плотных прессовок из порошка CsAg4Br2.5I2.5 требует несколько бóльших усилий (как отмечено в экспериментальной части, давление прессования должно быть в ~1.8 раза выше), однако и в этом случае удается без спекания получить керамику CsAg4Br2.5I2.5 с плотностью, близкой к 100%. На рис. 10 приведена электронная микрофотография поперечного скола таблетки CsAg4Br2.5I2.5, изготовленной путем прессования при комнатной температуре.
Электрохимические характеристики
Проводимость твердых электролитов CsAg4Br2.5I2.5 и RbAg4I5 измеряли на постоянном токе четырехконтактным методом, что для высокопроводящих материалов дает более точные результаты по сравнению с импедансной спектроскопией. При измерении температурных зависимостей проводимости в интервале –60…+120 (CsAg4Br2.5I2.5) и –50…+100°С (RbAg4I5) использовали режим термоциклирования, предложенный Вальверде [18], когда начальной и конечной точкой служила комнатная температура (25°С). Температурные зависимости проводимости приведены на рис. 11. Можно видеть, что кривые нагрева и охлаждения хорошо укладываются на одну линию, а значения проводимости в начальной и конечной точке измерений совпадают. Это говорит о том, что измеренные величины σi близки к равновесным.
Рис. 11.
Температурные зависимости проводимости твердых электролитов CsAg4Br2.5I2.5 и RbAg4I5. Режим термоциклирования: ступенчатое повышение температуры от 25°C до максимального значения (нагрев 1), затем ступенчатое охлаждение до минимальной температуры (охлаждение 1) и последующий ступенчатый нагрев до 25°C (нагрев 2).

Кривые в координатах ln(σT)–1/T (рис. 11) для обоих электролитов хорошо описываются линейными зависимостями; рассчитанные из них величины энергий активации проводимости (Еа) приведены в табл. 3. Прямолинейная форма зависимости для RbAg4I5 полностью согласуется с видом кривой ДСК, приведенной на рис. 7, и указывает на отсутствие каких-либо фазовых переходов во всем изученном температурном диапазоне ‒50…+120°С. (Как известно [17, 25], ФП I проявляется на температурной зависимости проводимости в виде разрыва кривой, тогда как фазовый переход второго рода (ФП II) – в виде излома). В то же время, исходя из общепринятого мнения о термодинамической неустойчивости RbAg4I5 ниже 27°С и распаде этой фазы на Rb2AgI3 и AgI, основанного на данных работы [26], следовало бы ожидать характерного для ФП I разрыва на кривой вблизи 27°С. Однако этого еще никогда не наблюдалось (см., например, работы [18, 27]). На наш взгляд, имеющиеся данные ставят под вопрос устоявшиеся представления о термодинамической природе наблюдаемой иногда [17] частичной деградации твердого электролита RbAg4I5 ниже 27°С; подобные сомнения были ранее высказаны Укше и Букун в монографии [28].
Таблица 3.
Электрохимические характеристики твердых электролитов CsAg4Br2.5I2.5 и RbAg4I5
| Электролит | σi, См см–1 | Еa, кДж моль–1 | σel, См см–1 (25°С) | Eox, В | |||
|---|---|---|---|---|---|---|---|
| 100°C | 25°C | –20°C | –50°C | ||||
| RbAg4I5 | 0.56 | 0.33 | 0.18* | 0.11 | 9.8 ± 0.1 | 2 × 10–8 | 0.63 |
| CsAg4Br2.5I2.5 | 0.44 | 0.22 | 0.13 | 0.08 | 10.3 ± 0.1 | 3 × 10–9 | 0.77 |
Кривая ионной проводимости для CsAg4Br2.5I2.5 лежит несколько ниже зависимости для RbAg4I5 (рис. 11), однако следует отметить, что в действительности разница невелика и не превышает 0.12 См см–1 во всем изученном диапазоне температур (табл. 3). Зависимость ln (σT)–1/T для CsAg4Br2.5I2.5 описывается прямой линией во всем изученном температурном интервале (рис. 11). Следует подчеркнуть, что при –60°С твердый электролит CsAg4Br2.5I2.5 все еще демонстрирует суперионную проводимость. Полученные нами величины проводимости близки к результатам Личковой и Деспотули с соавторами [5–8]. Как показано в работе [6], уникально высокая ионная проводимость сохраняется вплоть до –193°С, что обусловлено отсутствием у CsAg4Br2.5I2.5 каких-либо фазовых переходов ниже температуры плавления (рис. 7) и очень маленькой энергией активации проводимости (10.3 кДж моль–1). В то же время, известно, что транспортные свойства RbAg4I5 резко ухудшаются ниже –60°С вследствие полиморфных превращений [12, 22]. Транспортные характеристики исследуемых твердых электролитов суммированы в табл. 3.
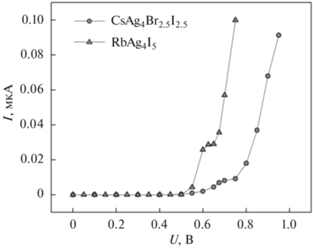
Важной характеристикой твердых электролитов, используемых в химических источниках тока, является электронная составляющая электропроводности, так как наличие заметной шунтирующей проводимости в электрохимической ячейке ведет к ее саморазряду. Кроме того, необходимо знать величину потенциала окисления твердого электролита, т. к. она накладывает ограничения на используемые в сочетании с ним электродные материалы. Согласно литературным данным, электрохимическая устойчивость RbAg4I5 ограничена величиной Eox = 0.65–0.67 В относительно металлического серебряного электрода [18, 29], а электронная проводимость варьируется в широком интервале от 10–11 до 10–8 [12, 18, 28, 29]. Для твердых растворов CsAg4Br3 –xI2 +x данных о величине потенциала окисления и вкладе электронной проводимости в литературе не обнаружено.
Эти важные сведения могут быть получены из вольт-амперных характеристик твердых электролитов, приведенных на рис. 12. Для их построения использовали методику пошаговой поляризации [18] и электрохимические ячейки, представленные на рис. 3. Расчет величины σel проводили в пределах области плато на кривой ВАХ (100–500 мВ) c преобладающим диффузионным переносом электронов и пренебрежимо малым вкладом дырочной проводимости (в соответствии с анализом, приведенным в работе [18]). Согласно полученным данным, электронная проводимость обоих твердых электролитов пренебрежимо мала по сравнению с ионной (табл. 3). Величину Eox оценивали по пересечению продолжения линии плато и касательной к последнему участку ВАХ с резким ростом стационарного тока, обусловленным окислительным разложением электролита. Как видно из рис. 12, твердый электролит CsAg4Br2.5I2.5 обладает замено более высокой электрохимической устойчивостью, чем RbAg4I5.
ЗАКЛЮЧЕНИЕ
С использованием оригинальной методики твердофазного синтеза получен твердый электролит CsAg4Br2.5I2.5 в виде однофазного продукта высокой чистоты. Его физико-химические и электрохимические характеристики сопоставлены со свойствами суперионного проводника RbAg4I5, также полученного путем твердофазного синтеза. Прямыми измерениями методом ДСК подтверждено отсутствие каких-либо фазовых переходов первого рода у CsAg4Br2.5I2.5 ниже температуры плавления (177°С) вплоть до –160°С при сохранении суперионного характера проводимости с Ea = 10.3 ± 0.1 кДж моль–1 Кроме того, твердый электролит CsAg4Br2.5I2.5 обладает повышенной электрохимической устойчивостью по сравнению с RbAg4I5 и характеризуется потенциалом окисления 0.78 В. Это делает его перспективным электролитическим материалом для использования в химических источниках тока и низкотемпературных применений.
Список литературы
Деспотули, А.Л., Личкова, Н.В., Миненкова, Н.А., Носенко, С.В. Получение и некоторые свойства тонких пленок твердых электролитов CsAg4Br3 –xI2 +x и RbAg4I5. Электрохимия. 1990. Т. 26. С. 1524. [Despotuli, A.L., Lichkova, H.V., Minenkova, H.A., and Nosenko, S.V., Preparation and certain properties of CsAg4Br3 –xI2 +x and RbAg4I5 thin film solid electrolytes, Elektrokhimiya (in Russian), 1990, vol. 26, p. 1364.]
Толстогузов, А.Б., Белых, С.Ф., Гололобов, Г.П., Гуров, В.С., Гусев, С.И., Суворов, Д.В., Таганов, А.И., Fu, D.J., Ai, Z., Liu, C.S. Ионные источники на твердых электролитах для аэрокосмического применения и ионно-лучевых технологий (обзор). Приборы и техника эксперимента. 2018. № 2. С. 5. [Tolstoguzov, A.B., Belykh, S.F., Gololobov, G.P., Gurov, V.S., Gusev, S.I., Suvorov, D.V., Taganov, A.I., Fu, D.J., Ai, Z., and Liu, C.S., Ion-beam sources based on solid electrolytes for aerospace applications and ion-beam technologies (Review), Instruments and Experimental Techniques, 2018, vol. 61, no. 2, p. 159.] https://doi.org/10.7868/S0032816218020106
Деспотули, А.Л., Андреева, А.В. Наноионика: новые материалы и суперконденсаторы. Рос. нанотехнологии. 2010. Т. 5. № 7–8. С. 89. [Despotuli, A.L. and Andreeva, A.V., Nanoionics: New materials and supercapacitors, Nanotechnologies in Russia, 2010, vol. 5, no. 7–8, p. 506.] https://doi.org/10.1134/S1995078010070116
Owens, B.B., Solid state electrolytes: overview of materials and applications during the last third of the Twentieth Century, J. Power Sources, 2000, vol. 90, p. 2. https://doi.org/10.1016/S0378-7753(00)00436-5
Личкова, Н.В., Деспотули, А.Л., Загороднев, В.Н., Миненкова, Н.А., Шахлевич, К.В. Ионная проводимость твердых электролитов в двух- и трехкомпонентных стеклообразующих системах AgX–CsX (X = Cl, Br, I). Электрохимия. 1989. Т. 25. С. 1636. [Lichkova, H.V., Despotuli, A.L., Zagorodnev, V.N., Minenkova, H.A., and Shakhlevich, K.V., Ionic conductivity of solid electrolytes in two- and three-component glass-forming systems AgX–CsX (X = Cl, Br, I), Elektrokhimiya (in Russian), 1989, vol. 25, p. 1465.]
Деспотули, А.Л., Загороднев, В.Н., Личкова, Н.В., Миненкова, Н.А. Новые высокопроводящие твердые электролиты: CsAg4Br3 –xI2 +x 0.25 ≤ х ≤ 1. ФТТ. 1989. Т. 31. № 9. С. 242. [Despotuli, A.L., Zagorodnev, V.N., Lichkova, N.V., and Minenkova, N.A., New High Conductive CsAg4Br3 –xI2 +x (0.25 < x < 1) Solid Electrolytes, Fiz. Tverd. Tela (Leningrad) (in Russian), 1989, vol. 31, no. 9, p. 242.]
Lichkova, N.V., Despotuli, A.L., Zagorodnev, V.N., and Minenkova, N.A., Superionic glasses based on silver and caesium monogalides, Materials Science Forum, 1991, vol. 67–68, p. 601. https://doi.org/10.4028/www.scientific.net/MSF.67-68.601
Личкова, Н.В., Деспотули, А.Л., Загороднев, В.Н., Миненкова, Н.А. Твердый электролит. Пат. RU 1697573 С. H01M 6/18 (1995.01) (Россия), 1989. [Lichkova, N.V., Despotuli, A.L., Zagorodnev, V.N., and Minenkova, N.A., Solid electrolyte, Patent RU 1697573 P. H01M 6/18 (1995.01) (Russia), 1989.]
Деспотули, А.Л., Личкова, Н.В. Ионистор. Пат. RU 2012105 C1, МПК H01M 6/18 (Россия), 1991. [Despotuli, A.L. and Lichkova, N.V., Ionistor, Patent RU 2012105 C1, IPC H01M 6/18 (Russia), 1991.]
Zuo, W.B., Pelenovich, V.O., Tolstogouzov, A.B., and Fu, D.J., Mechano-chemical synthesis of crystalline superionic conductors CsAg4Br3 –xI2 +x (0 < x < 1) and their silver-conducting properties, IOP Conf. Ser.: Mater. Sci. Eng., 2019, vol. 668, p. 012021. https://doi.org/10.1088/1757-899X/668/1/012021
Abudouwufu, T., Zuo, W., Pelenovich, V., Zhang, X., Zeng, X., Tolstoguzov, A., Zou, C., Tian, C., and Fu, D., Crystal structure and ion transport properties of solid electrolyte CsAg4Br3 –xI2 +x (0 < x < 1), Solid State Ionics, 2021, vol. 364, p. 115634. https://doi.org/10.1016/j.ssi.2021.115634
Geller, S., Crystal structure of the solid electrolyte, RbAg4I5, Science, 1967, vol. 157, no. 3786, p. 310. https://doi.org/10.1126/science.157.3786.310
Takahashi, H. and Tamaki, S., Phase equilibria of AgI–AgBr system, Solid State Ionics, 1984, vol. 14, p. 107.
Карякин, Ю.В., Ангелов, Н.Н. Чистые химические вещества, M.: Химия, 1974. 408 с. [Karyakin, Yu.V. and Angelov, I.I., Pure Chemical Substances (in Russian), M.: Chemistry, 1974. 408 p.]
Rodríguez, Carvajal, J., Recent advances in magnetic structure determination by neutron powder diffraction, Physica B, 1993, vol. 192, no. 1–2, p. 55. https://doi.org/10.1016/09214526(93)90108I
Rycerz, L., Practical remarks concerning phase diagrams determination on the basis of differential scanning calorimetry measurements, J. Therm. Anal. Calorim., 2013, vol. 113, p. 231. https://doi.org/10.1007/s10973-013-3097-0
Иванов-Шиц, А.К., Мурин, И.В. Ионика твердого тела, в 2 т. Т. I, CПб.: Изд-во СПбУ, 2000. 616 с. [Ivanov-Shits, A.K. and Murin, I.V. Solid state Ionics, in 2 vols. (in Russian), vol. I, St. Petersburg: Publishing House of St. Petersburg University, 2000. 616 p.]
Valverde, N., Thermodynamic stabilization of the solid electrolyte RbAg4I5, J. Electrochem. Soc.: Solid State Science and Technology, 1980, vol. 127, no. 11, p. 2425. https://doi.org/10.1149/1.2129487
Бушкова, О.В., Резницких, О.Г., Ярославцева, Т.В., Попов, Н.А., Непомилуев, А.М., Новиков, Д.В., Добровольский, Ю.А. Способ получения твердого электролита. Пат. 2720349 (Россия), 2019. [Bushkova, O.V., Reznitskikh, O.G., Yaroslavtseva, T.V., Popov, N.A., Nepomiluev, A.M., Novikov, D.V., and Dobrovolsky, Yu.A., Method of obtaining a solid electrolyte, Patent 2720349 (Russia), 2019.]
Genossar, J., Gordon, A., Steinits, M.O., and Well, R., Anomalous thermal expansion at phase transitions of Ag4RbI5, Solid State Commun., 1981, vol. 40, p. 253. https://doi.org/10.1016/0038-1098(81)90752-3
Johnston, W.V., Wiedersich, H., and Lindberg, G.W., Heat capacity, transformations, and thermal disorder in the solid electrolyte RbAg4I5, J. Chem. Phys., 1969, vol. 51, no. 9, p. 37393747. https://doi.org/10.1063/1.1672588
Owens, B.B. and Argue, G.R., High-conductivity solid electrolytes: MAg4I5, Science, 1967, vol. 157, p. 308. https://doi.org/10.1126/science.157.3786.308
Owens, B.B. and Skarstad, P.M., Ambient temperature solid state batteries, Solid State Ionics, 1992, vols. 53–56, p. 665. https://doi.org/10.1016/0167-2738(92)90444-T
Johnson, K.E., Sime, S.J., and Dudley, J., Drop calorimetric determination of enthalpy content of the systems AgI + MI (M = K, Rb, Cs, NH4, (CH3)4N, J. Chem. Soc. Faraday Trans I., 1972, vol. 68, p. 2015. https://doi.org/10.1039/F19726802015
Бурмакин, Е.И. Твердые электролиты с проводимостью по катионам щелочных металлов, М.: Наука, 1992. 363 с. [Burmakin, E.I., Solid electrolytes with conductivity by alkali metal cations (in Russian), M.: Nauka, 1992. 363 p.]
Topol, L.E. and Owens, B.B., Thermodynamic studies in the high-conducting solid systems rubidium iodide-silver iodide, potassium iodide-silver iodide, and ammonium iodide-silver iodide, J. Phys. Chem., 1968, vol. 72, no. 6, p. 2106. https://doi.org/10.1021/j100852a038
García, C., Franco, J.I., Lópes, J.C., Tonazzi, N.E., and Walsöe de Reca, Conductivity behavior of RbAg4I5, Solid State Ionics, 1983, vols. 9–10, p. 1233.
Укше, Е.А., Букун, Н.Г. Твердые электролиты, М.: Наука, 1977. С. 50–51.
De Rossi, M., Pistoia, G., and Scrosati, B., Reversible solid-state battery with RbAg4I5 as electrolyte, J. Electrochem. Soc.: Electrochem. Sci., 1969, vol. 116, no. 12, p. 1642.
Дополнительные материалы отсутствуют.