Электрохимия, 2022, T. 58, № 11, стр. 793-801
Транспортные свойства сложного оксида Ba2InAlO5
И. В. Алябышева a, *, Н. А. Кочетова a, Е. С. Матвеев a, Д. В. Корона a, Н. Г. Молчанова b, И. Е. Анимица a
a Уральский федеральный университет им. первого Президента России Б.Н. Ельцина
Екатеринбург, Россия
b Институт высокотемпературной электрохимии УрО РАН
Екатеринбург, Россия
* E-mail: I.V.Alyabysheva@urfu.ru
Поступила в редакцию 18.02.2022
После доработки 22.04.2022
Принята к публикации 28.04.2022
- EDN: HUMHQM
- DOI: 10.31857/S0424857022110032
Аннотация
В настоящей работе твердофазным методом получен сложный оксид Ba2InAlO5, впервые изучены его термические и транспортные свойства при варьировании температуры и состава газовой фазы (парциального давления паров воды и кислорода). Установлена возможность диссоциативного внедрения воды в структуру сложного оксида, приводящая к образованию протонных дефектов и формированию протонного переноса в области средних температур (500–700°C). Проведена дифференциация проводимости на составляющие, доказано, что общая электропроводность фазы в атмосфере осушенного воздуха имеет преимущественно дырочный характер с небольшим вкладом кислородно-ионного переноса. В атмосфере влажного воздуха вклад и величина ионной проводимости возрастают из-за появления протонного переноса.
ВВЕДЕНИЕ
Научный интерес к сложным оксидам, проявляющим протонный перенос в средней области температур 500–700°С, в настоящее время остается высоким и подкрепляется общим трендом исследований, направленных на снижение рабочих температур твердооксидных топливных элементов [1, 2].
Среди сложных оксидов состава ${\text{A}}_{2}^{{2 + }}{\text{B}}_{2}^{{3 + }}{{{\text{O}}}_{{\text{5}}}}$ широко известен кислородно-ионный и протонный проводник индат бария Ba2In2O5, характеризующийся некомплектной по кислородной подрешетке перовскитоподобной структурой с упорядоченным расположением кислородных вакансий – тип браунмиллерита [3–5]. Наличие структурных вакансий Ba2In2O5(Vo)1, т.е. присутствие в В-подрешетке, помимо октаэдров [InO6], полиэдров с пониженным координационным числом [InO4], обуславливает возможность взаимодействия сложного оксида с парами воды, приводящего к достраиванию полиэдров с пониженным координационным числом до октаэдров. Появление протонных дефектов в структуре определяет интересные электрические свойства данной фазы – преимущественно протонную проводимость в области средних температур во влажной атмосфере [6–9].
Одним из путей улучшения электрических свойств индата бария является введение изовалентного заместителя в In-подрешетку [9, 10]. Ранее нами были исследованы твердые растворы состава Ba2(In1 –xAlx)2O5. Установлено, что при замещении позиций In3+ на Al3+ стабилизируется тетрагональная симметрия структуры со статистическим расположением кислородных вакансий и общая проводимость возрастает на порядок величины. Область гомогенности твердых растворов ограничена составом с x = 0.2 [11]. Однако в литературе также описано индивидуальное соединение, содержащее в В-подрешетке катионы In3+ и Al3+ в соотношении 1 : 1, Ba2InAlO5, электрические свойства которого детально не изучены, а данные о структуре противоречивы.
Соединение Ba2InAlO5 можно отнести к группе изоформульных оксидных фаз состава Ba2ВВ'O5, где В и В' трехзарядные катионы одинаковой, либо разной природы (Al3+, In3+, Ga3+, Sc3+, Y3+, Ho3+) [12–18]. В зависимости от размерных и энергетических характеристик В-катионов, фазы Ba2ВВ'O5 могут описываться различными типами перовскитоподобных структур. Данные сложные оксиды в разной степени способны к внедрению молекул воды из газовой фазы и появлению протонной проводимости. Самой высокой величиной проводимости и наиболее высокой степенью гидратации (до 1 моль H2O на формульную единицу вещества) обладают фазы, где в позиции В‑катиона находятся In3+ или Sc3+ [3, 7, 12, 13].
Сложный оксид Ba2InAlO5 описан в работах [17, 18], но информация о его структуре противоречива. В работе [18] была получена фаза Ba2InAlO5 с гексагональной симметрией: пр. гр. P63/mmc, а = = 5.780(9) Å, c =19.624(8) Å, α = β = 90°, γ = 120°. Данную структуру в полиэдрическом виде можно представить как сеть конденсированных линейных групп [Al2O7] и октаэдров [InO6]. В работе [17] приводятся данные о кубической симметрии фазы Ba2InAlO5: пр. гр. Pm3m, а = 4.157(8) Å, α = β = = γ = 90°, то есть сложный оксид описывается структурой одинарного перовскита с вакансиями в кислородной подрешетке, где часть полиэдров [BOn] имеет координационное число меньше 6. Можно предположить, что причина различия наблюдаемых структур состоит в выборе метода синтеза. Так, авторы [18] выращивали Ba2InAlO5 в виде монокристаллов, верхняя температура синтеза составляла 1050°С. Транспортные свойства вещества не исследовались. В работе [17] получали поликристаллический порошок Ba2InAlO5 керамическим методом в одну стадию при 1100°С с верхней температурой спекания керамики 1400°С. В работе [17] была измерена общая электропроводность Ba2InAlO5 в узком температурном интервале 1000–650°С в атмосфере воздуха без контроля влажности, тип проводимости не определялся.
В настоящей работе проведены исследования фазового состава, термических и транспортных свойств сложного оксида Ba2InAlO5, полученного твердофазным методом синтеза. Транспортные свойства изучены при варьировании температуры, парциального давления кислорода и паров воды.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Сложный оксид Ba2InAlO5 получали твердофазным методом из исходных веществ BaCO3, In2O3 и Al2O3 (ос. ч.) по уравнению реакции:
(1)
$\begin{gathered} 4{\text{BaC}}{{{\text{O}}}_{3}} + {\text{I}}{{{\text{n}}}_{{\text{2}}}}{{{\text{O}}}_{3}} + {\text{A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{3}} \to \\ \to {\text{ }}2{\text{B}}{{{\text{a}}}_{{\text{2}}}}{\text{InAl}}{{{\text{O}}}_{5}} + 4{\text{C}}{{{\text{O}}}_{2}} \uparrow {\kern 1pt} . \\ \end{gathered} $Синтез осуществляли при ступенчатом повышении температуры от 800 до 1200°С с шагом 100°С и изотермическими выдержками 24 ч; между стадиями отжига проводили перетирание порошка в среде этилового спирта в агатовой ступке в течение 1 ч.
Съемку дифрактограмм осуществляли при комнатной температуре на порошковом рентгеновском дифрактометре D8 Advance (Bruker, Германия) с использованием CuKα-излучения в интервале углов 15° ≤ 2θ ≤ 80° с шагом 0.05° и с экспозицией 1 с. Обработку и расчет параметров элементарной ячейки проводили с использованием бесструктурной модели Ле Бэйла при помощи программного пакета Fullprof Suite.
Соотношение элементов в образце определяли спектрально-эмиссионным методом с индуктивно-связанной плазмой на оптическом эмиссионном спектрометре Optima 4300 DV (Perkin Elmer, США).
Морфология спеченного керамического образца была изучена методом сканирующей электронной микроскопии (СЭМ) с использованием сканирующего электронного микроскопа Sigma VP (Carl Zeiss, Германия). Условия съемки: 15 кВ, рабочее расстояние 10 мм. Изображения поверхности образца были получены в отраженных электронах.
Термогравиметрический анализ был проведен в режиме охлаждения на термовесах Pyris 1 TGA (PerkinElmer, США). Измерения проводили в интервале температур от 700 до 25°С, в потоке сухого и влажного азота (скорость подачи газа 100 мл/мин), после предварительной высокотемпературной выдержки образца в течение 30 мин; скорость охлаждения составляла 1°С/мин. Сухую атмосферу задавали потоком азота (pH2O = 1 × 10–5 атм); влажную атмосферу устанавливали, пропуская поток азота через насыщенный раствор бромида калия (pH2O = 2 × 10–2 атм).
Для измерений электрических свойств порошок исследуемого вещества компактировали методом холодного изостатического прессования в таблетки диаметром 7 мм и толщиной 1–2 мм; для эксперимента по измерению чисел переноса методом ЭДС прессовали таблетки большего размера: диаметр 15 мм, толщина 2 мм, что было обусловлено размерами измерительной ячейки. Спекание таблеток проводили при 1270°C в течение 24 ч. Относительная плотность керамики, определенная как отношение геометрической плотности образца к его рентгеновской плотности, составила ~90%. На предварительно отшлифованные торцевые поверхности спеченных образцов наносили платиновую пасту, вжигание Pt-электродов проводили при температуре 900○C в течение 1 ч.
Измерение электропроводности выполняли в двухконтактной ячейке методом импедансной спектроскопии с использованием измерителя импеданса Elins Z-1000P (ООО “Элинс”, Россия) при частоте 50 Гц–1 МГц, в интервале температур 200–900°C, в атмосферах с различным парциальным давлением паров воды. Съемку спектров импеданса проводили через каждые 20°С; для обработки полученных годографов использовали программу ZView 2. В области температур выше 450°С рассчитанные из годографов значения сопротивления образца хорошо совпадали со значениями сопротивления, измеренными на частоте 1 кГц.
Измерение электропроводности от парциального давления кислорода проводили в интервале значений pO2 = 10–17–0.21 атм при температурах Т = 600–900°С на частоте 1 кГц. Давление кислорода задавали и контролировали с помощью кислородного насоса и датчика парциальных давлений кислорода, изготовленных из оксида циркония ZrO2, допированного 10 мол. % Y2O3. Температура насоса поддерживалась автономной печью и составляла 900°С. Регулирование и задание pO2 осуществляли регулятором Zirconia-M (ООО “Исследовательские технологии”, Россия).
Для электрических измерений сухую атмосферу задавали непрерывным продуванием потока воздуха через аскарит (для очищения воздуха от CO2), CaCl2, цеолиты (для предварительного снижения pH2O) и пентаоксид фосфора P2O5 (для снижения pH2O до значения 3 × 10–5 атм). Для установления влажной атмосферы поток воздуха изначально пропускали через последовательно соединенные склянки Дрекселя с 30%-ным раствором NaOH (для очищения воздуха от CO2) и насыщенным раствором бромида калия KBr (для задания pH2O = 2 × 10–2 атм).
Определение суммарных ионных и протонных чисел переноса проводили в интервале температур
600–850°С во влажной атмосфере методом ЭДС на концентрационной ячейке с разделенными
газовыми пространствами, где в качестве электролита использовали исследуемое вещество.
Основы метода изложены в работах [19–21]. Измерения суммарного значения ионных чисел переноса, включающих числа переноса
ионов кислорода и протонных носителей, проводили в условиях градиента парциального
давления кислорода (pO2), который задавали воздухом ($p{\text{O}}_{2}^{'}$ = = 0.21 атм) и кислородом ( = 1 атм); в данном эксперименте парциальное давление паров воды поддерживалось постоянным
с обеих сторон ячейки: рН2О = 2 × 10–2 атм (влажные условия). Кажущиеся протонные числа переноса, в общем случае отражающие
суммарный перенос всех возможных миграционных форм протонсодержащих частиц (H+, OH–, H3O+) [20], определяли из измерений в условиях градиента рН2О на электродах ячейки, при постоянном значении рО2 = 0.21 атм (воздух). Градиент pH2O задавался пропусканием потока воздуха, предварительно очищенного от СО2, через насыщенный раствор KBr (pH2O' = 2 × × 10–2 атм) и насыщенный раствор LiCl (pH2O'' = = 5 × 10–3 атм). Для контроля влажности атмосферы использовали датчик HIH-4000 (Honeywell, США).
= 1 атм); в данном эксперименте парциальное давление паров воды поддерживалось постоянным
с обеих сторон ячейки: рН2О = 2 × 10–2 атм (влажные условия). Кажущиеся протонные числа переноса, в общем случае отражающие
суммарный перенос всех возможных миграционных форм протонсодержащих частиц (H+, OH–, H3O+) [20], определяли из измерений в условиях градиента рН2О на электродах ячейки, при постоянном значении рО2 = 0.21 атм (воздух). Градиент pH2O задавался пропусканием потока воздуха, предварительно очищенного от СО2, через насыщенный раствор KBr (pH2O' = 2 × × 10–2 атм) и насыщенный раствор LiCl (pH2O'' = = 5 × 10–3 атм). Для контроля влажности атмосферы использовали датчик HIH-4000 (Honeywell, США).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Структура и микроструктура
На рис. 1а представлена рентгенограмма полученного образца Ba2InAlO5. Структура описывается тетрагональной симметрией: пр. гр. P4/mmm, а = 4.238(5) Å, c = 7.768(4) Å, α = β = γ = 90°. Полученный результат не согласуется с литературными данными, где структура Ba2InAlO5 описана либо как гексагональная – исследования проведены на монокристаллах [18], либо как кубическая – исследован поликристаллический образец [17]. Наблюдаемое несоответствие, в том числе с работой [17], где использовался сходный метод синтеза поликристаллического образца, может быть связано с использованием различных режимов термообработки. Напомним, что в работе [17] синтез проводили в одну стадию при обработке на высокой температуре 1100°С. В настоящей работе образец был получен твердофазным методом при стадийном повышении температуры, начиная с 800°С, что обеспечивает более полное связывание компонентов шихты и сохранение заданной стехиометрии, в частности предотвращает потерю индия из-за высокой сублимации оксида индия In2O3 при температурах выше 800°С [22]. Элементный состав полученного образца был дополнительно подтвержден, мольное соотношение металлических элементов составило Ba : In : Al = = 2 : 0.97 : 1.04, что хорошо согласуется с заданной стехиометрией: 2 : 1 : 1.
Рис. 1.
Рентгенограмма образца Ba2InAlO5 (а); СЭМ-изображение поверхности скола керамики Ba2InAlO5 (б).

На рис. 1б приведено СЭМ-изображение скола керамики Ba2InAlO5 после обработки при 1270°С. Образец однофазен, характеризуется однородной морфологией, содержит сглаженные круглые небольшие зерна размером ~1 мкм и образованные ими агломераты.
При попытках обрабатывать керамику на температуре 1400°С, как это описано в работе [17], было установлено, что происходит разложение образца. На рентгенограмме фиксируется появление пиков, относящихся к фазам BaAl2O4, Ba4In2O7 и Ba2In2O5. Уравнение разложения Ba2InAlO5 можно записать в следующем виде:
(2)
$4{\text{B}}{{{\text{a}}}_{{\text{2}}}}{\text{InAl}}{{{\text{O}}}_{5}} \to {\text{B}}{{{\text{a}}}_{{\text{2}}}}{\text{I}}{{{\text{n}}}_{{\text{2}}}}{{{\text{O}}}_{5}} + 2{\text{BaA}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{4}} + {\text{B}}{{{\text{a}}}_{{\text{4}}}}{\text{I}}{{{\text{n}}}_{{\text{2}}}}{{{\text{O}}}_{7}}.$Процесс гидратации
По данным термогравиметрии, при охлаждении во влажном азоте в температурном интервале 600–100°С наблюдается увеличение массы образца, в то время как в сухом азоте значительного изменения массы не происходит, что позволяет предполагать диссоциативное внедрение молекул воды в структуру сложного оксида в атмосфере с высоким pH2O (см. рис. 2). Максимальное количество внедряемой воды невелико и составляет 0.12 моль на формульную единицу Ba2InAlO5.
Рис. 2.
Термогравиметрические кривые для Ba2InAlO5, полученные в режиме охлаждения в атмосферах влажного (1) и сухого (2) азота.

Внедрение молекул воды в структуру сложных оксидов связано с заполнением вакансий кислорода [3]. Однако даже при наличии кислородных вакансий взаимодействие с парами воды может быть затруднено из-за размерных или энергетических факторов. Так, в работе [10] показано, что для твердых растворов на основе Ba2In2O5 при замещении части ионов In3+ на Al3+ степень гидратации снижается, поскольку тетраэдры [AlO4], в отличие от [InO4], не достраиваются до октаэдров из-за различия в координационных тенденциях In3+ на Al3+, поэтому часть вакансий кислорода остается недоступной для внедрения воды. Описанная тенденция может объяснять невысокую степень гидратации фазы Ba2InAlO5.
Для исключения структурных изменений при гидратации фазы Ba2InAlO5 был проведен рентгенофазовый анализ осушенного и полностью гидратированного образцов. Полученные рентгенограммы были полностью идентичны.
Электрические свойства
Принимая во внимание возможность внедрения воды в структуру сложного оксида Ba2InAlO5, измерения электрических свойств были проведены в атмосферах сухого и влажного воздуха. На рис. 3 представлены температурные зависимости общей электропроводности и типичный вид годографов импеданса в эволюции от температуры на примере сухой атмосферы. При температурах ниже 450°С годографы представляли собой две перекрывающиеся полуокружности (см. рис. 3а), которые были отнесены к вкладам объема образца и границ зерен. При температурах выше 450°С в низкочастотной области спектра импеданса появлялся третий вклад – полуокружность, относящаяся к электродному процессу. За сопротивление образца принимали суммарное сопротивление объема и границ зерен, поскольку разделить вклады, выделив объемную составляющую, для всего исследуемого интервала температур не удалось. Полученные значения сопротивления использовали для расчета электропроводности.
Рис. 3.
Эволюция годографов импеданса образца Ba2InAlO5 в сухой атмосфере (а) при 415 (1), 455 (2), 490 (3), 530°С (4); температурные зависимости общей электропроводности образца в сухой (5) и влажной (6) атмосферах, полученные из данных годографов импеданса (б).
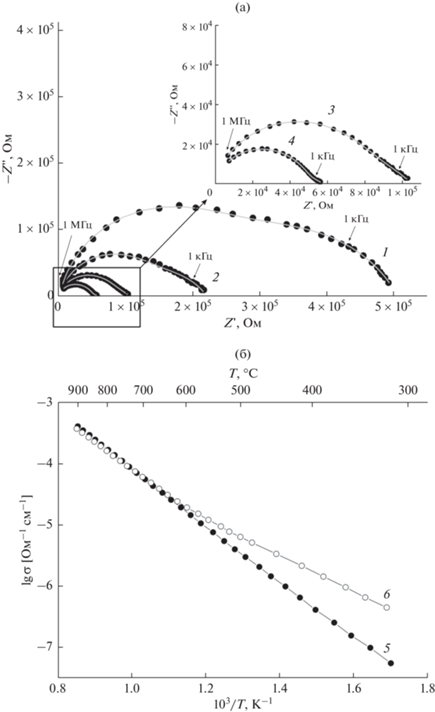
Исследуемая фаза обладает невысокими значениями проводимости, при 500°С электропроводность в сухой атмосфере составляет 3.4 × 10–6 Ом–1 см–1. Во влажной атмосфере ниже 650°С проводимость Ba2InAlO5 заметно возрастает, а кажущаяся энергия активации уменьшается с 0.79 до 0.58 эВ (для температурного участка 500–300°С), что косвенно свидетельствует о появлении вклада протонных носителей в общую электропроводность. Сравнительные данные по значениям общей электропроводности для фаз Ba2В'В''O5 (B', B'' – трехзарядные катионы) в сухой и влажной атмосферах приведены в табл. 1. Видно, что фазы Ba2В'В''O5 обладают значениями проводимости в пределах 10–4–10–7 Ом–1 см–1, в зависимости от природы катионов в В-позициях. Во влажной атмосфере для всех рассмотренных сложных оксидов наблюдается рост проводимости, что связно с внедрением воды и появлением вклада протонного переноса.
Таблица 1.
Сравнение значений общей электропроводности фаз Ba2В'В''O5 (B', B'' – трехзарядные катионы) в атмосферах сухого и влажного воздуха
| Формула | Симметрия структуры | σ (сух. атм.), Ом–1 см–1 (500°C) | σ (вл. атм.), Ом–1 см–1 (500°C) | Источник |
|---|---|---|---|---|
| Ba2In2O5 | Ромбическая | ~2 × 10–6* | ~6 × 10–5* | [7] |
| 8.45 × 10–6 | 1.92 × 10–5 | [8] | ||
| 2.9 × 10–5 3.6 × 10–5 (при pО2 = 10–6 атм) |
[9] [5] |
|||
| Ba2InGaO5 | Ромбическая | 4 × 10–7 | 5 × 10–7 | [16] |
| Ba2Sc2O5 | Тетрагональная | 1 × 10–4 2 × 10–4 |
2.5 × 10–4 2.13 × 10–4 |
[12] [13] |
| Ba2ScInO5 | Моноклинная | 6 × 10–5 | 7.5 × 10–5 | [12] |
| Ba2YGaO5 | Моноклинная | 1 × 10–6 | 7.5 × 10–6 | [12] |
| Ba2HoGaO5 | Моноклинная | 7.5 × 10–6 | 5 × 10–5 | [12] |
| Ba2InAlO5 | Кубическая | ~8 × 10–6* | [17] | |
| Ba2InAlO5 | Тетрагональная | 3.4 × 10–6 | 6.7 × 10–6 | Настоящая работа |
Для установления типа носителей были проведены измерения общей электропроводности Ba2InAlO5 от парциального давления кислорода в сухой и влажной атмосферах (см. рис. 4). В области высоких рО2 наблюдается положительный наклон зависимости, тангенс угла наклона составляет ~1/4, что свидетельствует о вкладе дырочных носителей, в области средних рО2 – электролитическое плато, соответствующее ионной проводимости. Во влажной атмосфере происходит увеличение общей проводимости в области средних рО2 и расширение электролитической области (наблюдаемый наклон в высоких рО2 сглаживается), что связано с ростом ионной составляющей проводимости. Можно предполагать, что ионная составляющая в сухих условиях обусловлена преимущественно переносом ионов кислорода. Таким образом, сложный оксид Ba2InAlO5 на воздухе характеризуется смешанной ионно-дырочной проводимостью с преобладанием электронного (р-типа) переноса. Во влажной атмосфере ионный вклад значимо возрастает, что можно связать с появлением подвижных протонных носителей и протонного вклада проводимости.
Рис. 4.
Зависимости общей электропроводности образца Ba2InAlO5 от парциального давления кислорода в сухой (закрытые символы) и влажной (открытые символы) атмосферах при 900 (1), 800 (2) и 600°С (3).

Суммарные ионные и кажущиеся протонные числа переноса во влажной атмосфере были определены методом ЭДС в ограниченном интервале температур 600–850°С, полученные зависимости представлены на рис. 5а. Можно видеть, что значения суммарных ионных чисел переноса при понижении температуры возрастают в интервале от 0.15 до 0.50. Вклад протонного переноса в общий ионный перенос также возрастает от 0.08 до 0.35.
Рис. 5.
Температурная зависимость чисел переноса для образца Ba2InAlO5, измеренных методом ЭДС в атмосфере влажного воздуха: 1 – суммарные ионные, 2 – кажущиеся протонные числа переноса (а); температурные зависимости парциальных проводимостей образца Ba2InAlO5 для влажной атмосферы: 3 – общая электропроводность во влажной атмосфере, 4 – дырочная, 5 – кислородно-ионная, 6 – протонная составляющие (б).
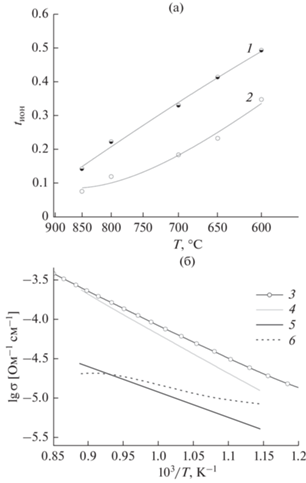
На основе данных метода ЭДС была проведена дифференциация проводимости во влажной атмосфере на парциальные вклады (см. рис. 5б).
Парциальные проводимости σi рассчитывали, как произведение соответствующих чисел переноса ti и общей проводимости образца в атмосфере влажного воздуха σ по следующей формуле:
где i – это тип носителя: суммарные ионные носители (ион); ионы кислорода (O2–); протонные носители (H+); носители дырочного типа (h).Методом ЭДС во влажной атмосфере были измерены суммарные ионные tион и кажущиеся протонные ${{t}_{{{{{\text{H}}}^{ + }}}}}$ числа переноса. Расчет чисел переноса ионов кислорода ${{t}_{{{{{\text{O}}}^{{2 - }}}}}}$ и дырочных носителей th производили по следующим формулам:
Результаты расчетов парциальных проводимостей во влажной атмосфере представлены на рис. 5б. В интервале температур 600–850°С образец Ba2InAlO5 проявляет преимущественно дырочный характер переноса с небольшим вкладом ионной проводимости, что согласуется с данными анализа зависимости проводимости от рО2. При 600°С вклады дырочной и ионной проводимостей становятся сопоставимы, со снижением температуры суммарная ионная проводимость будет доминировать. Для протонной проводимости была оценена кажущая энергия активации, которая составила: Еакт(H+) = 0.34 эВ. Можно предполагать перенос протонов посредством прыжкового механизма Гротгуса, описанного для высокотемпературных протонных проводников [23], хотя энергия активации несколько занижена относительно типичного значения, равного 0.5 эВ. Занижение Еакт(H+) может объясняться тем, что в изученном температурном диапазоне происходит резкий рост концентрации протонных дефектов в структуре оксида (см. рис. 3б), что частично компенсирует снижение проводимости при уменьшении температуры.
Основываясь на представленных данных, можно заключить, что в сухой атмосфере сложный оксид Ba2InAlO5 является преимущественно дырочными проводником, а во влажной атмосфере в области температур ниже 600°С доминирующими становятся ионные носители при значимом вкладе протонного переноса.
ЗАКЛЮЧЕНИЕ
В настоящей работе твердофазным методом синтезирован сложный оксид Ba2InAlO5. Установлено, что его структура имеет тетрагональную симметрию, пр. гр. P4/mmm, 4.238(5) Å, c = = 7.768(4) Å, α = β = γ = 90°. При нагревании на 1400°С данная фаза разрушается с образованием фаз: BaAl2O4, Ba4In2O7 и Ba2In2O5. Доказана возможность внедрения воды в структуру Ba2InAlO5, максимальная степень гидратации составляет 0.12 моль Н2О на формульную единицу. Установлено, что значения общей электропроводности невысоки, в области средних температур во влажной атмосфере по сравнению с сухой проводимость возрастает: при 500°С σ = 3.4 × 10–6 Ом–1 см–1 (сухая атмосфера), σ = 6.7 × 10–6 Ом–1 см–1 (влажная атмосфера). Общая проводимость фазы Ba2InAlO5 имеет смешанный характер с существенным преобладанием электронного переноса дырочного типа в сухой атмосфере. Во влажной атмосфере ниже 600°С ионная проводимость начинает преобладать за счет появления вклада протонных носителей.
Список литературы
Hossain, Sh., Abdalla, A.M., Jamaina, S.N.B., Zaini, J., and Azad, A.K., A review on proton conducting electrolytes for clean energy and intermediate temperature-solid oxide fuel cells, Renewable and Sustainable Energy Rev., 2017, vol. 79, p. 750.
Shen, M., Ai, F., Ma, H., Xu, H., and Zhang, Y., Progress and prospects of reversible solid oxide fuel cell materials, iScience, 2021, vol. 24, no. 103464.
Fisher, C.A.J. and Islam, M.S., Defect, protons and conductivity in brownmillerite-structured Ba2In2O5, Solid State Ionics, 1999, vol. 118, p. 355.
Speakman, S.A., Richardson, J.W., Mitchell, B.J., and Misture, S.T., In situ diffraction study of Ba2In2O5, Solid State Ionics, 2002, vol. 149, p. 247.
Goodenough, J.B., Ruiz-Diaz, J.E., and Zhen, Y.S., Oxide-ion conduction in Ba2In2O5 and Ba3In2MO8 (M = Ce, Hf, or Zr), Solid State Ionics, 1990, vol. 44, p. 21.
Mazzei, L., Piccinelli, F., Bettinelli, M., Parker, S.F., and Karlsson, M., The effect of cation substitution on the local coordination of protons in Ba2In1.85M0.15O6H2 (M = In, Ga, Sc and Y), Solid State Ionics, 2021, vol. 365, no. 115624.
Zhang, G.B. and Smyth, D.M., Defects and transport of the brownmillerite oxides with high oxygen ion conductivity – Ba2In2O5, Solid State Ionics, 1995, vol. 82, p. 161.
Kochetova, N., Alyabysheva, I., and Animitsa I., Composite proton-conducting electrolytes in the Ba2In2O5–Ba2InTaO6 system, Solid State Ionics, 2017, vol. 306, p. 118.
Yao, T., Uchimoto, Y., Kinuhata, M., Inagaki, T., and Yoshida, H., Crystal structure of Ga-doped Ba2In2O5 and its oxide ion conductivity, Solid State Ionics, 2000, vol. 132, p. 189.
Спесивцева, И.В., Кочетова, Н.А., Горбунова, Е.М., Анимица, И.Е. Твердые растворы Ba2(In1 –xAlx)2O5: эволюция структуры и процессы гидратации. Журн. физ. химии. 2011. Т. 85. № 10. С. 1816. [Spesivtseva, I.V., Kochetova, N.A., Gorbunova, E.M., and Animitsa, I.E., Solid solutions of Ba2(In1 –xAlx)2O5: structural evolution and hydration processes, Russ. J. Phys. Chem. A, 2011. vol. 85, no. 10, p. 1689.]
Кочетова, Н.А., Спесивцева, И.В., Анимица, И.Е. Электрические свойства твердых растворов Ba2(In1 –xAlx)2O5. Электрохимия. 2013. Т. 49. С. 194. [Kochetova, N.A., Spesivtseva, I.V., and Animitsa, I.E., Electrical properties of Ba2(In1 –xAlx)2O5 solid solutions, Russ. J. Electrochem., 2013, vol. 49, p. 176.]
Анимица, И.Е., Кочетова, Н.А., Шайхлисламова, А.Р. Электрические свойства и термогравиметрия браунмиллеритов на основе оксидов бария. Электрохимия. 2007. Т. 43. С. 743. [Animitsa, I.E., Kochetova, N.A., and Shaikhlislamova, A.R., Electric and Thermogravimetric Properties of Brownmillerites Based on Barium Oxides, Russ. J. Electrochem., 2007, vol. 43, p. 708.]
Omata, T., Fuke, T., and Otsuka-Yao-Matsuo, Sh., Hydration behavior of Ba2Sc2O5 with an oxygen-deficient perovskite structure, Solid State Ionics, 2006, vol. 177, p. 2447.
Müller-Buschbaum, Hk. and Abed, M., Ein Beitrag zur Kristallstruktur von Ba2ScAlO5 und Sr2Sc0.5Al1.5O5, J. Alloys Compd., 1992, vol. 189, p. 127.
Didier, C., Claridge, J., and Rosseinsky, M., Crystal structure of brownmillerite Ba2InGaO5, J. Solid State Chem., 2014, vol. 218, p. 38.
Yao, T., Uchimoto, Y., Kinuhata, M., Inagaki, T., and Yoshida, H., Cristal structure of Ga-doped Ba2In2O5 and its oxide ion conductivity, Solid State Ionics, 2000, vol. 132, p. 189.
Yamamura, H., Hamazaki, H., Kakinuma, K., Mori, T., and Haneda, H., Order-disorder transition and electrical conductivity of the brownmillerite solid-solutions system Ba2(In,M)2O5 (M = Ga, Al), J. Korean Phys. Soc., 1999, vol. 35, p. 200.
Müller-Buschbaum, H. and Abed, M., Ba2InAlO5: Ein weiterer Strukturtyp bei Oxometallaten der Formel A2M2O5, Zeitschrift für anorganische und allgemeine Chemie, 1990, Bd. 591, Nr. 1, S. 174.
Горелов, В.П., Балакирева, В.Б. Протонный и дырочный перенос в Yb2O3 с добавкой CaO. Известия АН СССР. Неорган. материалы. 1990. Т. 26. № 1. С. 102. [Gorelov, V.P. and Balakireva, V.B., Proton and hole transfer in Yb2O3 with CaO addition, Izvestia Academii Nauk SSSR. Neorganicheskie Materialy (in Russian), 1990, vol. 26(1), p. 102.]
Norby, T., EMF method determination of conductivity contributions from protons and other foreign ions in oxides, Solid State lonics, 1988, vol. 28–30, p. 1586.
Iwahara, H., Oxide-ionic and protonic conductors based on perovskite-type oxides and their possible applications, Solid State lonics, 1992, vol. 52, p. 99.
Казенас, Е.К., Цветков, Ю.В. Испарение оксидов, М: Наука, 1997. 543 с. [Kazenas, E.K. and Tsvetkov, Y.V., Evaporation of oxides (in Russian), M.: Nauka, 1997. 543 p.]
Kreuer, K.-D., Fuchs, A., and Maier, J.H.D., Isotope effect of proton conductivity and proton conduction mechanism in oxides, Solid State Ionics, 1995, vol. 77, p. 157.
Дополнительные материалы отсутствуют.


