Электрохимия, 2022, T. 58, № 11, стр. 779-792
Электрохимические свойства катионных комплексов молекулярных контейнеров ряда кукурбитурилов
Е. В. Стенина a, *, Л. Н. Свиридова a, **
a Московский государственный университет им. М.В. Ломоносова, Химический факультет
Москва, Россия
* E-mail: estenina@yandex.ru
** E-mail: slianan@mail.ru
Поступила в редакцию 10.02.2022
После доработки 13.05.2022
Принята к публикации 23.05.2022
- EDN: DKIONR
- DOI: 10.31857/S042485702211010X
Аннотация
Представлены результаты исследования электрохимических свойств катионных комплексов супрамолекулярных кавитандов ряда кукурбит[n]урилов (CBns). На основании анализа комплекса систематических данных для этих соединений сформулированы основные особенности, характеризующие их адсорбционное поведение, в частности чрезвычайно высокая поверхностная активность и необычно широкая область потенциалов адсорбции, в пределах которой происходит трансформация структуры адсорбционного слоя при изменении величины и знака заряда электрода. Показано, что в рассматриваемых системах варьирование концентраций участвующих в реакции комплексообразования реагентов, а именно кавитанда и неорганического катиона, позволяет существенно изменять наблюдаемую картину адсорбционных явлений. Сравнительный анализ адсорбционных данных для систем, содержащих супрамолекулярные комплексы кукурбитурилов с различными катионами, может служить базой для качественной оценки их констант прочности. На примере систем, содержащих инклюзивные комплексы кавитанда СВ7 с органическим катионом (катион красителя 3,3′-диэтилтиокарбоцианин иодида) и с органическими молекулами (сверхпрочные комплексы с 1-гидроксиадамантаном и ферроценом, константы прочности K порядка 109–1010 М–1), установлено, что инклюдирование в полость кавитанда нейтральной органической молекулы не препятствует формированию эксклюзивного комплекса с катионом натрия и что подобный комплекс не образуется в присутствии в полости кавитанда органического катиона. На примере редокс-системы кобальтоцен(Сос)/кобальтоцений(Сос+), исследованной в растворе без и в присутствии СВ7, показано, что предшествующее электродному процессу формирование адсорбционного слоя из частиц супрамолекулярного комплекса Сос+ ⊂ СВ7 приводит к изменению скорости и механизма электронного переноса.
ВВЕДЕНИЕ
Семейство кукурбитурилов (CBns) представляет собой относительно новую группу молекулярных контейнеров. Первый член этого гомологического ряда был синтезирован более ста лет назад Р. Берендом и сотр. [1], однако лишь в 1981 г. Мок и сотр. установили его строение [2]. Начиная с этого времени наблюдается возрастающий интерес исследователей к этим соединением [3–5]. Уникальной особенностью этих тыквообразных (cucurbitaceae family) молекул является наличие двух одинаковых окаймленных карбонильными группами порталов и объемной гидрофобной полости. Подобное строение обеспечивает возможность одновременного комплексообразования этими кавитандами как неорганических катионов (за счет их взаимодействия с карбонильными группами порталов), так и органических ионов и молекул (путем их инклюдирования во внутримолекулярную полость). По существу кукурбитурилы представляют собой “строительные блоки” для супрамолекулярной химии, что определяет перспективность их использования в самых различных областях, включая медицину, биохимию и нанотехнологии. В настоящей работе обобщаются новые и полученные к настоящему времени данные по электрохимическим свойствам катионных комплексов кавитандов данной группы.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исследования проведены на электроде в виде стационарной Hg-капли путем измерения дифференциальной емкости электрода С в зависимости от потенциала Е и циклических вольтамперограмм (ЦВА) с использованием потенциостата-гальваностата Autolab с FRA-программой (Eco Chemie Netherlands) при частоте f = 370 Гц и амплитуде переменного напряжения 1 мВ. Потенциал электрода изменялся с шагом 20 мВ. Ртутная капля с площадью поверхности 0.015 см2 (определенной по весу нескольких капель) формировалась на конце конусовидного капилляра с внутренним диаметром 80 мкм с использованием специальной установки, входящей в полярографический анализатор PA-3 (Czechoslovakia). Потенциалы рабочего электрода измерялись (и приведены в статье) относительно насыщенного каломельного электрода. Величины емкости регистрировались при выдержке рабочего электрода в течение t = 3–35 с при каждом значении Е. Кукурбит[n]урилы (Aldrich), FcBF4, CocPF6 (Strem Chemicals, Inc.), Hg (Merсk) использовались без дополнительной очистки, соли фоновых электролитов: Na2SO4, K2SO4, Cs2SO4, дважды перекристаллизованы и прокалены при 500°С, вода очищалась на установке Millipor, растворы деаэрировали аргоном высокой чистоты. При измерениях ЦВА ток аргона поддерживался над раствором для минимизации рерастворения кислорода.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В литературе имеются лишь единичные данные по электрохимическому поведению кавитандов данного типа, причем полученные главным образом с использованием стеклоуглеродного электрода. Единственное систематическое исследование адсорбционных свойств катионных комплексов щелочных металлов с CBns на примере комплексов с катионом натрия было проведено в цикле работ [6–10]. В этих работах была установлена необычно широкая (~2 В) для органических соединений (в том числе катионов) область потенциалов адсорбции изученных супрамолекулярных комплексов. При этом была отмечена их чрезвычайно высокая поверхностная активность, о чем свидетельствует достижение предельных значений дифференциальной емкости при низких (10–4–5 × 10–6 М) концентрациях. Как правило, отрицательная граница области потенциала адсорбции для этих систем расположена вблизи потенциала, где начинается электровосстановление катиона фонового электролита, в то время как соответствующий положительный потенциал во многих случаях находится примерно на 700 мВ положительнее потенциала нулевого заряда ртути (ПНЗ) в электролите фона (–0.44 В отн. нас. к.э.). Очевидно, строение адсорбционных слоев, образующихся на электроде в растворах этих супрамолекулярных комплексов, при столь существенном изменении заряда электрода и его знака не может быть неизменным и должно трансформироваться при смещении потенциала электрода. Соответственно подобная структурная перестройка должна отражаться на измеряемых С,Е-зависимостях что иллюстрируется данными рис. 1–3. Впервые подобные эффекты для супрамолекулярных катионных комплексов CBns были обнаружены в упомянутом цикле исследований для комплексов катиона Na+. Как видно, область адсорбции состоит для этих систем из двух различных частей. Область I, отвечающая преимущественно отрицательным зарядам поверхности, характеризуется практической независимостью значений С от концентрации адсорбирующегося соединения (вплоть до значений порядка 10–5 М), а также времени выдержки потенциала t при каждом его значении, что свидетельствует об очень быстром формировании слоя адсорбата. Для области II, расположенной положительнее потенциала нулевого заряда электрода, закономерности существенно иные. Для этого участка области адсорбции характерно существенное изменение С,Е-зависимостей при изменении концентрации адсорбирующегося соединения и времени выдержки t (постоянство значений С достигается в этой области при t порядка 20–30 с). Это говорит об относительно медленном протекании процесса структурирования в адсорбционном слое. В ряде случаев при этом происходит образование некоторых устойчивых структур адсорбционного слоя, что отражается в появлении характерных ступенек на С,Е-зависимостях (рис. 1). Следует отметить, что чувствительность этих процессов к изменению вышеуказанных факторов (концентрация адсорбирующегося соединения и время t) существенно различается для противоположных направлений развертки потенциала. Именно это определяет наличие гистерезиса при сопоставлении соответствующих С,Е-зависимостей (врезки на рис. 1–3). По существу, причиной этого эффекта является совершенно различный характер процессов, протекающих в области II при противоположных направлениях развертки потенциала. При переходе I → II происходит перестройка изначально предельно заполненного слоя адсорбата и постепенная десорбция образующих его частиц. Напротив, при обратном направлении изменения потенциала в области II происходит постепенное заполнение поверхности электрода диффундирующими из раствора частицами с образованием на конечном этапе слоя с предельным заполнением адсорбатом. Вероятно, такое различие процессов формирования и приводит к различию в структуре адсорбционных слоев, сформированных при противоположных направлениях развертки, что в конечном счете и приводит к появлению гистерезиса. Резюмируя, можно сделать вывод, что причиной описанных особенностей адсорбционных явлений в области II служит различие в “прекурсорах” для формирования слоя адсорбата: при развертке к положительным значениям потенциала – это ранее сформированный прочный адсорбционный слой из комплексных частиц, при противоположном направлении – это частицы комплекса и свободного кавитанда, диффундирующие к поверхности электрода. Сходные явления были предсказаны, а затем экспериментально обнаружены при изучении двумерных конденсированных адсорбционных слоев органических соединений на электродах [11].
Рис. 1.
Экспериментальные C,E-зависимости Hg-электрода в 0.1 M Na2SO4 в присутствии 2.5 × 10–4 M CB6, полученные при сканировании потенциала (a) от отрицательных значений к положительным и (б) – в противоположном направлении при выдержке рабочего электрода при каждом значении Е в течение времени t, с: 2 (1), 5 (2), 10 (3), 20 (4), 30 (5). На врезке: C,E-зависимости для противоположных направлений сканирования потенциала при t = 30 с. Здесь и далее: пунктир – С,Е-зависимость в фоновом электролите.

Рис. 2.
Экспериментальные C,E-зависимости Hg-электрода в 0.1 M K2SO4 в присутствии 2.5 × 10–4 M CB6, полученные при сканировании потенциала (a) от отрицательных значений к положительным при выдержке рабочего электрода при каждом значении Е в течение времени t, с: 1 (1), 5 (2), 10 (3), 20 (4) и (б) – в противоположном направлении при выдержке рабочего электрода при каждом значении Е в течение времени t, с: 2 (1), 5 (2), 10 (3), 20 (4), 30 (5). На врезке: C,E-зависимости для противоположных направлений сканирования потенциала при t = 20 с.
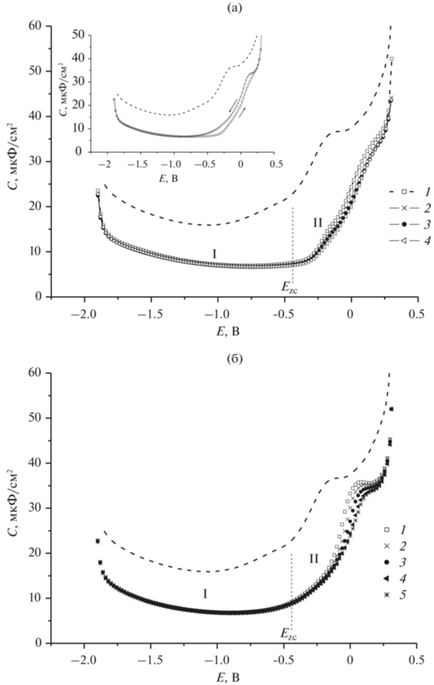
Рис. 3.
Экспериментальные С,Е-зависимости в 0.1 М Na2SO4 в присутствии CB7 в концентрации, М: 1 – 5 × 10–6, 2 – 1 × 10–5, 3 – 5 × 10–5, 4 – 1 × 10–4, 5 – 5 × 10–4, полученные при сканировании потенциала от отрицательных значений к положительным (a) и в противоположном направлении (б) при выдержке рабочего электрода при каждом значении Е в течение времени t = 30 с.

Что касается структуры, формируемых адсорбционных слоев, то очевидно, что в области I этот слой состоит из комплексных катионов. В области II благодаря действию электростатических сил наиболее благоприятные условия создаются для адсорбции свободных частиц кавитанда. Однако расчеты с использованием соответствующих констант комплексообразования (lgK) (3.49, 2.85 и 2.89 для комплексов Na+*СВ6, К+*СВ6 и Na+*СВ7 соответственно [12]) свидетельствуют, что для представленных на рис. 1–3 систем эти концентрации очень малы (10–6–10–8 М). Это позволяет предположить, что в образовании адсорбционного слоя в области II наряду со свободными частицами кавитанда могут участвовать и комплексные катионы, т.е. имеет место формирование смешанного адсорбционного слоя. Очевидно, что в таком случае форма С,Е-зависимостей и размеры этой области должны зависеть от концентрации свободных частиц кавитанда в системе, т.е. от прочности супрамолекулярных катионных комплексов и от состава раствора. Именно такие закономерности и проявляются при анализе представленных на рис. 1–3 данных. Для системы СВ6 + 0.1 М Na2SO4, содержащей наиболее прочный комплекс, характерно сужение области потенциалов адсорбции за счет смещения ее положительной границы к более отрицательным потенциалам и более резкое изменение С при потенциале этой границы (рис. 4). Для этой системы следует также отметить значительно более яркое проявление эффекта гистерезиса. Концентрация свободного кавитанда в растворе 2.5 × 10–4 М СВ6 + 0.1 М Na2SO4 (8.1 × 10–7 М СВ6), по всей вероятности, является слишком низкой, что делает невозможным существование смешанного адсорбционного слоя при потенциалах положительнее 0 В. В то же время при потенциалах отрицательнее 0 В в этом растворе такой слой образуется, о чем говорит наличие на С,Е-зависимостях в интервале примерно 200 мВ небольшой ступеньки, предельное значение С которой в 2 раза выше значений С, фиксируемых в широкой области адсорбции при еще более отрицательных потенциалах.
Рис. 4.
Экспериментальные С,Е-зависимости в растворе 2.5 × 10–4 М CB6 в присутствии 0.1 М Na2SO4 (1) и 0.1 M K2SO4 (2), полученные при сканировании потенциала от отрицательных значений к положительным (a) и в противоположном направлении (б) при выдержке рабочего электрода при каждом значении Е в течение времени t = 20 с.

В системе СВ7 + 0.1 М Na2SO4 формирование смешанного адсорбционного слоя наблюдается в широком интервале потенциалов при концентрациях СВ7, превышающих 5 × 10–6 М (рис. 3). Однако при более низких концентрациях свободного кавитанда (6.4 × 10–8 М СВ7 в растворе 5 × 10–6 М СВ7 + 0.1М Na2SO4) подобный эффект исчезает, поскольку эта концентрация кавитанда не обеспечивает необходимых для формирования смешанного адсорбционного слоя условий. При этом положительная граница области адсорбции, на которой наблюдается скачкообразное изменение С, резко смещается в сторону отрицательных потенциалов (Е ≈ –250 мВ). Таким образом, можно сделать вывод, что в системе СВ7 + Na2SO4 концентрация свободного лиганда порядка 10–7 М СВ7 является критической для формирования смешанного адсорбционного слоя из супрамолекулярных катионных комплексов и свободных молекул кавитанда, и при концентрациях, меньших критической, должны наблюдаться только процессы адсорбции/десорбции супрамолекулярных комплексов Na+*СВ7. При этом положительная граница области адсорбции этих комплексов должна отвечать Е ≈ –250 мВ.
В пользу этого предположения свидетельствуют и данные рис. 5, где представлены С,Е-зависимости в системе СВ7 + х М Na2SO4, где регулирование концентрацией свободного кавитанда осуществляется путем изменения концентрации фонового электролита. Очевидно, рост концентрации катиона Na+ на два порядка с 10–2 до 1 М позволяет уменьшить область потенциалов существования адсорбционного слоя примерно на 550 мВ. Как видно, в растворе 10–4 М СВ7 + 1 М Na2SO4, по всей вероятности, вообще не происходит формирование смешанного адсорбционного слоя: при этом отсутствует присущая процессу формирования смешанного адсорбционного слоя зависимость от времени выдержки потенциала t, а положительная граница области адсорбции, как и в растворе 5 × 10–6 М СВ7 + 0.1 М Na2SO4, Е ≈ –250 мВ и обозначает положительную границу существования слоя адсорбата из супрамолекулярных комплексов Na+*СВ7 в системе СВ7 + + Na2SO4 (рис. 6). При этом форма С,Е-зависимостей в области положительной границы области адсорбции близка к наблюдавшейся при двумерной конденсации нейтральных органических соединений и характеризуется резким, почти скачкообразным переходом от значений С, отвечающих предельному заполнению поверхности слоем адсорбата, до значений, соответствующих его отсутствию. Очевидно, это вызвано существенным снижением концентрации свободного кавитанда (1.3 × 10–7 М) в растворе 10–4 М СВ7 + + 1 М Na2SO4 по сравнению с системами с более низкими (10–2–0.5 М) концентрациями сульфата натрия (2.3 × 10–7–1.2 × 10–5 М СВ7). Это подтверждает высказанное выше предположение об исчезновении эффекта формирования смешанного адсорбционного слоя в системе СВ7 + Na2SO4 при концентрациях свободного кавитанда порядка 10–7 М. Это характерное для данной системы критическое значение может достигаться как снижением концентрации СВ7, так и увеличением концентрации Na2SO4.
Рис. 5.
Экспериментальные С,Е-зависимости в растворе 1 × 10–4 М CB7 в присутствии х М Na2SO4. x (М): 1 – 1, 2 – 0.5, 3 – 0.3, 4 – 0.1, 5 – 0.01, полученные при сканировании потенциала от отрицательных значений к положительным (а) и в противоположном направлении для х ( М): 1 – 1, 2 – 0.5, 3 – 0.1, 4 – 0.01 (б) при выдержке рабочего электрода при каждом значении Е в течение времени t = 30 с.

Рис. 6.
Экспериментальные С,Е-зависимости в растворе 1 × 10–4 М CB7 в присутствии 1 М Na2SO4, полученные при сканировании потенциала от отрицательных значений к положительным (а) и в противоположном направлении (б) при различном времени t выдержки электрода при каждом значении Е. t, с: 1 – 3, 2 – 5, 3 – 10, 4 – 20.

Таким образом, в рассматриваемых системах варьирование концентраций участвующих в реакции комплексообразования реагентов, а именно кавитанда и неорганического катиона, позволяет существенно изменять наблюдаемую картину адсорбционных явлений. В условиях, когда концентрация свободных молекул кавитанда превышает некоторое критическое для каждой системы значение, становится возможным формирование смешанного адсорбционного слоя из этих частиц и супрамолекулярных катионных комплексов. Характерные особенности С,Е-зависимостей определяются при этом прочностью супрамолекулярных катионных комплексов. В частности, анализ проявления эффекта гистерезиса (врезки на рис. 1–3) свидетельствует, что значительно ярче этот эффект проявляется в случае более прочного комплекса Na+*СВ6 (lg K = = 3.49). Очевидно причиной этого является более низкая по сравнению с другими системами концентрация свободного кавитанда в растворе, что замедляет формирование смешанного адсорбционного слоя с его участием при диффузионном контроле процесса адсорбции. Наблюдаемое различие С,Е-зависимостей для отличающихся по прочности комплексов катионов с одним и тем же кавитандом иллюстрируется данными рис. 4.
Таким образом, как следует из приведенных результатов, сравнительный анализ адсорбционных данных в системах, содержащих супрамолекулярные катионные комплексы кукурбитурилов, может служить базой для качественной оценки их констант прочности. Сужение области потенциалов адсорбции, наличие более резкого изменения значений дифференциальной емкости при потенциалах, отвечающих ее положительной границе, более яркое проявление эффекта гистерезиса при сопоставлении данных для противоположных направлений развертки потенциала могут, по всей вероятности, свидетельствовать о бóльшей прочности супрамолекулярного комплекса.
Сопоставление данных по адсорбции супрамолекулярных комплексов ряда катионов щелочных металлов с СВ7 (рис. 7) приводит к выводу об их относительно низкой прочности, поскольку не проявляется ни один из вышеперечисленных признаков. Согласно [12], для Na+*СВ7 lg K = = 2.89. Вероятно, очень близкое значение имеет lgK для комплекса К+*СВ7, поскольку практически совпадают С,Е-зависимости, измеренные в содержащих эти комплексы системах. Определенное заметное отличие С,Е-зависимости в области формирования смешанного адсорбционного слоя (более низкие значения емкости) для системы, содержащей Cs+*СВ7, возможно свидетельствует о более низком значении lg K для этого комплекса по сравнению с двумя вышеупомянутыми.
Рис. 7.
Экспериментальные С,Е-зависимости в растворе 1 × 10–4 М CB7 в присутствии 0.1 М Me2SO4: Na2SO4 (1), K2SO4 (2), Cs2SO4 (3), полученные при сканировании потенциала от отрицательных значений к положительным (а) и в противоположном направлении (б) при выдержке рабочего электрода при каждом значении Е в течение времени t = = 30 с.

Представляло интерес провести аналогичные исследования в системах, где наряду с кавитандами одновременно присутствуют частицы, способные к образованию с ними как экс-, так и инклюзивных комплексов. Известно, что сверхпрочные инклюзивные комплексы с СВ7 образуют производные адамантана и ферроцена, величина K для которых достигает значений порядка 1014, 1015 М–1 [13]. Для инклюзивного комплекса 1-гидроксиадамантана (адамантанол, AdOH) c CB7 (СВ7 ⊂ AdOH) K = 2.8 × 1010 M–1 [13], для соответствующего комплекса с ферроценом (Fc) эта величина должна быть близка к найденной для гидроксиметилферроцена (K = 3 × × 109 M–1) [14]. Очевидно, при столь высоких значениях этих величин в растворах практически должны отсутствовать свободные частицы кавитанда. Представляло интерес выяснить, каким образом в подобных системах происходит (не происходит?) взаимодействие нейтральных инклюзивных супрамолекулярных комплексов с неорганическими катионами. На рис. 8 приведены данные для раствора Na2SO4 в присутствии AdOH и в таком же растворе с добавкой эквимолярного количества СВ7. Как видно, С,Е-зависимости в растворах без и в присутствии AdOH различаются незначительно, что позволяет сделать вывод о том, что инклюдирование в полость кавитанда молекулы AdOH не препятствует формированию эксклюзивного комплекса с катионом натрия. Совершенно очевидно, что область потенциалов адсорбции такого тройного комплекса (Na+*СВ7 ⊂ AdOH) также состоит из двух участков. Что касается формирования смешанного адсорбционного слоя в области положительных потенциалов, то безусловно, исходя из высокой прочности комплекса СВ7 ⊂ AdOH и, соответственно, практического отсутствия в растворе свободных молекул СВ7, необходимо заключить, что в формировании слоя адсорбата при этих потенциалах наряду с тройными катионными комплексами участвуют исключительно нейтральные комплексы СВ 7⊂ AdOH. Возможно этим объясняется некоторое различие в области II для С,Е-зависимостей, измеренных в растворах с добавкой AdOH и без нее. Близкие данные были получены для системы, содержащей тройной комплекс Na+*СВ7 ⊂ Fc [10]. Для этой системы С,Е-зависимости в области II для растворов, содержащих комплекс СВ7 ⊂ Fc и в его отсутствие, различаются несколько больше.
Рис. 8.
Экспериментальные С,Е-зависимости в 0.1 M Na2SO4 в присутствии AdOH (1), CB7 (2), CB7 + AdOH (3) в концентрации 2.5 × 10–4 M для t = 20 с.

Включение в гидофобную полость кавитанда органического катиона очевидно должно препятствовать образованию эксклюзивного комплекса с неорганическим катионом, т.е. формированию тройных комплексов. В [10] были исследованы адсорбционные явления в системе, содержащей СВ7 и оргaнический краситель 3,3′-диэтил тиокарбоцианин иодид (DEC). Катион этого органического красителя образует с СВ7 прочный супрамолекулярный комплекс с lg K = 4.45 [15]. Как установлено в [10], форма С,Е-зависимостей при сканировании к положительным потенциалам (наличие ступеньки перед скачком С при десорбции) и область адсорбции этого инклюзивного катионного комплекса (ее положительная граница ~0 В) близки к обсужденным выше характеристикам для наиболее прочного из изученных экслюзивного комплекса Na+*СВ6.
Отдельный интерес представляет изучение электрохимического поведения электроактивных супрамолекулярных катионных комплексов и выявление влияния их адсорбции на процесс переноса электрона (ET). В [16] для ряда супрамолекулярных комплексов производных ферроцена с СВ7 было установлено, что электровосстановление (ЭВ) этих соединений на электроде из стеклоуглерода происходит без разрушения комплекса, путем прямого переноса электрона к электроактивной частице, локализованной внутри кукурбитурильного каркаса. В плане выявления роли адсорбционных процессов особый интерес представляют полученные на ртутном электроде данные, поскольку на твердых электродах адсорбция СВns протекает чрезвычайно медленно [17]. В [18] проводилось комплексное исследование с использованием модельного ртутного и стеклоуглеродного электродов электрохимических свойств комплексов катионов кобальтоцения и ферроцения с СВ7 (Сос+ ⊂ СВ7 и Fc+ ⊂ CB7), значения K для которых 5.71 × 109 М–1 [19] и 7.0 × × 109 М–1 [18] соответственно. В [18] установлено, что для Fc+ ⊂ CB7 процессы адсорбции и электровосстановления на ртутном электроде начинаются одновременно при потенциале, отвечающем положительной границе области адсорбции этого комплекса. Это не позволяет выявить роль адсорбции, поскольку все доставляемые к поверхности электрода частицы участвуют в электрохимической реакции без предварительного формирования слоя адсорбата.
На рис. 9 приведены С,Е-зависимости и циклические вольтамперограммы (ЦВА) для раствора 10–4 M СосPF6 + 0.1 М Na2SO4 и для этого раствора в присутствии 10–4 M СВ7. Как следует из данных рис. 9а, в случае системы, содержащей комплекс Сос+ ⊂ СВ7, имеет место предшествующее электродному процессу формирование из этих частиц адсорбционного слоя с предельным заполнением в интервале 0.2…–0.8 В (кривая 1). Значительно более низкая адсорбируемость и в более узком интервале потенциалов наблюдается для катиона Сос+, что связано с отсутствием эффективного экранирования его заряда каркасом кавитанда (кривая 3). При дальнейшем смещении потенциала к отрицательным значениям начинается рост емкости, связанный с началом ЭВ этого катиона с образованием нейтрального комплекса кобальтоцена с СВ7, и при Е = –1.2 В наблюдается соответствующий этому процессу пик псевдоемкости. Как видно, в отсутствие СВ7 (рис. 9б) токи существенно выше и наблюдается небольшое искажение анодного пика, вероятно связанное с воздействием нерастворимого кобальтоцена. Для реакции Сос+ ⊂ СВ7 + е ↔ Сос ⊂ СВ7 (рис. 9в), оба участника которой растворимы, этот эффект отсутствует. В отсутствие СВ7 значения разности потенциалов катодного и анодного пиков ∆ЕP = 87 мВ, в присутствии СВ7 ∆ЕP значительно возрастает (139 мВ), оставаясь практически неизменным во всем исследованном интервале скоростей развертки потенциала v, что отвечает снижению скорости реакции ЭВ комплекса Сос+ ⊂ СВ7. При комплексообразовании также происходит сдвиг Е1/2 в катодную сторону (–80 мВ), что свидетельствует о падении прочности комплекса при переходе из катионной в нейтральную форму. Было показано, что в отсутствие СВ7 зависимость тока катодного пика $I_{{\text{К}}}^{{\text{p}}}$ от v1/2 для ЭВ катиона Сос+ хорошо описывается уравнением Рэндлса–Шевчика для контролируемого диффузией процесса переноса электрона. Анализ данных по ЭВ супрамолекулярного катиона Сос+ ⊂ СВ7 показал, что эти экспериментальные данные не могут быть описаны в предположении о диффузионном контроле электронного переноса, но хорошо описываются уравнением Рэндлса–Шевчика для замедленного переноса электрона в предположении, что коэффициент переноса заряда α = 0.5. Поскольку в реакции ЭВ комплекса Сос+ ⊂ СВ7 участвуют адсорбированные частицы, была предпринята попытка использовать уравнения, предложенные в работе Лавирона для случая необратимого протекания реакций ЭВ адсорбированных частиц [20], что также позволило удовлетворительно описать данные по ЭВ этого супрамолекулярного катиона. Таким образом, инкапсулирование разряжающейся частицы в каркас кавитанда приводит к существенному изменению механизма реакции. В [20] предполагается, что подобный эффект роста энергетического барьера для переноса электрона в присутствии адсорбционного слоя реактанта на поверхности электрода может быть обусловлен влиянием сил межмолекулярного взаимодействия в этом слое.
Рис. 9.
Экспериментальные C,E-зависимости Hg-электрода в 0.1 M Na2SO4 (а) в присутствии 10–4 M комплексов Coc+ ⊂ СВ7 (1), Fc ⊂ СВ7 (2), и 10–4 M Coc+ (3). ЦВА в 0.1 M Na2SO4 в присутствии: 10–4 M Coc+ (б) и 10–4 M комплекса Coc+ ⊂ СВ7 (в); скорости сканирования: 5–1000 мВ/с (б) и 20–1500 мВ/с (в).

Для ряда изученных систем массивы экспериментальных данных были обработаны [6–10] с использованием созданного в работах Б.Б. Дамаскина и сотр. регрессионного метода, с целью получения количественных характеристик формирующихся двумерных структур – их адсорбционных параметров (потенциал максимальной адсорбции φm; логарифм константы адсорбционного равновесия ln Bm; параметр межмолекулярного взаимодействия am; емкость Сm при θ = 1; параметр А = RTΓm, где Γm – поверхностная концентрация органического вещества при θ = 1) [21].
Вследствие выявленного резкого различия адсорбционных явлений для областей I и II эти расчеты проводились отдельно для этих участков. Установлено, что значение предельной адсорбции для области I примерно в 2 раза выше, чем для области II. Это свидетельствует о формировании при отрицательных зарядах поверхности бислойной структуры из супрамолекулярных катионов. Подобные структуры были обнаружены на золоте в [17] для системы СВ7 + Na2SO4 (в отсутствие сульфата натрия этот эффект не наблюдался). Подобная структура может быть сформирована за счет одновременного связывания катионом натрия двух молекул кавитанда, одна из которых находится на поверхности электрода, а другая ориентирована в сторону раствора. Полученные значения адсорбционного сдвига потенциала противоположны по знаку для областей I и II: положительное значение этого параметра для области I свидетельствует об адсорбции катиона, противоположная по знаку величина этого сдвига для области II определяется ориентацией частиц адсорбата карбонильными группами к поверхности электрода. Для области I характерны высокие положительные значения аттракционной постоянной в изотерме Фрумкина, приближающиеся в ряде случаев к критическому значению a = 2. Показано, что рассчитанные с использованием полученных значений С,Е-зависимости удовлетворительно описывают экспериментальные данные.
ЗАКЛЮЧЕНИЕ
Анализ полученных к настоящему времени данных по электрохимическим свойствам супрамолекулярных катионных комплексов кавитандов ряда кукурбитурилов выявляет многообразие наблюдаемых для этих систем явлений. Варьирование состава раствора и изменение потенциала электрода позволяют изменять условия формирования адсорбционных слоев, что влияет на их структуру и свойства. Общим свойством изучаемых супрамолекулярных комплексов является способность адсорбироваться в очень широком интервале потенциалов, на разных участках которого могут формироваться слои адсорбата различного строения: в области отрицательных потенциалов – это бислойные структуры из катионных комплексов, при смещении в положительную область потенциалов – смешанные адсорбционные слои из супрамолекулярных комплексов и молекул кавитанда. При очень низких концентрациях кавитанда в растворе (малые значения общей его концентрации или высокие концентрации неорганического электролита) исчезают условия для формирования смешанного адсорбционного слоя, и на электроде образуется только слой адсорбата из частиц катионного комплекса, адсорбционное поведение которого напоминает наблюдаемое при двумерной конденсации органических соединений на электродах. Поскольку общая картина адсорбционных явлений в этих системах зависит от концентрации свободных частиц кавитанда в растворе, то есть от прочности супрамолекулярных комплексов, сравнительный анализ данных для комплексов различных катионов дает возможность качественно оценивать этот параметр. Наличие в полости кавитанда нейтральной органической молекулы не препятствует одновременному комплексообразованию с неорганическим катионом, в случае инклюзивного комплекса с органическим катионом подобный процесс не происходит. Формирование адсорбционного слоя из частиц электроактивного супрамолекулярного комплекса, предшествующее его электровосстановлению, приводит к изменению скорости и механизма электродной реакции.
Список литературы
Behrend, R., Meyer, E., and Rusche, F., Über Condensationsproducte aus Glicoluril und Formaldehyd, Justus Liebigs Ann. Chem., 1905, Bd. 339, S. 1.
Freeman, A., Mock, W.L., and Shih, N.Y., Cucurbituril, J. Am.Chem. Soc., 1981, vol. 103, no. 24, p. 7367.
Masson, E., Ling, X., Joseph, R., Kyeremeh-Mensah, L., and Lu, X., Cucurbituril Chemistry: a tale of supramolecular success, RSC Advances, 2012, vol. 2, p. 1213.
Khaleel, I., Assaf, Kh.I., and Nau, W.M., Cucurbiturils: from synthesis to high-affinity binding and catalysis, Chem. Soc. Rev., 2015, vol. 44, p. 394.
Герасько, О.А., Коваленко, Е.А., Федин, В.П. Макроциклические кавитанды кукурбит[n]урилы: перспективы применения в биохимии, медицине и нанотехнологиях. Успехи химии. 2016. Т.85. С.795. [Gerasko, O.A., Kovalenko, E.A., and Fedin, V.P., Macroscopic cavitands cucurbit[n]urils: perspectives of application in biochemistry, medicine and nanotechnologies, Russ. Chem. Rev., 2016, vol. 85, p. 795.]
Stenina, E.V. and Sviridova, L.N., Characteristics of the cucurbit[5]uril adsorption layer on the electrode/solution interface, Mendeleev. Commun., 2015, vol. 25, p. 59.
Stenina, E.V., Sviridova, L.N., and Ivanov, D.A., Adsorption of cucurbit[6]uril on the electrode/solution interface, Mendeleev. Commun., 2016, vol. 26, p. 410.
Стенина, Е.В., Свиридова, Л.Н., Петров, Н.Х. Адсорбционные явления в системах, содержащих макроциклический кавитанд кукурбит[7]урил. Электрохимия. 2017. Т. 53. С. 114. [Stenina, E.V., Sviridova, L.N., and Petrov, N.Kh., Adsorption Phenomena in the Systems Containing Macrocyclic Cavitand Cucurbit [7]uryl, Russ. J. Electrochem., 2017, vol. 53, p. 103.]
Stenina, E.V., Sviridova, L.N., and Petrov, N.Kh., Properties of cucurbit[8]uril adsorption layer on the electrode/solution interface, Mendeleev. Commun., 2018, vol.28, p. 281.
Stenina, E.V. and Sviridova, L.N., Adsorption phenomena in systems containing complexes of cucurbit[7]uril with organic compounds, J. Electroanal. Chem., 2019, vol. 833, p. 47.
Frumkin, A.N. and Damaskin, B.B., Adsorption of organic compounds, in Modern Aspects of Electrochemistry, Bocris, J. and Conway, B., Eds., London: Butterworths, 1964, vol. 3, p. 149. [Фрумкин, А.Н., Дамаскин, Б.Б. Адсорбция органических соединений на электродах. В кн: Современные аспекты электрохимии, под. ред. Дж. Бокриса и Б. Конуэя, пер. с англ., М.: Мир, 1967, с. 170.]
Lu, X. and Masson, A.E., Formation and Stabilization of Silver Nanoparticles with Cucurbit[n]urils (n = 5–8) and Cucurbituril-Based Pseudorotaxanes in Aqueous Medium, Langmuir, 2011, vol. 27, no. 6, p. 3051.
Moghaddam, S., Yang, Ch., Rekharsky, M., Ho Ko, Y., Inoue, Y., Kim, K., and Gilson, M.K., New Ultrahigh Affinity Host-Guest Complexes of Cucurbit[7]uril with Bicyclo[2.2.2]octane and Adamantane Guests: Thermodynamic Analysis and Evaluation of M2 Affinity Calculations, J. Am. Chem. Soc., 2011, vol. 133, p. 3570.
Lu, Cui, Suresh, Gadde, Wei, Li, and Kaifer, A.E., Electrochemistry of the Inclusion Complexes Formed Between the Cucurbit[7]uril Host and Several Cationic and Neutral Ferrocene Derivatives, Langmuir, 2009, vol. 25, p. 13763.
Petrov, N.Kh., Ivanov, D.A., Golubkov, D.V., Gromov, S.P., and Alfimov, M.V., The effect of cucurbit[7]uril on photophysical properties of aqueous solution of 3,30-diethylthiacarbocyanine iodide dye, Chem. Phys. Lett., 2009, vol. 480, p. 96.
Ong, W. and Kaifer, A.E., Unusual Electrochemical Properties of the Inclusion Complexes of Ferrocenium and Cobaltocenium with Cucurbit[7]uril, Organometallics, 2003, vol. 22, p. 4181.
Freitag, M. and Gallopini, E., Cucurbituril Complexes of Viologens Bound to TiO2 Films, Langmuir, 2010, vol. 26, p. 8262.
Stenina, E.V., Sviridova, L.N., Krivenko, A.G., Kochergin, V.K., and Manzhos, R.A., Electrochemistry of the inclusion complexes of metallocene derivatives with cucurbit[7]uril on glassy carbon and mercury electrodes, J. Electroanal. Chem., 2021, vol. 901. https://doi.org/10.1016/j.jelechem.2021.115746
Sobransingh, D. and Kaifer, A.E., New Dendrimers Containing a Single Cobaltocenium Unit Covalently Attached to the Apical Position of Newkome Dendrons: Electrochemistry and Guest Binding Interactions with Cucurbit[7]uril, Langmuir, 2006, vol. 22, no. 25, p. 10540.
Laviron, E., Adsorption, autoinhibitionandautocatalysis in polarography andin linear potential sweep voltammetry, J. Electroanal. Chem., 1974, vol. 52, p. 355.
Дамаскин, Б.Б., Сафонов, В.А., Батурина, О.А. Статистический метод определения адсорбционных параметров простых органических соединений из неравновесных кривых дифференциальной емкости. Электрохимия. 1997. Т. 33. С. 117. [Damaskin, B.B., Safonov, V.A., and Baturina, O.A., Statistical Method of Determining Adsorption Parameters for Simple Organic Compounds from Nonequilibrium Differential Capacitance Curves, Russ. J. Electrochem., 1997, vol. 33, p. 105.]
Дополнительные материалы отсутствуют.


