Электрохимия, 2022, T. 58, № 11, стр. 756-765
К вопросу об электрохимической активности редокс-пары Ni2+/Ni3+ в полианионных катодных материалах различных структурных типов
О. А. Дрожжин a, b, *, А. М. Алексеева a, О. А. Тябликов b, А. П. Маренко a, Е. В. Антипов a, b
a Московский государственный университет им. М.В. Ломоносова, Химический факультет
Москва, Ленинские горы, 1, стр. 3, Россия
b Сколковский институт науки и технологии
Москва, Большой бул., 30, стр. 1, Россия
* E-mail: drozhzhin@hotmail.com
Поступила в редакцию 07.02.2022
После доработки 19.04.2022
Принята к публикации 30.04.2022
- EDN: JCHRFZ
- DOI: 10.31857/S0424857022110056
Аннотация
В статье рассмотрены электрохимические свойства никельсодержащих полианионных катодных материалов металл-ионных аккумуляторов, кристаллизующихся в трех структурных типах: оливин, NASICON и α-CrPO4. В качестве объектов исследования выбраны: LiFe0.5Ni0.5PO4 (оливин), Na1 + 2xNixZr2 –x(PO4)3 (NASICON), а также Na2Ni2Cr(PO4)3 и Na2Ni2Al(PO4)3 (α-CrPO4). Образцы получены различными методами синтеза, исследован их фазовый состав, кристаллическая структура и морфология. Показано, что материалы на основе LiFe0.5Ni0.5PO4 и Na1 + 2xNixZr2 –x(PO4)3 претерпевают необратимые структурные изменения в ходе первого заряда, что сопровождается набором существенной необратимой электрохимической емкости (~70−100 мА ч г–1). При циклировании Na2Ni2Cr(PO4)3 и Na2Ni2Al(PO4)3 в натриевой полуячейке электрохимическую активность проявляет только редокс-пара Cr3+/Cr4+. В работе обсуждается взаимосвязь структурных особенностей исследованных соединений и их электрохимических свойств.
ВВЕДЕНИЕ
Впечатляющий успех литий-ионной технологии, захватывающей все новые рынки и ниши применения, стал возможен во многом благодаря значительному приросту в энергоемкости ячеек, не в последнюю очередь связанному с их высоким рабочим напряжением. Применение LiCoO2 в качестве катодного материала позволило увеличить этот параметр втрое по сравнению с предыдущими электрохимическими системами, основанными на водных электролитах (~3.7 против ~1.2 В) [1]. Таким образом, литий-ионные аккумуляторы (ЛИА) являются наиболее высоковольтными из когда-либо разрабатываемых электрохимических систем. Дальнейшее повышение потенциала катода может дать новый импульс для развития ЛИА и родственных технологий (в первую очередь – натрий-ионных аккумуляторов, НИА) [2–5].
На сегодняшний день наиболее распространенные катодные материалы ЛИА являются производными сложного оксида LiNiO2 при частичном замещении никеля на другие переходные и/или непереходные металлы. В так называемых NMC- и NCA-оксидах, имеющих состав Li(Ni,Mn,Co)O2 и Li(Ni,Co,Al)O2 соответственно, доля никеля в позициях переходного металла составляет 80−90% [3, 6]. Основным активным катионом в этих соединениях выступает Ni2+, который в ходе заряда окисляется до Ni4+, обеспечивая рабочее окно потенциалов ~2.8−4.3 В отн. Li/Li+. Наиболее высокие рабочие потенциалы в катодных материалах ЛИА и НИА могут быть достигнуты для так называемых “полианионных” соединений, родоначальником которых можно считать LiFePO4 со структурой оливина [7]. Индуктивный эффект анионных групп (${\text{PO}}_{4}^{{3 - }}{\text{,}}$ ${\text{SO}}_{4}^{{2 - }}{\text{,}}$ ${\text{SiO}}_{4}^{{4 - }},$ ${{{\text{P}}}_{{\text{2}}}}{\text{O}}_{7}^{{4 - }}{\text{,}}$ ${\text{BO}}_{3}^{{3 - }}$ и т.д.) приводит к повышению редокс-потенциала пар Mn+/Mn + 1 на 1−3 В по сравнению с потенциалом оксидных или сульфидных материалов [7–15]. Рекордные значения потенциала характерны для никельсодержащих полианионных соединений. Однако в большинстве случаев данное утверждение носит характер теоретической оценки, поскольку потенциал пары Ni2+/Ni3+ для многих полианионных материалов превышает 5.0 В отн. Li/Li+, в отличие от ранее упомянутых оксидных катодов. Это приводит к серьезным проблемам при экспериментальном исследовании материалов из-за необратимого окисления используемых электролитов [16–20]. Единственным никель-содержащим полианионным материалом, для которого была достоверно продемонстрирована обратимая (де)интеркаляция катионов щелочного металла, является фосфато-пирофосфат Na4Ni3(PO4)2P2O7, хотя и в этом случае наблюдается высокий вклад процесса окисления электролита в общую зарядную емкость ячейки [21]. Для решения этой проблемы проводят модификацию электролита путем использования более стойких к окислению растворителей, добавления интерфейс-формирующих компонентов или путем повышения концентрации соли [22–25]. Кроме того, продолжается активный поиск новых никельсодержащих материалов, имеющих стабильный анионный каркас и достаточно низкие энергетические барьеры для диффузии катионов щелочных металлов.
В настоящей статье представлены результаты работы по получению и исследованию никельсодержащих полианионных катодных материалов, кристаллизующихся в трех структурных типах: LiFe0.5Ni0.5PO4 (структурный тип оливина), Na1 + 2xNixZr2 − x(PO4)3 (NASICON), а также Na2Ni2Cr(PO4)3 и Na2Ni2Al(PO4)3 (α-CrPO4).
ЭКСПЕРИМЕНТ
Синтез материалов
В ходе работ использованы реагенты производства компании Sigma Aldrich (≥99.9%). Содержание воды в кристаллогидратах солей переходных металлов определяли термогравиметрическим анализом.
LiFe0.5Ni0.5PO4. Образцы LiFe0.5Ni0.5PO4 получали сольвотермальным методом с использованием LiOH, H3PO4, а также кристаллогидратов сульфатов FeSO4·7H2O и NiSO4·6H2O в качестве источников переходных металлов. Синтез проводили путем смешивания сульфатов железа и никеля c фосфорной кислотой с последующим введением в реакционную смесь гидроксида лития. Детальное описание и постадийное исследование использованного метода синтеза представлено в ранее опубликованных работах [26, 27]. Длительность сольвотермальной обработки варьировали в пределах 3−12 ч, температуру – от 190 до 250°С. Для получения проводящего углеродного покрытия полученные образцы LiFe0.5Ni0.5PO4 смешивали с источником углерода (глюкозой) и отжигали при температуре 650°С в течение 5 ч в токе аргона.
Na3NiZr(PO4)3. Синтез сложного фосфата никеля и циркония Na3NiZr(PO4)3 был впервые опубликован в [28]. Получение порошкообразного образца проводили золь–гель-методом с дальнейшим двухстадийным отжигом. В качестве исходных реагентов использовали ZrOCl2·8H2O, Ni(NO3)2·6H2O, Na2CO3 и NH4H2PO4. На первом этапе синтеза оксохлорид циркония и нитрат никеля растворяли при активном перемешивании в минимальном количестве дистиллированной воды при 80°С в стакане объемом 50 мл. Карбонат натрия и дигидрофосфат аммония растворяли в 1.5−2 мл концентрированной азотной кислоты, а затем приливали к раствору оксохлорида циркония и нитрата никеля. Полученный раствор переливали в фарфоровую чашку объемом 100−200 мл и упаривали на воздухе при 80°С до полного испарения растворителя. Фарфоровую чашку охлаждали, остаток переносили в агатовую ступку и перетирали в течение 5−10 мин. После этого полученный образец отжигали на воздухе при температуре 350°C в течение 3 ч и при 750°C в течение 7 ч с промежуточным помолом в планетарной мельнице Fritsch Pulverisette 7 Сlassic line со скоростью 300 об./мин в течение 1.5 ч.
Na2Ni2Cr(PO4)3 и Na2Ni2Al(PO4)3. Для синтеза образцов Na2Ni2Cr(PO4)3 и Na2Ni2Al(PO4)3 использовали золь–гель-метод. Стехиометрические количества NaNO3, Ni(NO3)2·6H2O, Cr(NO3)3·9H2O, Al(NO3)3·8H2O и NH4H2PO4 растворяли в 30 мл воды. К полученному раствору добавляли водный раствор цитрата аммония, и путем добавления раствора аммиака доводили pH до 7 (±0.2). На следующем этапе в реакционную смесь вводили акриламид и N-метилен-бис-акриламид, после чего перемешивали в течение 30 мин. Затем раствор нагревали до 85−90°C и добавляли несколько капель H2O2 для инициирования процесса радикальной полимеризации с последующим гелеобразованием. Полученный гель отжигали на воздухе при температуре 600°C в течение 6 ч, после чего измельчали в планетарной мельнице и еще раз отжигали в течение 1 ч при температуре 650°C в случае Na2Ni2Cr(PO4)3 и при 850°C в случае Na2Ni2Al(PO4)3.
Характеризация материалов
Порошковые рентгеновские дифракционные данные для поликристаллических образцов и электродов получали при комнатной температуре с использованием дифрактометра Panalytical Aeris Research (излучение СuKα, геометрия Брегга–Брентано, PiXCel детектор, интервал съемки 2θ ~ ~ 3.000°−120.000°, шаг 0.005°), камеры Гинье высокого разрешения (Image Plate Huber G670, излучение CuKα1, Ge(111) монохроматор, угловой диапазон 2θ ~ 3.000−100.300°, шаг 0.005°), а также дифрактометра STOE STADI P (излучение CoKα1, Ge(111) монохроматор, угловой диапазон 2θ ~ ~ 3.000°−100.300°, шаг 0.01°, линейный PSD-детектор). Для обработки данных порошковой рентгеновской дифракции применяли комплекс программ STOE WinXPow [29] и JANA2006 [30], базы данных PDF-2+ [31] и PDF-4+ [32].
Исследование морфологии образцов проводили методом сканирующей электронной микроскопии (СЭМ) с использованием растрового электронного микроскопа JEOL JSM-6490LV (ускоряющее напряжение 30 кВ, LaB6-катод). Катионный состав поликристаллических образцов и электродов определяли методом рентгеноспектрального микроанализа (РСМА) с помощью энергодисперсионного детектора вторичного рентгеновского излучения “INCA” (Energy+, Oxford instruments, Si-(Li)-детектор). Для термогравиметрического анализа (ТГА) использовали термический анализатор Netzsch STA-449. Измерения осуществляли на воздухе/или в токе аргона в различных температурных диапазонах со скоростью нагрева 10 K/мин.
Электрохимические испытания проводили в двухэлектродной электрохимической ячейке. Для приготовления электродных материалов в агатовой ступке смешивали 80 мас. % активного вещества, 10 мас. % поливинилидендифторида (PVdF), растворенного в н-метилпирролидоне (NMP), и 10 мас. % сажи марки “Timcal Super C”. Полученную пасту наносили равномерным слоем на алюминиевую фольгу с помощью аппликатора DoctorBlade. Фольгу с нанесенным материалом высушивали на воздухе при температуре 70°C в течение 30 мин для испарения растворителя. Затем из фольги вырезали электроды в виде дисков диаметром 16 мм, взвешивали и высушивали в вакууме при температуре 110°C в течение 12 ч. В качестве электролита использовали 1 M раствор LiBF4 в сульфолане в случае литиевых ячеек и 1 М раствор NaPF6 в пропиленкарбонате с добавлением 3 мас. % фторэтиленкарбоната – в случае натриевых. Противоэлектродом и электродом сравнения служил металлический литий или натрий соответственно. Основными электрохимическими методами исследования являлись гальваностатическое циклирование с пределом по потенциалу (ГЦ) и циклическая вольтамперометрия (ЦВ).
Исследование методом порошковой рентгеновской дифракции в процессе электрохимических экспериментов (в режиме operando) проводили с использованием дифрактометра Bruker D8 Advance (геометрия Брегга–Брентано, излучение CuKα, LynxEye детектор) и двухэлектродной электрохимической ячейки собственной разработки, конструкция которой предусматривает наличие Be-окошка со стороны катода. Дифрактограммы регистрировали в узком угловом диапазоне (2θ ~ 28°–33°) каждые 15 мин при проведении ГЦ при плотности тока 0.1 С.
РЕЗУЛЬТАТЫ
LiFe0.5Ni0.5PO4
Для получения смешанного трифилина LiFe0.5Ni0.5PO4 использовали широко распространенную методику сольвотермального синтеза, предусматривающую образование гидроксофосфата M3(PO4)2·8H2O (M = Fe, Ni) в качестве прекурсора [26, 27]. Этот метод позволяет получать образцы изоструктурного катодного материала LiFePO4 при температуре 190°С. Однако синтез образцов оливина смешанного состава по данной методике приводит к получению в качестве основного продукта соединения, которое (по данным порошковой рентгеновской дифракции и РСМА) может быть идентифицировано как кристаллогидрат смешанного фосфата никеля и железа (Ni,Fe)3(PO4)2·8H2O. Результаты ТГА полученного интермедиата (рис. 1а) свидетельствуют о протекании реакции дегидратации в температурном диапазоне от 157 до 219°С, что существенно выше температуры дегидратации Fe3(PO4)2·8H2O [33]. Повышение температуры сольвотермального синтеза до 250°С привело к получению однофазного образца смешанного фосфата LiFe0.5Ni0.5PO4 (рис. 1б). Полнопрофильным уточнением дифракционных данных методом Ле-Бейля в ромбической сингонии (пр.гр. Pnma, Z = 4) получены значения параметров и объема элементарной ячейки: a = 10.1917(4) Å, b = 5.9390(2) Å, c = = 4.6911(1) Å, V = 283.9(1) Å3, являющиеся промежуточными между таковыми для LiFePO4 и LiNiPO4 [7, 20]. По данным СЭМ (рис. 1в), образец состоит из частиц, имеющих форму параллелепипеда со скругленными краями с толщиной ~100 нм и длиной ~200 нм. Значение соотношения Fe/Ni = 1, соответствующее номинальному, подтверждено РСМА (Fe/Ni = 1.02(4)).
Рис. 1.
(а) Результаты ТГА интермедиата (Ni,Fe)3(PO4)2·8H2O. (б) Участок дифрактограммы, полученной для образца LiFe0.5Ni0.5PO4 (излучение СuKα), рефлексы проиндицированы в ромбической сингонии (пр.гр. Pnma) c параметрами a = 10.1917(4) Å, b = 5.9390(2) Å, c = 4.6911(1) Å, V = 283.9(1) Å3. (в) Изображение СЭМ для образца LiFe0.5Ni0.5PO4.

Электрохимические свойства материала с нанесенным углеродным покрытием, LiFe0.5Ni0.5PO4/C, были исследованы в литиевой полуячейке с электролитом на основе LiBF4 в сульфолане, ранее продемонстрировавшим удовлетворительную стабильность в диапазоне 4−5.3 В отн. Li/Li+ [34, 35].
Как можно видеть из рис. 2а, на первом цикле ЦВ наблюдается пик в области 3.5 В отн. Li/Li+, соответствующий редокс-переходу Fe2+/Fe3+. Форма пика характерна для материалов со структурой оливина, в которых позиции переходного металла занимают несколько различных d-катионов: резкий рост пика, характерный для двухфазного процесса, сопровождается более плавным спадом, типичным для твердорастворного механизма [36, 37]. Начиная с потенциала 4.5 В, анодный ток снова увеличивается, и на зарядной кривой появляется несколько слабо выраженных пиков. Этот процесс, как видно из катодной ветви ЦВ, является необратимым, но при дальнейшем восстановлении, в области ≈3.4 В, формируется катодный пик, имеющий характерную для твердорастворного механизма симметричную форму и соответствующий переходу Fe3+ → Fe2+.
Рис. 2.
Результаты электрохимического исследования LiFe0.5Ni0.5PO4/C: a – кривые ЦВ для первых двух циклов (0.05 мВ/с, 2.5−5.3 В отн. Li/Li+); б – гальваностатический заряд–разряд (20 мА/г, 2.0−5.3 В отн. Li/Li+); в – гальваностатический заряд–разряд с переменным анодным пределом потенциала (от 3.5 до 5.0 В отн. Li/Li+); г – дифрактограммы (излучение СuKα1), полученные в режиме operando при заряде и разряде LiFe0.5Ni0.5PO4/C.
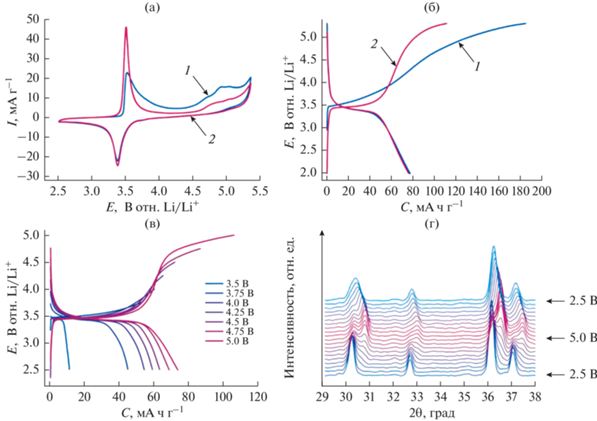
Кривая ЦВ, полученная в первом цикле для LiFe0.5Ni0.5PO4/C, в целом похожа на кривые, представленные ранее для замещенных материалов со структурой оливина, например LiFe0.5Mn0.5PO4 [36–38], но с необратимым редокс-переходом для второго (высоковольтного) катиона, т.е. Ni. На втором цикле анодный пик, соответствующий переходу Fe2+ → Fe3+, сужается, а интенсивность пиков при потенциале выше 4.5 В существенно падает.
Результаты ГЦ LiFe0.5Ni0.5PO4/C (рис. 2б) хорошо согласуются с данными ЦВ. На первом заряде до 5.3 В отн. Li/Li+ емкость составляет ≈190 мА ч г−1, тогда как на разряде лишь ≈80 мА ч г−1. Таким образом, наблюдается обратимая (де)интеркаляция ≈0.5Li+ на формульную единицу, что соответствует редокс-переходу Fe2+/Fe3+. Необратимая емкость при высоких потенциалах ко второму циклу падает от 110 до 30 мА ч г−1. Стоит отметить, что понижение предела потенциала при ГЦ не приводит к изменению разрядной емкости (рис. 2в). Процессы заряда–разряда являются обратимыми только до потенциала ≈4.5 В отн. Li/Li+, а дальнейшее повышение потенциала сопровождается ростом необратимой зарядной емкости.
Более подробная информация о фазовых переходах, сопровождающих процессы заряда–разряда LiFe0.5Ni0.5PO4/C, может быть получена методом operando порошковой рентгеновской дифракции (рис. 2г). Видно, что в ходе заряда материал окисляется по двухфазному механизму с образованием промежуточной фазы, аналогично уже упомянутому LiFe0.5Mn0.5PO4. Однако разряд LiFe0.5Ni0.5PO4/C протекает преимущественно по твердорастворному механизму, а конечная “точка” разряда, т.е. фаза, образовавшаяся по окончании эксперимента, отличается от исходной. Сдвиг рефлексов в область больших углов 2θ, наблюдающийся на рентгенограмме по окончании эксперимента, свидетельствует об уменьшении параметров ячейки разряженного фосфата. По данным ex situ порошковой рентгеновской дифракции объем ячейки разряженной фазы можно оценить, как 279.3(5) Å3, что на ≈1.5% меньше объема исходного соединения. Это хорошо соотносится с необратимостью, о которой свидетельствуют результаты электрохимических исследований. Таким образом, обратимого редокс-перехода Ni2+/Ni3+ для LiFe0.5Ni0.5PO4 обнаружено не было, а необратимый процесс, протекающий при первом заряде материала при потенциалах выше 4.5 В отн. Li/Li+, вероятно, связан с необратимыми структурными изменениями, сопровождающими извлечение лития (например, миграцией катионов никеля в позиции Li+, как это было обнаружено для Co3+ в Li1 –xCoPO4 [39]).
Na3NiZr(PO4)3
Рентгенограмма образца номинального состава Na3NiZr(PO4)3, полученного золь–гель-методом, показана на рис. 3a. Рефлексы могут быть проиндицированы в ромбоэдрической сингонии в гексагональной установке с параметрами, соответствующими структурному типу NASICON. Полнопрофильным уточнением порошковых дифракционных данных методом Ле-Бейля в пр. гр $R\bar {3}c$ получены значения параметров и объема элементарной ячейки: a = 8.8915(5) Å, c = 22.315(2) Å, V = 1527.9(3) Å3, незначительно превышающие значения, опубликованные ранее для Na3NiZr(PO4)3 [28]. На рентгенограмме также присутствуют слабые примесные рефлексы (относительная интенсивность ≤4%), которые могут быть идентифицированы, как принадлежащие тетрагональной модификации ZrO2 (PDF-2 #[50-1089]).
Рис. 3.
(а) Участок дифрактограммы образца номинального состава Na3NiZr(PO4)3. Рефлексы проиндицированы в ромбоэдрической сингонии в гексагональной установке с параметрами ячейки a = 8.8915(5) Å, c = 22.315(2) Å. Знаком “•” отмечены рефлексы, принадлежащие ZrO2. (б) Изображение СЭМ, полученное для образца номинального состава Na3NiZr(PO4)3. (в) Результаты ЦВ для этого образца (0.1 мВ/с, 2.5−4.8 В отн. Na/Na+). (г) Сопоставление участков рентгенограмм исходного образца (нижняя) и электрода, подвергнутого 3 циклам заряда–разряда в диапазоне потенциалов 2.5–5.0 В отн. Na/Na+ с последующим зарядом до 5 В (верхняя). На выделенном фрагменте показано уширение рефлекса (024) после электрохимических исследований.

Согласно данным СЭМ (рис. 3б), образец Na3NiZr(PO4)3 состоит из субмикронных кристаллитов неправильной формы, объединенных в агломераты размером 5−10 мкм. Полученные методом РСМА значения соотношений Ni/Zr = = 0.7(1), Na/(Ni + Zr) = 1.4(2) отличаются от номинальных, что может свидетельствовать о дефиците никеля в составе соединения. Принимая во внимание отличие параметров ячейки от литературных данных, предполагаемый состав соединения может быть записан, как Na2.6(1)Ni0.8(1)Zr1.2(1)(PO4)3, что соответствует Na1 + 2xNixZr2 −x(PO4)3, x = 0.8.
На кривой ЦВ первого цикла, полученной в натриевой ячейке с Na2.6Ni0.8Zr1.2(PO4)3 в качестве катода, обнаружен интенсивный необратимый анодный пик при ≈4.7 В отн. Na/Na+. Расчетная емкость составила 70 мА ч г−1, что эквивалентно извлечению 1.3 Na+ на формульную единицу. На втором и третьем циклах электрохимическая активность не наблюдается. Для исследования природы наблюдаемой необратимости электрод Na2.6Ni0.8Zr1.2(PO4)3 после 3 циклов заряда–разряда заряжали до 5 В отн. Na/Na+ и исследовали методом ex situ порошковой рентгеновской дифракции и СЭМ с применением РСМА. Сопоставление рентгенограмм исходного образца и заряженного электрода показано на рис. 3г. На рентгенограмме электрода сохраняются основные рефлексы исходного соединения, но наблюдается изменение положения и относительной интенсивности рефлексов, а также существенное уширение рефлексов. Полнопрофильное уточнение порошковых дифракционных данных, полученных для заряженного электрода методом Ле-Бейля, позволяет выделить две фазы со структурой NASICON. Объем ячейки основной по содержанию фазы (a = 8.8207(1) Å, c = 22.743(3) Å, V = 1532.5(3) Å3) больше такового для исходного соединения, а параметры ячейки близки к параметрам NaZr2(PO4)3 [40]. Вторая фаза, содержание которой существенно ниже – порядка 10–20%, – напротив, характеризуется меньшим объемом ячейки, а параметры (a = 8.886(1) Å, c = 22.292(7) Å, V = 1517.4(4) Å3) близки к параметрам исходного соединения. Результаты СЭМ/РСМА подтверждают деградацию кристаллитов исходного вещества, а также свидетельствуют о значительном понижении относительного содержания и натрия, и никеля по сравнению с исходным (Ni/Zr = = 0.3(1), Na/(Ni + Zr) = 1.0(2)).
По совокупности полученных данных, можно предположить, что процесс извлечения Na+ из Na2.6Ni0.8Zr1.2(PO4)3 сопровождается растворением катионов никеля (либо их переходом в аморфный приповерхностный слой) и образованием электрохимически неактивного продукта, близкого по составу и параметрам элементарной ячейки к NaZr2(PO4)3. Обратимой (де)интеркаляции Na+ в Na2.6Ni0.8Zr1.2(PO4)3 не обнаружено.
Na2Ni2Cr(PO4)3 и Na2Ni2Al(PO4)3
Однофазные образцы Na2Ni2Cr(PO4)3 и Na2Ni2Al(PO4)3 получены золь–гель-методом (рис. 4а). Все рефлексы на дифрактограммах полученных образцов могут быть проиндицированы в ромбической сингонии (пр. гр. Imma, Z = 4) с параметрами, согласующимися с литературными данными [41, 42]: a = 10.3420(2) Å, b = = 13.0952(2) Å, c = 6.4721(1) Å для Na2Ni2Cr(PO4)3, и a = 10.1452(1) Å, b = 13.0196 (2) Å, c = 6.4789 (1) Å для Na2Ni2Al(PO4)3. Оба образца состоят из субмикронных (~100−300 нм) частиц, которые в случае Na2Ni2Al(PO4)3 объединены в агломераты микронного размера. По данным РСМА, катионное соотношение в полученных образцах соответствует номинальному.
Рис. 4.
(а) Участки рентгенограмм Na2Ni2Cr(PO4)3 (верхняя) и Na2Ni2Al(PO4)3 (нижняя) (излучение CoKα1). Рефлексы проиндицированы в ромбической сингонии (пр. гр. Imma, Z = 4) с параметрами, указанными в тексте. (б) Изображение СЭМ для Na2Ni2Cr(PO4)3. (в) Изображение СЭМ для Na2Ni2Al(PO4)3. (г) Данные ЦВ для Na2Ni2Cr(PO4)3 (0.05 мВ/с, 2.5−5.3 В отн. Na/Na+). (д) Данные ЦВ для Na2Ni2Al(PO4)3 (0.05 мВ/с, 2.5–5.3 В отн. Na/Na+).

На кривых ЦВ для электрода Na2Ni2Cr(PO4)3 в натриевой полуячейке (рис. 4г) присутствует один обратимый пик в области ≈4.6 В отн. Na/Na+, емкость которого соответствует ≈30 мА ч г−1. Результаты аналогичного исследования Na2Ni2Al(PO4)3, в структуре которого отсутствует второй катион с переменной степенью окисления, свидетельствуют об отсутствии значимой электрохимической активности в данном диапазоне потенциалов (рис. 4д). Крайне слабо выраженные пики, заметные для Na2Ni2Al(PO4)3 на ≈4.7 В отн. Na/Na+ на анодном ходу и ≈4.5 В отн. Na/Na+ – на катодном, имеют емкость не более 3 мА ч г−1 и исчезают уже на втором цикле ЦВ. Это позволяет заключить, что наблюдаемая для Na2Ni2Cr(PO4)3 электрохимическая активность связана с редокс-переходом Cr3+/Cr4+ (и составляет около 60% от теоретического значения в 53 мА ч г−1 в расчете на (де)интеркаляцию одного катиона Na+), а редокс-пара Ni2+/Ni3+ в обоих исследованных соединениях электрохимически не активна.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Подводя итог изложенным выше данным, можно отметить два разных типа поведения изученных полианионных материалов, содержащих катионы Ni2+: 1) необратимые структурные изменения в ходе первого заряда, сопровождающиеся набором достаточно большой необратимой электрохимической емкости (~70–100 мА ч г–1), – для соединений со структурами типа оливин и NASICON, и 2) практически полная электрохимическая инертность – для Na2Ni2Al(PO4)3 со структурой типа α-CrPO4. Мы полагаем, что в обоих случаях причиной является, наравне с высоким потенциалом пары Ni2+/Ni3+, крайне небольшой радиус катиона Ni3+ – 0.56 Å в октаэдрическом окружении. Наиболее активно исследуемые полианионные материалы имеют структуры, устойчивые с более крупными B-катионами (в первую очередь Fe2+, Mn2+, V3+, радиусы которых составляют 0.78, 0.83 и 0.64 Å соответственно). Электрохимическое окисление Ni2+ в таких материалах, вероятно, крайне затруднено (по меньшей мере в стандартных условиях), поскольку сопровождается сильным искажением структуры. Кроме того, нельзя исключать и возможное окисление катионами Ni3+ анионов кислорода в структуре материалов, как это происходит на первом заряде так называемых “Li-обогащенных” оксидов Li1 +x(Ni,Mn,Co)1 –xO2 при потенциале ≈4.8 В отн. Li/Li+ [43, 44].
Очевидно, что реализация того или другого варианта электрохимической активности зависит от особенностей кристаллической структуры материала. Так, для структурного типа оливина, устойчивая электрохимическая циклируемость которого обеспечивается крупными катионами (такими, как Fe2+, Mn2+), известна склонность к образованию антиструктурных дефектов для заряженного Li1 – xCoPO4 (радиус Co3+ составляет 0.61 Å), а также возможность образования аналогичных дефектов для незаряженного LiNiPO4 [39, 45]. Для материалов со структурой NASICON образование катионов V5+ (радиус 0.54 Å) приводит к необратимым структурным изменениям, вероятно, связанным с миграцией ванадия в нехарактерные для V3+ позиции [46, 47]. С этими данными согласуется интенсивный анодный процесс в ходе первого заряда LiFe0.5Ni0.5PO4 и Na1 + 2xNixZr2 –x(PO4)3, связанный с деинтеркаляцией катионов щелочного металла и структурной перестройкой. С другой стороны, судя по полученным нами результатам, энергия образования подобных дефектов для структуры α-CrPO4 может быть достаточно велика, поэтому материал Na2Ni2Al(PO4)3 не проявляет значимой электрохимической активности ни на заряде, ни на разряде. Краткое резюме полученных результатов представлено на рис. 5.
Рис. 5.
Схематическое представление зависимости типа электрохимической активности полианионного материала, содержащего Ni2+ в позициях переходного металла M, от его структуры (Na2M3(PO4)3 – структурный тип α-CrPO4, LiMPO4 – структурный тип оливина, Na3M2(PO4)3–NASICON, Na4M3(PO4)2P2O7–Na4Ni3(PO4)2P2O7).

Таким образом, единственным известным на сегодняшний день полианионным структурным типом, для которого достоверно и воспроизводимо показана обратимая (де)интеркаляция катионов щелочного металла с участием редокс-пары Ni2+/Ni3+, является фосфат-пирофосфат Na4M3(PO4)2P2O7 [21]. Это позволяет предполагать, что могут быть обнаружены и другие типы полианионных каркасов, где удастся реализовать Ni2+/Ni3+ редокс-переход. Таким образом, поиск никельсодержащих полианионных катодных материалов может и должен быть продолжен в последующих работах.
ЗАКЛЮЧЕНИЕ
В работе впервые исследованы электрохимические свойства ряда никель-содержащих фосфатов, кристаллизующихся в различных структурных типах – оливин, NASICON и α-CrPO4. Хорошо известно, что материалы, изоструктурные исследованным в данной работе и содержащие другие 3d-катионы (Fe, Mn, V и т.д.), обладают привлекательными электрохимическими свойствами и демонстрируют обратимую (де)интеркаляцию катионов щелочных металлов. Было обнаружено, что наличие катионов Ni2+ препятствует обратимым (де)интеркаляционным процессам, что может быть связано с низкой стабильностью рассматриваемых структур при окислении никеля до Ni3+ из-за его слишком малого радиуса. Дальнейший поиск полианионных катодных материалов для реализации обратимого редокс-перехода Ni2+/Ni3+ должен быть сосредоточен на структурных типах, характерных для B-катионов с малым радиусом.
Список литературы
Mizushima, K., Jones, P.C., Wiseman, P.J., and Goodenough, J.B., LixCoO2 (0 < x < –1): A new cathode material for batteries of high energy density, Mater. Res. Bull., 1980, vol. 15, no. 6, p. 783.
Li, W., Song, B., and Manthiram, A., High-voltage positive electrode materials for lithium-ion batteries, Chem. Soc. Rev., 2017, vol. 46, no. 10, p. 3006.
Armand, M., Axmann, P., Bresser, D., Copley, M., Edström, K., Ekberg, C., Guyomard, D., Lestriez, B., Novák, P., Petranikova, M., Porcher, W., Trabesinger, S., Wohlfahrt-Mehrens, M., and Zhang, H., Lithium-ion batteries – Current state of the art and anticipated developments, J. Power Sources, 2020, vol. 479, p. 228708.
Кулова, Т.Л., Скундин, А.М. Высоковольтные материалы для положительных электродов литий-ионных аккумуляторов (обзор). Электрохимия. 2016. Т. 52. С. 563. [Kulova, T.L. and Skundin, A.M., High-Voltage Materials for Positive Electrodes of Lithium Ion Batteries (Review), Russ. J. Electrochem., 2016, vol. 52, p. 501.]
Hasa, I., Mariyappan, S., Saurel, D., Adelhelm, P., Koposov, A.Y., Masquelier, C., Croguennec, L., and Casas-Cabanas, M., Challenges of today for Na-based batteries of the future: From materials to cell metrics, J. Power Sources, 2021, vol. 482, p. 228872.
Xu, J., Lin, F., Doeff, M.M., and Tong, W., A review of Ni-based layered oxides for rechargeable Li-ion batteries, J. Mater. Chem. A, 2017, vol. 5, no. 3, p. 874.
Padhi, A.K., Nanjundaswamy, K.S., and Goodenough, J.B., Phospho-olivines as Positive Electrode Materials for Rechargeable Lithium Batteries, J. Electrochem. Soc., 1997, vol. 144, no. 4, p. 1188.
Okada, S., Ueno, M., Uebou, Y., and Yamaki, J.-I., Fluoride phosphate Li2CoPO4F as a high-voltage cathode in Li-ion batteries, J. Power Sources, 2005, vol. 146, no. 1, p. 565.
Khasanova, N.R., Gavrilov, A.N., Antipov, E.V., Bramnik, K.G., and Hibst, H., Structural transformation of Li2CoPO4F upon Li-deintercalation, J. Power Sources, 2011, vol. 196, no. 1, p. 355.
Khasanova, N.R., Drozhzhin, O.A., Storozhilova, D.A., Delmas, C., and Antipov, E.V., New Form of Li2FePO4F as Cathode Material for Li-Ion Batteries, Chem. Mater., 2012, vol. 24, no. 22, p. 4271.
Стафеева, В.С., Дрожжин, О.А., Панин, Р.В., Филимонов, Д.С., Фабричный, П.Б., Яшина, Л.В., Хасанова, Н.Р., Антипов, Е.В. Влияние условий синтеза композита LiFeBO3/C на его электрохимическую активность в качестве катодного материала для литий-ионных аккумуляторов. Электрохимия. 2015. Т. 51. С. 703. [Stafeeva, V.S., Drozhzhin, O.A., Panin, R.V., Filimonov, D.S., Fabrichnyi, P.B., Yashina, L.V., Khasanova, N.R., and Antipov, E.V., The effect of LiFeBO3/C composite synthetic conditions on the quality of the cathodic material for lithium-ion batteries, Russ. J. Electrochem., 2015, vol. 51, p. 619.]
Yamashita, Y., Barpanda, P., Yamada, Y., and Yamada, A., Demonstration of Co3+/Co2+ Electrochemical Activity in LiCoBO3 Cathode at 4.0 V, ECS Electrochem. Lett., 2013, vol. 2, no. 8, p. A75.
Dominko, R., Bele, M., Gaberšček, M., Meden, A., Remškar, M., and Jamnik, J., Structure and electrochemical performance of Li2MnSiO4 and Li2FeSiO4 as potential Li-battery cathode materials, Electrochem. Commun., 2006, vol. 8, no. 2, p. 217.
Barpanda, P., Ati, M., Melot, B.C., Rousse, G., Chotard, J.N., Doublet, M.L., Sougrati, M.T., Corr, S.A., Jumas, J.C., and Tarascon, J.M., A 3.90 V iron-based fluorosulphate material for lithium-ion batteries crystallizing in the triplite structure, Nature Mater., 2011, vol. 10, no. 10, p. 772.
Tertov, I.V., Drozhzhin, O.A., Alekseeva, A.M., Kirsanova, M.A., Mironov, A.V., Abakumov, A.M., and Antipov, E.V., β-LiVP2O7 as a positive electrode material for Li-ion batteries, Electrochim. Acta, 2021, vol. 389, p. 138759.
Nagahama, M., Hasegawa, N., and Okada, S., High Voltage Performances of Li2NiPO4F Cathode with Dinitrile-Based Electrolytes, J. Electrochem. Soc., 2010, vol. 157, no. 6, p. A748.
Ellis, B.L., Makahnouk, W.R.M., Rowan-Weetaluktuk, W.N., Ryan, D.H., and Nazar, L.F., Crystal Structure and Electrochemical Properties of A2MPO4F Fluorophosphates (A = Na, Li; M = Fe, Mn, Co, Ni), Chem. Mater., 2010, vol. 22, no. 3, p. 1059.
Mauger, A., Julien, C.M., Armand, M., Goodenough, J.B., and Zaghib, K., Li(Ni,Co)PO4 as cathode materials for lithium batteries: Will the dream come true?, Current Opinion in Electrochem., 2017, vol. 6, no. 1, p. 63.
Snydacker, D.H. and Wolverton, C., Transition-Metal Mixing and Redox Potentials in ${\text{L}}{{{\text{i}}}_{x}}\left( {{{{\text{M}}}_{{1--y}}}{\text{M}}_{y}^{'}} \right){\text{P}}{{{\text{O}}}_{4}}$ (M, M' = Mn, Fe, Ni) Olivine Materials from First-Principles Calculations, J. Phys. Chem. C, 2016, vol. 120, no. 11, p. 5932.
Hautier, G., Jain, A., Ong, S.P., Kang, B., Moore, C., Doe, R., and Ceder, G., Phosphates as Lithium-Ion Battery Cathodes: An Evaluation Based on High-Throughput ab Initio Calculations, Chem. Mater., 2011, vol. 23, no. 15, p. 3495.
Zhang, H., Hasa, I., Buchholz, D., Qin, B., Geiger, D., Jeong, S., Kaiser, U., and Passerini, S., Exploring the Ni redox activity in polyanionic compounds as conceivable high potential cathodes for Na rechargeable batteries, NPG Asia Materials, 2017, vol. 9, no. 3, p. e370.
Yang, L., Markmaitree, T., and Lucht, B.L., Inorganic additives for passivation of high voltage cathode materials, J. Power Sources, 2011, vol. 196, no. 4, p. 2251.
Zhang, T. and Paillard, E., Recent advances toward high voltage, EC-free electrolytes for graphite-based Li-ion battery, Front. Chem. Sci. and Engineering, 2018, vol. 12, no. 3, p. 577.
Haregewoin, A.M., Wotango, A.S., and Hwang, B.-J., Electrolyte additives for lithium ion battery electrodes: progress and perspectives, Energy & Environmental Science, 2016, vol. 9, no. 6, p. 1955.
Drozhzhin, O.A., Shevchenko, V.A., Zakharkin, M.V., Gamzyukov, P.I., Yashina, L.V., Abakumov, A.M., Stevenson, K.J., and Antipov, E.V., Improving salt-to-solvent ratio to enable high-voltage electrolyte stability for advanced Li-ion batteries, Electrochim. Acta, 2018, vol. 263, p. 127.
Sharikov, F.Y., Drozhzhin, O.A., Sumanov, V.D., Baranov, A.N., Abakumov, A.M., and Antipov, E.V., Exploring the Peculiarities of LiFePO4 Hydrothermal Synthesis Using In Situ Calvet Calorimetry, Crystal Growth & Design, 2018, vol. 18, no. 2, p. 879.
Chen, J., Vacchio, M.J., Wang, S., Chernova, N., Zavalij, P.Y., and Whittingham, M.S., The hydrothermal synthesis and characterization of olivines and related compounds for electrochemical applications, Solid State Ionics, 2008, vol. 178, no. 31, p. 1676.
Chakir, M., El Jazouli, A., and de Waal, D., Synthesis, crystal structure and spectroscopy properties of Na3AZr(PO4)3 (A = Mg, Ni) and Li2.6Na0.4NiZr(PO4)3 phosphates, J. Solid State Chem., 2006, vol. 179, no. 6, p. 1883.
STOE Win XPOW, Version 1.2 (27-Jul-2001), 2000 STOE, Cie GmbH, Hilpert str. 10, D64295 Darmstadt.
Petrícek, V., Dušek, M., and Palatinus, L., Crystallographic computing system JANA2006: General features, Zeitschrift fur Krist., 2014, Bd. 229, S. 345.
ICDD PDF-2, International Center for Diffraction Data, Newton Square, USA, 1998.
ICDD PDF-4+, International Center for Diffraction Data, Newton Square, USA, 2020.
Frost, R.L., Weier, M.L., Martens, W., Kloprogge, J.T., and Ding Z., Dehydration of synthetic and natural vivianite, Thermochim. Acta, 2003, vol. 401, no. 2, p. 121.
Abouimrane, A., Belharouak, I., and Amine, K., Sulfone-based electrolytes for high-voltage Li-ion batteries, Electrochem. Commun., 2009, vol. 11, no. 5, p. 1073.
Khasanova, N.R., Drozhzhin, O.A., Fedotov, S.S., Storozhilova, D.A., Panin, R.V., and Antipov, E.V., Synthesis and electrochemical performance of Li2Co1 –xMxPO4F (M = Fe, Mn) cathode materials, Beilstein J. Nanotechnol., 2013, vol. 4, p. 860.
Kosova, N.V., Devyatkina, E.T., Slobodyuk, A.B., and Petrov, S.A., Submicron LiFe1‑yMnyPO4 solid solutions prepared by mechanochemically assisted carbothermal reduction: The structure and properties, Electrochim. Acta, 2012, vol. 59, p. 404.
Molenda, J., Ojczyk, W., and Marzec, J., Electrical conductivity and reaction with lithium of LiFe1 –yMnyPO4 olivine-type cathode materials, J. Power Sources, 2007, vol. 174, no. 2, p. 689.
Drozhzhin, O.A., Sumanov, V.D., Karakulina, O.M., Abakumov, A.M., Hadermann, J., Baranov, A.N., Stevenson, K.J., and Antipov, E.V., Switching between solid solution and two-phase regimes in the Li1 –xFe1 –yMnyPO4 cathode materials during lithium (de)insertion: combined PITT, in situ XRPD and electron diffraction tomography study, Electrochim. Acta, 2016, vol. 191, p. 149.
Truong, Q.D., Devaraju, M.K., Sasaki, Y., Hyodo, H., Tomai, T., and Honma, I., Relocation of Cobalt Ions in Electrochemically Delithiated LiCoPO4 Cathode Materials, Chem. Mater., 2014, vol. 26, no. 9, p. 2770.
Zheng, L.-L., Xue, Y., Liu, B.-S., Zhou, Y.-X., Hao, S.-E., and Wang, Z.-B., High performance Na3V2(PO4)3 cathode prepared by a facile solution evaporation method for sodium-ion batteries, Ceram. Internat., 2017, vol. 43, no. 6, p. 4950.
Yahia, H.B., Essehli, R., Avdeev, M., Park, J.B., Sun, Y.K., Al-Maadeed, M.A., and Belharouak, I., Neutron diffraction studies of the Na-ion battery electrode materials NaCoCr2(PO4)3, NaNiCr2(PO4)3, and Na2Ni2Cr(PO4)3, J. Solid State Chem., 2016, vol. 238, p. 103.
Harbaoui, D., Sanad, M.M.S., Rossignol, C., Hlil, E.K., Amdouni, N., and Obbade, S., Synthesis and Structural, Electrical, and Magnetic Properties of New Iron–Aluminum Alluaudite Phases β-Na2Ni2M(PO4)3 (M = Fe and Al), Inorganic Chem., 2017, vol. 56, no. 21, p. 13051.
Cui, S.-L., Wang, Y.-Y., Liu, S., Li, G.-R., and Gao, X.-P., Evolution mechanism of phase transformation of Li-rich cathode materials in cycling, Electrochim. Acta, 2019, vol. 328, p. 135109.
Seo, D.-H., Lee, J., Urban, A., Malik, R., Kang, S., and Ceder, G., The structural and chemical origin of the oxygen redox activity in layered and cation-disordered Li-excess cathode materials, Nature Chem., 2016, vol. 8, no. 7, p. 692.
Kempaiah Devaraju, M., Duc Truong, Q., Hyodo, H., Sasaki, Y., and Honma, I., Synthesis, characterization and observation of antisite defects in LiNiPO4 nanomaterials, Scientific Reports, 2015, vol. 5, no. 1, p. 11041.
Liu, R., Zheng, S., Yuan, Y., Yu, P., Liang, Z., Zhao, W., Shahbazian-Yassar, R., Ding, J., Lu, J., and Yang, Y., Counter-Intuitive Structural Instability Aroused by Transition Metal Migration in Polyanionic Sodium Ion Host, Advanced Energy Mater., 2021, vol. 11, no. 3, p. 2003256.
Boivin, E., Chotard, J.-N., Masquelier, C., and Croguennec, L., Towards Reversible High-Voltage Multi-Electron Reactions in Alkali-Ion Batteries Using Vanadium Phosphate Positive Electrode Materials, Molecules, 2021, vol. 26, no. 5, p. 1428.
Дополнительные материалы отсутствуют.


