Электрохимия, 2022, T. 58, № 12, стр. 838-847
Специфическое поведение электрохимически генерируемого никельорганического сигма-комплекса [NiBr(Tcpp)(bpy)], где Tcpp – 2,4,6-трициклопентилфенил, bpy – 2,2'-бипиридил
И. Ф. Сахапов a, З. Н. Гафуров a, *, А. О. Кантюков a, b, А. А. Кагилев a, b, И. К. Михайлов a, b, Е. М. Зуева a, c, Д. Н. Бузюрова a, В. М. Бабаев a, С. А. Штейнгольц a, Р. Р. Файзуллин a, Г. Э. Бекмухамедов a, b, Д. Г. Яхваров a, b, **
a Институт органической и физической химии им. А.Е. Арбузова ФИЦ Казанский научный центр РАН
Казань, Россия
b Химический институт им. А.М. Бутлерова, Казанский (Приволжский) федеральный университет
Казань, Россия
c Казанский национальный исследовательский технологический университет
Казань, Россия
* E-mail: gafurov.zufar@iopc.ru
** E-mail: yakhvar@iopc.ru
Поступила в редакцию 28.02.2022
После доработки 13.05.2022
Принята к публикации 07.06.2022
- EDN: DTQNWW
- DOI: 10.31857/S0424857022120064
Аннотация
При использовании метода препаративного электрохимического синтеза был сгенерирован новый никельорганический сигма-комплекс [NiBr(Tcpp)(bpy)], где Tcpp – 2,4,6-трициклопентилфенил, bpy – 2,2'-бипиридил. Мониторинг препаративного электросинтеза методом масс-спектрометрии, а также проведенные исследования методом циклической вольтамперометрии показали, что никельорганический сигма-комплекс образуется в условиях электролиза, однако в отличие от аналогов с орто-замещенными ароматическими фрагментами, является неустойчивым и разлагается с образованием продукта гомо-сочетания – ранее не описанного стерически затрудненного биарильного производного 2,2',4,4',6,6'-гексациклопентил-1,1'-бифенила, молекулярная и кристаллическая структура которого были описаны методами ЯМР-спектроскопии и рентгеновской дифракции.
ВВЕДЕНИЕ
Одним из важных направлений развития современной химической науки является контроль каталитических процессов, включая электрокаталитические, понимание их механизмов, а также управление ими для разработки высокоэффективных систем получения практически значимых соединений и материалов [1–4]. В этом плане, реакции электрохимического гомо- и кросс-сочетания являются важной платформой для синтеза многих органических соединений, включая биарильные (Aryl–Aryl) производные, которые, в свою очередь, широко используются для получения биологически активных [5, 6] или супрамолекулярных соединений [7], токопроводящих или жидкокристаллических материалов [8], а также в других отраслях современной науки. Ключевыми интермедиатами этих процессов являются металлоорганические сигма-комплексы, содержащие сигма-связь металл–углерод (M–Aryl), стабильность и реакционная способность которых определяют дальнейший путь реакции [9, 10]. Так, процессы гомо- и кросс-сочетания могут конкурировать между собой, а образование побочных продуктов сочетания является серьезным ограничением для химиков-синтетиков и определенным препятствием для переноса лабораторных разработок на промышленный уровень. Понимание роли и влияния интермедиатов типа M–Aryl на процесс сочетания ускорит разработку этого важного класса реакций и повысит их синтетическую применимость [11–14].
Никельорганические сигма-комплексы типа [NiBr(Aryl)(bpy)], где Aryl = 2,6-диметилфенил (Xyl), 2,4,6-триметилфенил (Mes), 2,4,6-триизопропилфенил (Tipp), 2,4,6-трициклогексилфенил (Tchp), bpy – 2,2'-бипиридил, зарекомендовали себя как универсальные реагенты и интермедиаты в органической и элементоорганической химии, широко используемые для реакций кросс-сочетания с образованием связей C–C, P–C и N–C [15–21]. К примеру, [NiBr(Mes)(bpy)] способен реагировать с первичными фосфинами (PhPH2, MesPH2, i-BuPH2, CyPH2) или даже с PH3, приводя к образованию вторичных фосфинов путем формирования новой связи Р–С с участием мезитильного фрагмента [22–25]. Комплексы [NiBr(Xyl)(bpy)], [NiBr(Mes)(bpy)], [Ni Br(Tipp)(bpy)], [NiBr(Tchp)(bpy)] взаимодействуют с рядом нитрилов (ацетонитрил, пропионитрил, хлорацетонитрил, бензонитрил), приводя к получению иминов за счет образования новой связи С–С между атомами углерода ароматического фрагмента исходного никельорганического сигма-комплекса и нитрильной группой C≡N [26]. Нами был разработан электрохимический метод синтеза данных комплексов по реакции окислительного присоединения генерируемых на катоде комплексов никеля (0) из [NiBr2(bpy)] к орто-замещенным ароматическим бромидам (MesBr, TchpBr и др.) [27]. Полученные комплексы являются стабильными, в частности [NiBr(Mes)(bpy)] и [NiBr(Tchp)(bpy)] были охарактеризованы рентгенодифракционным методом [15, 19].
В данной работе описано специфическое поведение нового электрохимически полученного из [NiBr2(bpy)] и TcppBr никельорганического сигма-комплекса [NiBr(Tcpp)(bpy)], где Tcpp = 2,4,6-трициклопентилфенил, который, в отличие от своих аналогов [NiBr(Mes)(bpy)] и [NiBr(Tchp)(bpy)], является более реакционноспособным и приводит к образованию продукта гомо-сочетания – ранее не описанному биарилу (Tcpp)2 (2,2',4,4',6,6'-гексациклопентил-1,1'-бифенил). Стоит отметить, что данный биарил является труднодоступным при использовании классических методов синтеза из-за высокой стерической загруженности. Таким образом, результаты исследований, представленные в данной работе, раскрывают новый синтетический потенциал данного типа металлоорганических комплексов и могут быть использованы для дальнейшего рационального дизайна высокоэффективных каталитических систем для процессов кросс- и гомо-сочетания.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все эксперименты, связанные с подготовкой исходных реагентов и проведением электрохимических исследований, были выполнены в инертной атмосфере (азот, 99.6%) с использованием стандартной аппаратуры Шленка. Для проведения мониторинга электрохимического процесса и установления состава и строения продуктов электролиза использовался метод масс-спектрометрии с ионизацией электрораспылением (ИЭР). Образцы (объем 1 мл) для исследования методом масс-спектрометрии отбирались из рабочего раствора в противотоке азота. N,N-Диметилформамид (ДМФА) очищали трехкратной перегонкой над гидридом кальция в инертной атмосфере. Исходный комплекс никеля [NiBr2(bpy)] получали по ранее опубликованной методике [28]. Безводный дибромид никеля и ароматический бромид TcppBr (Sigma–Aldrich) использовались без дополнительной очистки.
Спектры ЯМР 1H и 13С записаны на спектрометре высокого разрешения BRUKER AVANCE-400 на частотах 400.17 и 100.62 МГц соответственно. Элементный анализ соединений выполнен на CHNS высокотемпературном анализаторе EuroEA3000 фирмы EUROVECTOR. Масс-спектры ИЭР получены на масс-спектрометре AmazonX (Bruker Daltonik GmbH, Бремен, Германия). Детектирование положительных ионов выполнено в интервале m/z от 100 до 2800. Напряжение на капилляре – 4500 В. В качестве газа-осушителя использовался азот с температурой 250°С и расходом 8 л/мин. Ввод образца осуществлялся со скоростью 4 мкл/мин при помощи шприцевого насоса. Данные ИЭР экспериментов обрабатывались с помощью программы DataAnalysis 4.0 (Bruker Daltonik GmbH, Бремен, Германия). Продукты электрохимического синтеза анализировали методом хромато-масс-спектрометрии (ГХ-МС) на газовом хроматографе 7890B GC (Agilent, США), совмещенном с масс-селективным электронно-ионизационным (ЭИ) детектором MSD 5977B (Agilent, США). Для разделения компонентов использовалась капиллярная колонка HP-5MS Ultra Inert (длина 30 м; диаметр 0.25 мм; толщина пленки неподвижной фазы – (5%-фенил)-метилполисилоксана – 0.50 мкм). Вещества были идентифицированы с помощью программы масс-спектрального поиска NIST (National Institute of Standards and Technology – Национальный институт стандартов и технологии, США), версия 2.2.
В исследованиях методом циклической вольтамперометрии (ЦВА) концентрация исследуемых компонентов [NiBr2(bpy)] и TcppBr составляла 5 × 10–3 M в ДМФА, концентрация фонового электролита n-Bu4NBF4 составляла 1 × 10–1 M. Объем рабочего раствора составлял 1.5 мл. Все эксперименты проводили в атмосфере инертного газа (азота) в трехканальной электрохимической ячейке, оснащенной рабочим электродом, вспомогательным и электродом сравнения (ЭС). В качестве рабочего электрода использовался стеклоуглеродный электрод (СУ) (рабочая поверхность 3.14 мм2). В качестве вспомогательного электрода использовалась платиновая проволока диаметром 1 мм. В качестве ЭС использовали систему Ag/AgNO3, 1 × 10–2 М в CH3CN (Е0(Fc/Fc+) = = +0.20 B, относительно нас. к. э. +0.17 B). Стеклоуглеродный электрод (СУ) полировали 0.05 мкм оксидом алюминия непосредственно перед каждым новым экспериментом. Препаративное накопление [Ni0(bpy)] в растворе осуществляли электровосстановлением [NiBr2(bpy)] при потенциале рабочего электрода –1.70 В в течение 1 мин. ЦВА-кривые записывали при постоянной скорости развертки потенциала рабочего электрода 50 мВ/с при помощи потенциостата E2P фирмы BASi Epsilon (США) с программным обеспечением Epsilon-EC-USB-V200.
Рентгеноструктурное исследование монокристалла соединения (Tcpp)2 проведено на дифрактометре Bruker D8 QUEST с MoKα-излучением (0.71073 Å) при температуре 100(2) К. Сбор и индексирование данных, определение и уточнение параметров элементарной ячейки, коррекция абсорбции, учет систематических ошибок и определение пространственной группы кристалла проведены с использованием пакета программ APEX3 (v2019.11-0, Bruker AXS). Структура расшифрована программой SHELXT-2018/2 [29] и уточнена полноматричным методом наименьших квадратов по F 2 программой SHELXL-2018/3 [30]. Все атомы, кроме водорода, уточнены в анизотропном приближении. Атомы водорода помещены в геометрически рассчитанные положения и включены в уточнение в модели “наездника”. Кристаллографические данные депонированы в Кембриджский банк структурных данных (http://www.ccdc.cam.ac.uk); номер депозита CCDC 2153809.
Монокристаллы соединения (Tcpp)2 получены медленным упариванием из раствора в ацетоне при комнатной температуре. Соединение (Tcpp)2 кристаллизуется в пространственной группе P$\bar {1}$ триклинной кристаллографической системы. Параметры элементарной ячейки: a = = 10.1453(10) Å, b = 21.252(2) Å, c = 31.565(3) Å, α = 98.477(3)°, β = 91.836(3)°, γ = 99.802(3)°; V = = 6621.7(11) Å3; Z = 8, Z ' = 4. Бесцветная пластина (0.345 × 0.086 × 0.083 мм3); формула C42H58, Mr = = 562.88, dвыч = 1.129 г см–3, μ(MoKα) = 0.063 мм–1; F(000) = 2480; Tmax = 0.9812, Tmin = 0.8917. Область сбора данных 1.307° ≤ θ ≤ 25.350°, диапазон индексов –12 ≤ h ≤ 12, –25 ≤ k ≤ 25, –38 ≤ l ≤ 38, полнота данных к θmax составляет 99.9%; собрано 137 261 рефлексов, из них 24241 независимых; Rint = 0.0933, Rσ = 0.0778. Уточнение 2070 параметров приводит к R1 = 0.1082, wR2 = 0.3146 для 15 917 наблюдаемых рефлексов с I > 2σ(I) и R1 = = 0.1459, wR2 = 0.3413 для всех данных, S = 1.037, остаточная электронная плотность ρmax/min = 0.603 и –0.470 e Å–3.
Электрохимическое генерирование никельорганического сигма-комплекса [NiBr(Tcpp)(bpy)] проводили в электрохимической ячейке без разделения электродных пространств рабочим объемом 60 мл. В качестве анода использовали растворимый никелевый стержень, а в качестве катода – платина (площадь рабочей поверхности 50 см2). Раствор для электролиза готовили растворением соли [NiBr2(bpy)] (400 мг, 10.330 ммоль) в ДМФА (50 мл) с последующим добавлением ароматического бромида TcppBr (305 мкл, 1 ммоль). После чего через раствор пропускали постоянный ток силой 28 мА в течение 120 мин при комнатной температуре и при постоянном перемешивании раствора. В ходе электролиза потенциал рабочего электрода находился в пределах –1.45…–1.60 В (отн. Ag/AgNO3, 1 × 10–2 M в СН3CN), что соответствует процессу электрохимического восстановления комплекса [NiBr2(bpy)] в комплекс [Ni0(bpy)]. В процессе электролиза фиксировалось изменение цвета рабочего раствора от зеленого до бордового. Мониторинг образования никельорганического комплекса в ходе электролиза осуществлялся анализом реакционной смеси методом масс-спектрометрии ИЭР с интервалом отбора проб 30 мин.
После окончания электролиза раствор был отфильтрован для удаления образовавшегося осадка и растворитель был упарен при пониженном давлении. Полученный после упаривания остаток представлял собой коричнево-красную смесь, которая была растворена в ацетоне и отфильтрована. Затем полученный раствор кипятили с обратным холодильником в течение 2 ч, что привело к обесцвечиванию раствора. После упаривания растворителя в вакууме остаток был промыт насыщенным водным раствором хлорида аммония и высушен. Выход продукта (Tcpp)2 составил 57 мг (62%).
2,2',4,4',6,6'-гексациклопентил-1,1'-бифенил (Tcpp)2. Масс-спектр (ЭИ, tR = 30.3 мин), m/z (Iотн (%)): 282.3 [Tcpp]+ (65), 213.2 [Tcpp – Cyp]+ (100), 145 [Tcpp – 2 Cyp]+ (44), 69.1 [Cyp] (30). Найдено для C42H58 (M = 562.93 г моль–1) (%): С 89.56, H 10.38. Вычислено (%): С, 89.61; Н, 10.39. Спектр ЯМР 1H (400.17 МГц, ацетон-D6, δ, м.д.): 1.4–2.1 (м, 48 Н, СН2), 2.52–2.94 (м, 6 Н, СН Cyp), 7.58 (с, 4 Н, СН Aryl). Спектр ЯМР 13С{1H} (100.62 МГц, ацетон-D6, δ, м.д.): 25.5 (с), 34.6 (с), 34.9 (с), 42.2 (с), 46.7 (с), 120.8 (с), 131.3 (с), 143.9 (с), 144.1 (с). Cyp = циклопентил.
Квантово-химические расчеты молекулярной структуры и термодинамических параметров проводили методом функционала плотности B3LYP с использованием псевдопотенциального базисного набора LANL2DZ с помощью программного пакета Gaussian 09 [31]. Учет влияния неспецифической сольватации проводили в рамках модели поляризуемого диэлектрического континуума (PCM) с учетом растворителя (ДМФА).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Как было отмечено ранее, процесс электрохимического синтеза никельорганических сигма-комплексов типа [NiBr(Aryl)(bpy)] заключается в генерировании на катоде комплекса никеля [Ni0(bpy)] и его последующей реакции окислительного присоединения к орто-замещенным ароматическим бромидам. Так, для оценки возможности электрохимического получения комплекса никеля с Aryl = Tcpp, были проведены ЦВА-исследования комплекса [NiBr2(bpy)] в присутствии TcppBr.
На рис. 1 представлены циклические вольтамперограммы комплекса [NiBr2(bpy)] в присутствии TcppBr (пунктирная линия) и при его отсутствии (сплошная линия). Так, при сканировании потенциала рабочего электрода в область катодных значений наблюдаются два квазиобратимых пика восстановления С1 и С2, имеющие пики реокисления А1 и А2. Согласно литературным данным [15, 16], пик С1 соответствует восстановлению [NiBr2(bpy)] до [Ni0(bpy)], а пик С2 – образованию анион-радикальной формы комплекса [Ni0(bpy)]•–. Стоит отметить, что на ЦВА-кривых также наблюдаются два анодных пика А3 и А4, которые соответствуют процессу окисления свободных бромид-анионов и анионов [Br3]– с образованием молекулярного брома и последующим ревосстановлением при потенциале С3 [2]. Как видно из рис. 1, добавление TcppBr не приводит к изменению морфологии ЦВА-кривой, и, следовательно, окислительного присоединения данного ароматического бромида с образованием целевого комплекса не происходит c достаточной скоростью.
Рис. 1.
ЦВА-кривые комплекса никеля [NiBr2(bpy)] в отсутствие (сплошная линия) и в присутствии (пунктирная линия) TcppBr. Концентрация субстратов 5 × × 10–3 М в ДМФА в присутствии n-Bu4NBF4 (1 × 10–1 M) (рабочий электрод – СУ, скорость развертки потенциала – 50 мВ/с), ЭС – Ag/AgNO3 (1 × 10–2 М раствор в CH3CN). Развертка потенциала от 0.00 В до –2.50 В, обратно до +1.20 В и далее до 0.00 В.

Однако, при накоплении восстановленной формы [Ni0(bpy)] (при задержке потенциала рабочего электрода в течение 1 мин при потенциале пика С1, см. табл. 1), с последующим сканированием потенциала рабочего электрода до –2.50 В наблюдалось появление нового катодного пика С3 ($E_{{\text{p}}}^{{{\text{red}}}}$ = –1.95 В) (рис. 2). Ранее нами были изучены электрохимические свойства никельорганического сигма-комплекса [NiBr(Mes)(bpy)], где при добавлении к комплексу [NiBr2(bpy)] эквивалентного количества MesBr наблюдалось увеличение предельного тока при потенциале –1.80 В, что соответствовало процессу восстановления сгенерированного при $E_{{\text{p}}}^{{{\text{C1}}}}$ никельорганического сигма-комплекса [NiBr(Mes)(bpy)] [15, 16]. Таким образом, мы предполагаем, что квазиобратимый пик восстановления С3 на рис. 2 соответствует восстановлению полученного в ходе электрохимического процесса при потенциале $E_{{\text{p}}}^{{{\text{C1}}}}$ комплекса [NiBr(Tcpp)(bpy)]. Данный эффект свидетельствует о более медленном протекании химической стадии, следующей после электрохимического процесса при $E_{{\text{p}}}^{{{\text{C1}}}}$ в случае Aryl = Tcpp по сравнению с Mes-аналогом. Стоит отметить, что мы также наблюдали увеличение предельного тока при потенциалах окисления свободных бромид-анионов ($E_{{\text{p}}}^{{{\text{А3}}}}$ и $E_{{\text{p}}}^{{{\text{А4}}}}$). Данное изменение интенсивности анодных пиков можно объяснить увеличением количества бромид анионов в растворе за счет их высвобождения при окислительном присоединении 2,4,6-трициклопентилфенил бромида к электрохимически генерируемому комплексу [Ni0(bpy)], образующегося из исходного комплекса [NiBr2(bpy)].
Таблица 1.
Потенциалы пиков (±0.01 В)* на ЦВА-кривых комплекса [NiBr2(bpy)] в отсутствие и в присутствии TcppBr. Концентрация субстратов 5 × 10–3 М в ДМФА в присутствии n-Bu4NBF4 (1 × 10–1 M) (рабочий электрод – СУ, скорость развертки потенциала – 50 мВ/с)
| Состав | Катодные пики | $E_{{\text{p}}}^{{{\text{red}}}}$, В | Анодные пики | $E_{{\text{p}}}^{{{\text{ox}}}}$, В |
|---|---|---|---|---|
| [NiBr2(bpy)] | С1 | –1.44 | А1 | –2.11 |
| С2 | –2.22 | А2 | –1.28 | |
| С3 | +0.70 | А3 | +0.41 | |
| А4 | +0.97 | |||
| [NiBr2(bpy)] в присутствии TcppBr | С1 | –1.47 | А1 | –2.14 |
| С2 | –1.57 | А2 | –1.85 | |
| С3 | –1.95 | А3 | –1.48 | |
| С4 | –2.34 | А4 | –1.33 |
Рис. 2.
ЦВА-кривая комплекса никеля [NiBr2(bpy)] в присутствии одного эквивалента TcppBr, при генерировании [Ni0(bpy)] при потенциале –1.44 В в течение 1 мин. Концентрация субстратов 5 × 10–3 М в ДМФА в присутствии n-Bu4NBF4 (1 × 10–1 M) (рабочий электрод – СУ, скорость развертки потенциала – 50 мВ/с), ЭС – Ag/AgNO3 (1 × 10–2 М раствор в CH3CN). Развертка потенциала от 0.00 до –2.50 В и обратно до 0.00 В.

Значения потенциалов пиков, фиксируемых на ЦВА-кривых для [NiBr2(bpy)] в присутствии TcppBr приведены в табл. 1.
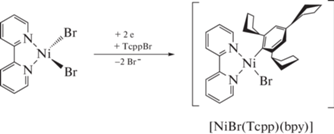
Препаративный электросинтез комплекса [NiBr(Tcpp)(bpy)] проводился в ДМФА с использованием двухэлектродной системы в ячейке без разделения анодного и катодного пространств, снабженной растворимым никелевым анодом и платиновым катодом (схема 1).
Схема 1.
Для установления природы продуктов, образующихся в ходе электрохимического процесса, был использован метод масс-спектрометрии ИЭР. Так, было установлено, что электролиз комплекса никеля [NiBr2(bpy)] в присутствии одного эквивалента TcppBr приводит к образованию никельорганического сигма-комплекса [NiBr(Tcpp)(bpy)]. На рис. 3 представлен мониторинг электрохимического генерирования комплекса никеля [NiBr(Tcpp)(bpy)]. Так, в масс-спектрах реакционной смеси наблюдается уменьшающийся в интенсивности пик m/z 287.9, который соответствует протонированной форме [Ni(DMF)(bpy) + H]+. Также, на масс-спектрах идентифицируются увеличивающиеся в интенсивности пики ионов, соответствующие катионным комплексам состава [Ni(Tcpp)(bpy)]+ (m/z 495.2) и [Ni(DMF)(Tcpp)(bpy)]+ (m/z 568.3).
Рис. 3.
Мониторинг электрохимического генерирования никельорганического комплекса [NiBr(Tcpp)(bpy)] методом масс-спектрометрии ИЭР.

Стоит отметить, что после 30 мин от начала электролиза образования целевого продукта не наблюдалось, тогда как масс-спектр, зарегистрированный после окончания процесса, содержит пик иона m/z 568.3 со 100%-ной относительной интенсивностью. Данное наблюдение подтверждает медленное протекание химической стадии, следующей после электрохимического процесса. При этом, согласно данным масс-спектрометрии, ИЭР продукт находится в растворе в катионной форме. Так, на рис. 4 представлено теоретическое и экспериментальное изотопное распределение для соответствующих катионных форм комплекса [NiBr(Tcpp)(bpy)], содержащих сигма-связанный Ni-Tcpp фрагмент, [Ni(Tcpp)(bpy)]+ и [Ni(DMF)(Tcpp)(bpy)]+.
Рис. 4.
Теоретическое и экспериментальное изотопное распределение для монокатионных форм [Ni(Tcpp)(bpy)]+ (а) и [Ni(DMF)(Tcpp)(bpy)]+ (б).

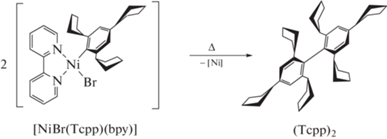
К сожалению, образующийся в реакционной смеси комплекс [NiBr(Tcpp)(bpy)] выделить не удалось. Установлено, что он является неустойчивым и разлагается при выделении с образованием продукта гомо-сочетания – биарила (Tcpp)2 (схема 2). Образование данного биарила было установлено методом хромато-масс-спектрометрии, а его молекулярная структура была подтверждена рентгенодифракционным методом (рис. 5).
Схема 2.
Рис. 5.
Геометрия молекулы биарила (Tcpp)2 в кристалле (эллипсоиды анизотропных смещений показаны с вероятностью 50%, атомы водорода не показаны для ясности).

По рентгенодифракционным данным 2,2',4,4',6,6'-гексациклопентил-1,1'-бифенил (Tcpp)2 кристаллизуется в триклинной пространственной группе P $\bar {1}$ с четырьмя молекулами в асимметрической части элементарной ячейки. Эти молекулы принимают близкие конформации с торсионным углом между плоскостями бензольных колец около 91°–96°, причем три из четырех молекул демонстрируют разупорядоченность нескольких гексациклопентильных фрагментов, а четвертая молекула оказывается полностью разупорядоченной.
Стоит отметить, что образование подобных биарильных производных (Ph)2 и (Tol)2 (Tol = орто-толил) из соответствующих низкостабильных комплексов [NiBr(Ph)(bpy)] и [NiBr(Tol)(bpy)] было описано ранее [32], однако использование ди-орто-замещенных ароматических фрагментов (например, Mes, Tipp, Tchp и т.д.) традиционно приводило к образованию стабильных органических производных никеля [27]. В частности, [NiBr(Tchp)(bpy)] был охарактеризован рентгеновской дифракцией [19]. Таким образом, полученный нами здесь результат представляет собой необычное поведение для стерически затрудненного сигма-комплекса никеля. Причем ранее образование (Ph)2 и (Tol)2 наблюдалось в результате электрохимического процесса с образованием NiI интермедиата и комплексов состава [Ni(Aryl)2(bpy)]. Однако, анализ продуктов электролиза [NiBr2(bpy)] в присутствии TcppBr методом масс-спектрометрии ИЭР не выявил образования соединения [Ni(Tcpp)2(bpy)], что говорит о протекании процесса димеризации после окончания электролиза из образованного в ходе электрохимического процесса никельорганического сигма-комплекса [NiBr(Tcpp)(bpy)].
Механизм разложения сигма-комплекса [NiBr(Aryl)(bpy)] может включать образование интермедиата [Ni(Aryl)2(bpy)] и его разложение с образованием биарила и комплекса никеля (0), мгновенно вступающего в дальнейшие превращения.
(1)
$\begin{gathered} {\text{2[NiBr(Aryl)(bpy)] = }} \\ {\text{ = [Ni(Aryl}}{{{\text{)}}}_{{\text{2}}}}{\text{(bpy)] + [NiB}}{{{\text{r}}}_{{\text{2}}}}{\text{(bpy)] ,}} \\ \end{gathered} $(2)
${\text{[Ni(Aryl}}{{{\text{)}}}_{{\text{2}}}}{\text{(bpy)] = (Aryl}}{{{\text{)}}}_{{\text{2}}}}{\text{ + [N}}{{{\text{i}}}^{{\text{0}}}}{\text{(bpy)]}}{\text{.}}$Согласно квантовохимическим расчетам, выполненным для сравнительной характеристики сигма-комплексов с Aryl = Tcpp и Tchp (373 К, 1 атм), реакция (1) характеризуется положительным значением свободной энергии Гиббса, причем чем выше стерическая загруженность ароматического заместителя, тем положительнее значение ΔG373 (27.8 и 58.5 ккал/моль для комплексов с Aryl = Tcpp и Tchp соответственно). Появление продукта (Aryl)2 в реакционной смеси, по-видимому, может быть обусловлено смещением химического равновесия вследствие высокой реакционной способности образующегося комплекса никеля (0).
Известно, что длина связи металл–углерод косвенно определяет ее реакционную способность [17]. На рис. 6 приведены оптимизированные структуры комплексов [NiBr(Tcpp)(bpy)] и [NiBr(Tchp)(bpy)]. Расстояния Ni–C в этих структурах близки и равны 1.925 и 1.924 Å для комплексов с Aryl = Tcpp и Tchp соответственно.
Полученные результаты позволяют предположить, что ключевую роль в специфическом поведении сигма-комплекса с Aryl = Tcpp играют межмолекулярные взаимодействия. В случае сигма-комплекса [NiBr(Tchp)(bpy)] в растворе формируется эффективная сетка межмолекулярных взаимодействий, которая мешает двум молекулам сигма-комплекса занять благоприятную для реакции (1) взаимную ориентацию. В случае сигма-комплекса [NiBr(Tcpp)(bpy)] межмолекулярные взаимодействия слабее, что уменьшает время жизни сигма-комплекса и способствует его разложению с образованием (Tcpp)2. Одним из аргументов в пользу высказанного предположения о ключевой роли межмолекулярных взаимодействий также может служить тот факт, что в обычных условиях TchpBr представляет собой кристаллическое соединение, а TcppBr – жидкость.
ЗАКЛЮЧЕНИЕ
Таким образом, в результате проведенных исследований было установлено, что электрохимическое восстановление раствора, содержащего [NiBr2(bpy)] и TcppBr, приводит к образованию никельорганического комплекса [NiBr(Tcpp)(bpy)], который, в отличие от своих аналогов [Ni Br(Mes)(bpy)] и [NiBr(Tchp)(bpy)], является термически лабильным и распадается с образованием продукта гомо-сочетания, ранее не описанного в литературе, стерически затрудненного биарила 2,2',4,4',6,6'-гексациклопентил-1,1'-бифенила (Tcpp)2, который был охарактеризован методами ЯМР-спектроскопии и масс-спектрометрии, а его структура в кристалле подтверждена рентгенодифракционным методом. Полученные результаты расширяют круг синтетических подходов к синтезу труднодоступных биарилов, а также раскрывают специфическое поведение никельорганического сигма-комплекса [NiBr(Tcpp)(bpy)] по сравнению с другими представителями семейства комплексов типа [NiBr(Aryl)(bpy)]. Описанные исследования могут служить фундаментальной основой для дизайна практически значимых органических соединений.
Список литературы
Petit, J., Magna, L., and Mézailles, N., Alkene oligomerization via metallacycles: Recent advances and mechanistic insights, Coord. Chem. Rev., 2022, vol. 450, 214 227.
Гафуров, З.Н., Кантюков, А.О., Кагилев, А.А., Сахапов, И.Ф., Лукони, Л., Россин, А., Джамбастиани, Д., Бабаев, В.М., Исламов, Д.Р., Усачев, К.С., Синяшин, О.Г., Яхваров, Д.Г. Электрохимическое генерирование пиразолил-пиридильных N-гетероциклических карбеновых комплексов никеля. Электрохимия. 2021. Т. 57. С. 110. [Gafurov, Z.N., Kantyukov, A.O., Kagilev, A.A., Sakhapov, I.F., Luconi, L., Rossin, A., Giambastiani, G., Babaev, V.M., Islamov, D.R., Usachev, K.S., Sinyashin, O.G., and Yakhvarov, D.G., Electrochemical Generation of Pyrazolyl-Pyridyl N-Heterocyclic Carbene Complexes of Nickel, Russ. J. Electrochem., 2021, vol. 57, p. 134.]
Huang, H.-M., Bellotti, P., Erchinger, J.E., Paulisch, T.O., and Glorius, F. J., Radical Carbonyl Umpolung Arylation via Dual Nickel Catalysis, J. Amer. Chem. Soc., 2022, vol. 144, p. 1899.
Wang, H., Liu, C.F., Martin, R.T., Gutierrez, O., and Koh, M.J., Directing-group-free catalytic dicarbofunctionalization of unactivated alkenes, Nat. Chem., 2022, vol. 14, p. 188.
Schäfer, P., Hamprecht, G., Puhl, M., Westphalen, K.O., and Zagar, C., Synthesis and herbicidal activity of phenylpyridines - A new lead, Chimia (Aarau), 2003, vol. 57, p. 715.
Bringmann, G., Rüdenauer, S., Bruhn, T., Benson, L., and Brun, R., Total synthesis of the antimalarial naphthylisoquinoline alkaloid 5-epi-4′-O-demethylancistrobertsonine C by asymmetric Suzuki cross-coupling, Tetrahedron, 2008, vol. 64, p. 5563.
Hajipour, A.R. and Rafiee, F., Synthesis of substituted biaryls via Suzuki, Stille and Hiyama cross-coupling and homo-coupling reactions by CN-dimeric and monomeric ortho-palladated catalysts, Appl. Organomet. Chem., 2013, vol. 27, p. 412.
Hassan, J., Sévignon, M., Gozzi, C., Schulz, E., and Lemaire, M., Aryl-aryl bond formation one century after the discovery of the Ullmann reaction, Chem. Rev., 2002, vol. 102, p. 1359.
Gafurov, Z.N., Kantyukov, A.O., Kagilev, A.A., Kagileva, A.A., Sakhapov, I.F., Mikhailov, I.K., and Yakhvarov, D.G., Recent advances in chemistry of unsymmetrical phosphorus-based pincer nickel complexes: From design to catalytic applications, Molecules, 2021, vol. 26, 13.
Zagidullin, A.A., Sakhapov, I.F., Miluykov, V.A., and Yakhvarov, D.G., Nickel complexes in C‒P bond formation, Molecules, 2021, vol. 26, 17.
Gafurov, Z.N., Zueva, E.M., Bekmukhamedov, G.E., Kagilev, A.A., Kantyukov, A.O., Mikhailov, I.K., Khayarov, K.R., Petrova, M.M., Dovzhenko, A.P., Rossin, A., Giambastiani, G., and Yakhvarov, D.G., Benzothiazole- vs. pyrazole-based unsymmetrical (PCN) pincer complexes of nickel(II) as homogeneous catalysts in ethylene oligomerization, J. Organomet. Chem., 2021, vol. 949, 121951.
Gafurov, Z.N., Bekmukhamedov, G.E., Kagilev, A.A., Kantyukov, A.O., Sakhapov, I.F., Mikhailov, I.K., Khayarov, K.R., Zaripov, R.B., Islamov, D.R., Usachev, K.S., Luconi, L., and Rossin, A., Unsymmetrical pyrazole-based PCN pincer NiII halides: Reactivity and catalytic activity in ethylene oligomerization, J. Organomet. Chem., 2020, vol. 912, 121163.
Luconi, L., Tuci, G., Gafurov, Z.N., Mercuri, G., Kagilev, A.A., Pettinari, C., Morozov, V.I., Yakhvarov, D.G., Rossin, A., and Giambastiani, G., Unsymmetrical nickel (PCN) pincer complexes with a benzothiazole side-arm: Synthesis, characterization and electrochemical properties, Inorg. Chim. Acta, 2020, vol. 517, 120182.
Ju, L., Lin, Q., LiBretto, N.J., Wagner, C.L., Hu, C.T., Miller, J.T., and Diao, T., Reactivity of (bi-Oxazoline)organonickel Complexes and Revision of a Catalytic Mechanism, J. Amer. Chem. Soc., 2021, vol. 143, p. 14 458.
Yakhvarov, D.G., Tazeev, D.I., Sinyashin, O.G., Giambastiani, G., Bianchini, C., Segarra, A.M., Lönnecke, P., and Hey-Hawkins, E., Electrochemical synthesis of the σ-aryl complex [NiBr(Mes)(bpy)] and its use as catalyst precursor for the oligomerization of ethylene (Mes = 2,4,6-trimethylphenyl, bpy = 2,2′-bipyridine), Polyhedron, 2006, vol. 25, p. 1607.
Яхваров, Д.Г., Трофимова, Е.А., Ризванов, И.Х., Фомина, О.С., Синяшин, О.Г. Электрохимический синтез и каталитическая активность никельорганических сигма-комплексов. Электрохимия. 2011. Т. 47. С. 1180. [Yakhvarov, D.G., Trofimova, E.A., Rizvanov, I.Kh., Fomina, O.S., and Sinyashin O.G., Electrochemical synthesis and catalytic activity of organonickel sigma-complexes, Russ. J. Electrochem., 2011, vol. 47, p. 1100.]
Gafurov, Z.N., Kagilev, A.A., Kantyukov, A.O., Sinyashin, O.G., and Yakhvarov, D.G., The role of organonickel reagents in organophosphorus chemistry, Coord. Chem. Rev., 2021, vol. 438, 213889.
Gafurov, Z.N., Kantyukov, A.O., Kagilev, A.A., Sinyashin, O.G., and Yakhvarov, D.G., Electrochemical methods for synthesis and in situ generation of organometallic compounds, Coord. Chem. Rev., 2021, vol. 442, 213 986.
Sakhapov, I.F., Gafurov, Z.N., Babaev, V.M., Rizvanov, I.K., Dobrynin, A.B., Krivolapov, D.B., Khayarov, K.R., Sinyashin, O.G., and Yakhvarov, D.G., First example of organonickel complex bearing three cyclic substituents in the σ-bonded aromatic ring: Bromo[(2,2’ -bipyridine)-2,4,6-tricyclohexylphenylnickel], Mendeleev Commun., 2016, vol. 26, p. 131.
Сахапов, И.Ф., Гафуров, З.Н., Бабаев, В.М., Курмаз, В.А., Мухаметбареев, Р.Р., Ризванов, И.Х., Синяшин, О.Г., Яхваров. Д.Г. Электрохимические свойства и реакционная способность никельорганического сигма-комплекса [NiBr(Mes)(bpy)] (Mes = 2,4,6-триметилфенил, bpy = 2,2′-бипиридил). Электрохимия. 2015. Т. 51. С. 1197. [Sakhapov, I.F., Gafurov, Z.N., Babaev, V.M., Kurmaz, V.A., Mukhametbareev, R.R., Rizvanov, I.Kh., Sinyashin, O.G., and Yakhvarov, D.G., Electrochemical properties and reactivity of organonickel sigma-complex [NiBr(Mes)(bpy)] (Mes = 2,4,6-trimethylphenyl, bpy = 2,2′-bipyridine), Russ. J. Electrochem., 2015, vol. 51, p. 1061.]
Magallón, C., Griego, L., Hu, C.H., Company, A., Ribas, X., and Mirica, L.M., Organometallic Ni(II), Ni(III), and Ni(IV) complexes relevant to carbon–carbon and carbon–oxygen bond formation reactions, Inorg. Chem. Front., 2022. https://doi.org/10.1039/D1QI01486B
Gafurov, Z.N., Musin, L.I., Sakhapov, I.F., Babaev, V.M., Musina, E.I., Karasik, A.A., Sinyashin, O. G., and Yakhvarov, D.G., The formation of secondary arylphosphines in the reaction of organonickel sigma-complex [NiBr(Mes)(bpy)], where Mes = 2,4,6-trimethylphenyl, bpy = 2,2′-bipyridine, with phenylphosphine, Phosphorus, Sulfur Silicon Relat. Elem., 2016, vol. 191, p. 1475.
Gafurov, Z.N., Sakhapov, I.F., Kagilev, A.A., Kantyukov, A.O., Khayarov, K.R., Sinyashin, O.G., and Yakhvarov, D.G., The formation of mesitylphosphine and dimesitylphosphine in the reaction of organonickel σ-complex [NiBr(Mes)(bpy)] (Mes = 2,4,6-trimethylphenyl, bpy = 2,2'-bipyridine) with phosphine PH3, Phosphorus, Sulfur Silicon Relat. Elem., 2020, vol. 195, p. 726.
Gafurov, Z.N., Sinyashin, O.G., and Yakhvarov, D.G., Electrochemical methods for synthesis of organoelement compounds and functional materials, Pure Appl. Chem., 2017, vol. 89, p. 1089.
Gafurov, Z.N., Zueva, E.M., and Yakhvarov, D.G., Sustainable Synthesis, NMR and Computational Study of Isobutylmesitylphosphine, ChemistrySelect, 2021, vol. 6, p. 1833.
Гафуров, З.Н., Сахапов, И.Ф., Бабаев, В.М., Добрынин, А.Б., Курмаз, В.А., Метлушка, К.Е., Ризванов, И.Х., Шайхутдинова, Г.Р., Синяшин, О.Г., Яхваров, Д.Г. Исследование реакционной способности никельорганических сигма-комплексов по отношению к нитрилам. Известия Академии наук. Серия химическая. 2017. Т. 66. С. 254. [Gafurov, Z.N., Sakhapov, I.F., Babaev, V.M., Dobrynin, A.B., Kurmaz, V.A., Metlushka, K.E., Rizvanov, I.K., Shaikhutdinova, G.R., Sinyashin, O.G., and Yakhvarov, D.G., Study of the reactivity of organonickel sigma-complexes towards nitriles, Russ. Chem. Bull., 2017, vol. 66, p. 254.]
Yakhvarov, D.G., Khusnuriyalova, A.F., and Sinyashin, O.G., Electrochemical synthesis and properties of organonickel σ-complexes, Organometallics, 2014, vol. 33, p. 4574.
Yakhvarov, D., Trofimova, E., Sinyashin, O., Kataeva, O., Budnikova, Y., Lönnecke, P., Hey-Hawkins, E., Petr, A., Krupskaya, Y., Kataev, V., Klingeler, R., and Büchner, B., New dinuclear nickel(II) complexes: Synthesis, structure, electrochemical, and magnetic properties, Inorg. Chem., 2011, vol. 50, p. 4553.
Sheldrick, G.M., and SHELXT: Integrating space group determination and structure solution, Acta Crystallogr., Sect. A: Found. Adv., 2015, vol. 71, p. 3.
Sheldrick, G.M., Crystal structure refinement with SHELXL, Acta Crystallogr., Sect. C: Struct. Chem., 2015, vol. 71, p. 3.
Frisch, M.J., Trucks, G.W., Schlegel, H.B., Scuseria, G.E., Robb, M.A., Cheeseman, J.R., Scalmani, G., Barone, V., Mennucci, B., Petersson, G.A., Nakatsuji, H., Caricato, M., Li, X., Hratchian, H.P., Izmaylov, A.F., Bloino, J., Zheng, G., Sonnenberg, J.L., Hada, M., Ehara, M., Toyota, K., Fukuda, R., Hasegawa, J., Ishida, M., Nakajima, T., Honda, Y., Kitao, O., Nakai, H., Vreven, T., Montgomery Jr., J.A., Peralta, J.E., Ogliaro, F., Bearpark, M., Heyd, J.J., Brothers, E., Kudin, K.N., Staroverov, V.N., Keith, T., Kobayashi, R., Normand, J., Raghavachari, K., Rendell, A., Burant, J.C., Iyengar, S.S., Tomasi, J., Cossi, M., Rega, N., Millam, J.M., Klene, M., Knox, J.E., Cross, J.B., Bakken, V., Adamo, C., Jaramill, J., and Fox, D.J., Gaussian 09, Revision D.01, Gaussian, Inc., Wallingford CT, 2009.
Яхваров, Д.Г., Будникова, Ю.Г., Синяшин, О.Г. Никельорганические σ-комплексы-ключевые интермедиаты электрокаталитических циклов. Электрохимия. 2003. Т. 39. С. 1407. [Yakhvarov, D.G., Budnikova, Y.G., and Sinyashin, O.G., Organonickel σ-complexes—Key intermediates of electrocatalytic cycles, Russ. J. Electrochem., 2003, vol. 39, p. 1261.]
Дополнительные материалы отсутствуют.