Электрохимия, 2022, T. 58, № 4, стр. 188-199
Дизайн твердотельного литиевого аккумулятора c LiFePO4-катодом и полимерным гель-электролитом с наночастицами диоксида кремния
Г. Р. Баймуратова a, *, К. Г. Хатмуллина a, b, А. В. Юдина a, О. В. Ярмоленко a, **
a Институт проблем химической физики РАН
Черноголовка, Россия
b Национальный исследовательский университет “МЭИ”
Москва, Россия
* E-mail: guzalia.rb@yandex.ru
** E-mail: oyarm@mail.ru
Поступила в редакцию 12.03.2021
После доработки 23.08.2021
Принята к публикации 10.09.2021
- EDN: APWYGF
- DOI: 10.31857/S0424857022030045
Аннотация
Разработан дизайн прототипа твердотельного литиевого аккумулятора с LiFePO4-катодом и нанокомпозитным полимерным гель-электролитом. Для лучшей совместимости границы твердый электролит/электрод была использована концепция асимметричного твердотельного электролита, где со стороны лития был использован переходный слой из наночастиц диоксида кремния, а со стороны катода – слой жидкого электролита. Была проведена оптимизация состава жидкого электролита. Показано, что для создания переходного ион-проводящего слоя между нанокомпозитным полимерным гель-электролитом и LiFePO4-катодом лучшим является 1 М раствор LiTFSI в смеси диоксолан/диметоксиэтан (2 : 1), в то время как для синтеза сетчатого полимерного гель-электролита был использован 1 М LiBF4 в гамма-бутиролактоне, как инертная жидкая среда для реакции полимеризации по радикальному механизму. Сравнительные испытания в прототипах Li//LiFePO4-аккумуляторов показали, что при использовании твердого электролита на основе диакрилата полиэтиленгликоля с 6% SiO2 с асимметричной границей достигается максимальная емкость LiFePO4-катода 170 мА ч/г.
ВВЕДЕНИЕ
Перспективным классом электролитов для полностью твердотельных литиевых и литий-ионных аккумуляторов являются нанокомпозитные полимерные электролиты (НПЭ), имеющие повышенную безопасность при эксплуатации [1‒3]. НПЭ обычно состоят из трех или четырех компонентов, таких как соль электролита, полимер, неорганические наночастицы, органический растворитель или ионная жидкость. В обзорах [1‒3] показан положительный вклад наночастиц как в механические, так и электрохимические свойства полимерных электролитов (увеличение проводимости, уменьшение сопротивления переноса заряда на границе электрод/электролит, расширение окна электрохимической стабильности электролита на границе с литиевым электродом).
Увеличение ионной проводимости в НПЭ может происходить за счет различных эффектов: увеличение разупорядоченности системы [4, 5], взаимодействие нанонаполнителя с солью или полимером по типу кислота–основание Льюиса [6], увеличение ионной подвижности [7, 8], увеличение чисел переноса [9, 10], увеличение сегментарного движения полимера [11], электростатические взаимодействия между ионами и частицами нанонаполнителя [12], образование пространственного заряда [13], создание новых благоприятных путей проводимости [7] и перколяционных эффектов [14]. В реальных системах повышение ионной проводимости может осуществляться по тому или иному механизму, а возможно проявление сразу нескольких механизмов из перечисленных выше. Вполне возможно, что комбинация двух и более механизмов будет более эффективна, чем один.
Обычно в работах по исследованию НПЭ все эти механизмы накладываются, и проявляется один пик на зависимости проводимости от концентрации наночастиц (SiO2, TiO2, ZrO2, глина и т.д.) [3, 15, 16]. Очень редко встречаются нанокомпозитные системы, где при небольшом количестве нанопорошка проявляется еще один максимум [9, 17–22]. Авторы относят этот пик к увеличению носителей заряда, вызванный ионной диссоциацией соли, а второй основной пик к созданию новых благоприятных путей проводимости и/или перколяционному эффекту. Эффект увеличения ионной диссоциации соли лития преимущественно проявляется на поверхности наночастиц SiO2. Данный эффект был отдельно изучен на примере полой наночастицы диоксида кремния в работе Lee и др. [23]. Авторы [23] показали, что чем меньше диаметр частиц, тем большее количество молекул соли лития будет вовлечено в процесс диссоциации и тем выше будет количество подвижных ионов, которые вносят вклад в проводимость. Перколяционный эффект в НПЭ был исследован в работе [24], где методом ЯМР с импульсным градиентом магнитного поля показано 10-кратное увеличение значения коэффициента самодиффузии на ядрах 7Li вблизи поверхности наночастиц TiO2 в НПЭ состава диакрилат полиэтиленгликоля/LiBF4. Этот результат согласуется с теоретическими расчетами взаимодействия ионов Li+ с кластерами TiO2 [25], где была смоделирована молекулярная динамика НПЭ на основе системы полиэтиленоксид (ПЭО)/LiBF4–ТiO2. Введение наночастиц TiO2 привело к образованию высокоструктурированного слоя толщиной 5–6 Å, в котором ионы Li+ имели подвижность на порядок величины больше по сравнению с объемом ПЭО/LiBF4. ПЭО и ионы в слоях, расположенных на расстоянии от 6 до 15 Å от наночастицы TiO2, также показали некоторое структурирование. На свойства слоя ПЭО/LiBF4, который удален более чем на 15 Å, присутствие наночастицы TiO2 не повлияло. Таким образом, наночастицы оказывают сильное влияние на ионную проводимость в НПЭ.
Несмотря на явные преимущества НПЭ, они имеют высокие сопротивления на межфазной границе электролит/электрод, что серьезно препятствует их коммерциализации. Существует разные подходы к решению этой проблемы. Одним из самых удобных способов является введение небольшого количества дополнительных жидких электролитов. Этот подход в первую очередь оправдан для систем, где в качестве электродных материалов используются пористые структуры (углеродный анод, LiFePO4 или LiCoO2 катоды и т.д.). В таких твердотельных аккумуляторах контакт между твердыми электролитами и электродами не эффективный в результате разной морфологии поверхности. На рис. 1 приведена схема заполнения контакта между двумя твердыми поверхностями электрода и электролита жидкой фазой, для которого введен термин “жидкофазная терапия” [26].
Надо понимать, что “жидкофазная терапия” заключается во введении жидких электролитов на межфазную границу электрод/электролит для увеличения обратимости электродной реакции за счет пропитки пористых катодов.
Рассмотрим литиевый твердотельный аккумулятор [27–30]. В нем может существовать несколько межфазных границ: 1) твердый электролит/литиевый анод, 2) твердый электролит/катод, 3) жидкий электролит/катод, 4) твердый электролит/жидкий электролит.
Для первой границы (c литием) ограниченный и неравномерный межфазный контакт твердого тела с твердым телом приводит к медленной миграции ионов, а также образованию дендритов Li на анодах [31–35]. Для образования переходного слоя на этой границе авторы работы [36] впервые применили “жидкофазную терапию”, введя карбонатные электролиты в качестве пленкообразующих добавок для образования межфазного слоя SEI (solid electrolyte interphase) между оксидными твердотельными электролитами и литием. После того авторы работ [37, 38] также использовали этот прием для модификации границы с литием и натрием. В работе [39] применили данную технику, уже комбинируя жидкую фазу с полимерной, или используя чисто полимерный подход [40, 41]. Появились и теоретические работы по разработке дизайна межфазных границ в твердотельном аккумуляторе [42, 43].
Для нанокомпозитных полимерных гель-электролитов реализуются другие способы формирования проводящего слоя SEI [44, 45] на поверхности лития. В случае использования НПЭ в работах [46, 47] показано, что в присутствии оксидных наночастиц (SiO2, TiO2, Al2O3 и т.п.) сопротивление на границе с металлическим литием уменьшается. Этому способствует два процесса. Первое, контакт полимерный электролит–литий не приводит к росту SEI большой толщины, как это происходит в жидкой фазе. Второе, оксидные наночастицы при их оптимальном содержании способны образовывать благоприятные пути для транспорта ионов лития [45, 47]. Поэтому, в случае использования НПЭ “жидкофазная терапия” на границе с литием является лишней.
Рассмотрим границу твердый электролит/катод [48, 49]. Понятно, что из-за отсутствия плотного контакта (рис. 1) здесь необходимо использовать “жидкофазную терапию”. Далее сразу возникает новая межфазная граница – жидкий электролит/катод [50, 51]. Здесь сопротивление переноса ионов Li+ в основном зависит от катода. Структура катода во время процесса заряда–разряда влияет на интеркаляцию и экстракцию ионов Li+. Так, например, в работе [52] было показано, что процесс десольватации ионов лития перед попаданием в катод на основе фторированных двойных оксидов марганца и никеля состоит из нескольких ступеней. Сначала происходит адсорбция сольватированных ионов лития, затем процесс их частичной десольватации, их миграция по поверхности катода с оставшимися молекулами растворителя и, наконец, отрыв последних молекул растворителя и внедрение иона лития в решетку активного материала электрода.
Работ, посвященных исследованию границы между жидкими и твердыми электролитами намного меньше, чем работ по изучению электродных границ [53–56]. В работе [57] описано динамическое образование межфазной границы твердый–жидкий электролит на примере керамики состава Li1 +xAlxGe2 –x(PO4)3. Показано, что жидкий электролит 1 М LiTFSI в смеси диоксолан–диметоксиэтан образует межфазный слой на керамической поверхности.
Недавно авторы работы [58] выдвинули концепцию асимметричного твердотельного электролита. В качестве полимерной матрицы был использован метакрилат полиэтиленгликоля. Со стороны литиевого анода поверхность полимерного электролита модифицировали жестким керамическим слоем (7.5 нм), который имел высокий модуль упругости для подавления образования дендритов Li. А со стороны катода, наоборот, мягкий полимерный слой обеспечивал хороший контакт за счет эластичных свойств, и межфазное сопротивление на границе уменьшалось. Аналогичный подход к созданию гибридных электролитов был использован в работах [59, 60].
Таким образом, целью настоящего исследования является разработка прототипа твердотельного литиевого аккумулятора с асимметричным твердым НПЭ на основе диакрилат полиэтиленгликоля с высокой ионной проводимостью порядка 10–3 См/см, синтез и исследование которого были проведены ранее [21, 47, 61]. В работе [47] была предпринята попытка собрать твердотельный литиевый аккумулятор с исходным НПЭ, но из-за высокого сопротивления на границе НПЭ/LiFePO4-катод стабильных значений емкости получить не удалось. Поэтому, задачей настоящего исследования является достижение высоких электрохимических показателей прототипа Li//LiFePO4-аккумулятора путем реализации приема “жидкофазной терапии” на границе НПЭ/катод.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Компоненты полимерных электролитов
Диакрилат полиэтиленгликоля ДАк-ПЭГ (Aldrich), Mn = 575
Наночастицы SiO2 марки Аэросил 380 (поверхность 380 м2/г, средний размер частиц 7 нм) имели гидрофильную пористую поверхность, pH (в 4%-ной водной дисперсии) 3.6–4.3. Перекись бензоила (ПБ) (Aldrich) очищали перекристаллизацией из хлороформа с последующей осушкой при комнатной температуре сначала на воздухе, потом в вакууме. Составы жидких электролитов: 1) 1 М раствор LiBF4 гамма-бутиролактоне (ГБЛ) (производства ЗАО “Экотех”, Россия), содержание воды 0.008 мас. %; 2) 1 М LiN(CF3SO2)2 (LiTFSI) в смеси диоксолан/диметоксиэтан (ДОЛ/ДМЭ) (2 : 1).
Компоненты электродов
В качестве анодов использовали прокатанную литиевую фольгу производства ОАО “Литий-элемент” (Саратов). Компоненты катода: LiFePO4 (MTI Corporation), сажа марки Timcal Super C65 (MTI Corporation); полимерное связующее поливинилидендифторид (ПВДФ) марки HSV 900 (KynarFlex). Состав катода (мас. %): LiFePO4/сажа /ПВДФ = 75/20/5.
Синтез образцов полимерного электролита
Для приготовления полимерных электролитов (ПЭ) навески олигомера ДАк-ПЭГ из расчета 15 мас. %, жидкого электролита и перекиси бензоила (1 мас. %) перемешивали на магнитной мешалке в течение 30–60 мин при 50°С до полного растворения кристаллов ПБ. Затем добавляли нанопорошок SiO2 (от 2 до 10 мас. %) и перемешивали на магнитной мешалке в течение 1 ч. Подготовленную нанокомпозитную смесь помещали между двух стекол размером 90 × 115 мм, обработанных антиадгезивным раствором. Методика подготовки стеклянного реактора для синтеза полимерного электролита описана в работе [62]. Отверждение смеси проводили по выбранному в работе [61] ступенчатому режиму: 60°С – 3 ч, 70°С – 1 ч, 80°С – 1 ч, 120°С – 1 ч. При этом получались прозрачные пленки толщиной ~0.3 мм и максимальным размером 80 × 105 мм.
Приготовление катода и сборка ячеек
В бюксе готовили раствор ПВДФ в N-метилпирролидоне (NMP) из расчета 2.5 мл растворителя на 1 г катодного материала, перемешивая смесь при 50°С на магнитной мешалке до полного растворения полимера. В бюкс с полученным раствором ПВДФ в NMP засыпали смесь порошка LiFePO4 и сажи, предварительно перетертую в ступке. Смесь перемешивали в течение 4 ч при 50°С на магнитной мешалке, полученную катодную массу наносили на графитированную алюминиевую подложку (d = 20 мкм) с помощью прибора Doctor Blade при нагревании 150°С в течение 4 ч, до полного удаления растворителя. Затем прессовали на вальцах. Прессованные катоды сушили в сушильном шкафу ТЕРМИКС СНОЛ-3,5.3,5.3,5/3,5-И5М (Россия) в течение 8 ч при температуре 120°С для удаления остатков растворителя. Масса LiFePO4 на электроде 1.0–1.3 мг/см2, толщина катода – 35 мкм.
В аргоновом боксе были собраны ячейки в герметичных дисковых корпусах СR 2032 следующего состава: симметричные LiFePO4//LiFePO4 – для исследований методом электрохимического импеданса, и Li//LiFePO4 – для исследований методом гальваностатического циклирования. В ячейках с жидким электролитом использовался полипропиленовый сепаратор Celgard (Франция) толщиной 20 мкм, который пропитывали ~25 мкл электролита.
Приборы
Толщину пленок измеряли с помощью цифрового микрометра МК Ц25 с погрешностью 0.0004 см.
Для измерения методом электрохимического импеданса в симметричных ячейках LiFePO4//LiFePO4 использовали импедансметр Z-2000 фирмы Elins (Россия) (интервал частот 1 Гц–600 кГц) с амплитудой сигнала 10 мВ.
Тестирование ячеек Li//LiFePO4 проводили на приборе BTS 5V10mA (Shenzhen Neware electronic Co., LTD, Китай) в гальваностатическом режиме С/10 в диапазоне 2.6–3.8 В.
Величину тока заряда/разряда (С) рассчитывали из теоретического значения удельной емкости (Стеор) с учетом массы активного слоя на электроде.
Исследование термической стабильности полимерных электролитов было проведено методом термогравиметрического анализатора (ТГА) TGA/DSC 3+ (METTLER TOLEDO). Измерения проводили от комнатной температуры до 150°С.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В результате синтеза образцов были получены 6 составов нанокомпозитных полимерных электролитов с массовым содержанием компонентов, представленных в табл. 1. Мольное соотношение основных компонентов электролитов было примерно одинаково: на 1 моль соли LiBF4 приходилось 0.3 моля ДАк-ПЭГ575 и 10.5 моля растворителя гамма-бутиролактона (состав НПЭ № 1).
Таблица 1.
Составы синтезированных нанокомпозитных полимерных электролитов
| № состава НПЭ | Исходные компоненты НПЭ, мас. % | |||
|---|---|---|---|---|
| ДАк-ПЭГ575 | SiO2 | 1 М LiBF4 в ГБЛ | ПБ | |
| 1 | 15 | 0 | 84 | 1 |
| 2 | 15 | 2 | 82 | 1 |
| 3 | 15 | 4 | 80 | 1 |
| 4 | 15 | 6 | 78 | 1 |
| 5 | 15 | 8 | 76 | 1 |
| 6 | 15 | 10 | 74 | 1 |
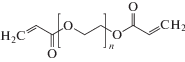
На первом этапе работы была исследована термическая стабильность образцов НПЭ. Термограммы образцов НПЭ составов с 1 по 6 (табл. 1) приведены на рис. 2.
Рис. 2.
Термограммы образцов пленок электролитов: 1 – без введения SiO2; с введением SiO2: 2 – 2 мас. %; 3 – 4 мас. %; 4 – 6 мас. %; 5 – 8 мас. %; 6 – 10 мас. %.
Из рис. 2 видно, что потеря массы полимерного гель-электролита без введения наночастиц SiO2 при 50°С в 2–3 раза превосходит составы НПЭ с добавками SiO2. В условиях проведения эксперимента (в открытом состоянии) пленки НПЭ составов 3–6 начинают терять растворитель ГБЛ, начиная с 50°С. Лучшие показатели по термоустойчивости у НПЭ № 4, с 6 мас. % SiO2. Данный состав НПЭ имеет и лучшие механические свойства [61], его модуль упругости имеет максимальное значение среди всех составов 16 МПа.
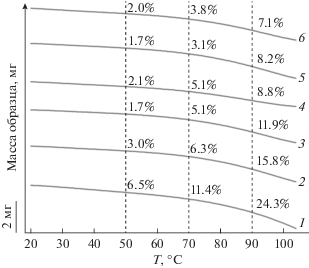
Ранее в работе [47] были собраны и изучены ячейки Li//LiFePO4 с исходным полимерным электролитом и НПЭ с 6 мас. % SiO2. Результаты ресурсных испытаний представлены на рис. 3.
Рис. 3.
Зависимость разрядной емкости и кулоновской эффективности ячейки Li//LiFePO4 от номера цикла заряда–разряда, где 1 – ПЭ без добавок, 2 – НПЭ с 6 мас. % SiO2 при режиме тока заряда (С/10)– разряда (С/5) [47].
Из рис. 3 видно, что ячейка с нанокомпозитным электролитом показывает более высокую разрядную емкость и кулоновскую эффективность в течение 50 циклов заряда–разряда. Причем, если для ПЭ без добавок SiO2 наблюдается эффект разработки в течение 10 циклов, то для НПЭ этот процесс не характерен, что говорит о лучшей совместимости границы электрод/электролит [47]. Общая тенденция к деградации ячеек обоих типов может быть вызвана большой величиной сопротивления на границе с LiFePO4-катодом.
В данной работе была изучена совместимость границы НПЭ с LiFePO4-катодом методом электрохимического импеданса в LiFePO4//LiFePO4-ячейках. Для этого собирали ячейки пуговичного типа с НПЭ с 6 мас. % SiO2 и различными вариантами обработки поверхности LiFePO4-катода. Составы электролитов и способ обработки поверхности LiFePO4-катодов указаны в табл. 2.
Таблица 2.
Составы электролитов и способ обработки поверхности LiFePO4-катодов
| № ячейки | № 1 | № 2 | № 3 | № 4 | № 5 |
|---|---|---|---|---|---|
| Электролит | НПЭ с 6 мас. % SiO2 | НПЭ с 6 мас. % SiO2 | НПЭ с 6 мас. % SiO2 | 1 M LiBF4 в ГБЛ* | 1 М LiTFSI в ДОЛ/ДМЭ (2 : 1)* |
| Обработка LiFePO4 | Нет | 1 M LiBF4 в ГБЛ | 1 М LiTFSI в ДОЛ/ДМЭ (2 : 1) | Нет | Нет |
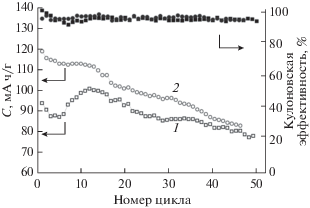
На рис. 4 приведены типичные годографы импеданса LiFePO4//LiFePO4-ячеек с различными электролитами и соответствующие им эквивалентные схемы ячеек, где R1 – сопротивление электролита, R2 – сопротивление границы электрод/электролит, а элемент постоянного угла сдвига фаз (CPE1) относится к емкости двойного электрического слоя, W1 – элемент Варбурга.
Рис. 4.
Годографы импеданса ячеек LiFePO4//LiFePO4, где: (а) ячейка № 1; (б) ячейка № 2; (в) ячейка № 3; (г) ячейка № 4; (д) ячейка № 5 и соответствующие им эквивалентные схемы.
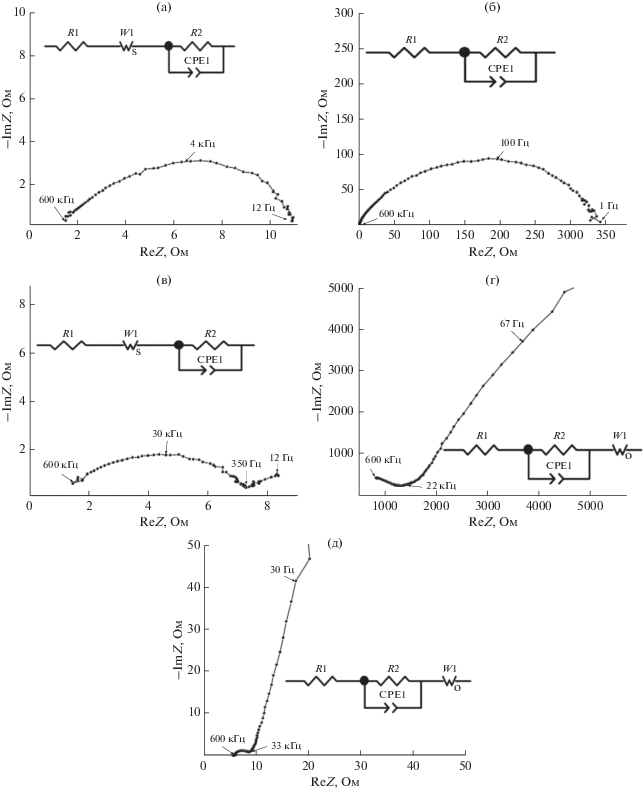
Из рис. 4 видно, что в эквивалентной схеме ячеек № 4 и 5 с жидкими электролитами элемент Варбурга (W1) является открытым, то есть проявляется при низких частотах, а с НПЭ (ячейки № 1 и 3) – закрытым (при высоких частотах). В первом случае ионы не могут в процессе диффузии переместиться через всю ячейку. Во втором случае, при малых частотах большое количество ионов, которые достигли противоположного электрода, может интеркалироваться в него и передать электрон во внешнюю цепь.
Годограф импеданса ячейки № 4 (рис. 4г) свидетельствует о максимальном сопротивлении (825 Ом) на границе электролит/LiFePO4. Данный результат является худшим, и электролит состава 1 М LiBF4 в гамма-бутиролактоне для сборки ячеек Li//LiFePO4 не применялся.
Из рис. 4 видно, что сопротивление на границе электролит/LiFePO4 минимально у ячейки №3. Исходя из этого, для испытаний в прототипах аккумуляторов были выбраны НПЭ и обработка поверхности LiFePO4-катодов 1 М раствором LiTFSI в ДОЛ/ДМЭ (2 : 1).
Далее были проведены испытания аккумуляторов Li//LiFePO4 с НПЭ содержанием SiO2 (0, 2, 4 и 6 мас. %). При сборке ячеек поверхность катода пропитывали жидким электролитом, а поверхность металлического лития оставалась “сухой”. Вид заряд-разрядных характеристик данных аккумуляторов приведен на рис. 5.
Рис. 5.
Заряд-разрядные характеристики ячеек Li//LiFePO4: (а) с 1 М LiTFSI в ДОЛ/ДМЭ (2 : 1); (б) с полимерным гель-электролитом; (в) с НПЭ с 2 мас. % SiO2; (г) с НПЭ с 4 мас. % SiO2; (д) с НПЭ с 6 мас. % SiO2 в диапазоне 2.6–3.8 В при режиме тока заряда–разряда С/10. Цифры у кривых – номера циклов. Пунктирные линии – кривые первого заряда–разряда.
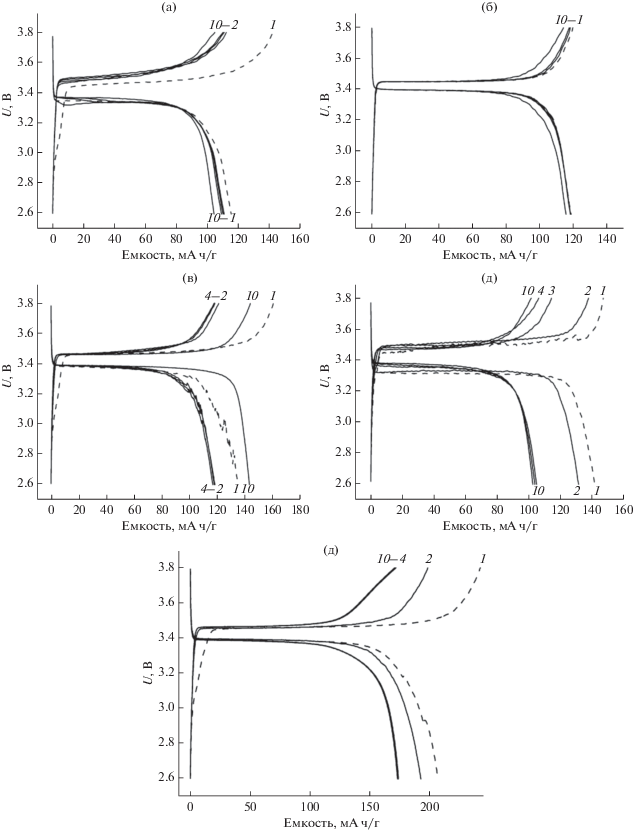
Большая необратимая емкость (25 мА ч/г) в процессе первого заряда ячейки с жидким электролитом 1 М LiTFSI в ДОЛ/ДМЭ (2 : 1) (рис. 5а) вызвана, по-видимому, образованием слоя SEI, в то время как для ячейки с чистым полимерным электролитом (рис. 5б) этого процесса не наблюдается.
При рассмотрении заряд-разрядных кривых ячеек с НПЭ первые циклы также отличаются по емкости, чем последующие, но все они имеют разрядную емкость в пределах 140 мА ч/г. Сильно отличается по емкости ячейка с НПЭ с 6 мас. % SiO2.
Из рис. 5д видно, что для ячейки № 5 наблюдается максимальное плато заряда и разряда, которое превышает 200 мА ч/г в течение первых двух циклов. Емкость в циклах, превышающая теоретическую, обусловлена дополнительными процессами. Возможно, они обусловлены участием оксида кремния в интеркаляционном процессе, как было показано в работах [63–65].
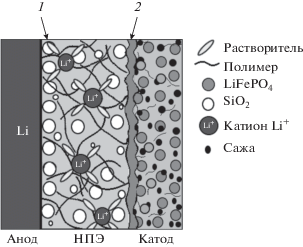
На рис. 6 представлена модель формирования переходных слоев на границах Li/НПЭ/LiFePO4. На границе Li/НПЭ происходит упорядочивание наночастиц SiO2, что уменьшает сопротивление на данной границе, как было показано методом электрохимического импеданса в работе [47]. На границе НПЭ/жидкий электролит/LiFePO4 реализуется концепция “жидкофазной терапии” [26], что способствует уменьшению сопротивления на границе электролит/катод (рис. 4д).
Рис. 6.
Модель формирования границ в ячейке Li/НПЭ/LiFePO4, где 1 – слой из наночастиц SiO2, 2 – жидкий электролит.
Следующим этапом работы явилось проведение ресурсных испытаний ячеек Li//LiFePO4. Зависимость разрядной емкости и кулоновской эффективности данных ячеек от номера цикла для всех электролитов представлена на рис. 7.
Рис. 7.
Зависимость разрядной емкости (а) и кулоновской эффективности (б) от номера цикла Li//LiFePO4-ячеек, где цифры у кривых – номера ячеек (табл. 3). Диапазон напряжений 2.6–3.8 В, режим тока заряда/разряда С/10.
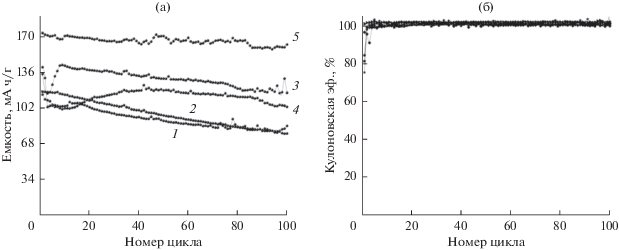
Значения разрядной емкости на первых и 100‑х циклах указаны в табл. 3. Приведение емкости для разных начальных циклов (1–4) обусловлено особенностью поведения ячейки для каждого состава электролита и выбрано для более корректного их сравнения.
Таблица 3.
Составы и параметры ячеек Li//LiFePO4
| № | Состав электролита | С (1–4 цикл), мА ч/г | С (100 цикл), мА ч/г | ΔС, % |
|---|---|---|---|---|
| 1 | 1 М LiTFSI в ДОЛ/ДМЭ (2 : 1) | 116 (2) | 87 | 30 |
| 2 | ПЭ без добавок | 118 (2) | 78 | 32 |
| 3 | НПЭ с 2 мас. % SiO2 | 134 (1) | 117 | 19 |
| 4 | НПЭ с 4 мас. % SiO2 | 130 (2) | 104 | 20 |
| 5 | НПЭ с 6 мас. % SiO2 | 170 (4) | 162 | 6 |
При рассмотрении результатов испытаний ячеек (рис. 7а и табл. 3) видно, что лучшие показатели по величине и стабильности разрядной емкости у ячейки с 6 мас. % SiO2 – 170 мА ч/г при величине тока заряда/разряда С/10. Это значение является теоретически достижимым показателем емкости для данного катодного материала. Потеря емкости ячейки после 100 циклов заряда–разряда составляет всего 6%.
ЗАКЛЮЧЕНИЕ
Разработан дизайн прототипа твердотельного литиевого аккумулятора с LiFePO4-катодом и нанокомпозитным полимерным гель-электролитом.
Проведены испытания НПЭ методом ТГА, которые показали перспективность использования состава НПЭ с 6 мас. % SiO2. Данный состав также выделяется и по прочностным свойствам, его модуль упругости максимальный среди всех составов и равен 16 МПа.
Методом электрохимического импеданса показано, что обработка поверхности LiFePO4-катода электролитом 1 М LiTFSI в ДОЛ/ДМЭ (2 : 1) уменьшает сопротивление на границе НПЭ/катод.
Ресурсные испытания НПЭ в литиевых ячейках с LiFePO4-катодом, обработанным LiTFSI-электролитом, показали преимущества использования полимерных электролитов с наночастицами SiO2. Лучшим составом электролита, при котором достигается максимальная емкость LiFePO4-катода (170 мА ч/г), является нанокомпозитный полимерный гель-электролит с 6% SiO2.
Список литературы
Suthanthiraraj, S.A. and Johnsi, M., Nanocomposite polymer electrolytes, Ionics, 2017, vol. 23, no. 10, p. 2531.
Keller, M., Varzi, A., and Passerini, S., Hybrid electrolytes for lithium metal batteries, J. Power Sources, 2018, vol. 392, p. 206.
Ярмоленко, О.В., Юдина, А.В., Хатмуллина, К.Г. Нанокомпозитные полимерные электролиты для литиевых источников тока (обзор). Электрохимия. 2018. Т. 54. С. 377. [Yarmolenko, O.V., Yudina, A.V., and Khatmullina, K.G., Nanocomposite polymer electrolytes for lithium power sources (review), Russ. J. Electrochem., 2018, vol. 54, p. 325.]
Capiglia, C., Mustarelli, P., Quartarone, E., Tomasi, C., and Magistris, A., Effects of nanoscale SiO2 on the thermal and transport properties of solvent-free, poly(ethylene oxide) (PEO)-based polymer electrolytes, Solid State Ionics, 1999, vol. 118, p. 73.
Mustarelli, P., Capiglia, C., Quartarone, E., Tomasi, C., Ferloni, P., and Linati, L., Cation dynamics and relaxation in nanoscale polymer electrolytes: a 7Li NMR study, Phys. Rev. B, 1999, vol. 60, p. 7228.
Croce, F., Persi, L., Scrosati, B., Serraino-Fiory, F., Plichta, E., and Hendrickson, M.A., Role of the ceramic fillers in enhancing the transport properties of composite polymer electrolytes, Electrochim. Acta, 2001, vol. 46, p. 2457.
Jayathilaka, P.A.R.D., Dissanayake, M.A.K.L., Albinsson, I., and Mellander, B.E., Effect of nano-porous Al2O3 on thermal, dielectric and transport properties of the (PEO)9LiTFSI polymer electrolyte system, Electrochim. Acta, 2002, vol. 47, p. 3257.
Chung, S.H., Wang, Y., Greenbaum, S.G., Marcinek, M., Persi, L., Croce, F., Wieczorek, W., and Scrosati, B., Nuclear magnetic resonance studies of nanocomposite polymer electrolytes, J. Phys.: Condens. Matter, 2001, vol. 13, p. 11763.
Баймуратова, Г.Р., Черняк, А.В., Слесаренко, А.А., Тулибаева, Г.З., Волков, В.И., Ярмоленко, О.В. Особенности ионного транспорта в новых нанокомпозитных гель-электролитах на основе сетчатых полимеров и наночастиц оксида кремния. Электрохимия. 2019. Т. 55. С. 701. [Baymuratova, G.R., Chernyak, A.V., Slesarenko, A.A., Tulibaeva, G.Z., Volkov, V.I., and Yarmolenko, O.V., Specific Features of Ion Transport in New Nanocomposite Gel Electrolytes Based on Cross-Linked Polymers and Silica Nanoparicles, Russ. J. Electrochem., 2019, vol. 55, p. 529.]
Croce, F., Appetecchi, G.B., Persi, L., and Scrosati, B., Nanocomposite polymer electrolytes for lithium batteries, Nature, 1998, vol. 394, p. 456.
Kim, Y.W., Lee, W., and Choi, B.K., Relation between glass transition and melting of PEO salt complexes, Electrochim. Acta, 2000, vol. 45, p. 1473.
Best, A.S., Adebahr, J., Jacobsson, P., MacFarlane, D.R., and Forsyth, M., Microscopic interactions in nanocomposite electrolytes, Macromolecules, 2001, vol. 34, p. 4549.
Tambelli, C.C., Bloise, A.C., Rosário, A.V., Pereira, E.C., Magon, C.J., and Donoso, J.P., Characterisation of PEO-Al2O3 composite polymer electrolyte, Electrochim. Acta, 2002, vol. 47, p. 1677.
Indris, S., Heitjans, P., Ulrich, M., and Bunde, A., AC and DC conductivity in nano- and microcrystalline Li2O:B2O3 composites: experimental results and theoretical models, Z. Phys. Chem., 2005, Bd 219, S. 89.
Nimah, Y.L., Ming-Yao Cheng, M.Y., Cheng, J.H., Rick, J., and Hwang, B.-H., Solid-state polymer nanocomposite electrolyte of TiO2/PEO/NaClO4 for sodium ion batteries, J. Power Sources, 2015, vol. 278, p. 375.
Zhou, R., Liu, W., Yao, X., Leong, Y.W., and Lu, X., Poly(vinylidene fluoride) nanofibrous mats with covalently attached SiO2 nanoparticles as an ionic liquid host: enhanced ion transport for electrochromic devices and lithium-ion batteries, J. Mater. Chem. A, 2015, vol. 3, p. 16040.
Boor, S., Rajiv, K., and Sekhon, S.S., Conductivity and Viscosity behavior of PMMA based gels and nano dispersed gels: Role of dielectric constant of solvent, Solid State Ionics, 2005, vol. 176, p. 1577.
Kumar, D., Suleman, M., and Hashmi, S.A., Studies on poly(vinylidene fluoride-co-hexafluoropropylene) based gel electrolyte nanocomposites for sodium-sulfur batteries, Solid State Ionics, 2011, vol. 202, p. 43.
Kumar, D. and Hashmi, S.A., Ion transport and ion-filler-polymer interaction in poly(methylmethacrylate)-based, sodium ion conducting, gel polymer electrolyte dispersed with silica nano-particles, J. Power Sources, 2010, vol. 195, p. 5101.
Ramesh, S. and Wen, L.C., Investigation on the effects of addition of SiO2 nanoparticles on ionic conductivity, FTIR, and thermal properties of nano-composite PMMA–LiCF3SO3–SiO2, Ionics, 2010, vol. 16, p. 255.
Yarmolenko, O.V., Khatmullina, K.G., Baimuratova, G.R., Tulibaeva, G.Z., and Bogdanova, L.M., On the nature of the Double Maximum Conductivity of Nanocomposite Polymer Electrolytes for Lithium Power Sources, Mend. Comm., 2018, vol. 28, Iss. 1, p. 41.
Юдина, А.В., Баймуратова, Г.Р., Тулибаева, Г.З., Литвинов, А.Л., Шестаков, А.Ф, Ярмоленко, О.В. Проявление эффекта увеличения проводимости в ИК-спектрах нанокомпозитного полимерного гель-электролита. Изв. АН, сер. хим. 2020. Т. 69. № 8. С. 1455. [Yudina, A.V., Baymuratova, G.R., Tulibaeva, G.Z., Litvinov, A.L., Shestakov, A.F., and Yarmolenko, O.V., Conductivity increase effect in nanocomposite polymer gel electrolytes: manifestation in the IR spectra, Russ. Chem. Bulletin, Int. Ed., 2020, vol. 69, no. 8, p. 1455.]
Lee, Y.-S., Shin, W.-K., Kim, J.S., and Kim, D.-W., High performance composite polymer electrolytes for lithium-ion polymer cells composed of a graphite negative electrode and LiFePO4 positive electrode, RSC Adv., 2015, vol. 5, p. 18359.
Ярмоленко, О.В., Хатмуллина, К.Г., Богданова, Л.М., Шувалова, Н.И., Джавадян, Э.А., Маринин, А.А., Волков, В.И. Влияние добавки наночастиц TiO2 на проводимость сетчатых полимерных электролитов для литиевых источников тока. Электрохимия. 2014. Т. 50. С. 377. [Yarmolenko, O.V., Khatmullina, K.G., Bogdanova, L.M., Shuvalova, N.I., Dzhavadyan, E.A., Marinin, A.A., and Volkov, V.I., Effect of TiO2 nanoparticle additions on the conductivity of network polymer electrolytes for lithium power sources, Russ. J. Electrochem. (Int. Ed.), 2014, vol. 50, p. 336.]
Borodin, O., Smith, G.D., Bandyopadhyaya, R., Redfern, P., and Curtiss, L.A., Molecular dynamics study of nanocomposite polymer electrolyte based on poly(ethylene oxide)/LiBF4, Modelling Simul. Mater. Sci. Eng., 2004, vol. 12, p. S73.
Zhao, C.-Z., Zhao, B.-C., Yan, C., Zhang, X.-Q., Huang, J.-Q., Mo, Y., Xu, X., Li, H., and Zhang, Q., Liquid phase therapy to solid electrolyte–electrode interface in solid-state Li metal batteries: A review, Energy Storage Materials, 2020, vol. 24, p. 75.
Zhang, X.-Q., Zhao, C.-Z., Huang, J.-Q., and Zhang, Q., Recent Advances in Energy Chemical Engineering of Next-Generation Lithium Batteries, Engineering, 2018, vol. 4, no. 6, p. 831.
Fan, L., Wei, S., Li, S., Li, Q., and Lu, Y., Recent progress of the solid-state electrolytes for high-energy metal-based batteries, Adv. Energy Mater., 2018, vol. 8, no. 11, A. 1702657.
Yang, C., Fu, K., Zhang, Y., Hitz, E., and Hu, L., Protected lithium-metal anodes in batteries: from liquid to solid, Adv. Mater., 2017, vol. 29, no. 36, p. 1701169.
Sun, C., Liu, J., Gong, Y., Wilkinson, D.P., and Zhang, J., Recent advances in all-solid-state rechargeable lithium batteries, Nano Energy, 2017, vol. 33, p. 363.
Cheng, X.-B., Zhang, R., Zhao, C.-Z., and Zhang, Q., Toward safe lithium metal anode in rechargeable batteries: a review, Chem. Rev., 2017, vol. 117, no. 15, p. 10403.
Han, F., Westover, A.S., Yue, J., Fan, X., Wang, F., Chi, M., Leonard, D.N., Dudney, N.J., Wang, H., and Wang, C., High electronic conductivity as the origin of lithium dendrite formation within solid electrolytes, Nat. Energy, 2019, vol. 4, no. 3, p. 187.
Kerman, K., Luntz, A., Viswanathan, V., Chiang, Y.-M., and Chen, Z., Review-practical challenges hindering the development of solid state Li ion batteries, J. Electrochem. Soc., 2017, vol. 164, no. 7, p. A1731.
Wang, L., Zhou, Z., Yan, X., Hou, F., Wen, L., Luo, W., Liang, J., and Dou, S.X., Engineering of lithium-metal anodes towards a safe and stable battery, Energy Storage Mater., 2018, vol. 14, p. 22.
Li, N.-W., Yin, Y.-X., Yang, C.-P., and Guo, Y.-G., An Artificial Solid Electrolyte Interphase Layer for Stable Lithium Metal Anodes, Adv. Mater., 2016, vol. 28, no. 9, p. 1853.
Wu, J.-Y., Ling, S.-G., Yang, Q., Li, H., Xu, X.-X., and Chen, L.-Q., Forming solid electrolyte interphase in situ in an ionic conducting Li1.5Al0.5Ge1.5(PO4)3–polypropylene (PP) based separator for Li-ion batteries, Chin. Phys. B, 2016, vol. 25, p. 078204.
Gao, H., Xue, L., Xin, S., Park, K., and Goodenough, J.B., A plastic-crystal electrolyte interphase for all-solid-state sodium batteries, Angew. Chem. Int. Ed., 2017, vol. 56, no. 20, p. 5541.
Zhang, Z., Zhang, Q., Shi, J., Chu, Y.S., Yu, X., Xu, K., Ge, M., Yan, H., Li, W., Gu, L., Hu, Y.-S., Li, H., Yang, X.-Q., Chen, L., and Huang, X., A self-forming composite electrolyte for solid-state sodium battery with ultralong cycle life, Adv. Energy Mater., 2017, vol. 7, no. 4, p. 1601196.
Li, J., Lin, Y., Yao, H., Yuan, C., and Liu, J., Tuning Thin-Film Electrolyte for Lithium Battery by Grafting Cyclic Carbonate and Combed Poly(ethylene oxide) on Polysiloxane, Chemsuschem, 2014, vol. 7, no. 7, p. 1901.
Cui, Y., Liang, X., Chai, J., Cui, Z., Wang, Q., He, W., Liu, X., Liu, Z., and Cui, G., High performance solid polymer electrolytes for rechargeable batteries: a self-catalyzed strategy toward facile synthesis, J. Feng, Adv. Sci., 2017, vol. 4, no. 11, A. 1700174.
Yan, C., Cheng, X.-B., Tian, Y., Chen, X., Zhang, X.-Q., Li, W.-J., Huang, J.-Q., and Zhang, Q., Dual-layered film protected lithium metal anode to enable dendrite-free lithium deposition, Adv. Mater., 2018, vol. 30, no. 25, p. 1707629.
Nolan, A.M., Zhu, Y., He, X., Bai, Q., and Mo, Y., Computation-accelerated design of materials and interfaces for all-solid-state lithium-ion batteries, Joule, 2018, vol. 2, no. 10, p. 2016.
Shi, S., Lu, P., Liu, Z., Qi, Y., Hector, L.G., Li, H., and Harris, S.J., Direct calculation of Li-ion transport in the solid electrolyte interphase, J. Amer. Chem. Soc., 2012, vol. 134, no. 37, p. 15476.
Lee, Y.-S., Lee, J.H., Choi, J.-A., Yoon, W.Y., and Kim, D.-W., Cycling characteristics of lithium powder polymer batteries assembled with composite gel polymer electrolytes and lithium powder anode, Adv. Funct. Mater., 2013, vol. 23, no. 8, p. 1019.
Gao, Y., Yan, Z., Gray, J.L., He, X., Wang, D., Chen, T., Huang, Q., Li, Y.C., Wang, H., Kim, S.H., Mallouk, T.E., and Wang, D., Polymer-inorganic solid-electrolyte interphase for stable lithium metal batteries under lean electrolyte conditions, Nat. Mater., 2019, vol. 18, no. 4, p. 384.
Zhou, D., Liu, R., He, Y.-B., Li, F., Liu, M., Li, B., Yang, Q.-H., Cai, Q., and Kang, F., SiO2 hollow nanosphere-based composite solid electrolyte for lithium metal batteries to suppress lithium dendrite growth and enhance cycle life, Adv. Energy Mater., 2016, vol. 6, no. 7, p. 1502214.
Баймуратова, Г.Р., Слесаренко, А.А., Юдина, А.В., Ярмоленко, О.В. Проводящие свойства нанокомпозитных полимерных электролитов на основе диакрилата полиэтиленгликоля и SiO2 на границе с литиевым электродом. Изв. АН, сер. хим. 2018. Т. 66. № 9. С. 1648. [Baymuratova, G.R., Slesarenko, A.A., Yudina, A.V., and Yarmolenko, O.V., Conducting properties of nanocomposite polymer electrolytes based on polyethylene glycol diacrylate and SiO2 nanoparticles at the interface with a lithium electrode, Russ. Chem. Bull., Int. Ed., 2018, vol. 67, no. 9, p. 1648.]
Richards, W.D., Miara, L.J., Wang, Y., Kim, J.C., and Ceder, G., Interface stability in solid-state batteries, Chem. Mater., 2016, vol. 28, no. 1, p. 266.
Zhu, Y., He, X., and Mo, Y., First principles study on electrochemical and chemical stability of solid electrolyte-electrode interfaces in all-solid-state Li-ion batteries, J. Mater. Chem. A, 2016, vol. 4, no. 9, p. 3253.
Cabana, J., Kwon, B.J., and Hu, L., Mechanisms of degradation and strategies for the stabilization of cathode-electrolyte interfaces in Li-ion batteries, Accounts Chem. Res., 2018, vol. 51, no. 2, p. 299.
Aurbach, D., Markovsky, B., Salitra, G., Markevich, E., Talyossef, Y., Koltypin, M., Nazar, L., Ellis, B., and Kovacheva, D., Review on electrode-electrolyte solution interactions, related to cathode materials for Li-ion batteries, J. Power Sources, 2007, vol. 165, no. 2, p. 491.
Okumura, T., Fukutsuka, T., Matsumoto, K., Orikasa, Y., Arai, H., Ogumi, Z., and Uchimoto, Y., Lithium-Ion Transfer Reaction at the Interface between Partially Fluorinated Insertion Electrodes and Electrolyte Solutions, J. Phys. Chem. Lett. C, 2011, vol. 115, p. 12990.
Zhao, Q., Liu, X., Stalin, S., Khan, K., and Archer, L.A., Solid-state polymer electrolytes with in-built fast interfacial transport for secondary lithium batteries, Nat. Energy, 2019, vol. 4, no. 5, p. 365.
Wang, C., Sun, Liu, Q., Y., Zhao, Y., Li, X., Lin, X., Banis, M.N., Li, M., Li, W., Adair, K.R., Wang, D., Liang, J., Li, R., Zhang, L., Yang, R., Lu, S., and Sun, X., Boosting the performance of lithium batteries with solid-liquid hybrid electrolytes: Interfacial properties and effects of liquid electrolytes, Nano Energy, 2018, vol. 48, p. 35.
Gao, Y., Wang, D., Li, Y.C., Yu, Z., Mallouk, T.E., and Wang, D., Salt-based organic-inorganic nanocomposites: towards a stable lithium metal/Li10GeP2S12 solid electrolyte interface, Angew. Chem. Int. Ed., 2018, vol. 57, no. 41, p. 13608.
Abe, T., Sagane, F., Ohtsuka, M., Iriyama, Y., and Ogumi, J. Z., Lithium-ion transfer at the interface between lithium-ion conductive ceramic electrolyte and liquid electrolyte – a key to enhancing the rate capability of lithium-ion batteries, Electrochem. Soc., 2005, vol. 152, № 11, p. A2151.
Busche, M.R., Drossel, T., Leichtweiss, T., Weber, D.A., Falk, M., Schneider, M., Reich, M.-L., Sommer, H., Adelhelm, P., and Janek, J., Dynamic formation of a solid–liquid electrolyte interphase and its consequences for hybrid battery concepts, Nat. Chem., 2016, vol. 8, no. 5, p. 426.
Duan, H., Yin, Y.-X., Shi, Y., Wang, P.-F., Zhang, X.-D., Yang, C.-P., Shi, J.-L., Wen, R., Guo, Y.-G., and Wan, L.-J., Dendrite-Free Li-Metal Battery Enabled by a Thin Asymmetric Solid Electrolyte with Engineered Layers, J. Amer. Chem. Soc., 2018, vol. 140, p. 82.
Dong, W., Zeng, X.-X., Zhang, X.-D., Li, J.-Y., Shi, J.-L., Xiao, Y., Shi, Y., Wen, R., Yin, Y.-X., Wang, T.-S., Wang, C.-R., and Guo, Y.-G., Gradiently polymerized solid electrolyte meets with micro-/nanostructured cathode array, ACS Appl. Mater. Interfaces, 2018, vol. 10, no. 21, p. 18005.
Li, X., Qian, K., He, Y.-B., Liu, C., An, D., Li, Y., Zhou, D., Lin, Z., Li, B., Yang, Q.-H., and Kang, F., A dual-functional gel-polymer electrolyte for lithium ion batteries with superior rate and safety performances, J. Mater. Chem. A, 2017, vol. 5, no. 35, p. 18888.
Юдина, А.В., Березин, М.П., Баймуратова, Г.Р., Шувалова, Н.И., Ярмоленко, О.В. Особенности синтеза и физико-химические свойства нанокомпозитных полимерных электролитов на основе диакрилата полиэтиленгликоля с введением SiO2. Изв. АН, сер. хим. 2017. Т. 65. № 7. С. 1278. [Yudina, A.V., Berezin, M.P., Baymuratova, G.R., Shuvalova, N.I., and Yarmolenko, O.V., Specific features of the synthesis and the physicochemical properties of nanocomposite polymer electrolytes based on poly(ethylene glycol) diacrylate with the introduction of SiO2, Russ. Chem. Bull., Int. Ed., 2017, vol. 66, no. 7, p. 1278.]
Черняк, А.В., Березин, М.П., Слесаренко, Н.А., Забродин, В.А., Волков, В.И., Юдина, А.В., Шувалова, Н.И., Ярмоленко, О.В. Влияние структуры сетчатого полимерного гель-электролита на ионную и молекулярную подвижность электролитной системы соль LiBF4–ионная жидкость 1-этил-3-метилимидазолий тетрафторборат. Изв. АН, cер. хим. 2016. Т. 65. С. 2053. [Chernyak, A.V., Berezin, M.P., Slesarenko, N.A., Zabrodin, V.A., Volkov, V.I., Yudina, A.V., Shuvalova, N.I., and Yarmolenko, O.V., Influence of the reticular polymeric gel-electrolyte structure on ionic and molecular mobility of an electrolyte system saltionic liquid: LiBF4–1-ethyl-3-methylimidazolium tetrafluoroborate, Russ. Chem.Bull., Int. Ed., 2016, vol. 65, p. 2053.]
Sivonxay, E., Aykol, M., and Persson, K.A., The lithiation process and Li diffusion in amorphous SiO2 and Si from first-principles, Electrochim. Acta, 2020, vol. 331, p. 13534.
Jung, S.C., Kim, H.-J., Kim, J.-H., and Han Y.-K., Atomic-Level Understanding toward a High-Capacity and High Power Silicon Oxide (SiO) Materia, J. Phys. Chem., 2016, vol. 120, p. 886.
Zhang, Y., Li, Y., Wang, Z., and Zhao, K., Lithiation of SiO2 in Li-Ion Batteries: In Situ Transmission Electron Microscopy Experiments and Theoretical Studies, Nano Lett., 2014, vol. 14, p. 7161.
Дополнительные материалы отсутствуют.