Электрохимия, 2022, T. 58, № 4, стр. 179-187
Рост электрической проводимости и появление липидных пор под действием магнитных наночастиц CoFe2O4 в бислойной липидной мембране
А. А. Аносов a, b, Е. А. Корепанова c, О. В. Коплак a, d, В. А. Казаманов e, А. С. Дерунец a, *, Р. Б. Моргунов a, d
a Первый московский медицинский университет им. И.М. Сеченова (Сеченовский университет)
119991 Москва, Россия
b Институт радиотехники и электроники им. В.А. Котельникова
125009 Москва, Россия
c Российский национальный исследовательский медицинский университет им. Н.И. Пирогова
117997 Москва, Россия
d Институт проблем химической физики РАН
142432 Черноголовка, Россия
e МИРЭА – Российский технологический университет
119991 Москва, Россия
* E-mail: derunets.alice@gmail.com
Поступила в редакцию 24.06.2021
После доработки 26.08.2021
Принята к публикации 08.09.2021
- EDN: KEIZPV
- DOI: 10.31857/S0424857022030033
Аннотация
Обнаружено увеличение электрической проводимости азолектиновых бислойных липидных мембран относительно фоновой проводимости 67 ± 13 пСм/мм2 в 10–40 раз при добавлении в них кубических наночастиц CoFe2O4, главная диагональ которых составляет 14 нм (МНЧ-14) и 27 нм (МНЧ-27). При увеличении концентрации МНЧ-14 в мембранном растворе в диапазоне от 50 до 450 мкг/мл рост проводимости мембран относительной фоновой являлся нелинейным и был аппроксимирован степенной функцией с показателем степени 2.75. В режиме фиксации напряжения при концентрации МНЧ-14, большей 250 мкг/мл, и при всех концентрациях МНЧ-27, начиная с 50 мкг/мл, зарегистрированы дискретные импульсы тока, что говорит о возникновении проводящих липидных пор.
ВВЕДЕНИЕ
Модификация биологических объектов с помощью наночастиц является одной из наиболее горячих тем на стыке физики с биологией и медициной. Управляемое введение наночастиц в клетки позволяет контролировать их нагрев, химические реакции в них, является ключом к адресной доставке лекарств, а также помогает развивать немеханические методы избирательного перемещения клеток, например с помощью магнитных пинцетов. Липидные мембраны являются защитной оболочкой клеток и поэтому механизмы проникновения наночастиц через мембрану находятся в фокусе внимания исследователей. Подробно исследовано влияние размера частиц [1, 2] и их формы [3, 4], кривизны изгиба мембран [5], полярных групп липидов и их взаимодействий с наночастицами [6] на проникновение наночастиц через липидные мембраны. Ранее сообщалось о том, что электрически заряженные золотые [1] или полимерные [2] наночастицы вызывают образование обширных (до 100 нм диаметром) дефектных областей фосфолипидной мембраны, окружающих сравнительно небольшие наночастицы диаметром 20 нм. Электрическая проводимость в мембранах без наночастиц осуществляется благодаря флуктуационному возникновению в них пор, которые образуются на короткое время и затем затягиваются липидами, диффундирующими в сторону таких короткоживущих дефектов.
В настоящей работе изучено влияние наночастиц феррита кобальта (CoFe2O4) на электрические свойства фосфолипидных мембран. Нами были выбраны частицы феррита кобальта CoFe2O4 потому, что именно эти частицы, обладая хорошей биосовместимостью, считаются перспективными для противораковых и других медицинских применений [7]. Низкая растворимость CoFe2O4 в воде ~1 мкл/л [8], обеспечивает биосовместимость и позволяет пренебрегать появлением частиц в растворе, окружающем мембрану. В [9] наночастицы CoFe2O4 были диспергированы в воде без потери их свойств. Фотовольтаическая активность [10], ширина запрещенной зоны 1.57–2.03 эВ и ферромагнитные свойства делают частицы CoFe2O4 функциональными в магниторезонансной томографии и гипертермии [11, 12].
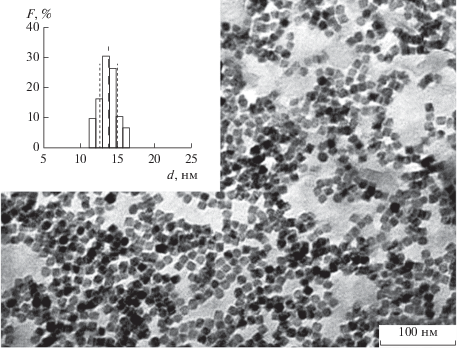
Наночастицы и их кластеры способны вызывать в липидной мембране структурную реорганизацию, формирование пор, изменение кривизны мембран [1–6]. Электрическая ионная проводимость мембран – весьма чувствительный отклик на нарушение их структурной целостности, появление дефектов и растяжения, вызванные внешними факторами. Мы использовали частицы кубической формы (рис. 1), так как они концентрируют магнитное поле рассеяния частиц, необходимое для их обнаружения в мембране методом магнитной силовой микроскопии (МСМ) [13]. Методом МСМ измеряют локальную намагниченность наночастиц (их поля рассеяния) по значению сдвига фазы колебаний кантилевера, которая прямо пропорциональна градиенту магнитной дипольной силы, возникающей между частицей и магнитным кантилевером. Поскольку липидная мембрана диамагнитная, то лишь поле рассеяния магнитных наночастиц будет давать контраст на магнитно-силовом изображении. Кроме того, кубическая форма обеспечивает концентрацию электрического поля для заряженных частиц и механических напряжений в вершинах куба, увеличивая эффективность возникновения дефектов в мембране под действием наночастиц.
Рис. 1.
Электронно-микроскопическое изображение кубических наночастиц феррита кобальта с диагональю 27 нм на графитовой подложке. На вставке показано распределение длин диагоналей наночастиц.
В нашей работе проведен анализ электрической проводимости азолектиновой бислойной мембраны, в которой находятся наночастицы феррита кобальта. Отметим, что увеличение проницаемости мембран является ключевым при адресной доставке лекарств с помощью наночастиц, используемых в качестве диагностических и терапевтических агентов.
МАТЕРИАЛЫ И МЕТОДЫ
Наночастицы CoFe2O4 были синтезированы в НИТУ МИСИС (рис. 1). Химическая стратегия приготовления наночастиц показана на рис. S1 в дополнительных материалах. После приготовления наночастицы (НЧ) были центрифугированы в течение 30 мин при 6000 об/мин и растворены в чистом толуоле (концентрация 5 мг/мл). Для визуализации частиц 10 мл коллоидального раствора НЧ в толуоле были помещены на карбоновую подложку и покрыты углеродной пленкой Agar Scientific, 300 mesh. После выдержки в течение суток анализ формы производили с помощью микроскопа JEOL JEM-1400 при ускоряющем напряжении 120 кВ. Средняя диагональ двух изученных образцов наночастиц составляла 27 нм (МНЧ-27) (рис. 1) или 14 нм (см. рис. S2 в дополнительных материалах) (МНЧ-14).
Азолектин (Avanti Polar Lipids, Alabaster) был использован для формирования плоских бислойных мембран в растворе 0.1 M KCl. Азолектиновые мембраны были сформированы на круглом отверстии площадью 0.64 мм2 в перегородке тефлоновой кюветы при температуре 21 ± 1°C. Мембранный раствор содержал азолектин в “х. ч.” декане в концентрации 30 мг/мл. Наночастицы, диспергированные в толуоле, были добавлены в мембранный раствор в концентрациях 50–450 мкг/мл. Ток через мембрану измеряли с помощью электродов Ag–AgCl, подключенных к усилителю VA-10X (NPI Electronics GmbH, Germany) с сопротивлением обратной связи 5 ГОм и постоянной времени 20 мс. Флуктуации тока через мембрану записывали в компьютер с частотой 1 кГц с помощью 16-разрядного АЦП (L-Card, Russia).
Полученные в экспериментах при постоянном напряжении на мембране токовые треки содержали импульсы. Мы полагаем, что эти импульсы обусловлены сквозными порами. Если рассматривать эти поры как цилиндры и считать, что удельная проводимость в поре равна проводимости в растворе, то радиус пор R определяется известной формулой (см., например, [14]):
где h = 5 нм – толщина мембраны, G – проводимость поры, g = 1.04 См/м – удельная проводимость 0.1 М раствора KCl при комнатной температуре.Образцы мультиламелярных везикул были приготовлены диспергированием азолектина в дистиллированной воде (pH 6.9) в ультразвуковой ванне, работающей на частоте 37 кГц, в течение 15 мин. Концентрация липидов составила 1 мг/мл. Наночастицы, диспергированные в толуоле, добавляли в суспензию липосом, чтобы получить концентрацию 50 мкг/мл. Данную смесь снова помещали в ультразвуковую ванну в течение 5 мин.
Полевые зависимости магнитного момента М наночастиц CoFe2O4, нормированного на намагниченность насыщения МS частиц, до и после их помещения в суспензию липосом были измерены на магнитометре MPMS 5XL Quantum Design при комнатной температуре в диапазоне полей ±1 кЭ. Наночастицы в толуоле и суспензия липосом с наночастицами наносились на диамагнитную подложку и высушивались, после чего измеряли их магнитный момент при одинаковых условиях.
Топография поверхности и распределение градиента магнитного поля рассеяния наночастиц были записаны с помощью атомного силового микроскопа (АСМ) Integra-Aura (NT MDT) и магнитного силового микроскопа (МСМ), оснащенного приставкой для создания магнитного поля. Мы прикладывали поле 1 кЭ во время записи распределения градиента магнитного поля, чтобы увеличить магнитный контраст, соответствующий наночастицам в мембране. Образцы для АСМ- и МСМ-сканирования были приготовлены по одному и тому же протоколу, при котором в контрольном опыте наночастицы, диспергированные в толуоле, были высушены на графитовой подложке, а в опыте с липосомами тот же объем наночастиц в толуоле был добавлен в суспензию липосом с последующей сушкой на графитовой подложке. Поскольку частицы были погружены в мембрану, их вклад в рельеф поверхности не обнаруживался в режиме АСМ, в то время как в режиме МСМ дальнодействующие поля рассеяния частиц позволяли судить об их наличии и концентрации. В режиме МСМ был использован стандартный кантилевер MFM-LM, покрытый слоем CoCr с коэрцитивной силой 400 Э, меньшей, чем коэрцитивная сила наночастиц 800 Э. Силовая константа 5 Н/м и резонансная частота кантилевера 63 кГц были определены в опытах с контрольным образцом.
При сканировании липидного раствора с наночастицами двухпроходной методикой в полуконтактном режиме, которую мы использовали, происходит сбор информации не только о морфологии поверхности, но и локальном распределении намагниченности [13]. Колеблющийся кантилевер при первом проходе испытывает влияние сил Ван-дер-Ваальса. В результате взаимодействия зонда и образца изменяются амплитудно-фазовые характеристики зонда, по которым в дальнейшем строится изображение поверхности. При втором проходе кантилевер направляют по тому же маршруту, при этом он не касается поверхности (движется на выбранной высоте 50 нм) и испытывает лишь влияние полей рассеяния наночастиц. В этом случае, по результату изменения сдвига фазы колебаний кантилевера строится картина магнитных свойств поверхности – распределение градиента магнитного поля. Формирование темных и светлых пятен на МСМ-изображении соответствует притяжению или отталкиванию магнитного кантилевера.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
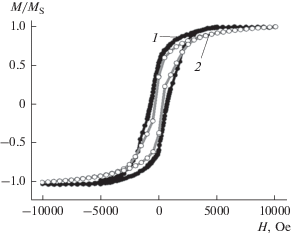
Были получены зависимости намагниченности наночастиц от величины поля, имеющие форму гистерезиса, до и после их помещения в диамагнитную мембрану (рис. 2). Исходные наночастицы, нанесенные на диамагнитную графитовую подложку, демонстрируют узкую петлю гистерезиса, характерную для суперпарамагнитного поведения. Неизменность магнитного момента насыщения наночастиц (рис. 2) свидетельствует о том, что растворением частиц в воде можно пренебречь. В образце высушенной мембраны с наночастицами наблюдается небольшое увеличение коэрцитивной силы, вызванное фиксацией частиц в высушенной мембране и предотвращением их механического вращения при изменении знака внешнего магнитного поля.
Рис. 2.
Зависимости намагниченности наночастиц феррита кобальта с диагональю 14 нм от величины магнитного поля H в контрольном эксперименте (1) и в суспензии липосом (2) на графитовой подложке. M – намагниченность, MS – намагниченность насыщения.
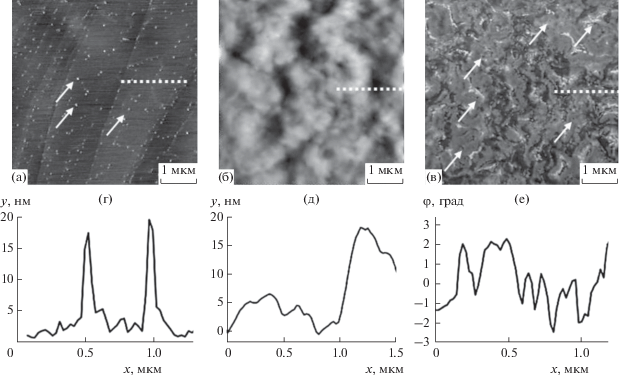
Результаты АСМ- и МСМ-сканирования образца с липидами и без, с наночастицами и без них представлены на рис. 3. В контрольном опыте был записан профиль АСМ поверхности графита с диспергированными на нем наночастицами (без мембраны) (рис. 3а). Этот профиль содержал узкие пики шириной ~0.05 мкм (рис. 3г). Плавный рельеф АСМ (рис. 3б) и соответствующий профиль (рис. 3д) высушенной мембраны c частицами на графитовой подложке с шириной пиков на полувысоте ~0.5 мкм соответствуют рельефу липидной мембраны, обычно демонстрируемой в литературе [13]. Мембрана с наночастицами не дает острых пиков в режиме АСМ, поскольку наночастицы погружены в нее. Обратный ход кантилевера по той же траектории в режиме МСМ выявил частицы на МСМ-изображении (показаны стрелками на рис. 3в) и острые пики на профиле мембраны с наночастицами (рис. 3е). Дальнодействующее магнитное поле рассеяния частиц эффективно притягивало кантилевер даже в условиях, когда они находились внутри мембраны. Острые пики на МСМ-профиле имеют полуширину ~0.05 мкм и разделены расстоянием 0.2–0.3 мкм. Мы ассоциировали эти пики с наночастицами и/или их кластерами в мембране.
Рис. 3.
АСМ-изображения наночастиц CoFe2O4 на графитовой подложке (a), АСМ-изображения высушенной липидной мембраны с наночастицами CoFe2O4 (б), МСМ-изображение высушенной липидной мембраны, записанное во внешнем в поле 1 кЭ, перпендикулярном плоскости образца (в). Наночастицы показаны стрелками. Соответствующие профили поверхности (г–е), записанные вдоль отрезка, показанного на рис. 3а–3в пунктиром.
Оценим число наночастиц, находящихся в бислойной липидной мембране. Если предположить, что соотношение числа наночастиц к числу молекул липида, характерное для мембранного раствора, сохранилось и в бислое, то при концентрации МНЧ-14 в мембранном растворе 50 мкг/мл концентрация наночастиц на поверхности мембраны составляет 1.74 1/мкм2, а характерное расстояние между ними 0.76 мкм. При увеличении концентрации наночастиц в мембранном растворе в 9 раз, характерное расстояние между частицами уменьшается до 0.25 мкм (расчеты представлены в дополнительных материалах). Отметим, что эти оценки одного порядка с величинами, полученными с помощью МСМ.
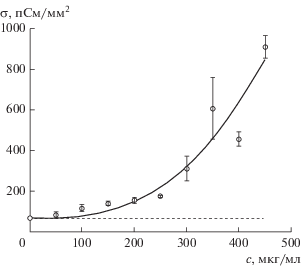
Эксперименты с плоскими бислойными липидными мембранами показали, что проводимость мембраны с наночастицами увеличивалась по сравнению с проводимостью без наночастиц (с фоновой проводимостью). Исследовали 21 мембрану с МНЧ-14 и 11 мембран с МНЧ-27. Зависимость удельной проводимости мембраны от концентрации МНЧ-14 показана на рис. 4. Горизонтальной линией показана фоновая проводимость мембраны 67 ± 13 пСм/мм2. При малых концентрациях наночастиц (менее 250 мкг/мл) крутизна кривой невелика (около 5 × 10–4 (нСм/мм2)/(мкг/мл)). При концентрациях, больших 250 мкг/мл, крутизна кривой увеличивается приблизительно в 8 раз. Аналогичный рост проводимости от ~0.2 to ~3 нСм/мм2 наблюдался и в мембране с добавленными наночастицами размером 27 нм (см. рис. S3 в дополнительных материалах). На рис. 4 также показана линия, аппроксимирующая экспериментальные данные функцией вида σ = σ0 + aсb, где σ0 – проводимость контрольных мембран, c – концентрация МНЧ-14, a = 3.9 × 10–5 и b = 2.75 – подгоночные параметры. Если связать увеличение интегральной проводимости мембраны с появлением сквозных проводящих пор, то полученный показатель степени свидетельствует о том, что для формирования поры необходимо наличие двух-трех наночастиц.
Рис. 4.
Зависимость удельной проводимости азолектиновых мембран, находящихся в 0.1 М растворе KCl, от концентрации наночастиц феррита кобальта (МНЧ-14) в мембранном растворе. Пунктирная линия показывает проводимость контрольных мембран, когда в мембранный раствор добавляли толуол без наночастиц. Сплошная линия σ = 67 + aсb, где 67 пСм/мм2 – проводимость контрольных мембран, c – концентрация МНЧ-14, a = 3.9 × 10–5 и b = 2.75 – подгоночные параметры, аппроксимирует экспериментальные данные методом наименьших квадратов.
Помимо увеличения интегральной проводимости под действием наночастиц были обнаружены токовые импульсы длительностью ~0.1 с, обусловленные, как мы предполагаем, формированием сквозных пор, возникающих при превышении концентрации 250 мкг/мл для МНЧ-14 и при меньшем значении концентрации 50 мкг/мл для МНЧ-27 (рис. 5). Проводимость импульсов составляет ~100–150 пСм при напряжениях 25 и 50 мВ.
Рис. 5.
Токовые треки (слева) и гистограммы проводимости (справа) для азолектиновой мембраны в 0.1 М растворе KCl без наночастиц (контроль) (a), с МНЧ-14 при концентрации 350 мкг/мл (б), с МНЧ-27 при концентрации 150 мкг/мл (в). Нулевой ток показан пунктирной линией. Постоянная времени усилителя 20 мс.
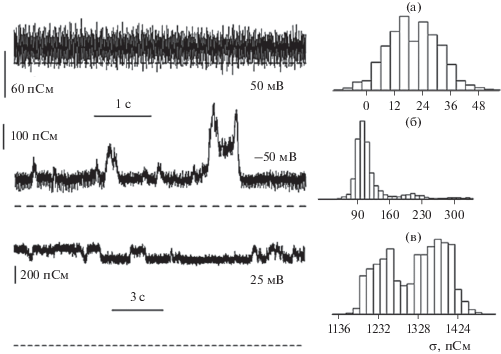
Дискретность токовых импульсов (рис. 5б) обусловлена возникновением проводящих пор. Три максимума с отношением проводимостей 1 : 2.1 : 3 можно видеть на гистограмме на рис. 5б. Это можно интерпретировать, как открытие 1, 2 или 3 пор одновременно. Однако, момент открытия поры с фоновой проводимостью 100 пСм не был зарегистрирован, потому рассмотрим три состояния мембраны: “нет пор” – фоновая проводимость ~100 пСм, “одна пора” – проводимость ~210 пСм, “две поры” – проводимость ~300 пСм. Если предположить, что эти состояния удовлетворяют пуассоновскому распределению, то соотношение вероятностей этих состояний должно определяется как exp(–λ) : λexp(–λ) : 0.5λ2exp(–λ), где λ – среднее число пор, существующих на мембране одновременно. Экспериментальное соотношение вероятностей для трека, показанного на рис. 5б, равно 0.87 : 0.09 : 0.04, что позволяет рассчитать параметр λ = 0.17. Соотношение вероятностей, рассчитанное исходя из пуассоновского распределения, равно 0.845 : 0.142 : 0.012. Различия в экспериментальных и расчетных вероятностях для состояний “нет пор” и “одна пора” незначительны: различия составляют 3 и 33% соответственно. Вероятности состояния “две поры” различаются в три раза, что говорит о зависимости состояния “две поры” от двух других состояний мембраны.
Распределения радиусов и времени жизни пор и длительности межимпульсных интервалов для МНЧ-14 и МНЧ-27 показаны на рис. 6. В случае с МНЧ-14 поры возникали только при концентрации наночастиц, большей 250 мкг/мл. При этим условии было исследовано 11 мембран, в восьми из которых зарегистрировано 77 пор. В случае с МНЧ-27 поры возникли уже при минимальной использованной концентрации наночастиц 50 мкг/мл: в восьми из одиннадцати мембран зарегистрирована 171 пора. Статистически значимых отличий в распределениях для МНЧ-14 и МНЧ-27 не обнаружено. Средние значения и стандартные отклонения параметров представлены в табл. 1. То, что средние значения и стандартные отклонения для времени жизни и для МНЧ‑14, и для МНЧ-27, и для межимпульсного интервала для МНЧ-14 практически совпадают, говорит об экспоненциальном характере распределений. То, что стандартное отклонение для межимпульсного интервала для МНЧ-27 больше среднего значения, говорит о наличии нескольких стадий в процессе формирования пор в этом случае. Например, это может свидетельствовать о медленном процессе, в результате которого в интактной мембране возникает и исчезает область, где могут формироваться поры. Второй, более быстрый процесс связан с открытием и закрытием пор в этой области мембраны.
Рис. 6.
Распределения радиусов R, времени жизни пор τ и длительности межимпульсных интервалов T для мембраны с МНЧ-14 (зарегистрировано fΣ = 77 пор) и МНЧ-27 (зарегистрирована fΣ = 171 пора). Радиус пор рассчитывался по формуле (1), время жизни поры определялось длительностью импульса тока, межимпульсный интервал соответствует временному интервалу между порами, f – частоты попадания величины в заданный интервал.
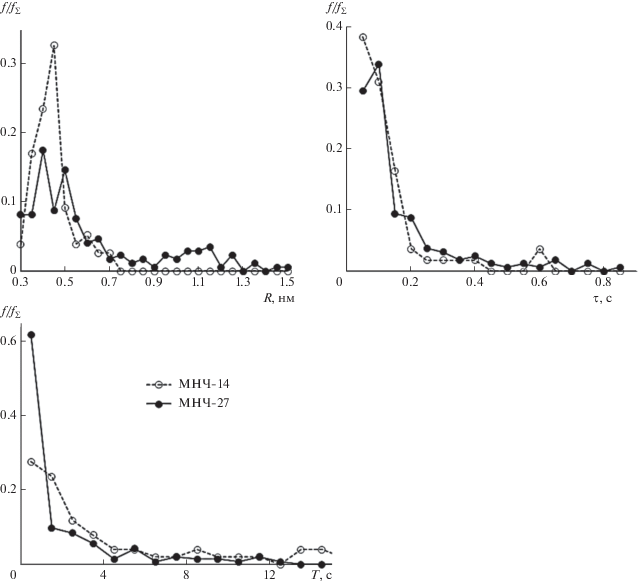
Таблица 1.
Средние значения радиусов, времени жизни пор и длительности межимпульсных интервалов для МНЧ-14 и МНЧ-27
| Показатель | МНЧ-14 | МНЧ-27 |
|---|---|---|
| Радиус, нм | 0.44 ± 0.09 | 0.61 ± 0.30 |
| Время жизни, с | 0.13 ± 0.12 | 0.16 ± 0.16 |
| Межимпульсный интервал, с | 7.5 ± 7.4 | 3.1 ± 5.4 |
Магнитные наночастицы (как и любые инородные структуры) вызывают возникновение в мембране дефектов, что приводит к росту проводимости мембраны. Однако предположение, что гидрофобные наночастицы непосредственно образуют стенки поры, представляется маловероятным. Мы предполагаем, что гидрофобные наночастицы полностью погружены в гидрофобную часть бислоя и образуют как бы микролинзы на его поверхности. Подобные структуры ограничивают латеральное перемещение липидов. Возможно, для формирования подобных кластеров необходимо наличие двух-трех наночастиц (см. показатель степени при аппроксимации зависимости проводимости мембран от концентрации МНЧ-14). Нам представляется, что такие структуры можно сравнить с зародышами гель-фазы при фазовом переходе липидов из жидкокристаллического в гель-состояние [15]. Эти образования препятствуют свободному затеканию проводящих дефектов, которые возникают при появлении в мембране наночастиц, что приводит к дополнительному росту проводимости.
Отметим, что одновременно с измерением электрической проводимости мы измеряли удельную емкость мембраны, которая практически не изменялась при вариациях концентрации наночастиц (рис. S5 в доп. материалах). Поэтому уменьшение толщины мембраны можно исключить из списка причин роста проводимости.
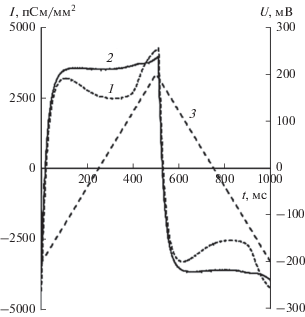
Для проверки гипотезы об ограничении свободного латерального движения липидов были проведены измерения жесткости азолектиновых мембран при добавлении в них МНЧ-14. Как известно, при подаче на мембрану напряжения емкость мембраны увеличивается. В частности, это связывается с тем, что остатки растворителя (декана) в результате электрострикции уходят из мембраны в торус [16], и толщина мембраны уменьшается. В более пластичных мембранах это движение растворителя проявляется в сильных изменениях мембранного емкостного тока. В более жестких мембранах изменения тока не столь существенны. На рис. 7 приведены изменения мембранного тока при подаче на мембрану пилообразного напряжения. При росте напряжения мембранный ток положителен за счет положительной емкостной составляющей, при снижении напряжения – отрицательный. Для более жесткой мембраны, емкость которой меняется незначительно, емкостный ток в течение полупериода приложенного напряжения будет практически постоянным. Для пластичной мембраны емкостный ток будет выглядеть как парабола с экстремумом при нулевом напряжении. Из рис. 7 видно, что при добавлении наночастиц мембрана становится, по сравнению с контролем, более жесткой, т.е. транспорт растворителя внутри мембраны к торусу ограничен. Это косвенно говорит в пользу гипотезы об ограничении свободного движения липида в мембране с наночастицами.
ЗАКЛЮЧЕНИЕ
Обнаружено влияние наночастиц феррита кобальта на проводимость бислойных азолектиновых мембран. Добавление наночастиц CoFe2O4 кубической формы размерами 14 или 27 нм вызывает увеличение электрической проводимости азолектиновых мембран в ~10–40 раз относительно фоновой проводимости 67 ± 13 пСм/мм2. При этом в мембране возникают проводящие липидные поры.
Список литературы
Mhashal, A.R. and Roy, S., Effect of gold nanoparticle on structure and fluidity of lipid membrane, PLoS ONE, 2014, vol. 9, e114152.
Limbach, L.U., Li, Y., Grass, R.N., Brunner, T.J., Hintermann, M.A., Muller, M., Gunther, D., and Stark, W.J., Oxide nanoparticle uptake in human lung fibroblasts: effects of particle size, agglomeration, and diffusion at low concentrations, Environ. Sci. Technol., 2005, vol. 39, p. 9370.
Yang, K. and Ma, Y., Computer simulation of the translocation of nanoparticles with different shapes across a lipid bilayer, Nature Nanotech., 2010, vol. 5, p. 579.
Gupta, R., Badhe, Y., Mitragotri, S., and Rai, B., Permeation of nanoparticles across intestinal lipid membrane: dependence on shape and surface chemistry studied through molecular simulations, Nanoscale, 2020, vol. 12, p. 6318.
Farnoud, M. and Nazemidashtarjandia, S., Emerging investigator series: interactions of engineered nanomaterials with the cell plasma membrane; what have we learned from membrane models, Environ. Sci. Nano, 2019, vol. 6, p. 13.
Wang, B., Zhang, L., Bae, S.C., and Granick, S., Nanoparticle-induced surface reconstruction of phospholipid membranes, PNAS, 2008, vol. 105, p. 18171.
Park, B.J., Choi, K.H., Nam, K.C., et al., Photodynamic anticancer activity of CoFe2O4 nanoparticles conjugated with hematoporphyrin, J. Nanosci. Nanotechnol., 2015, vol. 15, p. 7900.
Lambert, I. and Joyer, F., Solubility of cobalt in primary circuit solutions: Proc 6. In BNES international conference of water chemistry of nuclear reactor systems, Bournemouth: Thomas Telford Publ., 1992, vol. 1, p. 196.
Kim, D., Nikles, D.E., Johnson, D.T., and Brazel, C.S., Heat generation of aqueously dispersed CoFe2O4 nanoparticles as heating agents for magnetically activated drug delivery and hyperthermia, J. Magnetism and Magnetic Materials, 2008, vol. 320, p. 2390.
Tabish, T.A., Ashiq, M.N., Ullah, M.A., Iqbal, S., Latif, M., Ali, M., Ehsan, M.F., and Iqbal, F., Biocompatibility of cobalt iron oxide magnetic nanoparticles in male rabbits, Korean J. Chem. Eng., 2015, vol. 32, p. 1.
Loan, N.T.T., Lan, N.T.H., Hang, N.T.T., Hai, N.Q., Anh, D.T.T., Hau, V.T., Tan, L.V., and Tran, T.V., CoFe2O4 nanomaterials: effect of annealing temperature on characterization, magnetic, photocatalytic, and photo-Fenton properties, Processes, 2019, vol. 7, p. 885.
Urban, P., Kirchner, S.R., Mühlbauer, C., Lohmüller, T., and Feldmann, J., Reversible control of current across lipid membranes by local heating, Sci. Reports, 2016, vol. 6, p. 22686.
Koplak, O.V., Kunitsyna, E.I., Allayarov, R.S., Mangin, S., Granovskii, N.V., and Morgunov, R.B., Magnetization reversal of ferromagnetic CoFeB films and CoFeB/Ta/CoFeB heterostructures in the stray field of Fe/Fe3O4, J. Exp. Theor. Phys., 2020, vol. 131, p. 607.
Antonov, V.F., Smirnova, E.Y., Anosov, A.A., Norik, V.P., and Nemchenko, O.Y., PEG blocking of single pores arising on phase transitions in unmodified lipid bilayers, Biophysics, 2008, vol. 53, p. 390.
Antonov, V.F., Anosov, A.A., Norik, V.P., and Smirnova, E.Y., Soft perforation of planar transition from the liquid crystalline to gel state, Eur. Biophys. J., 2005, vol. 34, p. 155.
Hianik, T., Electrostriction and dynamics of solid supported lipid films, Reviews in Mol. Biotech., 2000, vol. 74, p. 189.
Дополнительные материалы
- скачать ESM.docx
- Рис. S1. - Рис. S6.