Электрохимия, 2022, T. 58, № 5, стр. 226-233
Материалы на основе нановолокон оксида ванадия для электродов электрохимических источников энергии
А. С. Шарлаев a, **, О. Я. Березина a, *, Е. Н. Колобова a, ***, В. В. Кондратьев b, ****
a Петрозаводский государственный университет, Физико-технический институт
Петрозаводск, Россия
b Санкт-Петербургский государственный университет, Институт химии
Санкт-Петербург, Россия
** E-mail: sharlaev-andrew@yandex.ru
* E-mail: berezina@petrsu.ru
*** E-mail: lencheg101996@gmail.com
**** E-mail: vkondratiev@mail.ru
Поступила в редакцию 22.03.2021
После доработки 08.09.2021
Принята к публикации 03.10.2021
- EDN: YBRNOQ
- DOI: 10.31857/S0424857022050103
Аннотация
В работе описывается методика синтеза нанонитей пентаоксида ванадия методом элекстроспиннинга и изготовления на их основе электродных материалов для перезаряжаемых литий-ионных аккумуляторов. Характеризация образцов нанонитей проводилась методами оптической и сканирующей электронной микроскопии, энергодисперсионного рентгеновского элементного анализа, рентгеновской дифракции. Катодный материал исследовался методами циклической вольтамперометрии и заряд-разрядного циклирования. Максимальное начальное значение удельной емкости, достигнутое в экспериментах, составило 163 мА ч/г в открытой трехэлектродной ячейке и 320 мА ч/г в модели батареи монетного типа.
ВВЕДЕНИЕ
В настоящее время одними из наиболее распространенных электрохимических источников энергии являются литий-ионные аккумуляторы (Li-ion). Они широко используются в мобильной электронике (мобильные телефоны, ноутбуки и многое другое), электроинструментах, электромобилях, космической и военной технике. Это связано с их преимуществами в сравнении с ранее применявшимися аккумуляторами. Но они обладают и рядом недостатков: относительно быстрое старение, небольшая удельная емкость. Преодоление этих недостатков позволило бы существенно расширить область их применения.
Характеристики Li-ion аккумуляторов в значительной мере определяются материалом катода. Материал должен обладать большой удельной емкостью и не разрушаться при циклировании. При этом технология его изготовления не должна быть очень сложной и дорогой.
Из большого разнообразия возможных катодных материалов достаточно перспективными считаются композитные соединения оксидов переходных металлов. Среди них выделяются оксиды ванадия, в которых разнообразие степеней окисления ванадия сочетается с высокой ионной проводимостью интеркалированных ионов щелочных металлов, в том числе ионов лития. Например, V2O5 обеспечивает высокую удельную емкость [1] из-за многочисленных степеней окисления ванадия. Кроме того, слоистая структура кристаллической решетки пентаоксида ванадия способствует легкой интеркаляции ионов лития [2]. V2O5 имеет теоретическую емкость 294 мА ч г–1 [3–5], что выше, чем у существующих сейчас материалов катода.
V2O5 имеет различные структурные модификации, такие как тонкие пленки, нанонити, наноленты, нанотрубки, нитевидные кристаллы. В одномерных наноструктурах V2O5 улучшается электрохимическая активность электродного материала, увеличивается его жизненный цикл [6].
Существует ряд методов синтеза двухмерных и одномерных наноструктур оксидов ванадия, например, гидротермальный синтез, соосаждение, золь–гель-методы. Одним из простых и недорогих методов является электроспиннинг [7]. Раствор прекурсора помещается в медицинский шприц, между иглой которого и коллектором из металлической фольги прикладывается высокое напряжение. Под действием электрического поля капля раствора вытягивается из иглы и распадается на отдельные струи, которые высыхают в воздухе и осаждаются на коллектор в виде нитей. Диаметр нитей можно менять, варьируя параметры раствора и процесса. Затем проводится отжиг нитей для удаления полимера и кристаллизации нитей.
В данной работе описывается синтез нанонитей пентаоксида ванадия методом электроспиннинга, их морфологические и структурные свойства, а также результаты электрохимического исследования материала катода на основе полученных нанонитей.
ЭКСПЕРИМЕНТ
Нанонити синтезировали методом электроспиннинга [7–9]. За основу была взята методика приготовления ксерогеля оксида ванадия путем растворения порошка V2O5 в растворе Н2О2, подробно описанная в работе [10].
В качестве исходного вещества для синтеза использовали порошок V2O5, который при температуре ниже комнатной растворяли в пероксиде водорода.
При растворении оксида ванадия (V) в Н2О2 происходит частичное восстановление V2O5 с образованием красно-коричневой моно- и ярко-желтой дипероксованадиевой кислоты по реакциям (1) и (2):
(1)
${{{\text{V}}}_{{\text{2}}}}{{{\text{O}}}_{5}} + 2{{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{2}} = {\text{ }}2{\text{HV}}{{{\text{O}}}_{2}}\left( {{{{\text{O}}}_{2}}} \right) + {{{\text{H}}}_{{\text{2}}}}{\text{O}},$(2)
${{{\text{V}}}_{{\text{2}}}}{{{\text{O}}}_{5}} + 4{{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{2}} = 2{{{\text{H}}}_{{\text{3}}}}{\text{V}}{{{\text{O}}}_{2}}{{\left( {{{{\text{O}}}_{2}}} \right)}_{2}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}}.$Полученную смесь пероксидных соединений медленно нагревали до 60°С, перемешивая на магнитной мешалке.
При нагревании пероксованадиевая кислота разлагается с образованием нейтрального гексакоординированного комплекса ванадия:
(3)
${\text{HV}}{{{\text{O}}}_{2}}\left( {{{{\text{O}}}_{2}}} \right) + 3{{{\text{H}}}_{{\text{2}}}}{\text{O}} = {{\left[ {{\text{VO}}{{{\left( {{\text{OH}}} \right)}}_{{\text{3}}}}{{{\left( {{\text{O}}{{{\text{H}}}_{{\text{2}}}}} \right)}}_{2}}} \right]}^{0}} + 1{\text{/2}}{{{\text{O}}}_{2}},$(4)
${{{\text{H}}}_{{\text{3}}}}{\text{V}}{{{\text{O}}}_{{\text{2}}}}{{\left( {{{{\text{O}}}_{{\text{2}}}}} \right)}_{2}} + 2{{{\text{H}}}_{{\text{2}}}}{\text{O}} = {{\left[ {{\text{VO}}{{{\left( {{\text{OH}}} \right)}}_{{\text{3}}}}{{{\left( {{\text{O}}{{{\text{H}}}_{{\text{2}}}}} \right)}}_{2}}} \right]}^{0}} + {{{\text{O}}}_{2}}.$Непрореагировавшую часть вещества в виде нерастворимого осадка удаляли при помощи фильтрования. После конденсации этого нейтрального прекурсора и охлаждения до комнатной температуры система переходит в гель V2O5⋅nH2O по реакции [10]:
(5)
$2{{\left[ {{\text{VO}}{{{\left( {{\text{OH}}} \right)}}_{{\text{3}}}}{{{\left( {{\text{O}}{{{\text{H}}}_{{\text{2}}}}} \right)}}_{2}}} \right]}^{0}} \to {{{\text{V}}}_{{\text{2}}}}{{{\text{O}}}_{5}}\cdot7{{{\text{H}}}_{{\text{2}}}}{\text{O}}.$В гель добавляли высокомолекулярный поливинилпирролидон (PVP) (Mr = 1.3 × 106 г/моль) для увеличения электропроводности и перемешивали в течение 2 ч до полного растворения частиц при комнатной температуре в закрытой емкости.
Полученную однородную смесь помещали в медицинский шприц с диаметром иглы 0.7 мм. Установка для электроспиннинга [11, 12] состояла из шприцевого насоса “NewEra” Syringe Pump NE-300, с помощью которого из шприца вытеснялся раствор со скоростью 0.3 мл/ч, и высоковольтного источника напряжения ИНВР-30/5. Между иглой и алюминиевым коллектором создавалось напряжение 17–18 кВ при расстоянии около 12 см.
Полученные нанонити отделялись от коллектора и отжигались в воздушной среде при температуре 500°С в течение 30 мин в программируемой вакуумной печи OTF-1200X. Отжиг необходим для удаления полимера, выпаривания излишков воды и кристаллизации нанонитей.
Рентгенофазовый анализ (XRD) нитей проводили с помощью дифрактометра Kristalloflex Siemens 5000 с CuKα-излучением (длина волны 1.5418 Å). Для подготовки образца нанонити пентаоксида ванадия прессовали и наносили на стеклянную подложку. При обработке результатов влияние подложки было исключено. Для определения фазы и параметров искомого вещества проводилось сравнение дифракционных пиков с картотекой рентгенодифракционных данных.
Исследования элементного состава проводилось с помощью энергодисперсионной приставки (EDX, Thermo Scientific Ultra Dry) к сканирующему электронному микроскопу HitachiSU1510.
Для детального изучения морфологии поверхности и оценки диаметра нанонитей использовали лазерный конфокальный микроскоп KEYNCE VK-9710.
Материал для рабочих электродов был приготовлен в соотношении 60/30/10 (V2O5/проводящая углеродная сажа (Super P)/связующее вещество). Нанонити пентаоксида ванадия тщательно перетирались в ступке и смешивались до однородного состояния с наночастицами сажи. Связующее вещество получалось путем растворения поливинилиденфторида в N-метилпирролидоне. Электродная масса ровным слоем наносилась на алюминиевую фольгу. Для удаления N-метилпирролидона электроды сушили в вакуумной сушильной камере при температуре 120°С в течение суток. Далее электроды повторно прокатывали для улучшения контакта между активным веществом электродов и алюминиевой фольгой.
Электрохимические исследования (циклическая вольтамперометрия и заряд-разрядное циклирование) проводились с помощью потенциостата-гальваностата Autolab. С целью предварительной оценки перспективности использования нанонитей пентаоксида ванадия в качестве катодного материала для литий-ионного аккумулятора образцы исследовались в воздушной атмосфере. При этом использовалась открытая трехэлектродная ячейка, которая состояла из рабочего электрода (исследуемое вещество), электрода сравнения (серебряная проволока) и противоэлектрода (платиновая фольга). В качестве электролита использовался одномолярный раствор перхлората лития в пропиленкарбонате. Скорость развертки составляла 1 мВ/с, диапазон напряжений от –1.5 до +1.5 В.
Для нахождения удельных токов заряда–разряда использовалась формула:
где Icv – максимальный ток на вольтамперограмме (А), m – масса смеси, нанесенной на электрод (г).Для исследования характеристик полученного катодного материала была собрана тестовая модель аккумулятора монетного типа. Сборка проводилась в перчаточном боксе Unilab, заполненном аргоном. Катодом являлся исследуемый материал, нанесенный на алюминий, а в качестве анода использовалась пластина из металлического лития. Площадь катода составляла 7 мм2. Электроды были разделены мембраной Celgard 2325, в качестве электролита использовался одномолярный раствор гексафторфосфата лития в смеси пропиленкарбоната с диметоксиэтаном в соотношении 1 : 1.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
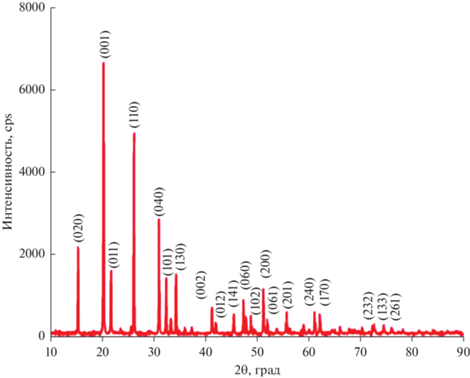
Рентгенофазовый анализ (рис. 1) показал, что были получены нанонити стехиометричного пентаоксида ванадия с орторомбической ячейкой. Параметры ячейки: a = 11.51 Å, b = 3.559 Å, c = = 4.371 Å, α = β = γ = 90° (ICSD № 15984).
Основные дифракционные пики соотнесены с плоскостями орторомбической кристаллической решетки V2O5, отмеченными на рентгентограмме, и указывают на получение однофазного продукта. Пики малой интенсивности также соответствуют данной фазе пентаоксида ванадия.
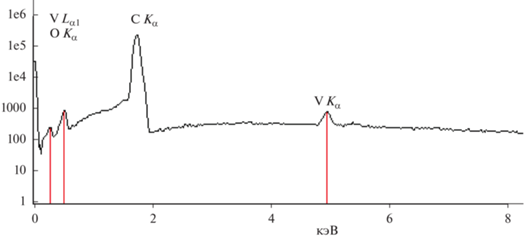
Результаты исследования элементного состава нанонитей V2O5 показаны на рис. 2. Присутствует углерод от подложки. Отсутствие азота говорит о том, что органических составляющих (PVP) после отжига в нитях не осталось.
Рис. 2.
Энергодисперсионный спектр для нанонитей V2O5, полученный с помощью приставки Thermo Scientific Ultra Dry к сканирующему электронному микроскопу HitachiSU1510.
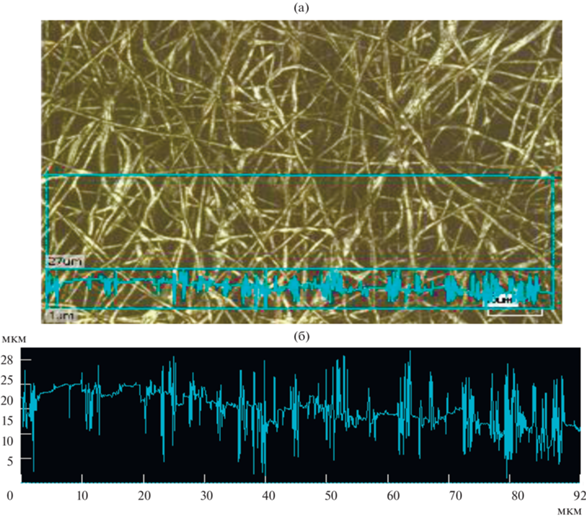
Сканирующая электронная микроскопия показала, что материал имеет наноразмерную нитевидную морфологию (рис. 3). Результаты измерения размеров нанонитей совпадают с результатами, полученными лазерной конфокальной микроскопией.
Рис. 3.
Изображения нанонитей V2O5, полученные с помощью сканирующей электронной микроскопии. Увеличение 10 000 (а) и 70 000 (б).

На рис. 4 представлена фотография нанонитей пентаоксида ванадия, полученная с помощью лазерного конфокального микроскопа KEYNCE VK-9710. Также показан способ определения толщины нанонитей. Нанонити имеют толщину порядка 200–250 нм.
Рис. 4.
Морфология нанонитей V2O5 с увеличением 3000, полученная с помощью лазерного конфокального микроскопа KEYNCE VK-9710: a – участок образца, взятый для анализа диаметра нанонитей и размеров пор, б – рельеф образца на выбранном участке.
Результаты электрохимических исследований катодов, изготовленных с использованием полученных нитей, представлены на рис. 5–7.
Рис. 5.
Вольтамперограмма при скорости развертки 1 мВ/с в открытой трехэлектродной ячейке в атмосфере воздуха.
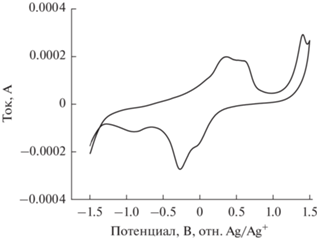
Рис. 6.
Зависимость заряда от времени при скорости развертки 1 мВ/с в открытой трехэлектродной ячейке в атмосфере воздуха.
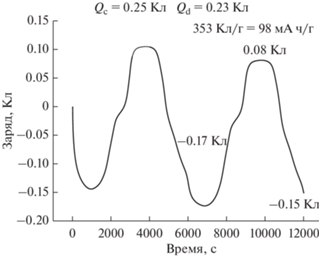
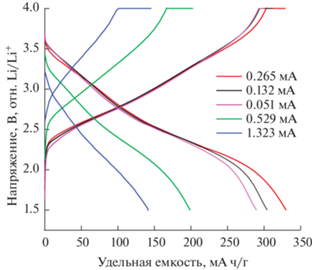
Рис. 7.
Зависимость потенциала от удельной емкости при различных токах заряда–разряда для модели аккумулятора монетного типа CR2032.
Циклические вольтамперограммы и кривые изменения заряда в зависимости от времени показаны на рис. 5 и 6. Первичные исследования были проведены в открытой трехэлектродной ячейке в атмосфере воздуха. На вольтамперограмме наблюдаются две основные пары катодных (–23 и –279 мВ) и соответствующих анодных (+353, +617 мВ) пиков. В согласии с имеющимися в литературе данными они, по-видимому, относятся к процессам последовательной обратимой интеркаляции/деинтеркаляции ионов лития с последовательным формированием структур Li0.5V2O5 и LiV2O5 [13–15]. Наблюдаемый анодный пик при высоких положительных потенциалах (1.4 В) может быть связан с побочным процессом окисления, идущим с участием примесей воды в условиях проведения экспериментов в открытой трехэлектродной ячейке.
На кривой изменения заряда в зависимости от времени (рис. 6) видно, что в процессе разряда материал отдает заряда больше, чем получил в процессе заряда. Это может быть вызвано деградацией материала в процессе интеркаляции и деинтеркаляции ионов лития.
На основании графика на рис. 6 была рассчитана удельная емкость активного вещества по формуле
где c – концентрация активного компонента (%), m – активная масса электрода (г), QD – заряд во время разряда аккумулятора (Кл).Значение удельной емкости, относящейся к массе электрода, составило 98 мА ч г–1, а значение удельной емкости, относящееся к массе активного компонента (V2O5), составило 163 мА ч г–1 при скорости сканирования 1 мВ/с.
Результаты заряд-разрядного циклирования для модели аккумулятора монетного типа представлены на рис. 7. На основании графика (рис. 7) по кривым заряда–разряда было найдено значение удельной емкости – 330 мА ч г–1 при плотности тока 0.068 А/г. Разница между значениями удельной емкости, извлеченными из CV-характеристик и кривых заряда–разряда, связана с более высокими плотностями тока в случае измерений CV при относительно высокой скорости сканирования.
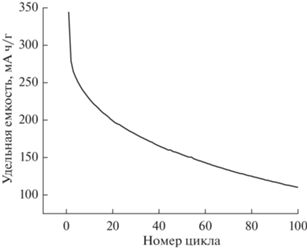
Результаты оценки скорости деградации емкости при циклировании приведены на рис. 8.
Первоначально образец имел большую удельную емкость около 320 мА ч г–1 при токе 0.3 мА во втором цикле, но после 50 циклов удельная емкость уменьшилась почти в два раза. Сравнивая полученные результаты с литературными данными, можно заметить, что по сравнению с другими наноструктурами пентаоксида ванадия нанонити обладают большей начальной удельной емкостью, однако быстро ее теряют и деградируют. Так, например, наночастицы пентаоксида ванадия обладают меньшей изначальной удельной емкостью (250 мА ч/г), но за 50 циклов теряют всего лишь около 5% емкости. Удельная емкость кластеров нановолокон пентаоксида ванадия составляет около 200 мА ч/г, деградация емкости за 50 циклов – около 5–10% [16–18]. Чтобы улучшить свойства и предотвратить деградацию синтезированного материала, нами планируется использование легирования нановолокна пятиокиси ванадия ионами переходных металлов, которые имеют больший ионный радиус [19]. Это должно приводить к расширению кристаллической решетки V2O5, тем самым упрощая интеркаляцию и деинтеркаляцию ионов лития.
По результатам электрохимических исследований показано, что материал на основе нанонитей пентаоксида ванадия способен к обратимой интеркаляции катионов лития и после доработки сможет использоваться в качестве активного вещества в катодах литий-ионных аккумуляторов.
ВЫВОДЫ
В результате проведенных исследований были синтезированы нанонити стехиометричного пентаоксида ванадия из золь–геля V2O5 методом электроспиннинга. Диаметр нитей составил 200–250 нм. Начальная удельная емкость катода в открытой трехэлектродной ячейке составляет около 163 мА ч г–1 при плотности тока 0.2 А/г.
В результате работы была собрана аккумуляторная батарея монетного типа, обладающая начальной удельной емкостью около 330 мА ч/г при плотности тока 0.068 А/г, что является хорошим результатом для литий-ионного аккумулятора. Недостатком полученной модели аккумулятора является плохая стабильность, которая выражается в потере 50% емкости после 50 циклов заряда–разряда. Данный недостаток можно исправить, например, путем легирования нанонитей пентаоксида ванадия ионами металлов, имеющими больший ионный радиус.
Показано, что нановолокна пентаоксида ванадия, полученные простым и надежным методом электроспиннинга, являются перспективным материалом для использования в катодах литий-ионных аккумуляторов.
Список литературы
Afyon, S., Krumeich, F., Mensing, C., Borgschulte, A., and Nesper, R., New high capacity cathode materials for rechargeable Li-ion batteries: vanadate–borate glasses, Sci. Rep., 2014, vol. 4, p. 7113-1.
Ceilidh, F.A., Joyce, S.Y., Xu, L., and Adrian, L., Electrospun vanadium-based oxides as electrode materials, J. Power Sources, 2018, vol. 395, p. 414.
Yu, J.J., Yang, J., Nie, W.B., Li, Z.H., Liu, E.H., Lei, G.T., and Xiao, Q.Z., A porous vanadium pentoxide nanomaterial as cathode material for rechargeable lithium batteries, Electrochim. Acta, 2013, vol. 89, p. 292.
Yan, B., Li, X., Bai, Z., Li, M., Dong, L., Xiong, D., and Li, D., Superior lithium storage performance of hierarchical porous vanadium pentoxide nanofibers for lithium-ion battery cathodes, J. Alloy. Comp., 2015, vol. 634, p. 50.
Zhu, C., Shu, J., Wu, X., Li, P., and Li, X., Electrospun V2O5 micro/nanorods as cathode materials for lithium-ion battery, J. Electroanal. Chem., 2015, vol. 759, no. 2, p. 184.
Yan, B., Li, X., Bai, Z., Li, M., Dong, L., Xiong, D., and Li, D., Sn–Al core–shell nanocomposite as thin film anode for lithium-ion batteries, J. Alloys Compd., 2015, vol. 634, p. 742.
Xue, Y., Castracane, J., Gadre, A., Lee, J.H., and Altemus, B., Fabrication and Characterization of Aligned Continuous Polymeric Electrospun Nanofibers, Micro and Nanosystems, 2009, vol. 1, no. 2, p. 116.
Berezina, O.Ya., Kirienko, D.A., Pergament, A.L., Stefanocih, G.B., Velichko, A.A., and Zlomanov, V.P., Vanadium Oxide Thin Films and Fibers Obtained by Acetylacetonate Sol-gel Method, Thin Solid Films, 2015, vol. 574, p. 15.
Berezina, O.Ya., Kirienko, D.A., Markova, N.P., and Pergament, A.L., Synthesis of Vanadium pentoxide micro- and nanofibers by electrospinning, Technical Physics, 2015, vol. 60, no. 9, p. 1361.
Захарова, Г.С. Интеркалаты оксидов ванадия и нанотубулены на их основе: синтез, строение, свойства. Автореф. дис. Екатеринбург, 2007. [Zakharova, G.S., Vanadium oxide intercalates and nanotubulenes based on them: synthesis, structure, properties (in Russian), abstract of dissertation, Yekaterinburg, 2007.]
Berenguer, R., Guerrero-Perez, M.O., Guzman, I., Rodriguez-Mirasol, J., and Cordero, T., Synthesis of Vanadium Oxide Nanofibers with Variable Crystallinity and V5+/V4+ Ratios, ACS Omega, 2017, vol. 2, p. 7739.
Nishide, H. and Oyaizu, K., Toward Flexible Batteries, Science, 2008, vol. 319, no. 5864, p. 737.
Cocciantelli, J., Doumerc, J.P., Pouchard, M., Broussely, M., and Labat, J., Crystalchemictry of electrochemically inserted LixV2O5, J. Power Sources, 1991, vol. 34, p. 103.
Wang, S., Lu, Z., Wang, D., Li, C., Chen, C., and Yin, Y., Porous monodisperse V2O5 microspheres as cathode materials for lithium-ion batteries, J. Materials Chem., 2011, vol. 21, p. 6365.
Liu, P., Wang, B., Sun, X., Gentle, I., and Zhao, X. S., A comparative study of V2O5 mofified with multi-walled carbon nanotubes and poly(3,4-ehtylenedioxythiophene) for lithium-ion batteries, Electrochim. Acta, 2016, vol. 213, p. 557.
Zhu, K., Meng, Y., Qiu, H., Gao, Y., Wang, C., Du, F., Wei, Y., and Chen, Gang, Facile Synthesis of V2O5 Nanoparticles as a Capable Cathode for High Energy Lithium-ion Batteries, J. Alloys and Compounds, 2015, vol. 650, p. 370.
Ramasami, A.K., Reddy, M.V., Nithyadharseni, P., Chowdari, B.V.R., and Balakrishna, G.R., Gel-combustion synthesized vanadium pentoxide nanowire clusters for rechargeable lithium batteries, J. Alloys and Compounds, 2016, vol. 695, p. 850.
Tang, Y., Rui, X., Zhang, Y., Lim, T.M., Dong, Z., Hng, H.H., Chen, X., Yand, Q., and Chen, Z., Vanadium pentoxide cathode materials for high-performance lithium-ion batteries enabled by a hierarchical nanoflower structure via an electrochemical process, 2013, vol. 1, p. 82.
Wei, Y.J., Ryu, C.W., and Kim, K.B., Improvement in Electrochemical Performance of V2O5 by Cu doping, Power Sources, 2007, vol. 165, no. 1, p. 386.
Дополнительные материалы отсутствуют.