Электрохимия, 2022, T. 58, № 7, стр. 380-384
Ионная проводимость композитов LiTi2(PO4)3–LiClO4
А. С. Улихин a, *, Д. В. Новожилов a, b, В. Р. Хуснутдинов a, Ю. Е. Синельникова a, c, Н. Ф. Уваров a, b, c
a Институт химии твердого тела и механохимии СО РАН
Новосибирск, Россия
b Новосибирский государственный университет
Новосибирск, Россия
c Новосибирский государственный технический университет
Новосибирск, Россия
* E-mail: ulikhin@solid.nsc.ru
Поступила в редакцию 27.11.2021
После доработки 19.01.2022
Принята к публикации 14.02.2022
- EDN: MBGURK
- DOI: 10.31857/S0424857022070143
Аннотация
Синтезированы композиционные твердые электролиты (1 – х)LiTi2(PO4)3–xLiClO4 и исследованы их электропроводящие свойства. Гетерогенное допирование LiTi2(PO4)3 перхлоратом лития LiClO4 приводит к заметному росту ионной проводимости и снижению энергии активации, по сравнению с чистым соединением, не подвергавшемуся предварительному спеканию. Проводимость композитов достигает значения 6.8 × 10–6 См/см при 100°С и 3.4 × 10–4 при 200°С с энергией активации 0.62 эВ.
ВВЕДЕНИЕ
Одной из ключевых проблем при изготовлении твердотельных электрохимических устройств, на основе известных на сегодняшний день твердых электролитов, является получение литий-проводящих мембран с высокой плотностью, что требует затратных методик, связанных с использованием высоких температур как для синтеза искомых материалов, так и для получения образцов мембраны с высокой плотностью. Решение данной проблемы позволит существенно продвинуться в области твердотельной электрохимической энергетики и обеспечит возможность создания устройств хранения и преобразования энергии, обладающих неоспоримыми преимуществами по сравнению с электрохимическими источниками тока, широко используемыми в настоящее время. Согласно недавнему обзору, представленному группой авторов из Массачусетского технологического института (MIT), главной проблемой, препятствующей массовому использованию твердотельных литиевых источников тока, являются высокие затраты, связанные с изготовлением твердотельных литий-проводящих мембран, так как ресурсные затраты на их изготовление достигают 75% от общих затрат [1]. Один из наиболее перспективных способов решения данной проблемы состоит в использовании в качестве ионпроводящей компоненты композитных твердых электролитов, так как получение плотной мембраны с высокой ионной проводимостью на основе таких электролитов не требует высоких температур и может быть проведено используя “холодные” способы. Одной из таких систем является композитный твердый электролит типа “суперионный проводник–ионная соль”.
Согласно литературным данным, LiTi2(PO4)3 (LTP) является суперионным проводником по ионам лития. Однако, хотя значение объемной ионной проводимости этого соединения при комнатной температуре достаточно велико, ~10–4–10–3 См/см [2–9], общая ионная проводимость LTP составляет 10–8–10–6 См/см при комнатной температуре. Низкие значения ионной проводимости обусловлены вкладом сопротивления межзеренных границ. Стоит отметить, что значение общей ионной проводимости является наиболее значимым критерием для практического применения материала в литий-ионных аккумуляторах. Ранее предпринимались различные попытки увеличить проводимость межзеренных границ, чтобы получить материал LTP с приемлемыми значениями общего сопротивления. Есть данные, что высокие значения общей ионной проводимости могут быть получены путем кристаллизации стекла на основе NASICON [10, 11]. Другой подход к модернизации LTP заключается в введении некоторой дополнительной, гетерогенной фазы в межзеренное пространство LTP, что может способствовать снижению сопротивления границы зерен [9, 12–14].
Ранее [15, 16] было показано, что гетерогенное допирование перхлората лития высокодисперсными оксидами приводит к существенному росту ионной проводимости LiClO4. Также в литературе имеются данные о композиционных твердых электролитах на основе соединения со структурой граната Li7La2.75Ca0.25Zr1.75Nb0.25O12–LiClO4 [17], в которых малая добавка перхлората лития оказывает существенное влияние на стабильность в процессе зарядно-разрядного циклирования твердотельных литиевых источников тока. Тем не менее, исследований проводимости композиционных твердых электролитов на основе суперионных соединений с добавкой перхлората лития в широком диапазоне концентраций ранее не проводилось.
В настоящей работе проведен синтез и исследование проводимости композиционных твердых электролитов на основе LTP с перхлоратом лития LiClO4 в качестве гетерогенной добавки.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Титанофосфат лития (LTP) был получен стандартным керамическим методом по реакции (1):
(1)
$\begin{gathered} {\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{C}}{{{\text{O}}}_{{\text{3}}}} + 6{\text{N}}{{{\text{H}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{2}}}}{\text{P}}{{{\text{O}}}_{{\text{4}}}} + 4{\text{Ti}}{{{\text{O}}}_{2}} \to \\ \to 2{\text{LiT}}{{{\text{i}}}_{{\text{2}}}}{{\left( {{\text{P}}{{{\text{O}}}_{{\text{4}}}}} \right)}_{{\text{3}}}} + {\text{ }}6{\text{N}}{{{\text{H}}}_{{\text{3}}}}{\kern 1pt} \uparrow + \,\,{\text{C}}{{{\text{O}}}_{2}} + 9{{{\text{H}}}_{{\text{2}}}}{\text{O}}. \\ \end{gathered} $Исходные компоненты Li2CO3 (х. ч.), NH4H2PO4 (х. ч.), TiO2 (х. ч.) были взяты в расчетных количествах (карбонат лития был взят с избытком 3 мас. %) и смешаны в ступке. Полученная смесь предварительно выдерживалась при 500°C в течение 5 ч. После охлаждения смесь растиралась в ступке. Из полученного порошка были спрессованы таблетки, которые спекались при температуре 950°C в течение 12 ч с образованием LTP. Для получения композитов образцы были растерты в ступке, смешаны в токе аргона в заданных соотношениях с предварительно осушенным LiClO4 (х. ч.) и прогреты в вакуумной печи при 300°С в течение 1 ч.
Кристаллическую структуру образцов исследовали методом рентгенофазового анализа с помощью дифрактометра Bruker D8 Advanced на излучении CuKα. Морфологию образцов изучали сканирующей электронной микроскопией (СЭМ) на электронном микроскопе HITACHI TM1000.
Измерения проводимости проводили в вакууме 5 × 10–2 торр в диапазоне температур 30–160°С на переменном токе с помощью прецизионного измерителя электрических параметров Hewlett Packard НР 4284А в диапазоне частот 30 Гц–1 МГц. Образцы представляли собой таблетки, спрессованные под давлением 3.5 МПа вместе с двумя порошковыми серебряными электродами. Значения проводимости рассчитывали путем анализа годографов импеданса в координатах Найквиста Z "–Z '.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Рентгенофазовый анализ
Результаты рентгенофазового анализа исходного порошка LTP приведены на рис. 1. Положения основных рефлексов на дифрактограмме продукта полностью соответствуют стандартному образцу LTP (JCPDS card PDF #32-754). Кроме того, присутствуют рефлексы, обусловленные наличием незначительного количества примесных фаз: LiTiOPO4 (PDF #77-944) и TiO2 (PDF # 71-1167, PDF #72-1148).
Согласно данным сканирующей микроскопии, размер зерен исходного порошка LTP составляет ~1–5 мкм (рис. 2).
На рис. 3 приведены результаты рентгенофазового анализа исходных соединений и композитов (1 – x)LiTi2(PO4)3–xLiClO4 (x = 0.3, 0.6). Из представленных дифрактограмм видно, что в ходе синтеза композитов не происходит химического взаимодействия между собой исходных компонентов с образованием новых кристаллических фаз, так как наблюдаются рефлексы только LTP и LiClO4.
Ионная проводимость
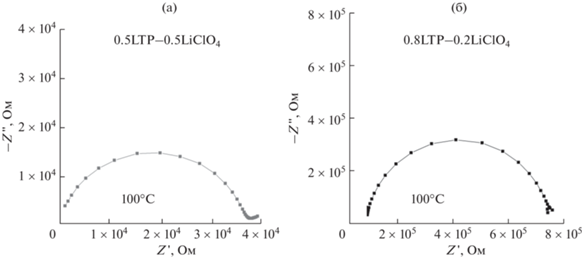
Годограф импеданса твердого электролита, представленный в координатах Найквиста, представляет собой полуокружность, соответствующую объемной проводимости ионной соли, находящейся в межзеренном пространстве, и линейную зависимость в области низких частот, обусловленную вкладом поляризации на блокирующих электродах (рис. 4). Типичные годографы импеданса композитов (1 – x)LTP–xLiClO4 с x = 0.5 и 0.2 приведены на рис. 4.
Рис. 5.
Температурная зависимость проводимости исходных соединений и композитов (1 – x)LiTi2(PO4)3–xLiClO4 (штриховая линия – литературные данные по проводимости LTP спеченного при T = 700°С [13]).

Температурные зависимости проводимости композитов (1 – x)LiTi2(PO4)3–xLiClO4 приведены на рис. 5 . Проводимость LTP составляет ~10–6 См/см при 200°C. Видно, что полученные значения существенно отличаются от литературных данных. Это обусловлено тем, что исследуемый образец после прессования не подвергался спеканию, в результате чего основной вклад в проводимость вносит сопротивление межзеренных границ [2]. Несмотря на то, что проводимость чистого LiClO4 не превышает 10–5 См/см при T = 200°C, гетерогенное допирование титанофосфата лития перхлоратом лития приводит к существенному росту ионной проводимости (более чем на 3 порядка при T = 200°С). Значения проводимости хорошо воспроизводятся в циклах нагрев–охлаждение. Это свидетельствует о том, что проводимость обусловлена переносом катиона Li+, а не протонами воды, которая может быть связана с ионной солью.
Результаты исследования зависимости проводимости композитов (1 – x)LiTi2(PO4)3–xLiClO4 от температуры показали, что несмотря на то, что перхлорат лития обладает низким значением ионной проводимости (не превышает 10–5 См/см), введение перхлората лития в межзеренное пространство титанофосфата лития приводит к заметному росту общей проводимости и снижению энергии активации. Параметры ионной проводимости приведены в табл. 1. Значения рассчитывались из уравнения Аррениуса–Френкеля σT = Aexp(–Ea/RT) (A – предэкспоненциальный множитель, Ea – энергия активации проводимости) в области температур 100–200°C.
Таблица 1.
Параметры ионной проводимости системы (1 – x)LiTi2(PO4)3–xLiClO4
| Соединение | σ100, См/cм | σ200, См/см | Еа, эВ |
|---|---|---|---|
| LiTi2(PO4)3 | 3.2 × 10–9 | 3.6 × 10–7 | 0.76 ± 0.02 |
| LiClO4 | 2.2 × 10–8 | 3.4 × 10–6 | 0.81 ± 0.02 |
| 0.8LiTi2(PO4)3–0.2LiClO4 | 8.3 × 10–7 | 9.4 × 10–5 | 0.73 ± 0.02 |
| 0.6LiTi2(PO4)3–0.4LiClO4 | 6.8 × 10–6 | 3.4 × 10–4 | 0.62 ± 0.02 |
| 0.5LiTi2(PO4)3–0.5LiClO4 | 6.3 × 10–6 | 5.1 × 10–4 | 0.70 ± 0.02 |
Наблюдаемый эффект может быть качественно объяснен следующим образом [18]: при холодном прессовании смеси LTP и LiClO4 морфология композита зависит от концентрации компонентов: при малом содержании перхлората образец представляет собой агрегат частиц LTP, поверхность которых покрыта тонким слоем соли, которая заполняет и межзеренные границы оксида. В наших ранних работах [15, 16] было показано, что в композитах на основе перхлората лития с оксидами вблизи поверхности раздела фаз образуются разупорядоченные высокопроводящие аморфные фазы LiClO4. По-видимому, аналогичный эффект наблюдается и на границе раздела фаз LiClO4/LTP. Образование проводящих прослоек аморфной фазы LiClO4 приводит к резкому уменьшению сопротивления межзеренных границ в композитной керамике, к росту общей проводимости композита и снижению энергии активации проводимости. При увеличении содержания перхлората лития он заполняет все поры керамического материала и образует непрерывную сетку проводящих слоев. При этом проводимость достигает максимума и определяется как объемной проводимостью, так и проводимостью аморфной фазы LiClO4. При дальнейшем увеличении концентрации добавки соли контакты между частицами LTP разрываются, и прослойки между ними, заполненные ионной солью, становятся более широкими. Учитывая, что слой аморфной фазы в ионных солях на границе раздела фаз имеет малую толщину порядка нескольких нанометров [19], рост толщины слоя фазы перхлората приводит к уменьшению проводимости вследствие перколяционного эффекта. В результате, введение ионной соли приводит к тому, что происходит снижение межзеренной составляющей проводимости, несмотря на то, что перхлорат лития обладает низкой ионной проводимостью.
ЗАКЛЮЧЕНИЕ
В работе впервые были синтезированы и исследованы композиционные твердые электролиты (1 – x)LiTi2(PO4)3–xLiClO4 в широком диапазоне концентраций компонентов. Показано, что введение малых количеств перхлората лития приводит к заполнению межзеренного пространства LiTi2(PO4)3 и приводит к заметному росту ионной проводимости и снижению энергии активации, по сравнению с чистым соединением, не подвергавшемуся предварительному спеканию. Причиной данного эффекта является высокая ионная проводимость перхлората лития в области контакта фаз с LTP. Ранее подобный эффект наблюдался для других композиционных электролитов, в том числе и на основе LiClO4. Проводимость полученных композитов достигает значений 6.8 × 10–6 См/см при 100°С и 3.4 × 10–4 при 200°С с энергией активации 0.62 эВ. Дальнейшее увеличение проводимости может быть достигнуто за счет предварительного спекания LTP и пропитки полученной керамики ионной солью, что позволит уменьшить относительную толщину межзеренных границ и обеспечить более плотный контакт через слой амофной фазы перхлората лития.
Список литературы
Balaish, M., Gonzalez-Rosillo, J.C., Kim, K.J., Zhu, Yu., Hood, Z.D., and Rupp, J.L.M., Processing thin but robust electrolytes for solid-state batteries, Nature Energy, 2021, vol. 6, p. 227.
Arbi, K., Rojo, J.M., and Sanz, J., Lithium mobility in titanium based Nasicon Li1 +xTi2 –xAlx(PO4)3 and LiTi2 –xZrx(PO4)3 materials followed by NMR and impedance spectroscopy, J. Eur. Ceram. Soc., 2007, vol. 27, p. 4215.
Aono, H., Sugimoto, E., Sadaoka, Y., and Imanaka, N.A., Ionic Conductivity of Solid Electrolytes Based on Lithium Titanium Phosphate, G., J. Electrochem. Soc., 1990, vol. 137, p. 1023.
Arbi, K., Mandal, S., Rojo, J.M., and Sanz, J., Dependence of Ionic Conductivity on Composition of Fast Ionic Conductors Li1 +xTi2 –xAlx(PO4)3, 0 ≤ x ≤ 0.7. A Parallel NMR and Electric Impedance Study, Chem. Mater., 2002, vol. 14, p. 1091.
Wang, S., Ben, L., Li, H., and Chen, L., Identifying Li+ ion transport properties of aluminum doped lithium titanium phosphate solid electrolyte at wide temperature range, Solid State Ionics, 2014, vol. 268 p. 110.
Arbi, K., Tabellout, M., and Sanz, J., NMR and electric impedance study of lithium mobility in fast ion conductors LiTi2 –xZrx(PO4)3 (0 ≤ x ≤ 2), Solid State Ionics, 2010, vol. 180, p. 1613.
Kahlaoui, R., Arbi, K., Sobrados, I., Jimenez, R., Sanz, J., and Ternane, R., Cation Miscibility and Lithium Mobility in NASICON Li1 +xTi2 –xScx(PO4)3 (0 ≤ x ≤ 0.5) Series A: Combined NMR and Impedance Study, Inorg. Chem., 2017, vol. 56, p. 1216.
Šalkus, T., Barre, M., Kežionis, A., Kazakevičius, E., Bohnke, O., Selskienė, A., and Orliukas, A.F., Ionic conductivity of Li1.3Al0.3 –xScxTi1.7(PO4)3 (x = 0, 0.1, 0.15, 0.2, 0.3) solid electrolytes prepared by Pechini process, Solid State Ionics, 2012, vol. 225, p. 615.
Kwatek, K. and Nowiński, J.L., Electrical properties of LiTi2(PO4)3 and Li1.3Al0.3Ti1.7(PO4)3 solid electrolytes containing ionic liquid, Solid State Ionics, 2017, vol. 302, p. 54.
Fu, J., Fast Li+ ion conduction in Li2O–(Al2O3 Ga22O3)–TiO2–P2O5 glass-ceramics, Mater. Sci., 1998, vol. 33, p. 1549.
Fu, J., Superionic conductivity of glass-ceramics in the system Li2O–Al2O3–TiO2–P2O5, Solid State Ionics, 1997, vol. 96, p. 195.
Kwatek, K. and Nowiński, J.L., Studies on electrical properties of composites based on lithium titanium phosphate with lithium iodide, Solid State Ionics, 2017, vol. 302, p. 35.
Kobayashi, Y., Tabuchi, Nakamura, M.O., Ionic conductivity enhancement in LiTi2(PO4)3-based composite electrolyte by the addition of lithium nitrate, J. Power Sources, 1997, vol. 68, p. 407.
Aono, H., Sugimoto, E., Sadaoka, Y.N., Adachi, Imanaka, G., Electrical property and sinterability of LiTi2(PO4)3 mixed with lithium salt (Li3PO4 or Li3BO3), Solid State Ionics, 1991, vol. 47, p. 257.
Ulihin, A.S., Uvarov, N.F., Mateyshina, Yu.G., Brezhneva, L.I., and Matvienko, A.A., Composite solid electrolytes LiClO4–Al2O3, Solid State Ionics, 2006, vol. 177, p. 2787.
Улихин, А.С., Уваров, Н.Ф. Электрохимические свойства композиционных твердых электролитов LiClO4–MgO. Электрохимия. 2009. Т. 45. С. 755. [Ulihin, A.S. and Uvarov, N.F., Electrochemical properties of composition solid electrolytes LiClO4–MgO, Russ. J. Electrochem., 2009, vol. 45, p. 707.]
Abrha, L.H., Zegeye, T.A., Hagos, T.T., Sutiono, H., Hagos, T.M., Berhe, G.B., Huang, C.-J., Jiang, S.-K., Su, W.-N., Yang, Y.-W., and Hwang, B.-J., Li7La2.75Ca0.25Zr1.75Nb0.25O12@LiClO4 composite film derived solid electrolyte interphase for anode-free lithium metal battery, Electrochim. Acta, 2019, vol. 325, p. 134825.
Uvarov, N.F., Estimation of electrical properties of composite solid electrolytes of different morphologies, Solid State Ionics, 2017, vol. 302, p. 19.
Уваров, Н.Ф., Болдырев, В.В. Размерные эффекты в химии гетерогенных систем. Успехи химии. 2001. Т. 70. С. 307. [Uvarov, N.F. and Boldyrev, V.V., Size effects in chemistry of heterogeneous systems, Russ. Chem. Rev., 2001, vol. 70, p. 265.]
Дополнительные материалы отсутствуют.