Электрохимия, 2022, T. 58, № 9, стр. 569-578
Влияние природы растворителя на состав катодных осадков, образующихся на стальном электроде при электроосаждении и растворении металлического лития
А. Л. Иванов a, С. Э. Мочалов a, Е. В. Карасева a, *, В. С. Колосницын a
a Уфимский Институт химии Уфимского федерального исследовательского центра РАН
Уфа, Россия
* E-mail: karaseva@anrb.ru
Поступила в редакцию 24.11.2021
После доработки 10.02.2022
Принята к публикации 14.02.2022
- EDN: QWZOWI
- DOI: 10.31857/S0424857022090080
Аннотация
Разработан простой и удобный метод количественного определения различных форм лития в катодных осадках, образующихся на электроде из нержавеющей стали в процессе циклирования, основанный на измерении количества водорода, выделяющегося при их взаимодействии с протонсодержащими растворителями. Определено количество и соотношение электрохимически активного металлического лития, электрохимически неактивного металлического лития и химически связанного лития в составе катодных осадков, образующихся на стальном электроде в процессе гальваностатического циклирования в растворах LiClO4 в сульфолане и пропиленкарбонате. Предложен метод определения количества электролитного растворителя, прореагировавшего в химических реакциях с металлическим литием. Установлено, что, вне зависимости от природы растворителя, мольное соотношение прореагировавший растворитель–свежеобразованный литий лежит в диапазоне 0.84–0.85. Предположено, что взаимодействие свежеобразованного металлического лития с электролитным растворителем происходит в мольном соотношении 1 : 1. Заниженное значение соотношения прореагировавший растворитель–свежеобразованный литий объяснено взаимодействием свежеосажденного лития с анионом соли, в результате которого образуется оксид лития. Показано, что скорость деструкции сульфолана в процессе циклирования литиевого электрода примерно в 1.5 раза больше скорости деструкции пропиленкарбоната. Пропиленкарбонат при взаимодействии со свежеобразованным металлическим литием образует поверхностные пленки с лучшими защитными свойствами, чем сульфолан, что приводит к уменьшению скорости его взаимодействия с металлическим литием, увеличению кулоновской эффективности и длительности циклирования литиевого электрода.
ВВЕДЕНИЕ
Металлический литий давно и заслуженно привлекает внимание в качестве активного материала отрицательного электрода энергоемких аккумуляторов. Однако высокая химическая активность и склонность к образованию мелкодисперсных осадков при катодном осаждении не позволяет использовать металлический литиевый электрод в аккумуляторах [1, 2].
При катодном осаждении только часть лития образует компактные осадки, прочно сцепленные с поверхностью электрода и обладающие электрохимической активностью. Другая часть электроосажденного лития образует мелкодисперсные осадки дендритной или мшистой структуры. Мелкодисперсные осадки лития после потери электрического контакта с поверхностью электрода становятся электрохимически неактивными. В процессе электрохимического осаждения свежеобразованный металлический литий также вступает в химические взаимодействия с компонентами электролитных систем (растворителями, анионами солей, добавками, примесями), что приводит к образованию органических и неорганических литийсодержащих соединений и расходованию части электролита и электрохимически осажденного лития.
Таким образом, при электрохимическом осаждении образуются три формы лития: электрохимически активный металлический литий (компактный и мелкодисперсный, имеющий электрический контакт с электродом), электрохимически неактивный металлический литий (преимущественно мелкодисперсный) и электрохимически неактивный химически связанный литий (литий, входящий в состав неорганических и органических соединений). Литий, не способный принимать участие в электрохимических реакциях, часто называют “мертвый” литий [3–5].
Для понимания факторов, оказывающих влияние на закономерности электрохимического поведения литиевого электрода, важно знать соотношение различных форм лития в катодных осадках, образующихся при длительном катодно-анодном циклировании.
В работе [6] предложен косвенный метод количественной оценки “мертвого” кристаллического лития (DLCs – dead lithium crystals), образующегося при гальваностатическом циклировании литиевого электрода. После определенного количества циклов катодно-анодной поляризации литиевого электрода в специально изготовленной оптической ячейке авторы получали микроснимки дендритных образований DLCs на поверхности электрода. Количественную оценку электрохимически неактивного металлического лития осуществляли путем компьютерного анализа оцифрованных изображений DLCs.
В работах [7, 8] авторы определяли количество электрохимически неактивного металлического лития, образовавшегося после гальваностатического циклирования на электроде из медной фольги, методом газовой хроматографии. После циклирования ячейки Li|электролит|Cu сепаратор и медный электрод с осадком, содержащим электрохимически неактивный металлический литий, извлекали из электрохимической ячейки, помещали в герметичный сосуд с известным объемом и вводили в него 0.5–1 мл воды. Количество выделившегося Н2 определяли методом газовой хроматографии. По количеству выделившегося водорода рассчитывали массу электрохимически неактивного металлического лития.
Так, в работе [7] было показано, что после 1-го цикла катодного осаждения 1 мА ч/см2 лития на медную подложку из 1 M раствора LiPF6 в смеси этиленкарбоната с этилметилкарбонатом и последующего анодного растворения при плотности тока 0.5 мА/см2 соотношение различных форм лития (Liакт : Liнеакт : Liхим. св), образовавшихся при катодном осаждении, было равным 82 : 14 : 4. При увеличении плотности тока анодного растворения до 5 мА/см2 это соотношение составляло уже приблизительно 64 : 28 : 8.
В работе [8] были получены схожие результаты – после 1-го цикла катодного осаждения 2.1 мА ч/см2 лития на медную подложку из 1 M раствора LiPF6 в смеси этиленкарбоната с этилметилкарбонатом и последующего анодного растворения при плотности тока 0.2 мА/см2 соотношение Liакт : Liнеакт : Liхим. св составило 86 : 10 : 4.
Применение метода газовой хроматографии для определения водорода, выделяющегося в результате взаимодействия металлического лития с протонсодержащими растворителями, требует использования дорогостоящего специализированного оборудования, которое не всегда доступно в электрохимических лабораториях. Поэтому целью нашей работы была разработка простого и удобного в экспериментальном оформлении метода для непосредственного определения количества электрохимически неактивного металлического лития, соотношения различных форм лития в составе катодных осадков, образующихся на стальном электроде в процессе циклирования, и оценка влияния природы электролитного растворителя на состав катодных осадков. В качестве объектов исследований были выбраны растворы LiClO4 в сульфолане и пропиленкарбонате.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Удобным методом изучения процессов, протекающих при гальваностатическом циклировании литиевого электрода, является катодное осаждение и анодное растворение лития на электроде из инертного металла, не образующего сплавы с литием. Потенциал электрода из нержавеющей стали относительно литиевого электрода составляет ~2.5 В, что позволяет проследить общие закономерности электрохимических процессов, протекающих при катодно-анодном циклировании лития на стальном электроде.
Электрохимические исследования проводили в герметичных двухэлектродных ячейках, изготовленных из нержавеющей стали, с плоскопараллельными дисковыми электродами площадью 5 см2 (рис. 1). Рабочими электродами были электроды из нержавеющей стали Aisi 430, а вспомогательными – из литиевой фольги толщиной 100 мкм (99.9%, China Energy Lithium Co., Ltd.).
Рис. 1.
Фото электрохимической ячейки Li|электролит, сепаратор|SS в разобранном (слева) и в собранном виде (справа).

Для обеспечения заданного объема электролита в электрохимических ячейках в качестве сепаратора использовали комбинацию из 2 слоев сепарационного материала Celgard®3501 и 2 слоев нетканого полипропилена, размещенных между сепараторами Celgard®3501. Суммарный объем пор комбинации сепарационных материалов составлял 0.0158 см3/см2 или 15.8 мкл/см2.
Электролитный раствор в экспериментальные ячейки вносили количественно с помощью микрошприца MICROLITERTM Syringe (Hamilton Company, USA) объемом 50 мкл. Точность дозирования электролита в ячейках составляла ±5%. Объем электролитного раствора во всех ячейках с учетом избытка, необходимого для заполнения пространства между электродами и сепараторами, составлял 24 мкл/см2.
Давление поджима электродов во всех ячейках было равным 1 кг/см2 и обеспечивалось применением тарированных пружин сжатия.
В качестве электролитных систем использовали 1 М растворы LiClO4 в сульфолане (СЛ) и пропиленкарбонате (ПК). Содержание воды в электролитных растворах, определенное методом кулонометрического титрования в среде реактива Фишера с помощью автоматического титратора Titroline®7500 KF trace (SI Analytics), составляло ≤50 ppm.
Все операции по изготовлению литиевых электродов, подготовке электролитов и сборке ячеек проводили в перчаточном боксе в атмосфере осушенного воздуха ([H2O] ~ 5–20 ppm).
Гальваностатическую поляризацию ячеек осуществляли с помощью потенциостата/гальваностата с функцией импедансного спектрометра BioLogic SP-200 (Франция). Плотность тока при катодной и анодной поляризации была равной 0.2 мА/см2, диапазон напряжений на ячейках ограничивали значениями ±500 мВ. Количество электричества при катодном осаждении лития было равным 0.5 мА ч/см2 (1.8 Кл/см2). Циклирование ячеек проводили при температуре 30°С. До начала эксперимента ячейки после сборки термостатировали в течение 24 ч при 30°С.
Для того чтобы минимизировать влияние уменьшения объема электролита в процессе циклирования и более корректно определить соотношение трех форм лития в составе катодных осадков, циклическую катодно-анодную поляризацию рабочего электрода из нержавеющей стали проводили ограниченное количество циклов (30 циклов). Циклирование ячеек останавливали на анодном полуцикле.
При гальваностатическом циклировании напряжение на ячейках изменяется как в отдельных циклах, так и в процессе циклирования. Средние значения напряжений для каждого катодного и анодного полуциклов рассчитывали по уравнению
где $\bar {U}$ – среднее значение напряжения на ячейке за полуцикл, В; Ui – значение напряжения (В) на ячейке в катодном или анодном полуцикле, измеренное через заданный интервал времени; n – количество временных интервалов измерения напряжения на ячейке.Кулоновскую эффективность циклирования (ЭЦ) лития на электроде из нержавеющей стали для каждого цикла рассчитывали из отношения количеств электричества, прошедших через рабочий электрод в анодном (Qа) и катодном (Qк) полуциклах, по уравнению (2) [5]:
(2)
${\text{ЭЦ}} = \left( {{{{{Q}_{{\text{a}}}}} \mathord{\left/ {\vphantom {{{{Q}_{{\text{a}}}}} {{{Q}_{{\text{к}}}}}}} \right. \kern-0em} {{{Q}_{{\text{к}}}}}}} \right) \times 100\% .$Для оценки состояния рабочих и вспомогательных электродов после завершения электрохимических экспериментов все ячейки разбирали и дефектировали (postmortem analysis of cycled/dead cells [9, 10]). Дефектацию проводили в перчаточном боксе в атмосфере сухого воздуха. Визуально определяли цвет и внешний вид поверхностных слоев на рабочих и вспомогательных электродах, образовавшихся при циклировании ячеек, а также цвет электролитных растворов и степень их содержания в сепараторах. С помощью микрометра измеряли толщину поверхностных слоев, образованных на электродах в процессе циклирования металлического лития.
Количество оставшегося растворителя на поверхности и в порах сепараторов и катодного осадка лития после циклирования определяли весовым методом. Для этого после дефектации ячейки сепараторы и электроды взвешивали на аналитических весах (A&D, HR-200), затем помещали их в герметичный эксикатор из нержавеющей стали и сушили в динамическом вакууме при +60°С до постоянного веса (~2 ч). Количество растворителя, оставшегося в ячейках после циклирования, рассчитывали по разнице суммарной массы сепараторов и электродов до и после сушки. Количество растворителя, прореагировавшего с литием в процессе циклирования, расcчитывали по разнице масс растворителя до и после циклирования ячеек.
Количества электрохимически активного лития (Qact), электрохимически неактивного лития (Qinact) и химически связанного лития (Qchem), образовавшихся в процессе циклирования на стальном электроде, определяли следующим образом.
Первоначально рассчитывали суммарное количество катодноосажденного лития, соответствующее количеству электричества, затраченного во всех катодных циклах в процессе циклирования лития
где: Qdeposited – суммарное количество катодноосажденного лития, мА ч/см2; $Q_{n}^{{\text{к}}}$ – количество катодноосажденного лития на n-м цикле, мА ч/см2; n – количество циклов (30 циклов).Количество электрохимически активного лития рассчитывали из суммарного количества электричества, полученного при анодном растворении катодноосажденного лития, по уравнению
где Qact – суммарное количество аноднорастворенного лития, мА ч/см2; $Q_{n}^{{\text{a}}}$ – количество электричества, полученного при анодном растворении лития на n-м цикле, мА ч/см2; n – количество циклов (30 циклов).Количество электрохимически неактивного металлического лития определяли путем измерения давления в барометрической ячейке и расчете количества H2, выделившегося после растворения в изопропаноле накопившегося “катодного” осадка (смесь электрохимически неактивного металлического лития с продуктами деструкции электролитного раствора). В предварительных экспериментах было установлено, что наиболее удобным протонсодержащим реагентом для определения металлического лития является изопропанол. Взаимодействие металлического лития с изопропанолом происходит с умеренной скоростью без существенного повышения температуры реакционной зоны. В случае существенного повышения температуры реакционной зоны происходит термодеструкция продуктов взаимодействия металлического лития с компонентами электролитной системы, в результате которой образуются газообразные продукты, искажающие результаты определения количества газообразного водорода.
Для определения электрохимически неактивного металлического лития использовали специально разработанную барометрическую ячейку, изготовленную из нержавеющей стали (рис. 2).
Рис. 2.
Фото барометрической ячейки для определения электрохимически неактивного металлического лития.

Объем барометрической ячейки, определенный в предварительных экспериментах по массе воды, полностью заполняющей ячейку, был равен 42.7 см3. При расчетах объема водорода, выделяющегося при взаимодействии катодных осадков с изопропанолом, учитывали объем введенного спирта (~1 см3) и объем стального электрода (0.7 см3), который переносили из электрохимической ячейки после циклирования в барометрическую ячейку. Объем “катодного” осадка на электроде не учитывали. Таким образом, свободный объем барометрической ячейки, который учитывали в расчетах, составлял 41 см3. Для оценки точности определения металлического лития было измерено увеличение давления в барометрической ячейке при взаимодействии известного количества металлического лития с изопропанолом. По данным пяти экспериментов точность определения количества металлического лития составила ±3%.
Определение электрохимически неактивного лития в катодном осадке, образовавшемся на стальном электроде в процессе циклирования, осуществляли следующим образом. Стальной электрод с “катодным” осадком помещали в барометрическую ячейку, ячейку продували сухим аргоном и вводили 1 мл изопропанола (25°С). По изменению давления внутри ячейки (ΔP, атм) рассчитывали массу электрохимически неактивного лития по уравнению
(5)
$m\left( {{\text{L}}{{{\text{i}}}_{{{\text{inact}}}}}} \right) = \frac{{\Delta P \cdot {{{\text{V}}}_{{{\text{cell}}}}} \cdot 2}}{{22\,400}} \cdot \frac{{{\text{MM}}\left( {{\text{Li}}} \right)}}{{{\text{MM}}\left( {{{{\text{H}}}_{2}}} \right)}},$Количество электрохимически неактивного лития, содержащегося в “катодном” осадке на стальном электроде, рассчитывали по уравнению
(6)
${{Q}_{{{\text{inact}}}}} = \frac{{m\left( {{\text{L}}{{{\text{i}}}_{{{\text{inact}}}}}} \right) \cdot 3860\,\,{\text{мA}}\,\,{\text{ч/г}}}}{{5\,\,{\text{с}}{{{\text{м}}}^{2}}}},$Количество лития, прореагировавшего в химических реакциях с компонентами электролитной системы (химически связанный литий, Qchem) в процессе циклирования на стальном электроде, определяли по уравнению
(7)
${{Q}_{{{\text{chem}}}}} = {{Q}_{{{\text{deposited}}}}}--{{Q}_{{{\text{act}}}}}--{{Q}_{{{\text{inact}}}}},$Скорость деструкции растворителя определяли как отношение количества растворителя, прореагировавшего в реакциях с литием, к суммарному количеству электричества, прошедшему через ячейку в процессе циклирования
(8)
$V = \frac{\nu }{{\left( {\sum\limits_1^n {{{Q}_{{\text{к}}}}} + \sum\limits_1^n {{{Q}_{{\text{a}}}}} } \right)}},$Для оценки воспроизводимости исследований проводили 3–4 параллельных эксперимента. Разброс результатов не превышал ±10%.
Мольное соотношение прореагировавшего растворителя и химически связанного лития (ω) рассчитывали по уравнению
(9)
$\omega = {{\frac{{m{\text{L}}{{{\text{i}}}_{{{\text{chem}}}}}}}{{6.9}}} \mathord{\left/ {\vphantom {{\frac{{m{\text{L}}{{{\text{i}}}_{{{\text{chem}}}}}}}{{6.9}}} {\frac{{{{m}_{{{\text{раств}}}}}}}{{{\text{M}}{{{\text{M}}}_{{{\text{раств}}}}}}}}}} \right. \kern-0em} {\frac{{{{m}_{{{\text{раств}}}}}}}{{{\text{M}}{{{\text{M}}}_{{{\text{раств}}}}}}}}},$РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
После сборки напряжение разомкнутой цепи (НРЦ) на всех ячейках лежало в диапазоне 2.4–2.5 В. При катодной поляризации электрода из нержавеющей стали на первом цикле первоначально происходит быстрое снижение напряжения на ячейке до –0.15 В, а затем – плавное увеличение (рис. 3). Форма хроновольтограмм первого катодного полуцикла определяется природой электролитного растворителя. Напряжение на ячейке с электролитом на основе сульфолана на первом катодном полуцикле после резкого уменьшения в первые секунды поляризации первоначально увеличивается до –0.065 В, затем плавно уменьшается до –0.155 В и вновь начинается увеличиваться (рис. 3а). Напряжение на ячейке с электролитом на основе пропиленкарбоната на первом катодном полуцикле после резкого снижения при начале поляризации плавно увеличивается (рис. 3б). Формы хроновольтограмм ячеек с электролитом на основе СЛ на последующих катодных полуциклах плавно изменяются и в конечном итоге представляют собой плавные, восходящие к оси абсцисс кривые. Формы хроновольтограмм ячеек с электролитом на основе ПК остаются подобными в течение всего циклирования. Различия в формах хроновольтограмм катодных полуциклов ячеек с различными электролитами указывают на различия в механизмах начальных стадий электроосаждения лития. Из полученных данных следует, что процесс зародышеобразования кристаллов металлического лития в электролитах на основе сульфолана более затруднен, чем в электролитах на основе пропиленкарбоната.
Рис. 3.
Эволюция хроновольтограмм катодного осаждения и анодного растворения лития на электроде их нержавеющей стали в 1 M растворах LiClO4 в сульфолане (а) и пропиленкарбонате (б). Условия циклирования: i = 0.2 мА/см2; Qкатод. ос = 0.5 мА ч/см2; t = 30°C.
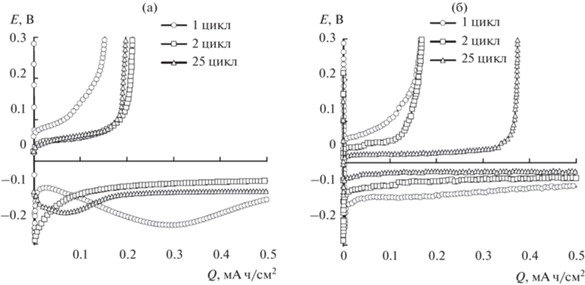
Формы хроновольтограмм ячеек на анодных полуциклах слабо зависят от природы электролитного растворителя (рис. 3а и 3б). В процессе циклирования на начальных циклах наблюдается незначительное снижение средних напряжений на ячейках, затем при последующем циклировании среднее напряжение на ячейках не изменяется, но после определенного количества циклов начинает возрастать и, в конечном итоге, достигает значений, ограниченных условиями эксперимента. Длительность циклирования ячеек Li|SS определяется как количество циклов, полученных до начала резкого увеличения напряжения на ячейках. Из полученных нами данных следует, что наименьшая поляризация и наибольшая длительность циклирования ячеек Li|SS достигается в электролите на основе пропиленкарбоната (рис. 4а).
Рис. 4.
Изменение средних значений напряжений катодных и анодных процессов с количеством циклов (а) и кулоновская эффективность циклирования лития на нержавеющей стали (б) в 1 M растворах LiClO4 в сульфолане (1) и пропиленкарбонате (2). Условия циклирования: i = 0.2 мА/см2; Qкатод. ос = 0.5 мА ч/см2; t = 30°C.
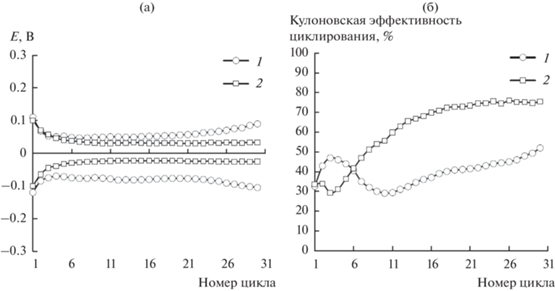
Формы зависимостей кулоновской эффективности циклирования также определяются природой электролитного растворителя (рис. 4б). В электролите на основе пропиленкарбоната кулоновская эффективность циклирования после некоторого снижения на начальных циклах плавно возрастает, достигая 75%. В электролитах на основе сульфолана зависимость кулоновской эффективности циклирования от количества циклов имеет более сложную форму. Первоначально она возрастает, затем снижается и вновь начинает возрастать, достигая к 30-му циклу 52%. Отметим, что кулоновская эффективность циклирования лития на электроде из нержавеющей стали в электролитах на основе пропиленкарбоната существенно выше, чем в электролитах на основе сульфолана.
При дефектации ячеек после циклирования на поверхности рабочих электродов из нержавеющей стали во всех случаях наблюдался пористый осадок серого цвета (рис. 5). В случае электролитного раствора на основе сульфолана толщина осадка составляла ~200 мкм, а пропиленкарбоната ~100 мкм. Эти осадки представляли собой смесь электрохимически неактивного металлического лития с продуктами разложения электролитных растворов. Вспомогательные литиевые электроды, вне зависимости от природы электролитного растворителя, были покрыты тонкой пленкой серого цвета толщиной ~10 мкм.
Рис. 5.
Фото рабочего стального электрода с образованным осадком (слева) и микрофотография (масштаб 1 : 15) центральной части электрода (справа) после 30 циклов катодно-анодной поляризации в 1 M растворе LiClO4 в сульфолане.

Сепараторы во всех ячейках были визуально полупрозрачными, что указывало на частичную деструкцию части электролитного растворителя.
В табл. 1 суммировано оцененное количество сульфолана и пропиленкарбоната, прореагировавшего с литием, в расчете на единицу поверхности рабочего электрода и на общее количество электричества, прошедшего через ячейки при катодно/анодном циклировании.
Таблица 1.
Количество сульфолана и пропиленкарбоната, прореагировавшего с литием в процессе циклирования ячеек Li|SS (i = 0.2 мА/см2, Qкатод. ос = 0.5 мА ч/см2, количество циклов = 30, t = 30°С)
| Электролитная система | ΣQ, мА ч/см2 | Количество растворителя, прореагировавшего с литием | ||
|---|---|---|---|---|
| г/см2 | ×10–3, моль/см2 | ×10–6, моль/(мА ч) | ||
| 1 М раствор LiClO4 в сульфолане | 21.2 | 0.0132 | 0.111 | 5.2 |
| 1 М раствор LiClO4 в пропиленкарбонате | 24.3 | 0.0768 | 0.075 | 3.3 |
Следует иметь в виду, что фазовый состав продуктов разложения сульфолана и пропиленкарбоната различаются. Так, сульфолан восстанавливается с образованием нелетучих продуктов (уравнения (10)–(12)) [5]:
(10)
${{{\text{С}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{8}}}}{\text{S}}{{{\text{O}}}_{2}} + 2{\text{Li}} \to {{{\text{С}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{8}}}}{\text{SO}} + {\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{O}}{\kern 1pt} \downarrow ,$(11)
${{{\text{С}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{8}}}}{\text{SO}} + 2{\text{Li}} \to {{{\text{С}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{8}}}}{\text{S}} + {\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{O}}{\kern 1pt} \downarrow ,$(12)
${\text{2}}{{{\text{С}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{8}}}}{\text{S}} + {\text{2Li}} \to {{{\text{С}}}_{{\text{8}}}}{{{\text{H}}}_{{{\text{16}}}}}{{{\text{S}}}_{{\text{2}}}}{\text{L}}{{{\text{i}}}_{2}}{\kern 1pt} \downarrow {\kern 1pt} .$Восстановление пропиленкарбоната происходит с образованием летучих продуктов (уравнение (13) [11, 12]):
(13)
$\begin{gathered} {\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{CHC}}{{{\text{H}}}_{{\text{2}}}}{\text{OC}}{{{\text{O}}}_{2}} + 2{\text{L}}{{{\text{i}}}^{ + }} + {\text{ }}2{\text{e}} \to \\ \to {\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{C}}{{{\text{O}}}_{3}}{\kern 1pt} \downarrow + {\text{ C}}{{{\text{H}}}_{{\text{3}}}}{\text{CH = C}}{{{\text{H}}}_{2}}{\kern 1pt} \uparrow {\kern 1pt} . \\ \end{gathered} $Состав катодных осадков лития, определенный через 30 циклов, представлен в табл. 2 и на рис. 6.
Таблица 2.
Состав катодных осадков на электроде из нержавеющей стали, образовавшихся при катодном осаждении из 1 М растворов LiClO4 в сульфолане и пропиленкарбонате (i = 0.2 мА/см2, Qкатод. ос = 0.5 мА ч/см2, количество циклов = 30, ΣQкатод. oс = 15 мА ч/см2, t = 30°С)
| Форма лития | Количество лития | ||
|---|---|---|---|
| ×10–3, г/см2 | ×10–3, моль/см2 | % | |
| 1 М раствор LiClO4 в сульфолане | |||
| Liact | 1.58 | 0.229 | 41 |
| Liinact | 1.40 | 0.203 | 36 |
| Lichem | 0.90 | 0.130 | 23 |
| 1 М раствор LiClO4 в пропиленкарбонате | |||
| Liact | 2.41 | 0.349 | 62 |
| Liinact | 0.85 | 0.123 | 22 |
| Lichem | 0.62 | 0.089 | 16 |
Рис. 6.
Диаграммы состава катодных осадков, образовавшихся на электроде из нержавеющей стали при циклировании в 1 М растворах LiClO4 в сульфолане и пропиленкарбонате в течение 30 циклов. Условия циклирования: i = 0.2 мА/см2; Qкатод. ос = 0.5 мА ч/см2; t = 30°C.
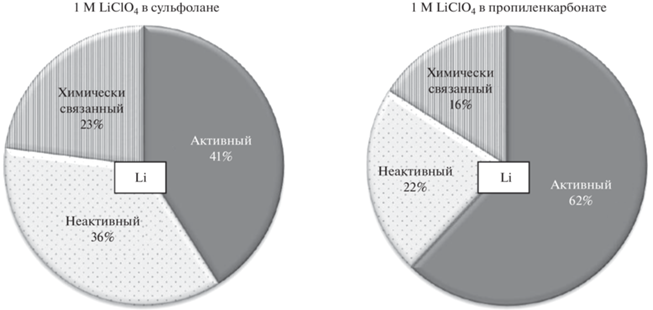
Мольное отношение прореагировавших растворителей и лития близки и составляют для сульфоланового электролита 0.85, а для электролита на основе пропиленкарбоната – 0.84. Однако в расчете на общее количество электричества, пропущенного через ячейку в процессе циклирования, скорость разложения сульфолана в 1.5 раза выше скорости разложения пропиленкарбоната (табл. 1).
Заниженное значение соотношения прореагировавший растворитель–свежеобразованный литий может быть объяснено взаимодействием свежеосажденного лития не только с растворителем, но и с анионом соли, в результате которого образуется оксид лития (уравнение (14)) [5]:
(14)
${\text{Cl}}{{{\text{O}}}_{{\text{4}}}}^{ - } + {\text{8Li}} \to {\text{C}}{{{\text{l}}}^{ - }} + {\text{4L}}{{{\text{i}}}_{{\text{2}}}}{\text{O}}{\kern 1pt} \downarrow {\kern 1pt} .$Поэтому катодный осадок может представлять собой смесь продуктов взаимодействия свежеобразованного лития с растворителем и солью.
С учетом возможных ошибок определения, полученные данные дают основание полагать, что, вне зависимости от природы электролитного растворителя, взаимодействие компонентов электролитной системы со свежеосажденным литием происходит в мольном соотношении 1 : 1.
Сравнивая результаты анализа состава катодных осадков, образующихся в электролитных системах на основе различных растворителей, можно заключить, что пропиленкарбонат при взаимодействии со свежеобразованным металлическим литием образует на его поверхности поверхностные пленки с лучшими защитными свойствами, чем сульфолан. Это приводит к меньшей скорости его взаимодействия с металлическим литием, увеличению кулоновской эффективности и длительности циклирования литиевого электрода.
ЗАКЛЮЧЕНИЕ
Разработан метод количественного определения различных форм лития в катодных осадках, образующихся на электроде из нержавеющей стали в процессе катодно-анодного циклирования. Метод основан на измерении давления в барометрической ячейке в результате образования водорода, выделяющегося при взаимодействии электрохимически неактивного металлического лития с протонсодержащим растворителем.
Определено количество и соотношение электрохимически активного металлического лития, электрохимически неактивного металлического лития и химически связанного лития в составе катодных осадков, образующихся на стальном электроде в процессе гальваностатического циклирования в растворах LiClO4 в сульфолане и пропиленкарбонате.
Предложен метод оценки количества электролитного растворителя, прореагировавшего в химических реакциях с металлическим литием. Установлено, что, вне зависимости от природы растворителя, мольное соотношение прореагировавший растворитель–свежеобразованный литий лежит в диапазоне 0.84–0.85. Предположено, что взаимодействие свежеобразованного металлического лития с электролитными растворителями происходит в мольном соотношении 1 : 1. Заниженное значение соотношения прореагировавший растворитель–свежеобразованный литий может быть объяснено взаимодействием свежеосажденного лития с анионом соли, в результате которого образуется оксид лития.
Пропиленкарбонат при взаимодействии со свежеобразованным металлическим литием образует поверхностные пленки с лучшими защитными свойствами, чем сульфолан, что приводит к уменьшению скорости его взаимодействия с металлическим литием, увеличению кулоновской эффективности и длительности циклирования литиевого электрода.
Список литературы
Xu, R., Cheng, X.-B., Yan, C., Zhang, X.-Q., Xiao, Y., Zhao, C.-Z., Huang, J.-Q., and Zhang, Q., Artificial Interphases for Highly Stable Lithium Metal Anode, Matter., 2019, vol. 1, no. 2, p. 317. https://doi.org/10.1016/j.matt.2019.05.016
Mercier-Guyona, B., Chavillon, B., Mayousse, E., Le Comte, A., Reynier, Y., and Barchasz, C., Influence of electrolyte composition on high energy lithium metal cells, Solid State Ionics, 2020, vol. 350, p. 115321. https://doi.org/10.1016/j.ssi.2020.115321
Chen, K.-H., Wood, K.N., Kazyak, E., LePage, W.S., Davis, A.L., Sanchez, A.J., and Dasgupta, N.P., Dead lithium: mass transport effects on voltage, capacity, and failure of lithium metal anodes, J. Mater. Chem. A, 2017, vol. 5, p. 11671. https://doi.org/10.1039/C7TA00371D
Li, Z., Huang, J., Liaw, B.Y., Metzler, V., and Zhang, J., A review of lithium deposition in lithium-ion and lithium metal secondary batteries, J. Power Sources, 2014, vol. 254, p. 168. https://doi.org/10.1016/j.jpowsour.2013.12.099
Nonaqueous electrochemistry, Ed. Aurbach, D. N.Y.: Marcel Dekker, Inc., 1999. 602 p.
Aryanfar, A., Brooks, D.J., Colussi, A.J., and Hoffmann, M.R., Quantifying the dependence of dead lithium losses on the cycling period in lithium metal batteries, Phys.Chem.Chem.Phys., 2014, vol. 16, p. 24965. https://doi.org/10.1039/C4CP03590A
Fang, C., Li, J., Zhang, M., Zhang, Y., Yang, F., Lee, J.Z., Lee, M.-H., Alvarado, J., Schroeder, M.A., Yang, Y., Lu, B., Williams, N., Ceja, M., Yang, L., Cai, M., Gu, J., Xu, K., Wang, X., and Meng, Y.S., Quantifying inactive lithium in lithium metal batteries, Nature, 2019, vol. 572, p. 511. https://doi.org/10.1038/s41586-019-1481-z
Hsieh, Y.-C., Leißing, M., Nowak, S., Hwang, B.-J., Winter, M., and Brunklaus, G., Quantification of Dead Lithium via In Situ Nuclear Magnetic Resonance Spectroscopy, Cell Reports Physical Science, 2020, vol. 1, no. 8, p. 100139. https://doi.org/10.1016/j.xcrp.2020.100139
Aurbach, D., Zinigrad, E., Teller, H., and Dan, P., Factors Which Limit the Cycle Life of Rechargeable Lithium (Metal) Batteries, J. Electrochem. Soc., 2000, vol. 147, no. 4, p. 1274. https://doi.org/10.1149/1.1393349
Aurbach, D., Zinigrad, E., Teller, H., Cohen, Y., Salitra, G., Yamin, H., Dan, P., and Elster, E., Attempts to Improve the Behavior of Li Electrodes in Rechargeable Lithium Batteries, J. Electrochem. Soc., 2003, vol. 150, no. 3, p. L6. https://doi.org/10.1149/1.1554419
Eggert, G. and Heitbaum, J., Electrochemical reactions of propylenecarbonate and electrolytes solved therein – a DEMS study, Electrochim. Acta, 1986, vol. 31, no. 11, p. 1443. https://doi.org/10.1016/0013-4686(86)87057-8
Mogi, R., Inaba, M., Iriyama, Y., Abe, T., and Ogumi, Z., Study of the Decomposition of Propylene Carbonate on Lithium Metal Surface by Pyrolysis-Gas Chromatography-Mass Spectroscopy, Langmuir, 2003, vol. 19, no. 3, p. 814. https://doi.org/10.1021/la026299b
Дополнительные материалы отсутствуют.


